aroC基因对迟缓爱德华氏菌生物学特性及致病性的影响
2023-11-24刘锐高大庆赵丹汪红秋谢小芳祁琳易甜甜潘振张海方杜鸿
刘锐, 高大庆, 赵丹, 汪红秋, 谢小芳, 祁琳, 易甜甜, 潘振, 张海方, 杜鸿
(1. 苏州大学附属第二医院精准医学诊断中心, 江苏 苏州 215004; 2. 东南大学医学院, 江苏 南京 210009)
迟缓爱德华氏菌(Edwardsiellatarda,Et)是肠杆菌科革兰氏阴性短杆菌,该菌感染宿主广泛,能够感染鱼类、两栖类、爬行类和人类等,导致危害严重的鱼类爱德华氏菌病,从而造成水产养殖业的巨大经济损失;人感染此菌,会引起败血症、肠炎、脓胸等[1]。近年来,临床上陆续发现患者感染Et还能引起感染性硬膜下血肿、自发性腹膜炎、急性胆管炎合并感染性休克等[2-4]。因此,研究Et的致病机制及寻找防治方法显得极其重要。
鱼类在水质差、高水温的水环境中易被Et感染,出现眼球突出、腹部肿胀、鳍和皮肤出现点状出血等症状,人类误食感染该菌的病鱼或疫水,容易引起人类爱德华氏菌病。研究发现,Et致病过程主要包括黏附和侵入宿主上皮细胞、抗宿主免疫机制、产生酶类和毒素,最后通过血液循环造成系统性感染[5]。鞭毛介导的运动性在Et致病的早期阶段发挥重要作用,它使菌体稳定地附着于宿主体内并在其黏膜内大量繁殖[6]。该致病菌侵入宿主后,释放大量过氧化氢酶、脂多糖等来抵抗宿主防御系统的杀伤作用。细菌的群体密度感应系统介导细菌种内或种间的信号交流,进而引起细菌运动性、毒性、耐药性、生物膜形成等生理活性的改变。吲哚作为Et一种新的密度感应信号分子,不仅调控Et的运动性、生物膜形成、耐药性、耐酸性、质粒稳定性,还参与该菌对斑马鱼的致病性[7]。
aroC基因编码的分支酸合成酶,是芳香族氨基酸合成的关键酶,芳香族氨基酸对细菌在体内的生长和存活具有重要作用。该基因缺失的细菌在芳香族氨基酸缺乏的培养基中难以生长,表现出低毒力,能诱导宿主产生保护性免疫力[8]。为了确定aroC基因对Et致病性的作用,本研究通过构建EtaroC缺失株,比较该菌野生株和缺失株生物学特性的差异,为进一步探讨aroC对该菌致病性的影响奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒、培养条件 本研究所用的菌株和质粒见表1。细菌用Luria-Bertani(LB)培养基培养,加入培养基抗生素终浓度分别为氯霉素(chloramphenicol,Cm)34 μg/mL,氨苄西林钠(ampicillin sodium,Amp)100 μg/mL,盐酸四环素(tetracycline hydrochloride,Tet)50 μg/mL,多黏菌素E(colistin,Col)50 μg/mL。

表1 本研究所用的菌株和质粒
1.1.2 人喉癌上皮细胞 Hep-2细胞为南京农业大学刘锦博士惠赠。胎牛血清、胰蛋白酶(美国Hyclone公司);细胞培养液DMEM(美国Gibco公司);Solarbio鞭毛染色试剂盒(天根生化科技有限公司)。
1.1.3 实验动物 28只6周龄雄性无菌级BALB/C小鼠,购买于扬州大学动物实验中心,许可证号:SCXK(苏)2017-0007。
1.2 方法
1.2.1aroC缺失株的构建 以ET13基因组DNA为模板,化学合成aroC基因上下游融合片段F1F2,将F1F2片段与自杀质粒pWM91进行连接,连接产物接种至LB平板(含Ampr),双酶切鉴定重组质粒pWM91-F1F2;将该重组质粒电转入SM10λpir中,含重组质粒的SM10λpir与ET13进行接合反应,接合产物接种至平板上(含Ampr和Colr),挑选阳性菌落,并以F1F2(表2)为引物进行PCR鉴定,筛选接合子;用含15%蔗糖的LB平板筛选aroC缺失株,挑选在Ampr和Colr双抗平板上不生长,仅在Colr抗性平板上生长的菌落,以aroC(表2)为引物进行PCR扩增,传代10次以后筛选稳定缺失株,所得到的缺失株命名为ΔaroC。

表2 本研究所用的引物和扩增产物大小
1.2.2aroC互补株和ΔaroC-pACYC184株的构建 以ET13基因组DNA为模板,aroC为引物(表2),PCR扩增aroC基因片段,插入到质粒pACYC184中,构建pACYC184-aroC重组质粒,将其电转入ΔaroC中,所得到的互补株命名为CΔaroC。将空质粒pACYC184电转入ΔaroC中,所得到的菌株命名为ΔaroC-pACYC184。
1.2.3 生长曲线测定 野生株、ΔaroC及CΔaroC株培养至对数生长期,然后调节菌液D(600 nm)=0.5,按1 ∶100比例转接至含100 mL的LB液体培养基的三角瓶中,每小时从中取出2 mL菌液,用酶标仪测定D值,每组重复3次取平均值,根据D(600 nm)数值绘制生长曲线。
1.2.4 吲哚浓度测定 制备不同浓度吲哚标准品与其对应D(571 nm)值的标准曲线;取不同时间点野生株、ΔaroC及CΔaroC菌液,过滤取上清液,在571 nm波长下,用酶标仪测定这些上清液的D值,根据标准曲线得出相应吲哚浓度。该实验重复3次后进行统计学分析。
1.2.5 结晶紫法检测生物膜 分别取250 μL含菌量108CFU/mL的野生株、ΔaroC及CΔaroC加入到96孔板中,培养48 h,在570 nm波长下,用酶标仪测定每孔中菌液D值,该实验重复3次后进行统计学分析。
1.2.6 扫描电镜法检测生物膜 无菌6 mm×6 mm盖玻片置于野生株、ΔaroC及CΔaroC中,培养48 h,用电镜观察盖玻片表面形成的生物膜。
1.2.7 Hep-2细胞黏附试验 制备Hep-2细胞悬液;对数期野生株、ΔaroC菌液按感染复数(MOI)=100 ∶1分别感染Hep-2细胞,共孵育2 h后,用1%的吉姆萨染色20 min,PBS清洗3次,室温干燥后于油镜下观察细菌黏附情况。加入1 mL Triton X-100裂解细胞10 min,收集裂解液,采用平板计数法计算各组细菌数。黏附率(%)=平板所得细菌数/原始加入细菌数×100%,重复3次后进行统计学分析。
1.2.8 软琼脂平板法检测细菌运动性 对数期野生株、ΔaroC、S.albus接种至0.3%半固体琼脂培养基上,CΔaroC、ΔaroC-pACYC184接种至0.3%半固体琼脂培养基上(含Tetr),24 h后观察各菌株鞭毛运动能力,并用游标卡尺测量运动环直径。S.albus作为阴性对照,该实验重复3次后进行统计学分析。
1.2.9 镀银法检测细菌鞭毛形态 接种环分别沾取野生株、ΔaroC及CΔaroC至载玻片上,按试剂盒说明书进行鞭毛染色,在油镜下观察鞭毛形态。
1.2.10 荧光定量PCR检测细菌fliS、flgK、fliM、flgL、fliA和fliC相对表达量 按试剂盒说明书提取细菌RNA并逆转录成cDNA,再以cDNA为模板,用fliS、flgK、fliM、flgL、fliA和fliC基因的引物(表2)扩增各基因,以扩增16SrRNA基因作为内标参照,定量测定各基因的转录水平,重复3次后进行统计学分析。PCR反应程序:95 ℃预变性5 min,95 ℃变性20 s,56 ℃退火20 s,72 ℃延伸30 s,循环40次,4 ℃保存;25 μL反应体系:cDNA 7 μL,DEPC水11 μL,2× SYBR Green Mix 5 μL,上、下游引物各1 μL。
1.2.11 致病力检测 野生株和ΔaroC株培养至对数生长期,调节菌液D(600 nm)=1.0,然后用PBS稀释至含菌量为108CFU/mL,每尾斑马鱼腹腔注射10 μL该浓度菌液;空白组注射相同剂量的无菌生理盐水,每组10尾,连续观察1周,每天记录斑马鱼死亡数量。以时间为横坐标,各组斑马鱼存活率为纵坐标,绘制两菌株感染斑马鱼的存活率图。
1.2.12 细菌组织载量测定 野生株和ΔaroC株培养至对数生长期,调节菌液D(600 nm)=1.0,用PBS稀释至含菌量为108CFU/mL;将6周龄雄性小鼠28只随机分成野生株组和ΔaroC组(每组14只):每只小鼠腹腔注射20 μL含菌量108CFU/mL菌液(野生株或ΔaroC),在感染后1、2、3、4、5、6、7 d,每组分别取2只小鼠,断脊处死小鼠,无菌操作,迅速解剖,取小鼠小肠、肝脏研磨均匀,研磨液稀释一定倍数后,涂布含Colr的LB固体平板,37 ℃培养过夜;次日进行菌落计数(CFU/mL)=菌落数/平板×10×稀释倍数。
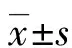
2 结果
2.1 Et aroC缺失株和互补株的鉴定
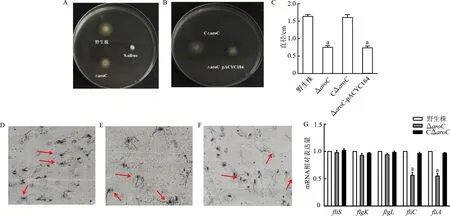
接合子接种于LB液体培养基中培养至对数期后,涂布于15%蔗糖LB平板,取单菌落分别划线于含Ampr+Colr双抗的LB固体平板和含Colr单抗LB固体平板上,挑取在双抗平板上不生长,而在单抗平板上生长的菌落,以aroC为引物做PCR鉴定,该引物扩增出来的aroC基因片段为1 200 bp。以aroC为引物扩增不出任何片段,则该菌为aroC缺失株,结果如图1A,共获得2株,1、3号为aroC缺失株,2号、4~7号为ET13的野生株,将aroC缺失株转接至LB液体培养基中培养,传代15次以后筛选稳定缺失株,于-80 ℃保种,将所得到的aroC缺失株命名为ΔaroC。将重组质粒pACYC184-aroC电击转化到ΔaroC株中,涂布含Tetr的LB固体平板,37 ℃培养过夜,次日从平板上挑取单菌落进行PCR鉴定,以aroC为引物能扩出aroC基因片段,说明互补株构建成功,结果如图1B,1号为CΔaroC株,将所得到的互补株命名为CΔaroC。

A:用aroC引物进行PCR鉴定ΔaroC株;M:DL5000;1,3:ΔaroC株;2,4~7:ET13的野生株。B:PCR鉴定CΔaroC株;M:DL2000;1:CΔaroC株
2.2 比较ET13的野生株、ΔaroC和CΔaroC生长能力的差异
结果如图2所示,野生株、ΔaroC和CΔaroC株的生长速度在各个时间段无显著差异(P>0.05),说明aroC基因缺失后,不影响ET13菌的生长能力。

图2 比较ET13的野生株、ΔaroC和CΔaroC生长能力的差异
2.3 比较ET13的野生株、ΔaroC和CΔaroC胞外吲哚含量的差异
检测野生株、ΔaroC和CΔaroC在48 h内不同时间点的胞外吲哚浓度,结果如图3所示,上述菌株在1~7 h时胞外吲哚浓度增长较缓慢、10~13 h时增长速度较快,在13 h时吲哚浓度达到最高值,以后逐渐下降。0~1 h时,上述3种菌株的胞外吲哚浓度无显著差异(P>0.05);在4~48 h时,ΔaroC胞外吲哚浓度明显低于野生株(P<0.05或<0.01),CΔaroC的吲哚浓度介于野生株和缺失株之间。结果表明,4~48 h时aroC缺失后影响ET13胞外吲哚的生成。
a:P<0.05,b:P<0.01,与野生株相比
2.4 比较ET13的野生株和ΔaroC在48 h时生物膜形成的差异
细菌经过48 h的培养,在气液交界面的孔壁上形成生物膜,人类肉眼无法观察到,借助结晶紫染色即能直观观察到生物膜,又能根据染色后颜色的深浅判断生物膜的形成量。结果见图4A,从左到右分别为未添加菌液的LB培养基,本试验中作为阴性对照、野生株、ΔaroC和CΔaroC株,未添加菌液的LB培养基的孔壁无色,说明无生物膜形成;野生株的孔壁呈深紫色,ΔaroC的孔壁有一点紫色,CΔaroC的孔壁颜色略浅于野生株的孔壁颜色;用酶标仪检测每个小孔中结晶紫脱色液的D(570 nm)值,结果如图4B所示,ΔaroC孔的D值明显低于野生株孔(P<0.01),但高于LB孔,CΔaroC孔的D值介于野生株和缺失株之间。进一步用扫描电镜检测ET13菌在盖玻片表面形成的生物膜,结果见图4C~4E,盖玻片表面ΔaroC细菌数及胞外多聚物量少且分布零散,野生株与CΔaroC黏附在盖玻片表面的细菌数及胞外多聚物量多且分布密集。以上结果表明,aroC基因缺失后,ET13生物膜形成能力明显降低。

A:结晶紫法检测野生株、ΔaroC和CΔaroC 48 h时在96孔板中形成的生物膜,从左到右分别为未添加菌液的LB培养基(阴性对照)、野生株、ΔaroC和CΔaroC株。B:酶标仪分别检测96孔板中LB、野生株、ΔaroC和CΔaroC的D值;a:P<0.01,与野生株相比。C~E:扫描电镜检测野生株、ΔaroC和CΔaroC 48 h时在盖玻片表面形成的生物膜(×2 500)
2.5 比较ET13的野生株和ΔaroC运动能力的差异
结果如图5A~5C所示,S.albus无鞭毛,在软琼脂平板上不能形成运动环。ΔaroC运动环直径明显小于野生株(P<0.01),该菌运动能力下降;CΔaroC运动环与野生株无明显差异(P>0.05);ΔaroC-pACYC184与ΔaroC运动环直径无明显差异(P>0.05),说明pACYC184质粒不影响ΔaroC鞭毛运动。镀银法观察鞭毛形态及数目,细菌菌体呈深褐色,鞭毛呈浅褐色,结果发现ΔaroC菌体周围只有1~2根鞭毛、较短,野生株和CΔaroC周身鞭毛密集且较长(图5D~5F)。如图5G所示,ΔaroC中fliC、fliA基因的转录水平相比野生株明显降低(P<0.01),CΔaroC中该基因的转录水平处于野生株和缺失株之间,其他3个基因fliS、flgK和flgL在上述3种菌株间的转录水平无明显差异(P>0.05)。上述结果表明,aroC基因缺失后,ET13鞭毛介导的运动能力下降。
A:比较野生株、ΔaroC和S.albus鞭毛运动环直径的差异;B:比较CΔaroC和ΔaroC-pACYC184鞭毛运动环直径的差异;C:野生株、ΔaroC、CΔaroC和ΔaroC-pACYC184的鞭毛运动环直径统计图;D~F:镀银法观察野生株、ΔaroC和CΔaroC鞭毛形态及数目的差异(×1 000);G:qRT-PCR比较野生株、ΔaroC和CΔaroC鞭毛合成相关基因的转录水平;a:P<0.01,与野生株相比
2.6 比较ET13的野生株和ΔaroC黏附Hep-2细胞能力的差异
光镜下观察野生株和ΔaroC黏附Hep-2细胞的差异,如图6A~6C所示,ΔaroC黏附在Hep-2细胞上的数目少于野生株。平板计数法定量检测结果表明,ΔaroC黏附在Hep-2细胞上的黏附率明显低于野生株(P<0.01),见图6D。以上结果表明,aroC基因缺失后,ET13黏附上皮细胞的能力降低。姬姆萨染色后,Hep-2细胞核和细菌被染成紫蓝色,细胞质被染成浅红色。

A:未感染细菌的Hep-2细胞;B:野生株感染的Hep-2细胞;C:ΔaroC感染的Hep-2细胞;D:平板计数法定量检测野生株和ΔaroC黏附Hep-2细胞的黏附率统计图。a:P<0.01,与野生株相比;箭头所示为黏附的细菌
2.7 比较ET13的野生株和ΔaroC感染斑马鱼后存活率的差异
将野生株和ΔaroC分别用PBS稀释至含菌量为108CFU/mL,每尾斑马鱼腹腔注射10 μL该浓度菌液,连续观察1周,结果如图7所示,野生株组第1、2、3、4天各死了1尾斑马鱼,第5、6天各死了2尾,第7天存活下来2尾;缺失株组第1天无斑马鱼死亡,第2、3、4、5、6天各死了1尾,第7天存活下来5尾。感染ΔaroC株斑马鱼存活率为50%,而感染野生株斑马鱼存活率仅为20%。以上结果表明,aroC基因缺失后,ET13对斑马鱼的毒力降低,提示aroC基因与该菌对宿主的致病性相关。

图7 比较ET13的野生株和ΔaroC感染斑马鱼后存活率的差异
2.8 比较ET13的野生株和ΔaroC在小鼠组织中存活能力的差异
野生株和ΔaroC腹腔感染小鼠1周,各菌株在小鼠肠道中的存活能力见图8A,仅在第1天和第7天时,两菌株在小鼠肠道中的存活数目无明显差异(P>0.05),其他时间段ΔaroC在肠道中的存活数目低于野生株(P<0.05或<0.01)。两菌株在小鼠肝脏中的存活能力如图8B所示,第2天到第7天,野生株在肝脏中的存活数目高于ΔaroC(P<0.05或<0.01);但感染第1天时,两菌株在肝脏中的存活数目无明显差异(P>0.05)。以上结果表明,aroC基因缺失后,ET13菌在小鼠组织中存活能力降低,该基因在ET13定植过程中发挥显著作用。

a:P<0.05,b:P<0.01,与野生株相比
3 讨论
Et作为爱德华氏菌属中唯一可以感染人的致病菌,其危害性引起临床上极大关注。分支酸合成酶作为莽草酸代谢途径下游支点的重要酶,影响莽草酸途径次生代谢产物吲哚的产生;吲哚作为细菌一种新的密度感应信号分子,近几年来受到研究者极大关注,研究发现其能参与细菌运动、黏附、抗酸性、毒力、生物膜形成等多种生理活动[9]。在Et中,吲哚可以通过CpxAR双组分系统和Ⅲ型分泌系统参与毒力调控[10]。本研究发现,aroC基因缺失株胞外吲哚生成量明显降低。
黏附和侵入作为Et致病过程的第一步,涉及了黏附素、鞭毛蛋白等,该菌可以黏附并侵入Hep-2细胞和HeLa细胞,鞭毛在黏附过程中可引起微丝发生重排,协助病原菌侵入到宿主体内并迁移到营养物质丰富的位置上[11]。FliA、FliC等鞭毛蛋白装配成细菌鞭毛丝;FlgK和FlgL共同构成鞭毛钩环状结构,是鞭毛形成及发挥功能的重要组成部分;鞭毛蛋白FliS作为FliC的分子伴侣,与鞭毛的形成、菌株的游动性、毒性等有着密切的关系[12]。本研究结果显示,与野生株和互补株相比,ΔaroC运动能力明显下降、鞭毛较短且量少、fliA和fliC基因的转录水平降低;该缺失株黏附Hep-2细胞的能力也显著降低。fliA和fliC基因转录水平降低,可能是ΔaroC运动能力降低的原因之一,具体机制有待进一步研究。细菌附着于惰性或活性实体的表面,分泌胞外多聚物将菌体包裹起来,形成的细菌聚集体膜状物称为生物膜。生物膜内部的细菌能逃避免疫系统的攻击和抗菌药物的杀伤作用,使感染易于慢性化、难于控制,从而能够增强细菌致病性[13]。本研究应用96孔酶标板结晶紫法和扫描电镜法检测了野生株、ΔaroC和CΔaroC在48 h形成的生物膜,结果发现与野生株和互补株相比,ΔaroC生物膜形成能力降低。
细菌侵入宿主后分泌多种毒素,这些毒素不仅为细菌自身生长繁殖提供营养,同时也能抵抗宿主防御机制,进而有利于细菌产生致病作用。有研究发现,猪链球菌aroC基因缺失株表面荚膜多糖合成受阻,导致该缺失株在感染过程中与免疫细胞充分接触,激活更高炎性反应,从而更易被宿主清除,毒力明显降低[14]。斑马鱼存活率实验结果显示,感染ΔaroC斑马鱼症状较轻,且存活率(50%)高于野生株(20%)。进一步检测两菌株在小鼠肠道和肝脏中的载量,结果发现ΔaroC在小鼠肠道和肝脏中的定植能力低于野生株。
本研究结果表明,Et的aroC基因缺失株生物膜形成能力、运动性、黏附性、吲哚生成量及致病力明显下降,为深入了解Et致病机制提供了理论基础。然而,aroC基因是通过何种作用机制影响Et的生物学特性,需要后期进一步深入研究。
