免疫浸润相关基因mRNA 在宫颈癌与宫颈癌前病变中的表达及其与预后的关系
2023-11-20杨勤秦刘占军杜鹃张云清
杨勤秦 ,刘占军 ,杜鹃 ,张云清
延安大学附属医院1检验科,3妇科 陕西省延安市,716000 2延安大学医学院 陕西省延安市,716000
据统计,宫颈癌是全球范围内第四大常见女性恶性肿瘤,具有高异质性、高复发率、预后较差等特点[1-2]。既往有报道证实,免疫浸润在宫颈癌前病变与宫颈癌发生发展中发挥关键作用,明确免疫浸润相关基因改变机制有可能降低宫颈癌发病风险、帮助诊断及预后预测[3]。人类白细胞抗原G(human leukocyte antigen G,HLA-G) 属于免疫耐受分子,可抑制T 细胞、NK 细胞功能,在肿瘤免疫浸润中具有重要作用[4]。叉状头螺旋转录因子3(forkhead helix transcription factor 3,FOXP3) 可调节与转导T 细胞发育和功能完善过程,参与肿瘤发生发展相关免疫机制[5]。T 细胞免疫球蛋白黏连蛋白-3 (T cell immunoglobulin cohesin-3,TIM-3)是Ⅰ型膜表面蛋白分子,属于调节机体免疫的关键分子,在抑制T 细胞对肿瘤的反应中具有重要调节作用[6]。但关于上述免疫浸润相关基因在宫颈癌与宫颈癌前病变中的表达及与预后的关系仍有待明确,为此本研究对该课题进行探讨,旨在从免疫浸润角度为临床制定防治措施提供新思路。
1 材料与方法
1.1 一般资料
选取我院2017 年1 月至2019 年1 月宫颈癌患者74 例作为宫颈癌变组,宫颈癌前病变患者74 例作为宫颈癌前病变组,另选取同期因子宫肌瘤行子宫切除术患者74 例作为宫颈正常组。本研究经我院伦理委员会审批通过(审批号: 20170115097)。
1.2 选取标准
纳入标准: 宫颈癌、宫颈癌前病变、子宫肌瘤均经病理活检证实;子宫肌瘤均符合子宫切除术且顺利完成手术;患者均知情本研究方案,自愿签订知情同意书。排除标准: 参与本研究前接受放化疗等抗肿瘤治疗者;合并其他妇科恶性肿瘤者;存在自身免疫性疾病者;伴有急慢性传染病者;属于转移性肿瘤者。
1.3 方法
取3 组组织样本106~107个细胞,PBS 清洗后加入1 mL 的TRIzol Reagent 试剂(Thermo Fisher),提取总RNA,经反转录试剂盒(TaKaRa) 行逆转录,合成cDNA,使用聚合酶链式反应(polymerase chain reaction,PCR) 扩增,试剂盒购自QIAGEN 公司,HLA-G、FOXP3、TIM-3、侵袭相关基因P21-活化的激酶6 (P21 activated kinase 6,PAK-6)、zeste 2 多梳抑制复合物2 亚基增强子(enhancer of Zeste homolog 2,EZH2)、增殖相关基因血管生成素样蛋白4 (angiopoietin like protein 4,ANGPTL4)、同源盒基因B7 (homeobox gene B7,HOXB7) 引物由宝生物工程(大连) 有限公司设计合成,以甘油醛-3-磷酸脱氢酶(GAPDH) 作为内参,行实时定量PCR 反应,反应条件: 95 ℃15 min,95 ℃15 s,60 ℃15 s,72 ℃35 s,连续40 个循环。采用2-ΔΔct来计算目的基因的mRNA 相对表达量。
1.4 观察指标
①3 组免疫浸润相关基因HLA-G、FOXP3、TIM-3 mRNA 表达情况;②宫颈癌变组不同病理特征患者免疫浸润相关基因HLA-G、FOXP3、TIM-3 mRNA 表达情况;③宫颈癌变组不同病理特征患者恶性生物学行为指标mRNA 表达情况,包括侵袭相关基因PAK-6、EZH2、增殖相关基因ANGPTL4、HOXB7;④免疫浸润相关基因与宫颈癌前病变进展至宫颈癌的关系;⑤宫颈癌患者免疫浸润相关基因与恶性生物学行为相关性;⑥不同免疫浸润相关基因mRNA 表达水平的宫颈癌患者的3 年生存率。
1.5 统计学处理
采用统计学软件SPSS22.0 处理数据,符合正态分布的计量资料以表示,多组间比较采用单因素方差分析,进一步两两组间比较采用LSD-t检验,两组间比较采用独立样本t检验;计数资料用n(%) 表示,χ2检验;相关性采用Pearson相关系数模型分析;危险度采用RR表示,U检验;采用Kaplan-Meier 曲线进行生存分析,采用Logrank检验。P<0.05 表明差异有统计学意义。
2 结果
2.1 3 组一般资料比较
3 组年龄、体质量指数、孕次、生育史、是否绝经等一般资料均无可比性(P>0.05) (表1)。

表1 3 组一般资料比较
2.2 3 组免疫浸润相关基因HLA-G、FOXP3、TIM-3 表达情况
单因素方差分析,3 组HLA-G、FOXP3、TIM-3 mRNA 相对表达量比较,差异有统计学意义(P<0.05);HLA-G、FOXP3、TIM-3 mRNA 相对表达量为宫颈癌变组>宫颈癌前病变组>宫颈正常组(P<0.05)(表2)。
表2 3 组免疫浸润相关基因mRNA 表达情况比较()

表2 3 组免疫浸润相关基因mRNA 表达情况比较()
“ -”表示无表达
2.3 宫颈癌变组中不同生理及病理特征患者免疫浸润相关基因HLA-G、FOXP3、TIM-3 mRNA 表达情况
宫颈癌变组中不同年龄、病理类型患者HLA-G、FOXP3、TIM-3 mRNA 相对表达量差异无统计学意义(P>0.05);不同临床分期、分化程度,以及有无淋巴结转移、有无脉管浸润的患者HLA-G、FOXP3、TIM-3 mRNA 相对表达量差异有统计学意义(P<0.05)(表3)。
表3 宫颈癌变组中不同生理及病理特征患者免疫浸润相关基因HLA-G、FOXP3、TIM-3 的mRNA 表达情况比较()
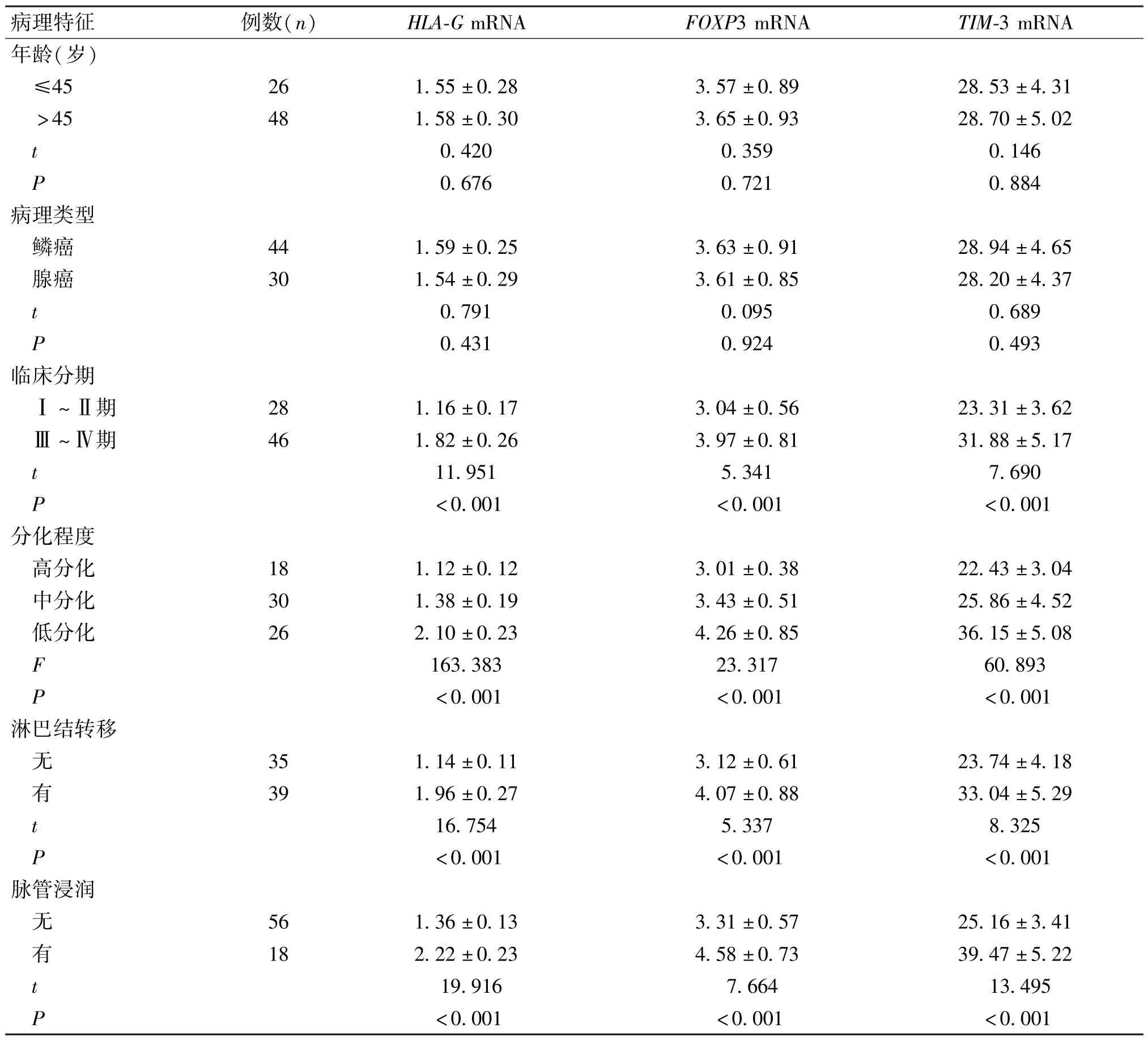
表3 宫颈癌变组中不同生理及病理特征患者免疫浸润相关基因HLA-G、FOXP3、TIM-3 的mRNA 表达情况比较()
2.4 宫颈癌变组中不同生理及病理特征患者恶性生物学行为指标表达情况
宫颈癌变组中不同年龄、性别患者侵袭相关基因PAK-6、EZH2 mRNA 相对表达量、增殖相关基因ANGPTL4、HOXB7 mRNA 相对表达量差异无统计学意义(P>0.05);不同临床分期、分化程度、有无淋巴结转移、有无脉管浸润患者侵袭相关基因PAK-6、EZH2 mRNA 相对表达量、增殖相关基因ANGPTL4、HOXB7 mRNA 相对表达量差异有统计学意义(P<0.05)(表4)。
表4 宫颈癌变组中不同生理及病理特征患者恶性生物学行为指标mRNA 表达情况比较()

表4 宫颈癌变组中不同生理及病理特征患者恶性生物学行为指标mRNA 表达情况比较()
续表4 宫颈癌变组中不同生理及病理特征患者恶性生物学行为指标mRNA 表达情况比较()
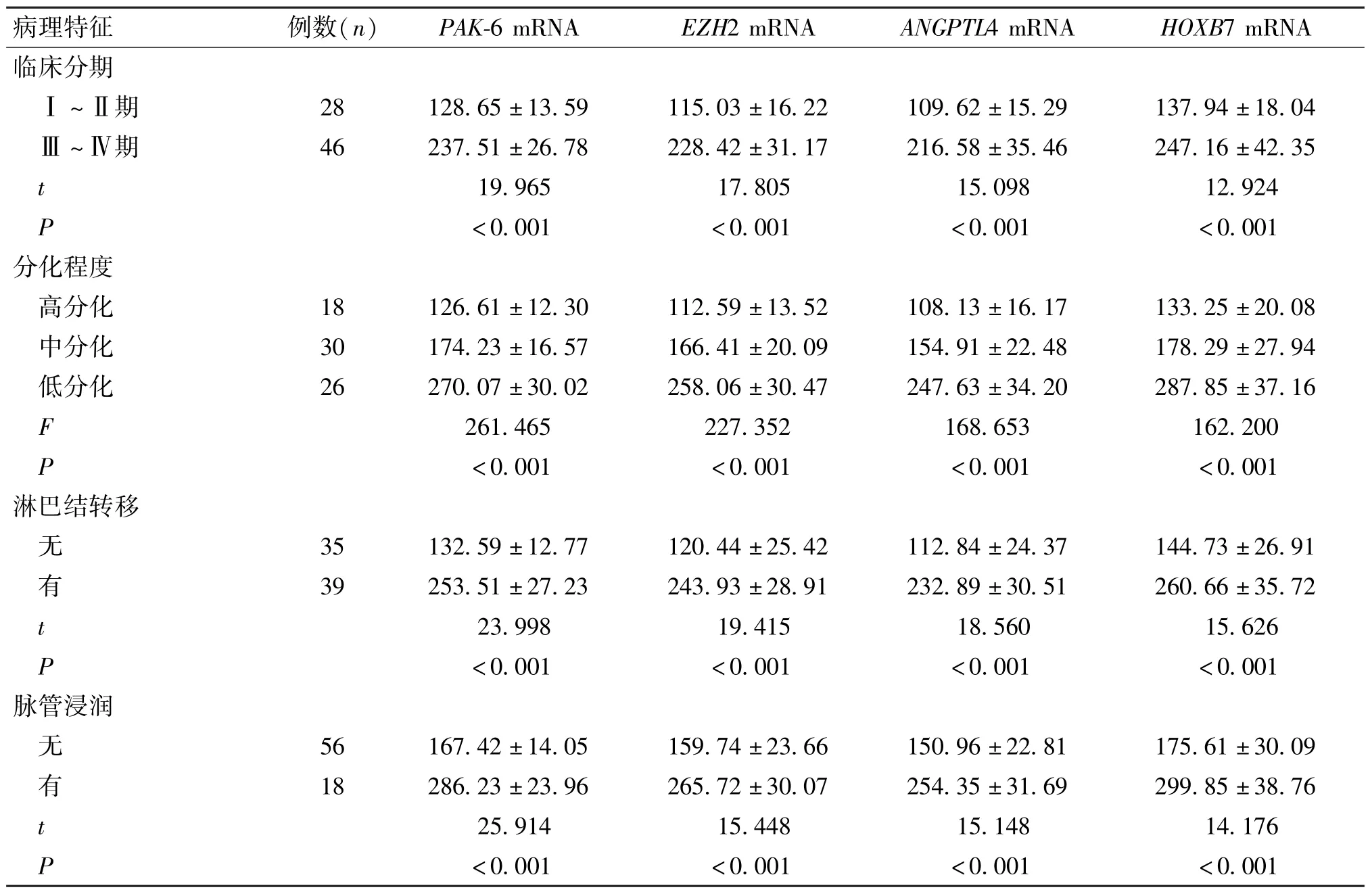
表4 宫颈癌变组中不同生理及病理特征患者恶性生物学行为指标mRNA 表达情况比较()
2.5 免疫浸润相关基因表达与宫颈癌前病变进展至宫颈癌的关系
以宫颈癌变组与宫颈癌前病变组共148 例患者中HLA-G、FOXP3、TIM-3 的mRNA 表达水平的平均值(分别为0.93、3.05、19.60)为界分为各基因的高表达组与低表达组。
危险度分析显示,HLA-G、FOXP3、TIM-3 mRNA高表达组中患者宫颈癌前病变进展至宫颈癌的风险分别是低表达组患者的3.005 倍、4.654 倍、3.343倍(表5)。

表5 免疫浸润相关基因与宫颈癌前病变进展至宫颈癌的关系
2.6 宫颈癌患者免疫浸润相关基因与恶性生物学行为相关性
Pearson相关性分析,宫颈癌患者中HLA-G、FOXP3、TIM-3 mRNA 表达水平与侵袭相关基因PAK-6、EZH2 mRNA 和增殖相关基因ANGPTL4、HOXB7 mRNA 的表达水平均呈正相关(P<0.05)(表6)。

表6 宫颈癌患者免疫浸润相关基因与恶性生物学行为相关性
2.7 不同免疫浸润相关基因的表达水平与宫颈癌患者3 年生存率
宫颈癌患者随访3 年,2 例失访,72 例3 年生存率为68.06 % (49/72)。KM 曲线分析,HLA-G、FOXP3、TIM-3 mRNA 高表达组患者3 年生存率分别为62.71 %(37/59)、65.08 %(41/63)、62.50 %(35/56)低于低表达组患者的92.31 % (12/13)、88.89 %(8/9)、87.50 %(14/16)(P<0.05)(图1)。
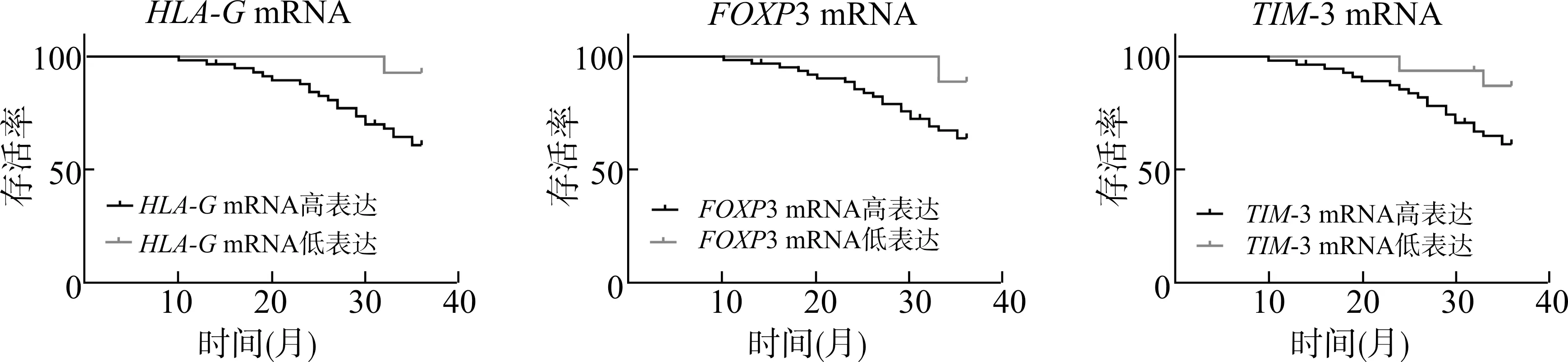
图1 不同免疫浸润相关基因表达水平宫颈癌患者3 年生存曲线
3 讨论
宫颈癌前病变发展至宫颈癌是一个多步骤、多因素的过程,其中人乳头瘤病毒(human papillomavirus,HPV)感染仅是宫颈癌发生的必要条件,并不是充分条件,癌前病变能否发展为宫颈癌还与宿主因素联系较为紧密,而免疫功能是最重要的宿主因素[7-8]。同时,大量临床实践证实,浸润肿瘤的免疫细胞对肿瘤发生发展和抗肿瘤治疗具有较为深远的影响[9-10]。因此,积极探索免疫浸润相关基因的改变对宫颈癌发生发展的影响成为临床重要研究方向。
HLA-G 是一种非经典的HLA-Ⅰ类抗原分子,具有分布局限性,最早研究发现其可保护胚胎免受母体免疫系统的攻击,近年来相关报道证实,HLA-G在多种恶性肿瘤中呈阳性表达,可能是肿瘤细胞逃避宿主免疫防御的途径之一[11-12]。FOXP3 属于Treg 特异性高表达转录因子,可直接抑制活化T 细胞核因子和核细胞κB 这两种T 细胞关键转录因子活性,调节机体免疫反应[13]。沙梦玲等[14]报道指出,FOXP3 高表达可阻碍免疫系统对非小细胞肺癌肿瘤细胞的监视,为肿瘤细胞免疫逃逸提供有利条件。Tim-3 是临床常见的免疫检测点分子,在机体自身免疫、Th1 细胞免疫中发挥重要作用[15]。动物实验证实,Tim-3 及其配体在肿瘤免疫的小鼠模型中具有介导免疫耐受作用[16]。为此,本研究尝试探讨以上免疫浸润相关基因mRNA 在宫颈癌与宫颈癌前病变中的表达,结果显示,HLA-G、FOXP3、TIM-3 mRNA 相对表达量在宫颈正常组、宫颈癌前病变组、宫颈癌变组呈不断升高趋势,可见HLA-G、FOXP3、TIM-3 基因上调表达参与宫颈癌前病变与宫颈癌发生过程。
产生上述结果的原因如下:HLA-G 在此过程中的作用机制主要是可结合CD8+T 细胞,上调凋亡因子及其配体表达,诱导CD8+T 细胞凋亡,抑制机体免疫应答反应;能结合多种抗原递呈细胞表面的受体ILT-4,减弱其抗原递呈功能,降低免疫系统对肿瘤细胞的防御能力;还能黏附在肿瘤细胞表面识别、结合杀伤细胞抑制性受体,激活肿瘤细胞浆内的免疫受体酪氨酸抑制基序,从而抑制细胞毒性T 淋巴细胞、NK 细胞活性,使肿瘤细胞避免被溶解,从而促进恶性肿瘤发生[17-18]。FOXP3 主要是经由阻碍肿瘤相关抗原抗体的有效免疫应答,致使肿瘤细胞逃避免疫系统的监视,促进肿瘤进展[19]。相关研究显示,FOXP3 在宫颈间质组织中定位于T 细胞的细胞核,在宫颈癌细胞中于细胞浆内表达,能通过抑制机体免疫反应和肿瘤间质T 细胞活化参与宫颈癌肿瘤细胞免疫逃逸,加快宫颈癌发生[20]。Tim-3 则是经由参与扩增髓系来源移植细胞增殖、T 细胞功能障碍或消耗等途径在肿瘤免疫中发挥负调控作用[21]。亦有报道表明,Tim-3 可通过其特异性配体半乳凝素-9(Gal-9)产生抑制信号,诱导Th1 细胞死亡,负调节Th1 细胞免疫应答,从而共同调控机体抗肿瘤的免疫应答反应,在肿瘤发生过程中扮演重要的免疫调节角色[22]。同时,本研究发现,HLA-G、FOXP3、TIM-3 基因mRNA 高表达会显著增加宫颈癌前病变进展至宫颈癌的风险,提示下调HLA-G、FOXP3、TIM-3 基因mRNA 表达可能是降低宫颈癌发生风险的重要环节,临床可将上述免疫浸润相关基因作为预防宫颈癌的靶基因。
本研究数据还表明,宫颈癌患者HLA-G、FOXP3、TIM-3 mRNA 与侵袭相关基因PAK-6、EZH2 mRNA、增殖相关基因ANGPTL4、HOXB7 mRNA 表达呈正相关,提示免疫浸润相关基因HLA-G、FOXP3、TIM-3 基因mRNA 上调可能与宫颈癌细胞增殖、侵袭等作用有关,与宫颈癌进展相关,可为临床控制宫颈癌病情进展提供潜在的新途径。此外,本研究对宫颈癌患者随访3 年发现,HLA-G、FOXP3、TIM-3 mRNA 高表达组患者3 年生存率低于低表达组患者,可见HLA-G、FOXP3、TIM-3 基因mRNA 水平与宫颈癌患者生存预后有关,但其中具体机制与原因仍需进一步探讨。
综上可知,免疫浸润相关基因HLA-G、FOXP3、TIM-3 mRNA 在宫颈癌与宫颈癌前病变中呈上调表达,会显著增加宫颈癌发病风险,且与宫颈癌恶性生物学行为密切相关,还可能对生存预后产生重要影响。
