BMP9 通过P38 MAPK 信号通路对成骨细胞自噬和凋亡的作用研究
2023-11-20张阳马菁菁喻哲昊刘雪妮孙林春
张阳,马菁菁,喻哲昊,刘雪妮,孙林春
南京医科大学附属儿童医院检验科 南京市,210008
骨骼是人体的重要组织器官,具有支持、保护和运动功能。骨组织的新陈代谢活跃,始终处于成骨细胞介导的骨形成和破骨细胞介导的骨吸收过程的动态自我更新和平衡中,即骨的重塑[1]。生理情况下,成骨细胞和破骨细胞协同作用,在骨形成和骨吸收之间形成稳态,以维持正常的骨骼细胞形态、数量和功能[2]。骨代谢过程的任一环节出现异常都会导致代谢性骨病的发生。代谢性骨病的发病与营养、药物、衰老等多种因素有关。过去的很长时间里,研究者对骨重塑障碍的关注点更多集中在破骨细胞的过度活化。然而近年来,成骨细胞功能异常在骨重塑障碍和代谢性骨病的研究中越来越受重视[3]。成骨细胞(osteoblast,OB) 起源于间充质细胞,主要存在于骨外膜的内层、骨髓内以及穿行于骨内的小血管周围,是骨形成的主要执行者。有研究发现,成骨细胞分泌的骨胶原、骨基质、细胞因子和酶等能激活骨形成过程,并对破骨细胞的生成、成熟与活化有调控作用[4]。骨髓间充质细胞的自我更新活跃度下降和向成骨细胞分化障碍,会导致骨形成减少,易发骨质疏松、骨折修复能力低等问题[5]。研究成骨细胞的生物学行为及调控机制,对于了解代谢性骨病的发病机理并以成骨细胞为切入点寻找治疗策略,具有重大价值。
自噬是一种细胞在应激刺激下的生存机制,基础水平的自噬能维持细胞稳态;当机体遭遇应激刺激时,自噬通过降解一些非必需的细胞器,帮助细胞以最低的能耗生存下来。近来不断有研究发现,自噬现象贯穿各类骨细胞的发育成熟过程,对骨代谢平衡有调节作用,自噬异常可能成为骨代谢疾病新的发病机制[6]。通过调节自噬改变骨组织结构、改善代谢性骨病病程,已成为骨科领域研究的热点之一。骨形成蛋白 (bone morphogenetic protein,BMPs) 是一类重要的骨诱导因子,目前发现的BMPs 成员有20 多种,BMP9 是BMPs 家族一员,在造血、神经元分化发育、物质代谢等过程中都有重要功能[7-8],近来有研究发现BMP9 能诱导间充质干细胞向成骨细胞和软骨细胞分化,与骨形成有关[9-10]。P38 MAPK 是BMP9 的一个下游通路,参与细胞自噬过程[11]。此外,在肿瘤[12]、干细胞定向分化[13]、肝脏疾病[14]等的发生发展中都有BMP9/P38 MAPK 途径参与的相关报道。P38 MAPK 活化对破骨细胞、成骨细胞及软骨细胞活化或凋亡有影响,参与骨代谢进程[15-16],但具体机制未完全阐明。本研究中,我们拟探索BMP9/P38 MAPK 信号通路通过调控成骨细胞自噬,影响成骨细胞增殖和凋亡,参与骨形成的过程,揭示其在骨重塑过程中的作用。
1 材料和方法
1.1 细胞系
将本实验室长期保种的小鼠成骨细胞系细胞系MC3T3-E1,用含10 %胎牛血清和双抗霉素的α-MEM 培养基,37 ℃,5 % CO2,饱和湿度培养。自噬诱导方法如下: 将成骨细胞MC3T3-E1 用200 ng/mL 雷帕霉素(rapamycin) 处理24 h,对照组则加入等体积的雷帕霉素稀释液。
1.2 主要仪器和试剂
雷帕霉素(北京索莱宝科技有限公司)、TRIzol 试剂盒(日本Takara 公司)、SuperReal PreMix Plus 试剂盒(北京天根生化科技有限公司)、Western 印迹兔单克隆抗体(ab207318,美国Abcam 公司) 和羊抗兔多克隆抗体(ab205718,美国Abcam 公司)、真核表达载体pcDNA3.1 (上海吉凯基因)、siRNA (上海吉玛基因)、Lipofectamine 2000 转染试剂(美国Invitrogen 公司)、P38 MAPK激活剂和抑制剂(北京中杉金桥生物技术有限公司)、CCK-8 试剂盒和ROS 检测试剂盒(南京建成生物科技研究所)、Annexin V-FITC/PI 细胞凋亡试剂盒(美国BD 公司)。
1.3 细胞分组及处理
pcDNA3.1-BMP9 组(转入pcDNA3.1-BMP9)、BMP9 siRNA 组(转入BMP9 siRNA)、P38 激活组(10 μmol/L 茴香霉素处理)、P38 抑制组 (10 μmol/L SB-202190 处理)、pcDNA3.1-BMP9+P38抑制组 (pcDNA3.1-BMP9+10 μmol/L SB-202190)、BMP9 siRNA+P38 激活组(BMP9 siRNA+10 μmol/L 茴香霉素处理),同时设立pcDNA3.1 组(转入pcDNA3.1)、siRNA NC 组(转入siRNA NC) 和对照组(不做处理)。
1.4 pcDNA3.1-BMP9 和BMP9 siRNA 构建
根据NCBI 检索的基因序列设计并合成针对BMP9 开放阅读框的上下游引物,PCR 扩增BMP9开读框序列,上游引物5′-TTCCTTCAGAGCAAACAGCA-3′,下游引物 5′-GTTGTGCTCAAATCCCCATT-3′,反应产物经回收、测序无误后,在序列两端加上EcoRⅠ和XbaⅠ内切酶位点,再与用限制性内切酶EcoR Ⅰ和XbaⅠ双酶切后的线性pcDNA3.1 质粒大片段按2∶1 摩尔比例,T4 连接酶16 ℃过夜。连接产物转化大肠埃希菌感受态细胞,长出的克隆用载体特异性上下游引物先将进行PCR 鉴定,再测序验证。由上海吉玛基因公司设计并合成3 条BMP9 siRNA 和1 条siRNA NC,引物序列见表1,转染MC3T3-E1 细胞后,定量PCR 验证其对BMP9 的干涉效果,上游引物为5′-GGACCCGATGCGGTTAGAG-3′,下游引物为 5′-ATCAAGTGGATGCCCCACAG-3′;内参基因GAPDH上游引物为5′-GAATGGGCAGCCGTTAGGAA-3′,下游引物为5′-AGGAAAAGCATCACCCGGAG-3′,干涉效率最高的siRNA 用于正式实验。

表1 BMP9 siRNA 和siRNA NC 引物序列
1.5 细胞转染
将MC3T3-E1 细胞按105个/孔接种到6 孔板中,培养过夜。转染前1 h 更换不完全培养液,用Lipofectamine 2000 转染试剂盒,根据操作说明进行细胞转染,放回培养箱培养6 h 后,更换新鲜完全培养基,继续培养48 h,收集细胞检测转染效率,进行后续实验。
1.6 蛋白免疫印迹实验
收集各组细胞于EP 管,加入1 mL RIPA 冰浴裂解20 min,低温高速离心后,将上清转移到新EP 管,煮沸5 min,再次离心后取上清,BCA 法进行蛋白定量。聚丙烯酰胺凝胶(8 %分离胶,12 %浓缩胶) 电泳(80 V,20 min;120 V,90 min),转印至硝酸纤维素膜(350 mA,90 min)。封闭2 h后洗膜,加入1∶1 000 稀释后的一抗4 ℃过夜,充分洗膜,再加入1∶2 000 酶标二抗,室温孵育1 h;洗膜,ECL 显影,用自动凝胶成像分析仪检测各组细胞BMP9、P38 MAPK、LC3-Ⅱ、Beclin-1、P62蛋白表达。
1.7 细胞增殖检测
各组细胞用胰酶消化后调整浓度为1 ×105个/mL,按100 μL/孔接种96 孔板,置于培养箱培养46 h;每孔加入10 μL CCK-8 试剂,避免产生气泡影响读数,再放回培养箱孵育2 h;取出96 孔板,用全自动酶标仪在450 nm 处检测各孔吸光度,反映细胞增殖情况。
1.8 细胞凋亡检测
将各组细胞用胰酶消化,用1 ×PBS 制成105个/mL 的单细胞悬液,按100 μL/孔加入上样管中,先加入20 μL FITC,涡旋混匀后,室温避光孵育20 min;再加入20 μL PI,混匀后再次避光孵育20 min;每管加入500 μL 1 ×PBS 缓冲液,混匀后1 h 内上机检测。
2 结果
2.1 筛选有效的BMP9 siRNA
定量PCR 结果(图1) 显示,转染BMP9 siRNA-1、BMP9 siRNA-2 和BMP9 siRNA-3 的细胞BMP9 mRNA 表达水平分别为 (0.66 ± 0.12)、(0.53 ±0.10) 和(0.41 ±0.09),均较对照组显著降低(P<0.01),BMP9 siRNA-3 的干涉效果最好,故选定BMP9 siRNA-3 为有效siRNA 用于后续实验。

图1 BMP9 siRNA 干涉效果鉴定
2.2 Rapamycin 诱导MC3T3-E1 细胞自噬
由图2 可见,Rapamycin 组MC3T3-E1 细胞LC3-Ⅱ和Beclin-1 蛋白水平较对照组高 (P<0.05),P62 蛋白水平较对照组低(P<0.05)。结果表明Rapamycin 诱导MC3T3-E1 细胞发生自噬。

图2 Rapamycin 诱导的MC3T3-E1 细胞自噬相关蛋白表达水平
2.3 Rapamycin 诱导MC3T3-E1 细胞BMP9 表达和P38磷酸化
由图3 可见,Rapamycin 组MC3T3-E1 细胞BMP9 蛋白水平较对照组升高(P<0.05);P38 蛋白水平与对照组无差异,p-P38 蛋白水平较对照组升高(P<0.05)。结果显示,Rapamycin 能诱导细胞BMP9 高表达和P38 磷酸化。

图3 Rapamycin 诱导的MC3T3-E1 细胞BMP9 和P38 蛋白表达水平
2.4 BMP9/P38 MAPK 对MC3T3-E1 细胞自噬的调控
由图4A 可见,pcDNA3.1-BMP9 组MC3T3-E1细胞LC3-Ⅱ和Beclin-1 蛋白水平高于对照组(P<0.05),P62 蛋白水平较对照组低 (P<0.05);BMP9 siRNA 组细胞LC3-Ⅱ和Beclin-1 蛋白水平低于对照组(P<0.05),P62 蛋白水平高于对照组(P<0.05),pcDNA3.1 组和siRNA NC 组细 胞LC3-Ⅱ、Beclin-1 和P62 蛋白水平与对照组无差异(P>0.05)。结果表明,BMP9 能引起MC3T3-E1细胞自噬。

图4 BMP9/P38 MAPK 对MC3T3-E1 细胞自噬的影响
图4B 显示,P38 激活组MC3T3-E1 细胞LC3-Ⅱ和Beclin-1 蛋白水平高于对照组(P<0.05),P62 蛋白水平较对照组低(P<0.05);P38 抑制组LC3-Ⅱ和Beclin-1 蛋白水平低于对照组 (P<0.05),P62 蛋白水平高于对照组(P<0.05),提示P38 通路活化能引起MC3T3-E1 细胞自噬。pcDNA3.1-BMP9+P38 抑制组细胞LC3-Ⅱ、Beclin-1和P62 蛋白水平与对照组无差异,BMP9 siRNA +P38 激活组LC3-Ⅱ、Beclin-1 和P62 蛋白水平与对照组无差异(P>0.05) (图4C),提示BMP9 能通过P38 MAPK 通路调控MC3T3-E1 细胞自噬。
2.5 BMP9/P38 MAPK 对MC3T3-E1 细胞增殖和凋亡的影响
由图5A 可见,pcDNA3.1-BMP9 组细胞增殖率为(189 ±13)%,高于对照组(P<0.05);BMP9 siRNA 细胞增殖率为(132 ±10)%,低于对照组(P<0.05);pcDNA3.1 组和siRNA NC 组细胞增殖率与对照组无差异(P>0.05),表明BMP9 能促进MC3T3-E1 细胞增殖。

图5 BMP9/P38 MAPK 对MC3T3-E1 细胞增殖的影响
P38 激活组细胞增殖率为(204 ±14)%,高于对照组(P<0.05);P38 抑制组细胞增殖率为(121 ±6)%,低于对照组(P<0.05) (图5B),表明P38 MAPK 通路能促进MC3T3-E1 细胞增殖。pcDNA3.1-BMP9+P38 抑制组和BMP9 siRNA+P38 激活组细胞增殖率分别为(145±8)%和(156±6)%,与对照组无差异(P>0.05) (图5C),提示BMP9 能通过p38 MAPK 通路调控MC3T3-E1 细胞增殖。
pcDNA3.1-BMP9 组细胞凋亡率为 (6.56 ±1.23)%,低于对照组(P<0.05);BMP9 siRNA组细胞凋亡率为(18.45 ±3.54)%,高于对照组(P<0.05);pcDNA3.1 组和siRNA NC 组细胞凋亡率与对照组无差异(P>0.05),表明BMP9 能减少MC3T3-E1 细胞凋亡(图6)。

图6 BMP9 对MC3T3-E1 细胞凋亡的调控
P38 激活组细胞凋亡率为(4.12 ±0.87)%,低于对照组(P<0.05);P38 抑制组细胞凋亡率为(20.71 ±2.44)%,高于对照组(P<0.05),表明P38 MAPK 通路能减少MC3T3-E1 细胞凋亡 (图7A)。pcDNA3.1-BMP9+P38 抑制组和BMP9 siRNA+P38 激活组细胞凋亡率分别为 (10.04 ±1.78)%和(13.15 ±2.01)%,与对照组无显著性差异(P>0.05) (图7B)。
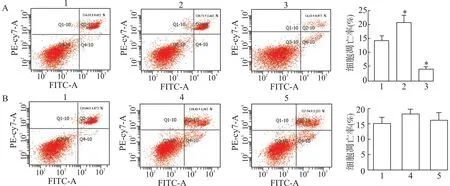
图7 BMP9/P38 MAPK 对MC3T3-E1 细胞凋亡的影响
以上结果提示BMP9 能通过P38 MAPK 通路影响MC3T3-E1 细胞的凋亡。
3 讨论
近年来,不断有研究发现自噬现象贯穿于骨组织及各类骨细胞的发育成熟过程。Shi 等[17]发现糖皮质激素能以剂量依赖的方式影响破骨细胞的生成,随着剂量的升高,破骨细胞内自噬水平也上调;应用自噬抑制剂3-MA 后糖皮质激素对破骨细胞生成的调控作用消失,证明糖皮质激素通过自噬影响破骨细胞生成;Nollet 等[18]发现自噬伴随着成骨细胞的矿化过程,在敲除自噬基因的成骨细胞和自噬基因特异性缺陷小鼠中发现,成骨细胞的矿化能力显著降低,自噬作用与成骨细胞的矿化和骨稳态密切相关。Yang 等[19]研究发现内质网应激能通过诱导成骨细胞自噬,缓解ROS 对成骨细胞的氧化损伤,调节成骨细胞自噬可能对骨质疏松症具有潜在的治疗价值。以上均提示我们自噬通路在骨代谢平衡中有重要的调节作用。我们用自噬诱导剂雷帕霉素处理成骨细胞后发现,细胞的自噬蛋白LC3-Ⅱ和Beclin-1 水平明显升高,同时发现BMP9蛋白水平也升高。目前报道与骨形成有关的BMP家族成员有BMP2、BMP4、BMP5、BMP7、BMP9等。有研究指出,BMP9 能诱导成骨细胞ALP 活性和钙盐沉积,促进裸鼠皮下异位成骨[20]。但关于BMP9 诱导成骨的机制研究还很少,尚未见其他报道。雷帕霉素诱导后,我们还发现,P38 蛋白发生了磷酸化激活。P38 MAPK 是BMP9 的下游通路,上述结果提示我们,雷帕霉素诱导的成骨细胞内发生了自噬和BMP9/P38 MAPK 信号通路的活化。
通过研究我们进一步发现,在MC3T3-E1 细胞中转入外源性BMP9 后,细胞自噬蛋白LC3-Ⅱ和Beclin-1 表达均上调,P62 蛋白表达下调;而转入外源性BMP9 siRNA 后,自噬蛋白LC3-Ⅱ和Beclin-1表达均下调,P62 蛋白表达上调,以上结果表明BMP9 能诱导成骨细胞发生自噬。P38 激活剂处理MC3T3-E1 细胞后,LC3-Ⅱ和Beclin-1 蛋白表达上调,P62 蛋白表达下调;相反地,P38 抑制剂处理的MC3T3-E1 细胞LC3-Ⅱ和Beclin-1 蛋白表达下调,而P62 蛋白表达上调,说明P38 MAPK 通路活化能引起成骨细胞自噬。
目前对调控骨细胞自噬过程的相关蛋白和信号通路的研究较少。已有的研究中,Pantovic 等[21]研究发现,AMPK 通路能通过mTOR 抑制介导的细胞自噬控制间充质干细胞的成骨分化。Song 等[22]发现PTEN 和Notch 信号通路对骨髓间充质干细胞自噬有调控作用,从而影响骨髓间充质干细胞的成脂分化。用不同浓度NF-κB 信号通路抑制剂SN50 体外诱导小鼠成骨细胞MC3T3-E1,发现细胞自噬水平明显升高[23]。BMP9 能活化P38 MAPK 信号通路,诱导间充质干细胞的定向分化[24];且BMP9和P38 MAPK 信号通路与自噬的关系已经得到诸多研究证实,但目前尚未见BMP9/P38 MAPK 与骨细胞自噬的研究报道。我们发现,用P38 抑制剂处理转入了外源性BMP9 基因的MC3T3-E1 细胞后,细胞的LC3-Ⅱ、Beclin-1 和P62 蛋白水平均回复至与对照组相当的水平,说明阻断P38 活化能有效抑制BMP9 高表达所引起的细胞自噬;而对转入了外源性BMP9 siRNA 的MC3T3-E1 细胞用P38 激活剂处理后,细胞的LC3-Ⅱ、Beclin-1 和P62 蛋白水平也与对照组无显著差异,即P38 活化能逆转BMP9 低表达对成骨细胞自噬的抑制作用,BMP9 通过调控P38 MAPK 信号通路诱导成骨细胞发生自噬。
自噬是细胞在应激条件下的一种自我保护机制。自噬与凋亡的平衡对维持细胞稳态至关重要,在骨代谢疾病和恢复过程中常伴随成骨细胞自噬和凋亡的发生,两者在功能上既存在联系,又有明显不同。自噬可以发生在凋亡之前,并启动细胞凋亡;也可以保护细胞免于凋亡和坏死。我们发现,BMP9 高表达和P38 MAPK 活化都能促进MC3T3-E1 细胞的增殖,抑制细胞的凋亡;P38 抑制剂能抑制BMP9 高表达的MC3T3-E1 细胞增殖,促进细胞凋亡,而P38 活化剂能促进BMP9 低表达的MC3T3-E1 细胞增殖,抑制细胞凋亡。我们的研究结果表明,MC3T3-E1 细胞发生自噬时,细胞凋亡减少;抑制MC3T3-E1 细胞自噬时,细胞凋亡增加,即自噬可能抑制MC3T3-E1 细胞凋亡,说明自噬活性对成骨细胞的保护作用。
综合以上,BMP9 能通过P38 MAPK 信号通路调控成骨细胞自噬和凋亡,这为BMP9/P38 MAPK 通路在骨代谢疾病中的应用提供新证据,也为进一步揭示细胞自噬对成骨细胞的保护作用的机制提供新思路,对骨代谢疾病的临床治疗及修复有积极的意义。
