去外泌体血清制备方法筛选及对成骨细胞与破骨细胞生物活性的影响
2023-11-13司誉豪
司誉豪,马 勇,尹 恒
0 引 言
外泌体是一类纳米级(30~150 nm)内源性细胞囊泡,由不同类型的组织细胞分泌,广泛分布于外周血液、尿液、关节液、脑脊液等生物体液中。外泌体能够携带各种功能性生物分子,包括蛋白质、信号分子、mRNA、miRNA等[1]。供体细胞通过外泌体将遗传信息和蛋白质传递给靶细胞,在细胞间通讯中起着至关重要的作用[2]。当前对于外泌体的研究涉及人体多组织细胞,其中,成骨细胞与破骨细胞的外泌体活性及其生物作用愈发引起关注,是骨质疏松症领域的研究热点之一[3]。
研究表明,成骨细胞来源外泌体对骨组织具有靶向作用,在骨微环境中与破骨细胞的相互作用,可载核因子κB受体活化因子配体(receptor activator for nuclear factor-κB ligand,RANKL)与二磷酸盐等药物对破骨细胞产生调控作用[4-5],在开发抗骨质疏松生物技术方面具有广阔前景。破骨细胞源性外泌体含有多种关键骨调节蛋白,对骨感觉神经支配具有塑造和引导作用,可调节成骨细胞骨形成[6]。可见,研究成骨与破骨细胞来源外泌体的特征以及生物作用对揭示成骨细胞-破骨细胞之间crosstalk机制意义重大[7]。然而,成骨与破骨细胞的培养需要加入胎牛血清,其中含有大量血清外泌体,对目标外泌体提取与分析等实验结果会产生较大干扰[8]。部分研究在分离外泌体前会选择短期使用无血清培养基以排除干扰,但会对细胞自身活性以及外泌体产出造成不利影响,因而目前研究主要以去外泌体血清来培养细胞。去外泌体血清制备方法较多,暂无统一标准,因此本文基于MISEV2018选取3种主流方法制备去外泌体血清[9],评估去除效果以及对成骨与破骨细胞生物活性的影响,为进一步获取合格的成骨、破骨细胞来源外泌体用于骨质疏松症领域的研究提供方法借鉴。
1 材料与方法
1.1 材料用于分离原代成骨细胞的新生乳大鼠及分离破骨细胞的12周龄大鼠购买自南京市青龙山动物繁殖场,大鼠饲养温度18~22 ℃,湿度40%~70%,光照12 h,昼夜交替。实验动物许可证号:SCXK(浙)2019-0002。DMEM、澳洲胎牛血清、青霉素链霉素双抗、PBS、胰蛋白酶、Ⅱ型胶原蛋白酶购买自美国Gibco公司,TSG101(ab125011)、CD63(ab134045)、CD9(ab236630)、Calnexin(ab133615)抗体购买自美国Abcam公司,去外泌体胎牛血清购买自上海逍鹏生物科技有限公司,碱性磷酸酶染色液购买自上海懋康生物有限公司,茜素红s染色液购买自北京索莱宝科技有限公司,苏木精染色试剂盒、BeyoClickTMEdU-555细胞增殖检测试剂盒、Annexin V-FITC细胞凋亡检测试剂盒购买自上海碧云天生物有限公司。
1.2 方法
1.2.1 去外泌体血清制备根据外泌体指南MISEV2018选取3种主流方法[9]。方法一:纯胎牛血清以100 000×g,4 ℃离心18 h后取75%上清液;方法二:胎牛血清与细胞培养基以1∶4比例混合,以100 000×g,4 ℃离心18 h,取75%上清液;方法三:纯胎牛血清超高离心力180 000×g离心3 h,取75%上清液。
1.2.2 纳米颗粒测定使用纳米颗粒追踪分析技术(nanoparticle Tracking Analysis,NTA)检测上述3种方法离心前后血清及商品化去外泌体血清中纳米级颗粒浓度变化情况,并据此选出最佳方法制备去外泌体血清用于后续实验。
1.2.3 Western blot检测外泌体标志蛋白去外泌体血清设为Exo-free组,普通胎牛血清设为对照组。采用Western blot技术检测两组的外泌体标志蛋白:以超速离心110 000×g,4 ℃离心6 h提取各组去外泌体血清及市售商品化去外泌体血清中的外泌体,BCA法测定蛋白浓度,以每孔20 μg将5×SDS-PAGE上样缓冲液和外泌体蛋白样品以1∶4比例混合,在水浴锅中加热煮沸15 min,令蛋白充分变性,冷却后放入超低温冰箱备用。制备SDS-PAGE凝胶进行上样、电泳与转膜操作。TBST漂洗3次,每次5 min,加入5%脱脂牛奶里,置于摇床振荡封闭2 h。TSG101、CD63、CD9、Actin抗体孵育过夜,TBST漂洗3次,继续加入相应二抗,室温孵育2 h,上机检测。
1.2.4 成骨细胞分离将新生乳鼠脱颈处死,置于灌满75%乙醇烧杯浸泡5 min消毒,分离颅骨置于含有PBS的50 mL离心管内,将离心管于涡旋振荡仪上振荡2 min,将混有血丝的PBS弃掉,加入0.25%胰蛋白酶,将颅骨组织剪成约1 mm×1 mm大小的碎块,放入培养箱内消化30 min。终止消化后离心去除上层消化液,加入0.1%Ⅱ型胶原酶,置于恒温振荡箱中消化4 h,终止消化后将悬液过100 μm细胞筛,离心获得细胞沉淀,重悬。
1.2.5 成骨细胞生物活性检测去外泌体血清设为Exo-free组,普通胎牛血清设为对照组。具体方法:①第7天时行碱性磷酸酶染色:多聚甲醛固定20 min,按照说明书配制ALP孵育液加入培养皿中,培养皿放入湿盒中,常温避光孵育20 min,弃液,漂洗,倒置显微镜下观察拍照;②第21天时行茜素红+苏木精染色:多聚甲醛固定20 min,去离子水漂洗,加入茜素红s染色液,常温孵育30 min,弃液,再次漂洗,加入苏木精染色液10 min,弃液漂洗后于倒置显微镜下观察拍照。使用Image J半定量分析比较两组ALP阳性与矿化结节区域面积。
1.2.6 破骨细胞分离与诱导取12周龄大鼠,分离出胫骨与股骨,两端离断后用1 mL注射器吸入足量血清,吹出骨髓,加入红细胞裂解液去除红细胞,离心弃沉淀获得单核细胞悬液,置于培养皿中培养,隔天半量换液。在确定细胞存活后,加入100 ng/mL RANKL与30 ng/mL M-CSF,每2天换液1次,诱导至第4天或第5天时观察细胞是否融合。
1.2.7 破骨细胞生物活性检测①TRAP染色鉴定:多聚甲醛固定10 min,漂洗,加入透膜液,室温反应5 min,吸弃漂洗,加入说明书推荐比例的TRAP染色液,放于37 ℃培养箱内反应45 min,漂洗后加入苏木精染色液反应3 min,漂洗后镜下观察,使用Image J半定量分析阳性区域;②骨吸收功能:在骨吸收板中诱导破骨细胞,第5天时吸弃培养液,无菌去离子水漂洗沥干,置于倒置显微镜下观察,每组100倍镜下随机选取3个视野内骨吸收陷窝数量记录。
1.2.8 成骨细胞增殖活性检测EdU法:常规固定、通透细胞,按照产品说明书配制Click反应液,每孔加入0.5 mL Click反应液,摇晃均匀使之充分接触,室温避光下孵育30 min,去离子水漂洗,DAPI染料对细胞核染色5 min,漂洗,置于荧光显微镜下观察,所得图像使用Image J进行半定量分析。
1.2.9 成骨细胞凋亡检测吸弃培养液并漂洗,用细胞刮刀将细胞刮下,加入500 μL Binding Buffer与5 μL Annexin V-EGFP混匀后,再加入5 μL Propidium Iodide,4 ℃下避光反应10 min,上机检测,Ideas软件分析细胞凋亡率。
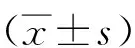
2 结 果
2.1 3种超速离心法与商品化去外泌体血清中纳米颗粒数比较NTA结果显示各组纳米颗粒数分别为方法一:(6.3×108±0.16×108)个/mL;方法二:(5.2×109±1.25×109)个/mL;方法三:(9.10×109±2.08×109)个/mL;商品化去外泌体血清:(1.70×109±0.27×109)个/mL;普通胎牛血清:(9.1×1010)个/mL,单因素方差分析提示以上4组比较具有统计学差异(P<0. 01),其中,方法一去除效果最佳,外泌体清除率约达到99.31%,高于商品化血清的98.14%,SNK-q检验提示,方法一的纳米颗粒数明显低于商品化去外泌体血清,具有显著统计学差异(P<0. 01),故选取方法一行后续实验。
2.2 Western blot检测胎牛血清去外泌体效果Western blot结果显示Exo-free组外泌体标志蛋白CD63、CD9、TSG101表达相较于对照组明显降低,表明方法一的血清外泌体清除效果显著,见图1。

图1 Western blot检测外泌体标志蛋白表达Figure 1 Western blot of exosome marker protein expression
2.3 去外泌体血清对成骨细胞成熟与矿化的影响第7天两组均见成骨细胞贴壁生长,形态不规则,当细胞量接近90%时呈现“鹅卵石样”排布,生长状态良好;ALP染色后两组细胞均呈现紫色阳性区域,提示细胞成熟;第21天两组细胞均连接成片,形成矿化结节,茜素红染色后结节呈红色。Image J半定量分析表明Exo-free组细胞ALP阳性面积(2 390 229±191 425)、矿化结节面积(5 723 563±505 532)较对对照组(2 637 895±271 639、6 637 895±181 396)差异无显著统计学意义(P>0.05),提示去外泌体血清未明显影响成骨细胞成熟与矿化,见图2。

a:成骨细胞形态学观察;b:ALP染色( ×100);c:茜素红、苏木精染色( ×100)图2 成骨细胞形态、ALP及茜素红染色Figure 2 Osteoblast morphology, ALP and alizarin red staining
2.4 去外泌体血清对破骨细胞分化与骨吸收功能的影响对照组用普通胎牛血清培养,Exo-free组用方法一去外泌体血清培养。两组在诱导第5天时均可见细胞明显融合,TRAP染色结果显示两组骨髓单核细胞均可在M-CSF及RANKL的诱导下融合为破骨细胞,Exo-free组融合面积(293 563±15 417)较对照组(304 561±42 250)差异无统计学意义(P>0.05)。此外,Exo-free组在骨吸收板上形成明显骨吸收陷窝数量[(178.7±16.7) 个)]较对照组[(185.7±14.8) 个)] 差异无统计学意义(P>0.05)。上述结果表明去外泌体血清并不会影响骨髓单核细胞向破骨细胞的分化与破骨细胞骨吸收功能,见图3。

a:破骨细胞TRAP染色( ×100);b:骨吸收陷窝( ×100)图3 破骨细胞TRAP染色、骨吸收陷窝及Image J半定量分析Figure 3 osteoclasts TRAP staining and bone resorption lacunae
2.5 去外泌体血清对成骨细胞增殖的影响EdU结果显示24 h与48 h的Exo-free组成骨细胞增殖活性均略低于对照组,但两者差异无统计学意义(P>0.05),提示成骨细胞增殖并未明显受到去外泌体血清的限制,见图4。

图4 EdU法检测成骨细胞增殖活性Figure 4 Proliferative activity of osteoblasts detected by the EdU method
2.6 去外泌体血清对成骨细胞凋亡的影响使用Annexin V-FITC细胞凋亡检测试剂盒染色成骨细胞后用流式细胞仪进行分析,结果显示无论48 h或96 h,Exo-free组早期或晚期凋亡率均略高于对照组,但差异无统计学意义(P>0.05),表明去外泌体血清未明显改变成骨细胞的凋亡情况。见表1,图5。

表1 各组成骨细胞早期与晚期凋亡率比较Table 1 Comparison of early and late apoptosis rates of osteoblasts in two groups
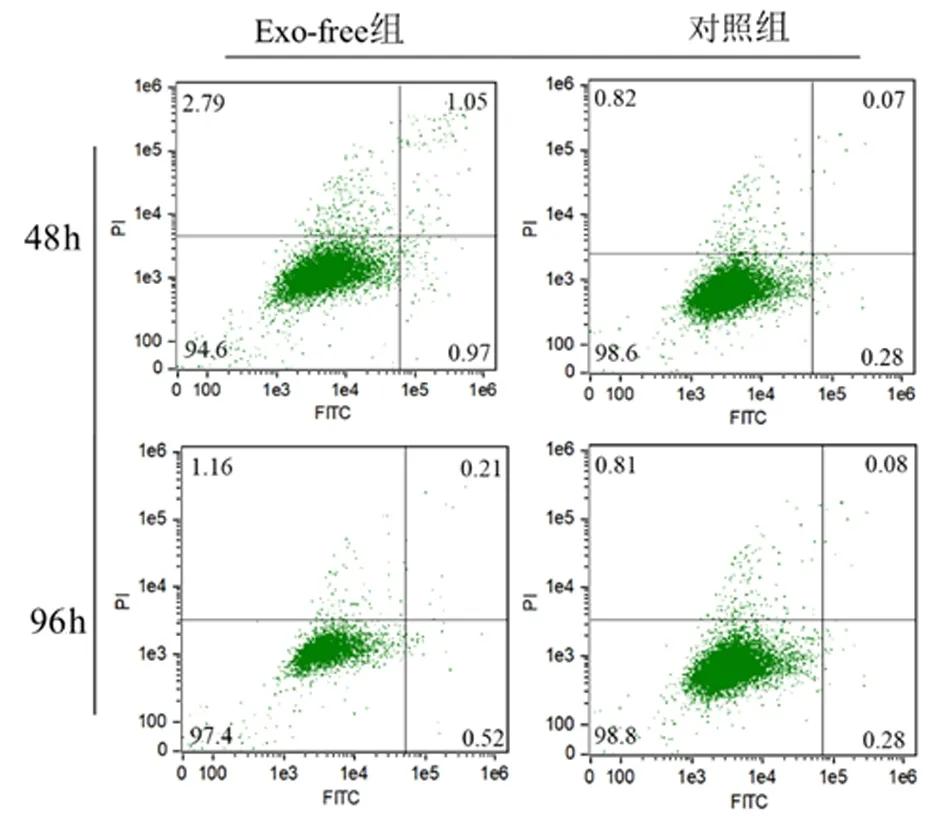
图5 流式细胞仪检测成骨细胞凋亡结果Figure 5 Flow cytometry results of osteoblast apoptosis
3 讨 论
外泌体是细胞间通讯的重要媒介,参与多种正常生理过程和病理进展。外泌体可通过胞吞作用或膜融合内化,将其内容物释放到受体细胞中[10-11],包括各类蛋白质、糖类、脂类及DNA、mRNA等,这些物质受到限制膜保护,不受细胞外的蛋白酶与核酸酶的影响,使得外泌体在细胞微环境中稳定传输生物信息[12]。成骨细胞与破骨细胞之间的信号交流目前有3种已知的机制[13]:①细胞直接接触,通过细胞膜表面的受体-配体结合,激活细胞内信号通路,完成信息传递;②旁分泌机制,分泌水溶性旁分泌因子传递细胞信号;③分泌细胞因子沉淀于骨基质中,通过骨基质调节骨重建。近年来的研究表明,旁分泌机制在维持骨稳态的过程中发挥了关键的作用,成骨细胞与破骨细胞外泌体均参与调节骨重建过程,因而在骨质疏松症相关研究中备受关注[7, 14-15]。在骨重建的微环境中,外泌体可向成骨细胞传递特异性蛋白(如Sema4D、tenascin C)、miRNA以及生长因子(如BMP7、TGF/β)以调节骨形成[4, 16]。外泌体也能向破骨细胞递送miRNA、RANK以及RANKL等细胞因子调节骨吸收过程[7, 16-17]。此外,外泌体包裹生物活性分子,可作为骨质疏松症诊断和预后的生物标志物[18]。同时,相较于干细胞注射治疗,外泌体易通过生物屏障,在膜完整的情况下不会引起免疫反应,具备全身特异性递送的可行性,对开发骨质疏松症靶向药物具有重要意义[19],因此,进一步研究成骨与破骨细胞来源外泌体的生物特性与功能十分必要。
目前一些高质量外泌体研究主要使用去外泌体血清培养细胞[20-22],然而无论是用外泌体分离试剂盒或是超速离心法分离目标细胞外泌体,都需要首先提取细胞上清液,而血清是维持细胞生长的必需品,如直接用含血清细胞上清分离外泌体势必会导致所得外泌体掺杂大量牛源性外泌体,对后续实验结果造成干扰。不仅如此,胎牛血清外泌体对某些细胞功能也存在影响。如血清外泌体能促进乳腺癌细胞的锚定非依赖性生长[23],还能够诱导A549从生殖表型转向迁移表性,加重恶化程度[24]。此外,Chang等[25]发现在脐带间充质干细胞注射治疗骨关节炎中,使用去外泌体血清培养的脐带间充质干细胞具有更强的成软骨能力,并且能够减少软骨破坏。虽然去外泌体血清已广泛用于多种细胞培养,但有学者发现去外泌体血清存在抑制细胞增殖率和分化能力的缺点[26]。因此,研究成骨与破骨细胞来源外泌体的前提是需要选择最优去外泌体血清制备方法并评估对细胞的影响。
本研究通过NTA技术将商品化血清与3种超速离心法所得去外泌体血清比较发现,方法一用纯FBS以100 000×g、4 ℃超速离心18 h后取75%上清液获取的血清样本去除效果最佳,纳米颗粒清除率可达99%以上,外泌体蛋白标志物CD9、CD63与TSG101均明显下降,佐证了去除效果,此结果与Tian等[8]的外泌体98%清除率一致,并且高于商品化去外泌体血清清除率。市场上存在一部分商品化去外泌体血清,但价格高昂并且可能对一些特定细胞的生长和功能产生不利影响[27],相比之下,方法一制备去外泌体血清具有经济、简便、去除效果佳的优势,因而我们用其培养成骨与破骨细胞,进一步分析对细胞增殖分化与生物活性的影响。在成骨细胞实验中,Exo-free组与对照组的ALP染色、矿化结节染色结果基本一致。EdU结果提示成骨细胞增殖率略低于对照组,其原因可能是胎牛血清外泌体对成骨细胞增殖具有促进作用[28];流式细胞技术发现Exo-free组早期与晚期凋亡率均略高于对照组,但上述差异均无显著统计学差异(P>0.05),表明成骨细胞能够正常成熟与形成矿化结节,且增殖与凋亡未发生明显改变,此结果与去外泌体血清培养脂肪干细胞及胃癌细胞的结果相一致[29]。在破骨细胞部分,骨髓单核巨噬细胞在去外泌体血清培养下经M-CSF与RANKL诱导在第5天可正常融合成破骨细胞,且能在骨吸收板上形成陷窝,Exo-free组在破骨细胞诱导天数、骨陷窝数量、TRAP阳性面积与对照组均不存在显著统计学差异(P>0.05),表明破骨细胞分化与骨吸收功能同样未受到显著影响。综上,方法一所得去外泌体血清不仅外泌体去除效果更好,并且对成骨、破骨细胞的增殖分化与生物活性无明显影响。因此,我们认为方法一超速离心法经济高效,可明显降低后续实验干扰,获得更为纯净的成骨与破骨细胞来源外泌体,有助于从旁分泌机制的角度深入研究骨质疏松症的发病机制。
本研究也存在一些局限性,例如有研究报道饥饿培养法能更好排除外泌体污染,但也会造成细胞应激反应[23]。又例如商品化去外泌体血清可能会改变细胞的体内活性及外泌体的效应[27],而我们并未探究超离法去外泌体血清对成骨、破骨细胞外泌体产量、膜完整性与内容物等是否具有影响,未来可进一步运用透射电镜、高通量测序等手段进一步分析,改进现有方案,为建立系统的成骨、破骨细胞来源外泌体分离和储存流程提供前期技术支持。
