miR-151-3p在子宫内膜异位症组织中的表达及其对子宫内膜基质细胞迁移和侵袭的影响
2023-11-13王雅丽马丽霞赵彩粉
谢 震,赵 健,吴 娟,王雅丽,马丽霞,赵彩粉
0 引 言
子宫内膜异位症(endometriosis,EMS)是一种慢性妇科疾病,其特征是存在植入子宫外的子宫内膜样组织,最常见于盆腔腹膜和卵巢。这些雌激素依赖性异位植入物是一种良性炎症性疾病,但影响全球高达10%的育龄妇女,可导致痛经和不孕等症状[1-3]。目前,EMS的发病机制有多种学说,其中月经逆行学说被普遍认为是导致EMS形成的主要原因,即子宫内膜碎片通过月经逆行在盆腔或盆腔外不同的表面植入并异位生长。然而,有证据表明约90%的女性会发生月经逆行现象,但大约只有10%的女性会患有EMS,表明其还需要其他致病因素如炎症、氧化应激和表观遗传变化的参与,而这些因素会影响子宫内膜细胞的迁移、粘附和侵袭[4]。MicroRNA (miRNA)是一种内源性小的单链非编码RNA,长度为20~22个核苷酸,可与靶mRNA的互补序列结合,以阻断翻译或影响mRNA的稳定性[5]。MiR-151在癌症的发生发展过程扮演抑癌基因的作用,Zhang等[6]研究显示,miR-151-3p可抑制人神经胶质瘤细胞的增殖和上皮-间充质转化(EMT);Chen等[7]研究称,miR-151-3p可抑制前列腺癌细胞生长、迁移和侵袭[7]。众所周知,细胞迁移和侵袭在EMS发病过程中发挥重要的促进作用[8],但具体作用机制尚不明确,而miR-151-3p在EMS患者子宫内膜组织中表达水平以及其对宫内膜基质细胞(endometrial stromal cells,ESCs)的迁移和侵袭还有待于研究。为此,本研究检测EMS患者子宫内膜组织中miR-151-3p表达情况,并分析了miR-151-3p对ESCs细胞增殖、侵袭与迁移的影响,旨在为临床治疗EMS提供更多的潜在靶点。
1 材料与方法
1.1 组织样本收集2018年3月至2020年12月在本院妇科行手术治疗的EMS患者组织87份,根据发病部位分为在位子宫内膜组(eEMS组)和异位子宫内膜组(nEMS组),同时选取47份因子宫肌瘤等良性妇科疾病进行手术治疗的患者正常子宫内膜组织作为对照组。
1.2 主要试剂引物序列、mimics NC、miR-151-3p mimics、inhibitors NC和miR-151-3pinhibitors均由苏州金唯智公司设计和合成;DMEM/F12和Lipofectamine 3000购自美国Thermo Fisher公司;miRNA逆转录试剂盒购自上海新贝生物科技有限公司;miRNA荧光定量PCR试剂盒购自上海吉玛制药技术有限公司;I型胶原酶购自美国Gibco公司;CCK-8试剂盒购自北京索莱宝科技有限公司;GAPDH、MMP-2、MMP-9、N-cadherin、Vimentin和E-cadherin抗体均购自美国Cell Signaling Technology公司;二抗购自美国Millipore公司;人波形蛋白、人角蛋白单克隆抗体和荧光二抗购自英国Abcam公司。
1.3 ESCs细胞提取、分离、培养及鉴定取子宫内膜组织清洗剪碎,加入含有I型胶原酶(1 mg/mL)的DMEM/F12培养基孵育消化50 min。使用400目滤膜过滤分离的ESCs细胞,随后离心收集细胞,加入含有10% FBS的DMEM/F-12培养基重悬细胞,放入37 ℃、5% CO2的培养箱。将ESCs细胞接种于放有盖玻片的六孔板中培养24 h。弃去培养基,加入4%甲醛固定30 min,再加1% NP-40处理5 min,用5% BSA室温孵育1 h,接着加人波形蛋白(vimentin)和人角蛋白(keratin)单抗,4 ℃过夜。次日,加入相应的荧光二抗,室温孵育1 h。最后加入80 μL DAPI,孵育20 min。滴加放淬灭剂封片,放于倒置荧光显微镜观察拍照,以人波形蛋白阳性且人角蛋白阴性的细胞鉴定为ESCs细胞。
1.4 细胞转染及分组将ESCs细胞以3×105个/每孔接种到6孔板上,每孔加2 mL含10% FBS 的DMEM/F12培养基进行培养,将ESCs细胞进行分组:mimics NC组、miR-151-3p mimics组、inhibitors NC组和miR-151-3pinhibitors组。待细胞丰度达到80%时,依照Lipofectamine 3000说明书进行操作,将miR-151-3p mimics、mimics NC、miR-151-3p inhibitors和inhibitors NC转染到相应的细胞中,48 h后进行后续实验。
1.5 qRT-PCR检测采用TRIzol法提取子宫内膜组织及各组细胞内总RNA,然后用miRNA逆转录试剂盒合成cDNA,随后依照miRNA荧光定量PCR试剂盒反应体系进行实验。所用引物序列如下:miR-151-3p上游5′-GGATGCTAGACT GAAGCTCCT-3′,下游5′-CAGTGCGTGTCGTGGAGT-3′;U6上游5′-CTCGCTTC GGCAGCACA-3′,下游5′-AACGCTTCACGAATTTGCGT-3′。U6作为内参,采用2-ΔΔCT法计算miR-151-3p的相对表达量。
1.6 CCK-8实验将转染后ESCs细胞以5×103个/每孔接种到96孔板中,分别培养24、48和72 h后,每孔加10 μL CCK-8溶液,接着培养4 h 。酶标仪检测450 nm处的A值,并以A450值表示细胞增殖活性。
1.7 Transwell检测迁移与侵袭实验迁移实验:将转染后ESCs细胞,用无血清DMEM/F-12培养基重悬,其密度为1×105个/mL,加200 μL细胞悬液至Transwell小室的上层,同时加500 μL含10% FBS的DMEM/F-12培养基至小室下层,培养24 h。取出小室,多聚甲醛固定下层细胞,结晶紫染色,用载玻片固定小室中的膜后,显微镜观察,每组随机选取5个视野拍片,统计细胞数。侵袭实验:提前将用无血清DMEM/F-12培养基稀释的Matrigel胶(1 mg/mL)加到小室上层,随后步骤同迁移实验。
1.8 Western blot实验提取各组总蛋白并用考马斯亮蓝法定量。取等量蛋白用10% SDS-PAGE电泳分离,并转至PVDF膜,用5%脱脂奶粉封闭PVDF膜2 h,以1∶1000的稀释比例加入GAPDH、MMP-2、MMP-9、N-cadherin、Vimentin和E-cadherin抗体4 ℃过夜,再加二抗(1∶10 000)室温孵育1 h,最后加ECL曝光显色。以GAPDH为内参,用Image J软件对各蛋白进行定量分析。
1.9 生物信息学分析使用miRDB(http://mirdb.org/)、TargetScan7.1(https://www.targetscan.org/vert_71/)及mirDIP(http://ophid.utoronto.ca/mirDIP/)等数据库对miR-151-3p下游靶基因进行预测,并使用String(http://string-db.org/)在线数据库进行差异基因的PPI分析,筛选出关键靶基因。
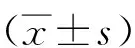
2 结 果
2.1 EMS患者子宫内膜组织中miR-151-3p表达水平变化qRT-PCR 结果显示,与对照组中miR-151-3P表达水平(1.02±0.17)相比,eEMS组(0.79±0.21)和nEMS组(0.62±0.15)均明显降低(P<0.05);与eEMS组相比,nEMS组中miR-151-3P表达水平均明显降低(P<0.05)。
2.2 转染后各组ESCs细胞中miR-151-3p表达水平ESCs细胞分离培养,其鉴定结果显示,人波形蛋白阳性细胞比率>95%,人角蛋白阳性细胞比率<5%,ESCs细胞分离培养成功。转染结果显示,与mimics NC组ESCs细胞中miR-151-3p表达水平(1.00±0.02)比较,miR-151-3p mimics组(3.62±0.29)显著上升(P<0.05),而与inhibitors NC组ESCs细胞中miR-151-3p表达水平(0.99±0.09)比较,miR-151-3p inhibitors组(0.17±0.05)显著降低(P<0.05),细胞转染成功。
2.3 转染后各组ESCs细胞增殖水平细胞培养24、48和72 h,增殖结果显示,与mimics NC组比较,miR-151-3p mimics组ESCs细胞增殖水平显著降低(P<0.05),而与inhibitors NC组比较,miR-151-3p inhibitors组ESCs细胞增殖水平显著升高(P<0.05)。见图1。

与mimics NC组比较,*P<0.05;与inhibitors NC组比较,#P<0.05图1 CCK-8检测各组细胞增殖活性Figure 1 CCK-8 was used to detect cell proliferation activity in each group
2.4 miR-151-3p表达水平对ESCs细胞迁移和侵袭的影响Transwell实验结果显示,与mimics NC组比较,miR-151-3p mimics组ESCs细胞迁移和侵袭细胞数显著减少(P<0.05),而与inhibitors NC组比较,miR-151-3pinhibitors组ESCs细胞迁移和侵袭细胞数显著增加(P<0.05)。见图2、图3。

1:mimics NC组;2:miR-151-3p mimics组;3:inhibitors NC组;4:miR-151-3pinhibitors组a:各组细胞迁移情况;b:各组细胞迁移数目统计分析与mimics NC组比较,*P<0.05;与inhibitors NC组比较,#P<0.05图2 Transwell实验检测各组细胞迁移情况Figure 2 Transwell assay was used to detect cell migration in each group

1:mimics NC组;2:miR-151-3p mimics组;3:inhibitors NC组;4:miR-151-3pinhibitors组a:各组细胞侵袭情况;b:各组细胞侵袭数目统计分析与mimics NC组比较:*P<0.05;与inhibitors NC组比较,#P<0.05图3 Transwell实验检测各组细胞侵袭情况Figure 3 Transwell assay was used to detect cell invasion in each group
2.5 miR-151-3p表达水平对ESCs细胞中MMPs和EMT相关蛋白表达的影响Western blot 检测结果显示,与mimics NC组比较,miR-151-3p mimics组ESCs细胞中MMP-2和MMP-9蛋白表达水平明显降低(P<0.05),而与inhibitors NC组比较,miR-151-3pinhibitors组ESCs细胞中MMP-2和MMP-9蛋白表达水平明显升高(P<0.05)。见图4。与mimics NC组比较,miR-151-3p mimics组ESCs细胞中E-cadherin蛋白表达水平明显升高(P<0.05),N-cadherin和Vimentin蛋白表达水平明显降低(P<0.05),而与inhibitors NC组比较,E-cadherin蛋白表达水平明显降低(P<0.05),miR-151-3pinhibitors组ESCs细胞中N-cadherin和Vimentin蛋白表达水平明显升高(P<0.05)。见图5。
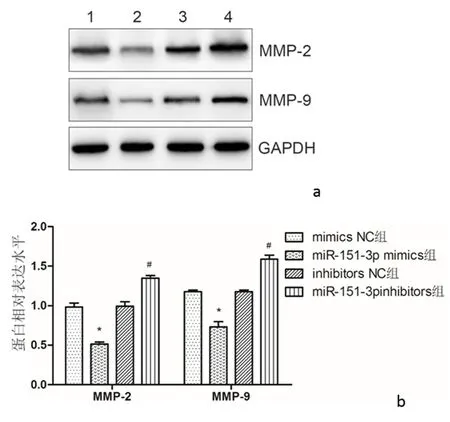
1:mimics NC组;2:miR-151-3p mimics组;3:inhibitors NC组;4:miR-151-3pinhibitors组a:各组细胞MMP-2和MMP-9蛋白表达水平;b:各组细胞MMP-2和MMP-9蛋白表达水平定量分析与mimics NC组比较,*P<0.05;与inhibitors NC组比较,#P<0.05图4 Western blot检测各组细胞中MMP-2和MMP-9蛋白表达水平Figure 4 Western blot analysis of MMP-2 and MMP-9 protein expression levels in cells of each group

1:mimics NC组;2:miR-151-3p mimics组;3:inhibitors NC组;4:miR-151-3pinhibitors组a:各组细胞E-cadherin、N-cadherin和Vimentin蛋白表达水平;b:各组细胞E-cadherin、N-cadherin和Vimentin蛋白表达水平定量分析与mimics NC组比较,*P<0.05;与inhibitors NC组比较,#P<0.05图5 Western blot检测各组细胞中E-cadherin、N-cadherin和Vimentin蛋白表达水平Figure 5 Western blot analysis of the expression levels of E-cadherin, N-cadherin and Vimentin in cells of each group
2.6 miR-151-3p靶基因的预测与分析通过miRDB、TargetScan7.1和mirDIP3大数据库预测的miR-151-3p潜在靶基因分别有220、114和159个,其中三者交集有34个靶基因。随后,使用String在线数据库对交集靶基因进行PPI分析,筛选出RC3H1、AGO2、AGO3和FXR1等4个关键靶基因。见图6。

a:在线数据库预测miR-151-3p下游靶基因;b:PPI分析图6 生物信息学筛选miR-151-3p下游靶基因Figure 6 Bioinformatics screening of downstream target genes of miR-151-3p3
3 讨 论
EMS是育龄妇女的一种慢性疾病,其特点是子宫腔外子宫内膜样组织异位生长,导致慢性盆腔疼痛和不孕,严重影响了患者的生活质量并给其带来了很大的经济负担[3]。近年来,已报道多种miRNA在EMS中表达异常,并参与子宫内膜的异位植入及生长[9-10]。miR-151-3p参与多种人类肿瘤的发生、发展,其作为肿瘤抑制因子抑制前列腺癌细胞、结肠癌细胞和乳腺癌细胞的增殖、迁移和侵袭[7,11-12]。本研究发现,miR-151-3p在EMS患者的eEMS组织和nEMS组织中均低表达,并且在nEMS组织中表达最低,这提示miR-151-3p的表达水平可能与EMS的发生、发展有关。
本研究通过分离培养ESCs细胞,将miR-151-3p mimics和miR-151-3p inhibitors转染ESCs细胞,进一步研究miR-151-3p对ESCs细胞增殖、侵袭与迁移的影响。miR-151-3p过表达明显抑制ESCs细胞的增殖活性,降低细胞的侵袭和迁移能力;而抑制miR-151-3p表达明显增强ESCs细胞的增殖活性,促进细胞的侵袭和迁移。结果提示,miR-151-3p可能通过影响ESCs细胞增殖、侵袭与迁移来参与EMS的进展。
EMS是一种炎症性疾病,而炎症的标志是基质金属蛋白酶(matrix metalloproteinase,MMPs)的过度激活。MMPs作为一类蛋白水解酶,可分解细胞外基质(extracellular matrix, ECM),并在生理或病理条件下触发ECM重塑过程。MMPs通过降解ECM促进细胞迁移和侵袭,并广泛参与血管重塑,从而促进子宫内膜细胞异位植入和EMS形成。此外研究报道,MMP-2和MMP-9在EMS患者病变组织和患者的在位子宫内膜中表达上调[13]。本研究发现,miR-151-3p过表达显著降低ESCs细胞中MMP-2和MMP-9蛋白表达水平;而抑制miR-151-3p表达显著升高ESCs细胞中MMP-2和MMP-9蛋白表达水平。
EMT是上皮细胞转变成间质表型的生物学过程,在此过程中上皮细胞获得迁移、侵袭和重新定位的能力,其异常激活是肿瘤侵袭和转移等病理过程的关键因素[8,14-15]。研究报道,EMT现象普遍存在于EMS病变中,并在子宫内膜细胞异位植入中发挥重要作用[16]。本研究发现,miR-151-3p过表达明显上调ESCs细胞中E-cadherin蛋白表达水平,降低N-cadherin和Vimentin蛋白表达水平;而抑制miR-151-3p表达明显降低ESCs细胞中E-cadherin蛋白表达水平,上调N-cadherin和Vimentin蛋白表达水平。结果提示,miR-151-3p可能通过影响MMPs和EMT进而影响ESCs细胞的侵袭与迁移。
本研究基于在线miRNA靶基因预测网站对miR-151-3p下游靶基因进行预测,并结合PPI分析筛选关键靶基因,得到RC3H1、AGO2、AGO3和FXR1这4个关键靶基因。经查阅文献,Huang等[17]报道,LncRNA SNHG11通过调节hsa-miR-184/AGO2促进肝癌细胞的增殖与迁移;Pan等[18]研究显示,AGO3通过调节Wnt/β-catenin信号通路促进宫颈癌细胞的迁移与侵袭;Cao等[19]研究发现,FXR1通过调节FBXO4影响前列腺癌细胞的迁移与侵袭。因此,miR-151-3p是否通过这些关键靶基因影响ESCs细胞的迁移和侵袭还有待于后期研究。
综上所述,miR-151-3p在EMS患者的eEMS组织和nEMS组织中均低表达,并且在nEMS组织中表达最低。过表达miR-151-3p可以抑制ESCs细胞的迁移和侵袭。这提示miR-151-3p可能为EMS治疗提供新的思路。
