褪黑素对无渗透性冷冻保护剂的精子玻璃化冷冻影响
2023-11-13石学颖姜经航
邵 帅,石学颖,王 洋,丁 涛,姜经航,江 梅
0 引 言
精子冷冻技术作为辅助生殖技术中的重要组成部分,广泛应用于供精的保存、自体精子保存以及放化疗前生育力保护。玻璃化冷冻是将细胞中的水分置换成高浓度的冷冻保护剂,在冷冻过程中形成玻璃化状态,保存了细胞中的正常分子和离子分布,避免细胞内冰晶的形成,从而达到保护精子细胞的目的[1]。由于微量精子像严重少精症精子、睾丸穿刺和附睾穿刺精子不易获取,质量也差,精子的特殊结构,其内部水分含量很低,常规冷冻方法不适用于精子冷冻;此方法使用高浓度渗透性保护剂具有很强的细胞毒性,能对细胞产生化学损伤,导致精子化学结构改变和能量代谢紊乱[2-3]。
为了避免高渗透性冷冻保护剂对精子的毒性影响,近年来研究发现无渗透性冷冻保护剂玻璃化冷冻精子开始应用,通过加入终浓度为0.25 mol/L 蔗糖玻璃化冷冻精子的方法,避免了渗透性冷冻保护剂的使用,与常规冷冻相比,有更高的回收率、活力以及更低的DNA碎片[4]。尽管在精子冷冻领域取得了长足的进展,但精子解冻后的活力和受精率显著下降,这在一定程度上是由于低温保存诱导氧化应激,从而形成活性氧(ROS),精子质膜的多不饱和脂肪酸易受ROS损伤,导致精子结构和功能受损。因此,寻找合适的抗氧化剂减少自由基和氧化应激,从而提高辅助生殖技术的生育潜力势在必行。本研究通过在微量精液中加入褪黑素,观察对无渗透性冷冻保护剂的精子玻璃化冷冻影响研究。
1 资料与方法
1.1 研究对象选取2022 年4-9月在荆门市人民医院生殖医学中心就诊的30例男性患者的精液样本。患者禁欲2~7 d后手淫取精,精液取出置于 37 ℃孵箱,完全液化后检查,正常精液先进行梯度离心(SAGE),然后加精子培养液(COOK)进行洗涤,最后加精子培养液进行上游,将上游后的精子密度调至( 1-5) × 106/mL待用。纳入标准:①年龄20~55岁;②世界卫生组织 (WHO)《人类精液检查与处理实验室手册》第五版正常值(精子浓度≥15×106/mL,前向运动精子(PR)≥32%,PR+非前向运动精子≥40%,pH≥7.2,液化时间<60 min)、正常形态≥4%。排除标准:精液量<1 mL。本研究经医院伦理委员会批准通过(批准号:2022051215),患者知情同意,所有精液样本处理后按医疗废物处理。
1.2 方法
1.2.1 精子冷冻分组上游处理后每份精子分为4组,常规冷冻组:精子悬液中逐滴加入等体积的精子冷冻保护剂(Quinns Advantage Sperm Freezing Me-dium, SAGE),取60 μL加入 2 mL 的冷冻管中,然后置于液氮面上方 15 cm 熏蒸 30 min,投入液氮保存;微滴冷冻组:将精子悬液与等体积精子冷冻保护剂混合后共计60 μL,用拉细巴斯德吸管吸取精子混合液于管口形成10~15 μL液滴后即滴入液氮中,形成致密微滴后沉入液氮底部,将其装入冷冻管后置于液氮中保存;无保护剂微滴冷冻组:将精子悬液加入等体积 0.5 mol/L蔗糖溶液共计60 μL,混合液中蔗糖终浓度为 0.25 mol/L,用拉细巴斯德吸管吸取精子混合液于管口形成10~15 μL液滴后即滴入液氮中,将其装入冷冻麦管后置于液氮中保存;褪黑素+无保护剂微滴冷冻组:将精子悬液加入等体积 0.5 mol/L蔗糖溶液共计60 μL,混合液中加入褪黑素使其终浓度为0.01 mmol/L。用拉细巴斯德吸管吸取精子混合液于管口形成10~15 μL液滴后即滴入液氮中,形成致密微滴后便沉入液氮底部,将其装入冷冻麦管后置于液氮中保存。
1.2.2 精子复苏精子液氮冻存 24 h 后取出,常规冷冻立即将冻存管置于 37 ℃ 恒温水浴箱中振荡混匀直至完全液化,300g离心10 min留底部沉淀100 μL;微滴组将冻存管内的冷冻微滴投入 37 ℃孵育的 3 mL精子培养液中,直至微滴全部溶解。300 g离心10 min留底部沉淀100 μL。计算机辅助精液分析法(CASA)检测精子活力,计算精子复苏率。
1.2.3 精子存活情况应用伊红-苯胺黑染色试剂盒测定存活精子百分率,分别取20 μL复苏后精液与20 μL染色剂在室温下混合,染色 30 s后,取20 μL精液涂片,干燥封片。计数 200个精子,头部未染色的为活精子,而头部染红为死精子,计算存活精子百分率。
1.2.4 精子形态情况采用改良巴氏染色法,对精子头部、颈部、尾部形态进行评判,计算正常形态精子。
1.2.5 质膜完整性检测采用低渗肿胀试验检测精子质膜完整性。取20 μL精液加入到200 μL低渗试剂(含有果糖和柠檬酸)中, 37 ℃水浴中平衡30 min,取15 μL涂片,用光学显微镜观察观察弯尾的精子数。
1.2.6 顶体完整性采用改良巴氏染色法,Ⅰ型:顶体完整,顶体边缘整齐,有时可见清晰的赤道板;Ⅱ型:顶体轻微膨胀,顶体膜疏松膨大;Ⅲ型:顶体破坏,精子质膜严重受损,边缘不整齐;Ⅳ型:顶体全部脱落,核裸露。Ⅰ型是顶体正常的精子,Ⅱ、Ⅲ、Ⅳ型均为顶体不完整。计算顶体完整率。
1.2.7 DFI检测DFI检测采用精子DNA碎片检测试剂盒 (深圳博锐德) , 按试剂盒说明书步骤操作,100倍油镜下观察, 比较精子核和核周围晕轮大小, 评价精子DNA碎片率。根据单侧晕轮厚度与精子头部最小直径比例进行评判, 当单侧晕轮厚度≤1/3精子头部最小直径时,表明精子存在DNA碎片。精子DNA碎片率>25%视为异常。
1.2.8 MDA、SOD和GSH-Px检测采用南京建成生物工程研究所试剂盒测定,按照说明书操作,各管分别加入精子悬液以及相应的试剂,酶标仪测定测各管吸光度值,通过公式计算含量。
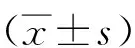
2 结 果
2.1 褪黑素对复苏后精子活力、复苏率以及存活率的影响CASA和伊红-苯胺黑染色结果显示,4组复苏后PR和存活率均低于冷冻前(P<0.01);微滴冷冻组、无保护剂微滴冷冻组复苏后PR、复苏率及复苏后存活率高于常规冷冻组(P<0.05);无保护剂微滴冷冻组复苏后精子存活率明显高于微滴冷冻组(P<0.05);褪黑素+无保护剂微滴冷冻组复苏后PR和复苏率高于无保护剂微滴冷冻组(P<0.05)。见表1。

表1 褪黑素对精子复苏后活力、复苏率以及存活率的影响Table 1 Effects of melatonin on sperm motility, resuscitation rate and survival rate after
2.2 褪黑素对精子复苏后正常形态率和顶体完整性的影响巴氏染色结果显示,4组复苏后正常形态率和顶体完整性明显低于冷冻前(P<0.01);褪黑素+无保护剂微滴冷冻组复苏后正常形态率和顶体完整性明显高于其他3组(P<0.05)。见表2。

表2 褪黑素对精子复苏后形态率和顶体完整性的影响Table 2 Effects of melatonin on morphological rate and acrosomal integrity of sperm after resuscitation
2.3 褪黑素对复苏后精子质膜完整率和DFI的影响低渗肿胀实验和SCD检测结果显示,4组复苏后质膜完整率均明显低于冷冻前(P<0.01),DFI明显高于冷冻前(P<0.01)。微滴冷冻组、无保护剂微滴冷冻组复苏后质膜完整率高于常规冷冻组(P<0.05);褪黑素+无保护剂微滴冷冻组复苏后质膜完整率高于微滴冷冻组(P<0.05),而DFI明显低于微滴冷冻组(P<0.05)。见表3。

表3 褪黑素对复苏后精子质膜完整率和DFI的影响Table 3 Effects of melatonin on plasma membrane integrity and DFI of sperm after resuscitation
2.4 褪黑素对复苏后精子氧化应激水平的影响氧化应激结果显示,4组复苏后MDA明显高于冷冻前,SOD以及GSH-Px明显低于冷冻前(P<0.01)。与常规冷冻组相比,无保护剂微滴冷冻组、褪黑素+无保护剂微滴冷冻组MDA明显降低(P<0.05),SOD及GSH-Px明显升高(P<0.01);与微滴冷冻组相比,褪黑素+无保护剂微滴冷冻组MDA明显降低(P<0.05)。褪黑素+无保护剂微滴冷冻组SOD、 GSH-Px较其他3组明显升高(P<0.05)。见表4。

表4 褪黑素对复苏后精子氧化应激水平的影响Table 4 Effect of melatonin on oxidative stress level of sperm after resuscitation
3 讨 论
常规精子冷冻技术相对成熟,广泛应用于生殖中心和精子库,然而像睾丸切开显微取精、睾丸穿刺取精以及附睾穿刺取精的精子等由于精子数量少、活力差,常规精子冷冻保存方法不仅回收率低,而且存活率低[6-7]。精子冷冻过程中冰晶的形成、保护剂在降温以及升温中对细胞和膜渗透性损伤的毒性效应,都严重影响精子的活力、结构功能。冻融过程产生大量的活性氧(ROS )一方面会导致主要的精子功能缺陷;另一方面ROS 导致脂质过氧化,从而损伤线粒体膜以及导致膜完整性降低,并诱导精子凋亡、DNA 碎片化[8-9]。因此,复苏后无活动精子或精子损伤严重导致受精率低下,胚胎质量下降,临床妊娠率降低而流产率高等。对于稀少精子冷冻一直是研究的热点和难点。
针对微量精子冷冻中的高浓度的渗透性保护剂的毒性作用,本研究采取无渗透性冷冻保护剂进行冷冻。无渗透性冷冻保护剂玻璃化冷冻是指不添加任何渗透性保护剂,通过添加蔗糖快速降温,使精子迅速达到玻璃化状态,避免了冰晶形成对精子细胞膜和细胞骨架的物理损伤[10]。针对冷冻过程中的精子损伤以及氧化应激,本研究通过添加褪黑素,褪黑激素合成的吲哚胺激素,由于褪黑激素具有很强的抗氧化和抗凋亡特性,而且在男性生育力保存和男性生殖系统中的发挥了极大的作用[11-12]。因此,本实验以精子微滴进行无渗透性保护剂玻璃化冷冻,通过添加褪黑素研究微滴无保护剂玻璃化冷冻玻璃化冷冻微量精子的可行性及安全性。
研究结果显示无渗透性冷冻保护剂冷冻复苏后的精子前向运动和复苏率要明显优于常规精子冷冻组,略好于微滴玻璃化冷冻组,这与葛斌等[13]在无保护剂玻璃化冷冻技术冻存 PESA 精子中的实用性研究的结果相一致,说明此方法相对常规冷冻和微滴玻璃化冷冻而言有优势;添加褪黑素的无保护剂冷冻组复苏后的精子前向运动、复苏率、正常形态率以及DFI均明显优于其他冷冻组,这与Mehaisen GMK等[14]研究显示添加褪黑素能够对冷冻的公鸡精子质量起保护作用,降低冷冻过程脂质过氧化、DNA 断裂和凋亡的研究结果一样。说明褪黑素在精子冷冻过程中能够发挥保护作用,避免冷冻损伤。无保护剂微滴冷冻组和添加褪黑素冷冻组的复苏存活率均高于微滴冷冻组和常规冷冻组,可能与蔗糖作在冷冻过程中提高了细胞外的渗透压,避免细胞内水分向外流出而造成细胞脱水而皱缩,减少了细胞内冰晶形成,从而避免细胞遭受破坏[15]。精子质膜和顶体是在精子冷冻和解冻过程中最易受损伤的部位,也是影响精子受精能力的重要因素之一。精子质膜和顶体的完整性对精子维持自身新陈代谢、精子获能和顶体反应等能力有直接关系。添加褪黑素的无保护剂冷冻组复苏后的精子质膜和顶体的完整性均明显优于其他冷冻组,Fadl AM等[14]研究也显示添加 1.0 mmol/L 褪黑素的精液稀释剂可改善冷冻精液的运动性、活力、质膜和顶体完整性,能够提高受精率和出生率。在冷冻过程中,渗透压变化通过改变盐浓度来影响膜完整性和精子稳态[16]。褪黑素能够减少脂质过氧化和调节渗透平衡和 pH 值,增加细胞内抗氧化剂的合成,对抗氧化酶的活性和增加SOD、GPx、GSH和过氧化氢酶的蛋白质有积极作用[17]。本研究也显示褪黑素能够降低MDA活性表达,增加SOD以及GSH-Px活性表达,从而发挥抗氧化保护作用。其机制可能与褪黑素增加线粒体呼吸链复合物成分的mRNA表达和复合物I、II、III和IV的活性,改善了冷冻精子的 OXPHOS,其具体机制可能通过PI3K/AKT以及HGF/c-Met信号通路发挥作用[18-20]。本研究使用正常精液进行稀释成微量精子进行冷冻复苏,不能直接反应严重少精弱症精子、睾丸穿刺、附睾穿刺以及睾丸切开显微取精精子的冷冻复苏后状态,有一定局限性。后期需要进一步研究验证无渗透性微滴玻璃化冷冻对睾丸穿刺精子冷冻复苏的影响,以便为严重少精弱症精子、睾丸穿刺、附睾穿刺以及睾丸切开显微取精精子的冷冻起一定的指导意义。
综上所述,无渗透性微滴玻璃化冷冻有其独特优势,能够有效保存微量精子,而添加褪黑素能够明显提高精子的PR、活力、正常形态、DFI、质膜和顶体完整性,其原因可能与降低MDA,增加SOD以及GSH-Px表达有关。添加褪黑素进行无保护剂微滴法玻璃化冷冻可能是一种安全有效的冷冻方法。
