高尿酸血症对小鼠生精功能和精子质量的影响及其机制
2023-11-08江晓翠田代志赵敏龚健余何姜兴宇萧闵
江晓翠 田代志 赵敏 龚健 余何 姜兴宇 萧闵
摘要:目的 探讨高尿酸血症(HUA)通过氧化损伤诱导睾丸细胞凋亡、降低小鼠生精功能和精子质量的机制。方法 36只雄性昆明小鼠随机分6组:氧嗪酸钾1 d、7 d、14 d组,对照1 d、7 d、14 d组。其中氧嗪酸钾组腹腔注射氧嗪酸钾悬液600 mg/(kg·d)。生化法检测血清尿酸(UA)、肌酐(Cre)、尿素氮(BUN)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、黄嘌呤氧化酶(XO)和睾丸组织超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA);HE染色法观察肝、肾、睾丸组织病理学变化并对睾丸HE切片进行生精功能评分;全自动精子分析仪检测精子密度和活动率;蛋白免疫印迹法检测睾丸组织B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关蛋白X(Bax)、胱天蛋白酶3(Caspase-3)的表达。结果 与各自對照组比较,氧嗪酸钾1 d组UA升高,氧嗪酸钾7 d组UA、BUN、AST、XO均升高,氧嗪酸钾14 d组UA、BUN、AST均升高(均P<0.01)。氧嗪酸钾7 d、14 d组肝、肾组织形态均有病变,氧嗪酸钾7 d组较14 d组轻微。与对照7 d组比较,氧嗪酸钾7 d组睾丸组织有明显病变,生精功能、精子密度和活动率降低(P<0.05),MDA含量升高,SOD、CAT活性降低(P<0.05),Bax、Caspase-3蛋白表达量及Bax/Bcl-2比例上升(P<0.05),Bcl-2蛋白表达量下降(P<0.05)。结论 HUA小鼠生精功能和精子质量降低,其机制可能为睾丸氧化损伤诱导细胞凋亡。
关键词:高尿酸血症;睾丸;精液分析;精子发生;氧化性应激;细胞凋亡
中图分类号:R698.2文献标志码:ADOI:10.11958/20221083
Effects and mechanism of hyperuricemia on spermatogenesis and sperm quality in mice
JIANG Xiaocui, TIAN Daizhi, ZHAO Min, GONG Jian, YU He, JIANG Xingyu, XIAO Min
Experimental Center of Chinese Medicine, Hubei University of Chinese Medicine, Wuhan 430065, China
Corresponding Author E-mail: 531637551@qq.com
Abstract: Objective To investigate the mechanism of hyperuricemia (HUA) inducing testicular cell apoptosis and reducing spermatogenesis and sperm quality in mice through oxidative damage. Methods Thirty-six Kunming male mice were divided into 6 groups by random number method: the potassium oxyazinate groups for 1 d, 7 d and 14 d, and the control groups for 1 d, 7 d and 14 d. The potassium oxyazinate group was intraperitoneally injected with potassium oxyazinate suspension 600 mg/(kg·d). Serum levels of uric acid (UA), creatinine (Cre), urea nitrogen (BUN), alanine aminotransferase (ALT), aspartate aminotransferase (AST), xanthine oxidase (XO), and superoxide dismutase (SOD), catalase (CAT), malondialdehyde (MDA) in testicular tissue were detected by biochemical method. Eosin-hematoxylin (HE) staining was used to observe histopathological changes of liver, kidney and testis, and the spermatogenic function of testicular HE sections was scored. Automatic sperm analyzer detected sperm density and motility rate. The expression levels of B-cell lymphoma-2 (Bcl-2), Bcl-2 associated X protein (Bax) and Caspase-3 protein in testicular tissue were detected by Western blotting. Results Compared with the control group, UA was significantly increased in the potassium oxazinate 1 d group (P<0.01). The levels of UA, BUN, AST and XO were significantly increased in the potassium oxazinate 7 d group (P<0.01). The levels of UA, BUN and AST were significantly increased in the potassium oxazinate 14 d group (P<0.01). The pathological changes in liver and kidney tissue were observed in the potassium oxazinate 7 d and 14 d groups, and the lesion was milder in the potassium oxazinate 7 d groug than that of the potassium oxazinate 14 d group. Compared with the control 7 d group, there were obvious pathological changes and significantly decreased spermatogenic function in the potassium oxazinate 7 d group (P<0.01). The content of MDA was significantly increased (P<0.05), while the activities of SOD and CAT were significantly decreased (P<0.05). The protein expression levels of Bax and Caspase-3 were significantly increased (P<0.05), the ratio of Bax to Bcl-2 was also increased (P<0.05), and the protein expression level of Bcl-2 was significantly decreased (P<0.05). Conclusion The spermatogenic function and sperm quality are decreased in HUA mice, which may be caused by testicular oxidative damage induced apoptosis.
Key words: hyperuricemia; testis; semen analysis; spermatogenesis; oxidative stress; apoptosis
高尿酸血症(HUA)是一种由于嘌呤代谢紊乱或尿酸排泄不足导致体内尿酸高于正常值的常见代谢病[1]。随着生活水平提高、饮食结构改变以及遗传和环境因素影响,HUA患病率逐年增高[2]。研究显示,HUA患病率有明显性别差异,男性高于女性,患病人群呈现出年轻化趋势,在18~29岁男性中达到峰值[3-4]。在全球男性生殖功能下降的趋势下,典型代谢病,如肥胖[5]、糖尿病[6]已被证实可降低精子质量,诱发不育。HUA男性易发人群多处在育龄阶段,因症状不明显,对精子质量的影响常被忽视。已有研究显示,男性HUA患者精子质量下降,但机制不明[7-8],相关动物实验研究少见。本研究采用氧嗪酸钾诱导HUA小鼠模型,探讨HUA对小鼠生精功能和精子质量的影响及其可能机制。
1 材料与方法
1.1 实验动物 8周龄无特定病原体(SPF)雄性昆明小鼠36只,体质量18~22 g,购自湖北省实验动物研究中心,动物生产许可证号:SCXK(鄂)2020-0018。小鼠饲养于湖北中医药大学实验动物中心SPF级动物实验室,动物使用许可证号:SYXK(鄂)2017-0067。饲养温度(22±2)℃,相对湿度50%~70%,采用12 h/12 h昼夜间断照明,动物自由进食和饮水,适应性喂养1周后开展实验。本研究经湖北中医药大学动物实验伦理委员会批准(伦理批号:HUCMS202112002),并按实验动物使用3R原则给予人道关怀。
1.2 主要試剂与仪器 氧嗪酸钾(YZLCP0016)购自合肥博美生物科技有限责任公司;尿酸(UA)、肌酐(Cre)、尿素氮(BUN)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、黄嘌呤氧化酶(XO)、超氧化物歧化酶(SOD)、丙二醛(MDA)、过氧化氢酶(CAT)测定试剂盒购自南京建成生物工程研究所;放射免疫沉淀法(RIPA)裂解液、超敏增强型发光剂(ECL)显影液购自上海碧云天生物技术有限公司;蛋白酶抑制剂、能与小鼠发生交叉反应的兔源β-肌动蛋白(β-actin)单克隆抗体、辣根过氧化物酶(HRP)标记山羊抗兔二抗购自武汉塞维尔生物科技有限公司;二辛可宁酸(BCA)蛋白定量试剂盒购自武汉博士德生物科技有限公司;能与小鼠发生交叉反应的兔源B淋巴细胞瘤-2(Bcl-2)多克隆抗体、兔源Bcl-2相关蛋白X(Bax)单克隆抗体、兔源胱天蛋白酶3(Caspase-3)多克隆抗体购自北京博奥森生物科技有限公司。
KZ-III-F型高速低温组织研磨仪(武汉塞维尔生物科技有限公司);CR21G型冷冻高速离心机(日本日立公司);DYCZ-40型电转仪(北京六一仪器厂);E100型显微镜、NikonDS-U3成像系统(日本尼康公司);WLJY-9000型彩色精子质量检测系统(北京伟力科技公司);Multiskan FC型酶标仪(上海赛默飞世尔科技有限公司)。
1.3 实验方法
1.3.1 动物分组和造模 将氧嗪酸钾溶于蒸馏水,置于液晶超声波搅拌器充分搅拌,配制5 g/L氧嗪酸钾悬液。36只小鼠适应性喂养1周后,采用随机数字表法分为6组,每组6只:氧嗪酸钾1 d、7 d、14 d组依据文献[9-10],按照600 mg/(kg·d)腹腔注射氧嗪酸钾悬液,对照1 d、7 d、14 d组腹腔注射等体积生理盐水,每组注射天数依次为1 d、7 d、14 d。
1.3.2 血液及组织生化指标检测 采血前12 h禁食不禁水,末次腹腔注射氧嗪酸钾1 h时,以1%戊巴比妥钠(50 mg/kg)腹腔注射,麻醉小鼠,腹主动脉采血1 mL。血样在室温下静置1 h后,3 000 r/min,离心半径13 cm,4 ℃,离心10 min,收集上清液,置于-20 ℃冰箱冷冻保存。按试剂盒操作说明测定小鼠血清UA、BUN、Cre水平,AST、ALT、XO活性。取100 mg睾丸组织,高速组织研磨仪匀浆后,10 000 r/min,离心半径13 cm,离心10 min,取上清液,4 ℃保存备用。按照试剂盒说明书,测定SOD、CAT活性及MDA含量。
1.3.3 苏木精-伊红(HE)染色 小鼠安乐死后,快速剥离肝、肾、睾丸,生理盐水冲洗干净,取部分肝、肾、睾丸室温置于固定液中固定48 h,梯度乙醇脱水;二甲苯透明;浸蜡、包埋;切片、脱蜡,HE染色后,光学显微镜下观察并采集图片。
1.3.4 生精功能评分 对1.3.2、1.3.3生化指标及病理切片结果进行分析,筛选UA显著升高且肝肾组织病变更轻微的组别,为本研究模拟临床无明显症状HUA的模型组,生理盐水腹腔注射相同时间的小鼠为对照组。显微镜下对模型组及对照组睾丸HE染色切片进行评分。每个样品选取10个曲细精管断面,进行曲细精管内径(D)、管周膜厚度(M)、管壁生殖细胞层数(P)、生殖细胞成熟程度(S)评分。D<25 μm、25 μm≤D<50 μm、50 μm≤D<75 μm、75 μm≤D<100 μm、100 μm≤D<130 μm、130 μm≤D<160 μm分别计0~5分;M>13 μm、10 μm≤M<13 μm、7 μm≤M<10 μm、5 μm≤M<7 μm、3 μm≤M<5 μm、M<3 μm分别计0~5分;P为0层、1层、1~2层、2~3层、3~4层、大于4层分别计0~5分;S为仅有支持细胞、精原细胞、初级精母细胞、阻滞在次级精母细胞、阻滞在精子细胞阶段、成熟精子分别计0~5分[11]。四项满分合计20分,总分记为TMS,得分越高代表睾丸生精功能越好。
1.3.5 蛋白免疫印迹实验 取模型组及对照组小鼠睾丸组织50 mg,加入RIPA裂解液、PMSF蛋白酶抑制剂,高速组织研磨仪匀浆后置于冰上反应30 min,10 000 r/min,离心半径13 cm,离心15 min取上清液。采用BCA法测定蛋白浓度,制备蛋白样品。经聚丙烯酰胺凝胶电泳后,湿转法转膜,10%脱脂奶粉室温下封闭2 h,TBST洗膜3次。加入1∶1 000稀释的Bax、Bcl-2、Caspase-3一抗,4 ℃冰箱孵育过夜,次日HRP标记羊抗兔二抗室温孵育1 h,TBST洗膜3次,超敏ECL液显影。采用Image J软件分析出目标蛋白和内参的灰度值,计算两者比值,用于统计分析。
1.3.6 精子活力检测 取模型组及对照组小鼠附睾尾,剪成小块,置于37 ℃磷酸盐缓冲液(PBS)中,37 ℃孵育10 min,释放精子,200目筛过滤,分离精子与组织残片,按照全自动精子分析仪操作说明,进行精子密度和活动率分析。
1.4 统计学方法 采用SPSS 25.0软件进行数据分析。符合正态分布的计量数据用均数±标准差(x±s)表示,2组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
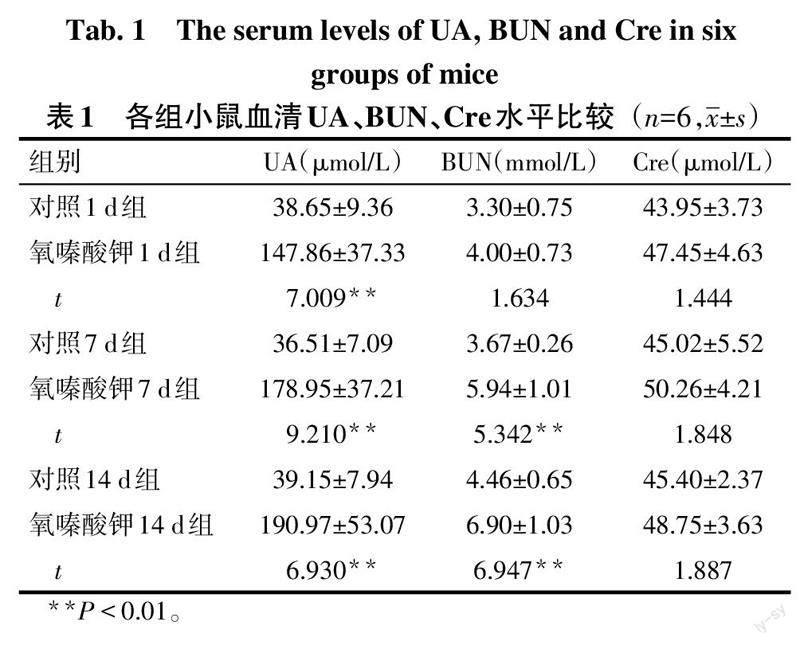
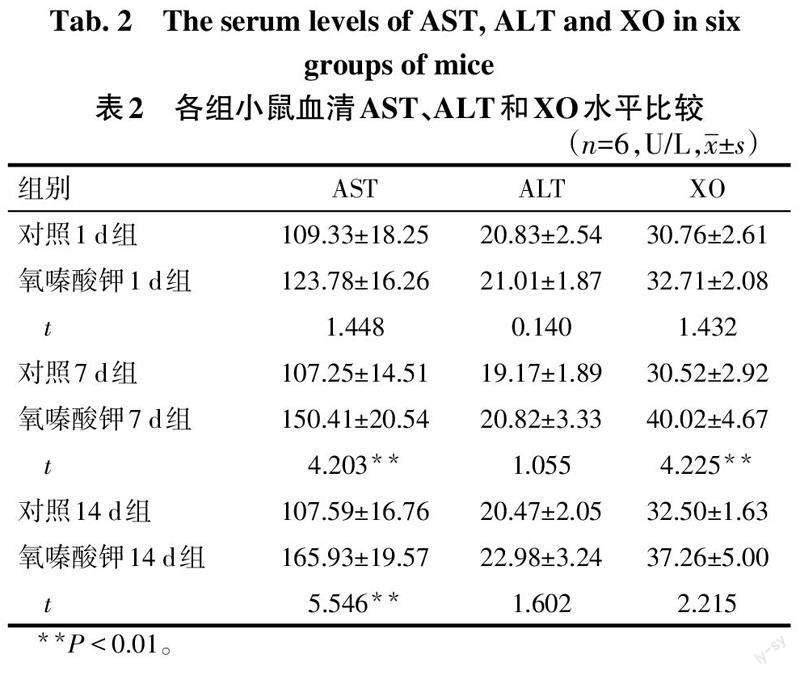
2.1 氧嗪酸钾不同注射天数对小鼠血清生化指标的影响 (1)肾功能。与各自对照组比较,氧嗪酸钾1 d、7 d、14 d组血清UA均升高(P<0.01),Cre差异无统计学意义;氧嗪酸钾1 d组血清BUN差异无统计学意义,7 d、14 d组升高(P<0.01),见表1。(2)肝功能。与各自对照组比较,氧嗪酸钾1 d组血清AST含量差异无统计学意义,氧嗪酸钾7 d、14 d组血清AST升高(P<0.01);氧嗪酸钾1 d、7 d、14 d组血清ALT差异无统计学意义,见表2。(3)XO活性。与各自对照组比较,氧嗪酸钾7 d组血清XO活性升高(P<0.01),氧嗪酸钾1 d、14 d组血清XO活性差异无统计学意义,见表2。
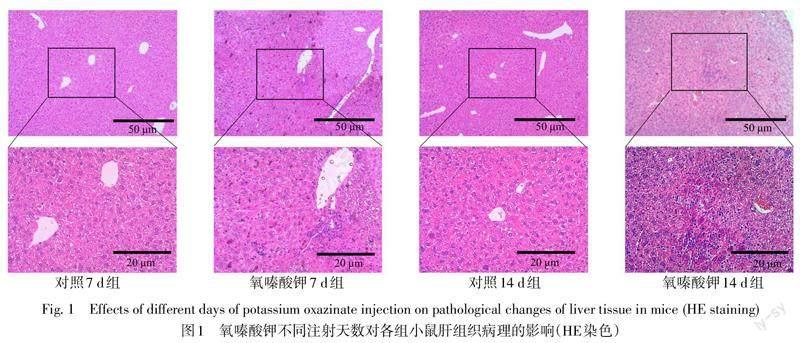
2.2 氧嗪酸钾不同注射天数对小鼠肝肾组织的影响 对照7 d、14 d组,肝细胞形态正常,排列规则,细胞核圆居中或有双核,肝索清晰;氧嗪酸钾7 d组,肝细胞疏松、轻微水肿,排列不规则,部分区域有淋巴细胞聚集;氧嗪酸钾14 d组,肝细胞排列不规则,肝索模糊不清,多个区域有炎性细胞浸润,见图1。
对照7 d、14 d组,肾组织形态结构未见异常,肾小球大小均匀,肾小管结构清晰,边界明显,上皮细胞形态正常;氧嗪酸钾7 d组,肾间质有炎性细胞浸润,肾小球未见明显萎缩,肾小管结构可见,上皮细胞轻微脱落;氧嗪酸钾14 d组,肾间质有明显炎性细胞浸润,肾小管结构模糊,上皮细胞明显脱落,见图2。
2.3 筛选后模型组小鼠睾丸病理形态变化及生精功能评分 由2.1、2.2可见,氧嗪酸钾1 d组尿酸一过性升高,氧嗪酸钾14 d组肝、肾组织病变较重,易有尿酸性肾病等并发症,因此筛选氧嗪酸钾7 d组为模型组,相应的对照7 d组为对照组。
对照组睾丸组织曲细精管分布密集、结构清晰、呈规则椭圆形,生精上皮完整,各级生精细胞及精子排列有序,精原细胞规律地排列于基膜上,多数管腔内有大量精子,支持细胞和间质细胞均未见异常,未见多核巨细胞;模型组睾丸组织曲细精管分布密集度变低、管壁不光滑、皱缩变形,生精上皮变薄,生精细胞排列紊乱,管腔中精子数量明显减少,见图3。与对照组比较,模型组睾丸生精功能下降(P<0.05),见表3。
2.4 2组小鼠精子密度和活动率变化 与对照组比较,模型组精子密度和活动率均下降(P<0.01),见表4。
2.5 2组小鼠睾丸组织SOD、CAT活性及MDA含量变化 与对照组比较,模型组睾丸组织SOD和CAT活性均降低;MDA含量升高(P<0.05),见图4。
2.6 2组小鼠睾丸组织Bax、Bcl-2、Caspase-3蛋白表达量变化 与对照组比较,模型组睾丸组织Bax、Caspase-3表达量升高,Bcl-2表达量降低,Bax/Bcl-2比值上升(P<0.05),见图5。
3 讨论
不孕不育家庭中男性因素占50%[12]。精子质量是男性不育的主要原因,中国男性精子浓度总体呈下降趋势,每年下降0.751 3×106/mL[13]。现阶段,机体代谢紊乱,如肥胖可通过影响性腺轴、阴囊温度等降低男性精子质量[14]。长期高血糖也会导致睾丸、附睾等生殖器官功能障碍[15]。HUA亦属代谢紊乱范畴,且与肥胖等密切相关[16],但HUA对男性生育能力的影响却鲜见报道。因此,明确HUA与睾丸生精功能、精子质量的关系及其相关机制具有重要意义。
HUA形成的关键因素之一是UA排泄失衡,氧嗪酸钾化学结构与UA的嘌呤环相似,与UA竞争结合尿酸酶,抑制尿酸酶活性[17],减少尿酸排出,可诱导小鼠HUA。本实验结果显示,腹腔注射氧嗪酸钾1 d后,血清UA显著升高,连续注射7 d、14 d时血清UA、BUN、AST显著升高;HE染色显示连续注射7 d后肝、肾组织病变轻微,连续注射14 d后,肝、肾病理损伤明显。临床UA达到500 μmol/L时,便会对肝肾有影响,造成尿酸沉积,随着UA水平增高和作用时间延长,细胞氧化应激作用增强,当尿酸积累到一定程度时,出现肝肾损伤[18-19]。腹腔注射氧嗪酸钾1 d时,除UA含量升高,其他肝功能、肾功能指标均正常,过量UA随代谢排泄出体外,形成一过性升高,不符合临床HUA患者尿酸持续超标现状。腹腔注射氧嗪酸钾14 d时,肝、肾损伤严重,可导致其他严重并发症,也不属于临床无明显症状HUA范畴。因此,连续腹腔注射氧嗪酸钾7 d是构建符合本研究特征的稳定HUA小鼠模型的方法。
有临床报道显示,当空腹血清UA≥420 μmol/L时,男性精液量降低0.4 mL,精子总数减少6.67×107/L,血清UA水平与精液量、精子总数呈显著负相关,随着UA水平升高,精子质量下降[7];但缺乏动物实验佐证且机制未明。本研究显示,HUA模型小鼠睾丸生精功能、精子密度和活动率均显著下降。从实验角度证实,HUA降低睾丸生精功能及精子质量,影响男性生殖。
血清UA过高可活化还原型辅酶Ⅱ(NADPH)氧化酶依赖性途径产生细胞内氧化物,促进脂质过氧化,激活氧化应激和炎症反应,造成组织损伤[20],初步推测HUA影响男性生殖的机制是UA沉积,增强氧化应激反应引起睾丸组织氧化损伤。细胞在氧化应激状态下会生成大量活性氧(ROS)、活性氮(RNS)等,消耗SOD、谷胱甘肽过氧化物酶等抗氧化物质的同时,产生有害的MDA及过量的H2O2,引发蛋白氧化、脂质过氧化等损害细胞膜完整性的反應,从而导致细胞凋亡[21]。同时,氧化应激状态下,高水平ROS与精子数量、运动性、DNA完整性和受精率直接相关,抗氧化基因的遗传差异也与氧化应激,精子DNA损伤有关[22]。本实验结果显示,模型组小鼠睾丸组织SOD和CAT活性均显著降低,MDA含量则显著升高,提示HUA小鼠睾丸组织处于氧化应激状态;且睾丸组织Bax、Caspase-3表达量,Bax/Bcl-2比例均显著升高,Bcl-2表达量显著降低,标志睾丸细胞凋亡增强。因此,HUA小鼠睾丸UA沉积会导致睾丸组织氧化损伤,诱导细胞凋亡。
綜上所述,HUA小鼠睾丸生精功能、精子质量下降,UA沉积导致睾丸氧化损伤,进而诱导细胞凋亡是其可能机制,本研究为深入探讨HUA对男性生殖能力的影响奠定了实验基础。HUA对雄性小鼠生育力的影响及具体机制仍有待进一步研究。
参考文献
[1] LIU L,JIANG S,LIU X,et al. Inflammatory response and oxidative stress as mechanism of reducing hyperuricemia of gardenia jasminoide-poria cocos with network pharmacology[J]. Oxid Med Cell Longev,2021,2021:8031319. doi:10.1155/2021/8031319.
[2] KIMURA Y,TSUKUI D,KONO H. Uric acid in inflammation and the pathogenesis of atherosclerosis[J]. Int J Mol Sci,2021,22(22):12394. doi:10.3390/ijms222212394.
[3] PIAO W,ZHAO L,YANG Y,et al. The prevalence of hyperuricemia and its correlates among adults in China: Results from CNHS 2015-2017[J]. Nutrients,2022,14(19):4095. doi:10.3390/nu14194095.
[4] 左俊,李坤,邓大同,等. 2017-2020年成人体检人群高尿酸血症患病率调查分析[J]. 安徽医专学报,2021,20(4):10-15. ZUO J,LI K,DENG D T,et al. Investigation and analysis of the prevalence of hyperuricemia in adult physical examination population from 2017 to 2020[J]. Journal of Anhui Medical College,2021,20(4):10-15. doi:10.3969/j.issn.2097-0196.2021.04.005.
[5] LEISEGANG K,SENGUPTA P,AGARWAL A,et al. Obesity and male infertility:Mechanisms and management[J]. Andrologia,2021,53(1):e13617. doi:10.1111/and.13617.
[6] FACONDO P,DI LODOVICO E,DELBARBA A,et al. The impact of diabetes mellitus type 1 on male fertility:Systematic review and meta-analysis[J]. Andrology,2022,10(3):426-440. doi:10.1111/andr.13140.
[7] 韩瑞钰,马婧,崔彤,等. 高尿酸血症对不育男性精液参数的影响[J]. 中华男科学杂志,2018,24(12):1069-1072. HAN R Y,MA J,CUI T,et al. Hyperuricemia reduces semen parameters in infertile men[J]. Chinese Journal of Andrology,2018,24(12):1069-1072. doi:10.13263/j.cnki.nja.2018.12.003.
[8] MA J,HAN R,CUI T,et al. Effects of high serum uric acid levels on oxidative stress levels and semen parameters in male infertile patients[J]. Medicine (Baltimore),2022,101(3):e28442. doi:10.1097/MD.0000000000028442.
[9]LIN G,YU Q,XU L,et al. Berberrubine attenuates potassium oxonate- and hypoxanthine-induced hyperuricemia by regulating urate transporters and JAK2/STAT3 signaling pathway[J]. Eur J Pharmacol,2021,912:174592. doi: 10.1016/j.ejphar.2021.174592.
[10] PAI H L,HSIEH S M,SU Y S,et al. Short-term hyperuricemia leads to structural retinal changes that can be reversed by serum uric acid lowering agents in mice[J]. Invest Ophthalmol Vis Sci,2022,63(10):8. doi:10.1167/iovs.63.10.8.
[11] 萧闵,王威,魏巍,等. 疏肝补肾毓麟汤调节VDAC2基因甲基化影响弱精症大鼠精子线粒体功能改善精子质量[J]. 中国实验方剂学杂志,2021,27(23):72-79. XIAO M,WANG W,WEI W,et al. Shugan Bushen Yulin Decoction regulates VDAC2 gene methylation to affect sperm mitochondrial function and improve sperm quality in asthenospermia rats[J]. Chinese Journal of Experimental Traditional Medical Formulae,2021,27(23)72-79. doi:10.13422/j.cnki.syfjx.20212338.
[12] YANG C,LI P,LI Z. Clinical application of aromatase inhibitors to treat male infertility[J]. Hum Reprod Update,2021,28(1):30-50. doi:10.1093/humupd/dmab036.
[13] 李昕,李豫,邵骏,等. 中国有生育力男性精子浓度35年变化趋势分析[J]. 中華男科学杂志,2021,27(7):645-648. LI X,LI Y,SHAO J,et al. Trend of change in sperm concentration in Chinese fertile males from 1984 to 2019[J]. National Journal of Andrology,2021,27(7):645-648. doi:10.13263/j.cnki.nja.2021.07.012.
[14] ANTINOZZI C,LISTA M,CAPONECCHIA L,et al. Exploratory analysis in the differences in blood serum and seminal plasma of adipose-tissue related peptides in obese and non-obese men and their correlations with semen parameters[J]. Front Endocrinol(Lausanne),2021,12:681939. doi:10.3389/fendo.2021.681939.
[15] NETHENGWE M,OKAIYETO K,OGUNTIBEJU O O,et al. Ameliorative effects of Anchomanes difformis aqueous extract against oxidative stress in the testes and epididymis of streptozotocin-induced diabetic male Wistar rats[J]. Saudi J Biol Sci,2022,29(5):3122-3132. doi:10.1016/j.sjbs.2022.03.015.
[16] NIU Y,TANG Q,ZHAO X,et al. Obesity-induced insulin resistance is mediated by high uric acid in obese children and adolescents[J]. Front Endocrinol (Lausanne),2021,12:773820. doi:10.3389/fendo.2021.773820.
[17] CHEN M,JI H,SONG W,et al. Anserine beneficial effects in hyperuricemic rats by inhibiting XOD,regulating uric acid transporter and repairing hepatorenal injury[J]. Food Funct,2022,13(18):9434-9442. doi:10.1039/d2fo01533a.
[18] WANG F,ZHAO X,SU X,et al. Isorhamnetin,the xanthine oxidase inhibitor from Sophora japonica,ameliorates uric acid levels and renal function in hyperuricemic mice[J]. Food Funct,2021,12(24):12503-12512. doi: 10.1039/d1fo02719k.
[19] 谭璐嫔,唐凤,韩萍萍,等. 二甲双胍对高尿酸诱导HepG2细胞脂质沉积的作用及其机制研究[J]. 中华糖尿病杂志,2021,13(6):618-625. TAN L P,TANG F,HAN P P,et al. Effects of metformin on lipid deposition in HepG2 cells induced by high uric acid[J]. Chinese Journal of Diabetes Mellitus,2021,13(6):618-625. doi:10.3760/cma.j.cn115791-20210107-00009.
[20] 谢超,张胜健,谭嘉莉,等. 血尿酸升高是导致肾功能下降的独立危险因素[J]. 中华肾脏病杂志,2019,35(2):100-105. XIE C,ZHANG S J,TAN J L,et al. Elevated serum uric acid is an independent risk factor for the loss of renal function[J]. Chinese Journal of Nephrology,2019,35(2):100-105. doi: 10.3760/cma.j.issn.1001-7097.2019.02.004.
[21] 乔美玲,骆骄阳,杨明翰,等. 多伞阿魏对人胃癌MGC-803裸鼠移植瘤生长及凋亡的影响[J]. 中国中药杂志,2019,44(13):2827-2834. QIAO M L,LUO J Y,YANG M H,et al. Effect of Ferula ferulaeoides on growth and apoptosis of human gastric cancer MGC-803 transplantation tumor in nude mice[J]. China Journal of Chinese Materia Medica,2019,44(13):2827-2834. doi:10.19540/j.cnki.cjcmm.20190401.401.
[22] KARAM Z M,BABA SALARI M,ANJOM SHOAA A,et al. Impact of oxidative stress SNPs on sperm DNA damage and male infertility in a south-east Iranian population[J]. Reprod Fertil Dev,2022,34(8):633-643. doi:10.1071/RD21305.
(2022-07-08收稿 2022-11-10修回)
(本文编辑 李国琪)
