hUC-MSCs来源的外泌体miR-1260a影响PCOS患者颗粒细胞凋亡的研究
2023-11-08赵元元吴小华
赵元元 吴小华
摘要:目的 探究人臍带间充质干细胞(hUC-MSCs)来源的外泌体miR-1260a靶向CASP8对多囊卵巢综合征(PCOS)患者颗粒细胞凋亡的影响。方法 取健康足月胎儿的脐带进行组织块贴壁法分离培养获得hUC-MSCs,采用流式细胞仪检测其标志性蛋白CD73和CD90的表达。收集hUC-MSCs培养上清液,提取hUC-MSCs外泌体,透射电镜观察其形态,Western blot检测外泌体膜表面标志物热休克蛋白70(HSP70)和肿瘤易感基因101(TSG101)的表达。PKH67标记外泌体,采用激光共聚焦显微镜观察PCOS颗粒细胞对外泌体的内化作用。Western blot检测hUC-MSCs外泌体对PCOS颗粒细胞凋亡的影响。利用GSE69909临床样本进行生物信息学分析,得到hUC-MSCs外泌体中异常高表达的miRNAs,并通过实时荧光定量PCR进行验证。合成miR-1260a模拟物及其对照转染至KGN细胞中,流式细胞术检测颗粒细胞凋亡率。利用Target Scan Human 7.2数据库进行miR-1260a靶基因的预测,采用双荧光素酶报告基因系统检测miR-1260a对靶基因的调控作用。qPCR检测PCOS颗粒细胞摄取hUC-MSCs外泌体前后miR-1260a及CASP8的表达情况。结果 经鉴定所培养的细胞符合hUC-MSCs的特征,hUC-MSCs外泌体为直径30~150 nm的圆形或椭圆形囊泡状结构,表达标志物蛋白HSP70和TSG101,并且可被PCOS颗粒细胞摄取。与对照组相比,hUC-MSCs上清液处理组及hUC-MSCs外泌体处理组Cleaved-Caspase-8、Cleaved-Caspase-3和Bax蛋白表达显著下调,抗凋亡蛋白Bcl-2表达显著上调(P<0.05)。经GSE69909数据库筛选及qPCR验证发现miR-1260a在hUC-MSCs外泌体中富集,miR-1260a过表达可显著抑制颗粒细胞的凋亡(P<0.05),经验证miR-1260a可直接靶向CASP8且PCOS颗粒细胞摄取hUC-MSCs外泌体后,颗粒细胞中miR-1260a的表达升高,CASP8的表达降低(P<0.05)。结论 hUC-MSCs来源的外泌体miR-1260a通过靶向CASP8抑制PCOS颗粒细胞凋亡。
关键词:多囊卵巢综合征;脐带;间质干细胞;外泌体;粒层细胞;细胞凋亡;微RNAs;miR-1260a
中图分类号:R711.75 文献标志码:A DOI:10.11958/20221070
The effect of exosomal miR-1260a derived from human umbilical mesenchymal stem cells on apoptosis of granulosa cells in PCOS patients
ZHAO Yuanyuan, WU Xiaohua
Center for Reproductive Medicine, the Fourth Hospital of Shijiazhuang (Gynecology and Obstetrics Hospital Affiliated to
Hebei Medical University); Key Laboratory of Maternal and Fetal Medicine of Hebei Province; the Institute of
Reproductive Health and Infertility, Shijiazhuang 050011, China
Corresponding Author E-mail: wuxiaohua1965@163.com
Abstract: Objective To explore the effect of exosomal miR-1260a derived from human umbilical mesenchymal stem cells (hUC-MSCs) on apoptosis of granulosa cells (GCs) in polycystic ovary syndrome (PCOS) by targeting CASP8. Methods hUC-MSCs were obtained from the umbilical cord of healthy full-term fetus by tissue explants adherent method. The surface markers CD73 and CD90 were detected by flow cytometry. The hUC-MSCs- exosomes (exos) were extracted from the supernatant of hUC-MSCs, and the morphology was observed by transmission electron microscopy (TEM). The surface heat shock protein (HSP70) and tumor susceptibility gene 101 (TSG101) were detected by Western blot assay. Confocal microscope was used to observe whether PKH67 labeled hUC-MSCs-exos could be absorbed by GCs. Western blot assay was used to assess the protective effect of hUC-MSCs-exos on PCOS GCs. Clinical samples of GSE69909 were used for bioinformatics analysis. The differentially expressed miRNAs in hUC-MSCs-exos were obtained and verified by qPCR. miR-1260a mimics and negative control (NC) were synthesized and then transfected into KGN cells. Subsequently, cell apoptosis was measured by flow cytometry. Target genes of miR-1260a were predicted using Target Scan Human 7.2 database and verified by a dual-luciferase reporter gene assay. Expression levels of miR-1260a and CASP8 before and after uptake of hUC-MSCs-exos by PCOS GCs were detected by qPCR. Results The isolated cells accorded with the characteristics of hUC-MSCs. hUC-MSCs-exos were circular or elliptical membranous vesicle with diameter ranged from 30-150 nm and expressed the typical exosome markers HSP70 and TSG101. Confocal microscopy results showed that hUC-MSCs-exos could be absorbed by GCs. Compared with the control group, the expression of Cleaved-Caspase-8, Cleaved-Caspase-3 and Bax were significantly down-regulated and the expression of Bcl-2 was significantly up-regulated in the hUC-MSCs supernatant treated and the hUC-MSCs-exos treated groups (P<0.05). After GSE69909 database screening and qPCR verification, it was found that miR-1260a was enriched in hUC-MSCs-exos, and the overexpression of miR-1260a significantly inhibited the apoptosis of KGN cells (P<0.05). A dual-luciferase reporter gene assay showed that CASP8 was a direct target of miR-1260a. Moreover, the uptake of hUC-MSCs-exos by PCOS GCs increased the expression of miR-1260a and decreased the expression of CASP8 (P<0.05). Conclusion Our study reveals that exosomal miR-1260a derived from hUC-MSCs inhibits apoptosis of GCs in PCOS by targeting CASP8.
Key words: polycystic ovary syndrome; umbilical cord; mesenchymal stem cells; exosomes; granulosa cells; apoptosis; microRNAs; miR-1260a
多囊卵巢综合征(PCOS)是育龄期女性常见的生殖功能障碍与代谢异常并存的内分泌疾病[1-2]。基于鹿特丹标准,PCOS在全球的发病率高达8%~15%,约占无排卵性不孕疾病的75%[3-4]。目前,卵泡发育异常是导致育龄期女性排卵障碍性不孕的主要原因[5]。颗粒细胞(granulosa cells,GCs)作为卵泡中的重要组成部分可直接影响卵泡的生长、发育、成熟及闭锁。其中,GCs凋亡直接影响卵泡发育,进而影响卵巢功能[6]。研究表明,PCOS患者卵巢GCs凋亡异常增多,干扰卵泡正常发育[5,7]。近年来,间充质干细胞(mesenchymal stem cells,MSCs)用于治疗卵巢功能障碍受到越来越多的关注[8-9]。目前研究发现,移植的MSCs主要通过分泌外泌体的方式调控卵巢微环境[10]。外泌体含有RNA、蛋白质等成分,可传递特定的信号分子,进一步影响受体细胞的生物学功能[11]。MSCs外泌体中富集了多种微小RNAs(microRNAs,miRNAs)[12]。然而,人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)来源的外泌体miRNA对PCOS卵泡发育的影响尚不清楚。本文详细探究了hUC-MSC来源的外泌体miR-1260a对PCOS颗粒细胞凋亡的影响,并分析其潜在的分子机制,以期为PCOS的临床治疗提供新思路。
1 资料与方法
1.1 标本 选取2020年3月—2022年9月就诊于石家庄市第四医院生殖医学中心行体外受精-胚胎移植(IVF-ET)助孕治疗的PCOS患者12例,年龄22~33岁,平均(28.33±2.77)岁,排除高血压及其他内分泌疾病,如肾上腺皮质增生、库欣综合征、雄激素分泌性肿瘤、糖尿病、甲状腺功能异常等。收集PCOS患者第1管无血清污染的卵泡液,提取原代GCs。剖宫产术中采集来自石家庄市第四医院产科生产的健康足月胎儿的脐带1~2 cm(家属知情),采集后的脐带保存于生理盐水中,6 h之内送达实验室分离hUC-MSCs。人卵巢颗粒细胞KGN(货号:ZQ0916)购自上海中乔新舟生物技术有限公司。本研究已通过石家庄市第四医院伦理委员会批准(20200006),所有患者均知情并签署知情同意书。
1.2 主要试剂及仪器 DMEM/F-12培养基、胎牛血清(FBS)购自美国Gibco公司;0.25%胰蛋白酶、青链霉素混合液购自北京索莱宝生物科技有限公司;样本密度分离液购自天津灏洋华科生物科技有限公司;exoEasy Maxi Kit、exoRNeasy Maxi Kit购自德国凯杰生物技术有限公司;PKH67 Green Fluorescent Cell Linker Mini Kit购自美国Sigma-Aldrich公司;TRIzol、Lipofectamine 2000购自美国Invitrogen公司;反转录试剂盒、实时荧光定量试剂盒购自上海翌圣生物科技有限公司;miR-1260a mimics及无义序列Negative Control购自广州锐博生物技术有限公司;miR-1260a、U6反转录引物和miR-1260a、U6、β-actin及CASP8定量引物由上海生工生物工程有限公司合成;Cleaved-Caspase3、Cleaved-Caspase8兔抗人单克隆抗体购自美国Cell Signaling Technology公司;Bax、Bcl-2兔抗人多克隆抗体购自成都正能生物科技有限公司;肿瘤易感基因101(tumor susceptibility gene101,TSG101)兔抗人单克隆抗体购自英国Abcam公司;热休克蛋白70(heat shock protein70,HSP70)兔抗人单克隆抗体购自美国Santa Cruz公司;内参β-actin兔抗人单克隆抗体购自美国Sigma-Aldrich公司;辣根过氧化物酶(HRP)标记的IgG山羊抗兔/鼠抗体购自美国KPL公司;PVDF膜购自美国密理博公司;PE AnnexinV Apoptosis Detection Kit购自美国BD公司;荧光素酶报告基因系统(E1910)购自美国Promega公司。实时荧光定量PCR(qPCR)仪(qTOWER3G,德国);蛋白电泳系统(Bio-Rad,美国);化学发光成像系统(FUSIONFX7.EDGE,法国);流式细胞仪(BD Melody,美国);倒置显微镜(Nikon,日本);激光共聚焦显微镜(Olympus,日本);化学发光仪(Promega,美国)。
1.3 研究方法
1.3.1 原代GCs的提取、培养 将PCOS患者卵泡液收集于50 mL无菌离心管中,2 000×g室温离心10 min;去除上清液后,将沉淀重悬于4 mL磷酸盐缓冲液(PBS),混匀后缓慢加入4 mL的样本密度分离液,1 500×g室温离心15 min;取中间白膜层,加入5 mL PBS混匀后1 000×g室温下离心5 min;重复操作1次。将所得的沉淀用含10% FBS、100 U/mL青霉素和100 mg/L链霉素的DMEM/F-12细胞培养液重悬,放置在6 cm的培养皿中,置于37 ℃含5%CO2细胞培养箱中培养,24 h后无菌PBS清洗细胞,更换为新鲜培养基,供后续实验使用。
1.3.2 hUC-MSCs的提取、培养及鉴定 超净台内取出脐带,PBS溶液充分冲洗残留的血液和血凝块,用无菌眼科剪沿脐带静脉纵向剪开,剔除动静脉及脐带外膜;将得到的华通氏胶剪为直径1 mm大小的组织块,置于T25的培养瓶中,使用无菌镊将组织块分散摆放至瓶皿并用镊子轻轻按压,使其与瓶底接触牢固,培养瓶倒置,在另一侧加入少量的含10% FBS的DMEM/F-12培养基,放置在37 ℃含5% CO2培养箱中4 h(组织块一侧在上),待组织块完全贴壁后,将培养瓶正放,添加适量的培养基使其完全浸润组织块。第3天开始半量换液,去除漂浮组织块,此后每3~4 d更换1次新鲜培养液,直至组织块周围析出细胞达到80%左右,进行细胞消化、传代。取第3代对数生长期细胞,胰蛋白酶消化,PBS清洗細胞,然后取1×106个细胞,分别加入藻红蛋白(P-phycoerythrin,PE)标记的CD73、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的CD90、别藻蓝蛋白(allophycocyanin,APC)标记的CD34和串联染料PE-Cy7标记的CD45抗体各5 μL,混匀室温避光孵育15 min,1 h内流式细胞仪上机检测CD73、CD90、CD34和CD45的表达情况。
1.3.3 外泌体提取与鉴定 hUC-MSCs无血清培养48 h后,收集上清液,严格按照exoEasy Maxi Kit试剂盒进行操作,提取后0.22 μm滤膜过滤,Nanodrop2000检测其浓度,分装保存至-80 ℃。取20 μL hUC-MSCs-exos滴在碳支持膜铜网放置3~5 min,然后用滤纸吸去多余的液体,2%磷钨酸滴在碳支持膜铜网放置2~3 min,用滤纸吸去多余液体,室温干燥,透射电镜下观察hUC-MSCs-exos的形态。Western blot检测hUC-MSCs-exos膜表面标志性蛋白HSP70和TSG101的表达,hUC-MSCs-exos上样量分别为40、80、100、150 μg。
1.3.4 外泌体摄取实验 使用PKH67荧光标记hUC-MSCs-exos,严格按照PKH67 Green Fluorescent Cell Linker Mini Kit说明书操作,标记后使用外泌体提取试剂盒重新提取外泌体,即得PKH67荧光标记的外泌体。PCOS原代GCs常规培养铺至12孔板中,24 h更换为新鲜培养基并加入PKH67荧光标记的外泌体,对照组加入PBS,孵育12 h后,PBS洗细胞2~3次,4%多聚甲醛固定10 min,PBS清洗2~3次,用含DAPI的封片剂封片,共聚焦显微镜下观察hUC-MSCs-exos是否被PCOS GCs摄取。
1.3.5 Western blot检测各组细胞凋亡蛋白表达情况 PCOS原代GCs培养至对数生长期后胰蛋白酶消化处理,将细胞分为3等份,分别标记为A、B、C组。待细胞贴壁后A组加入PBS,B组加入hUC-MSCs上清液,C组加入hUC-MSCs外泌体,继续培养48 h后用预冷的PBS清洗细胞2~3次,加入适量的SDS裂解液吹打混匀,4 ℃裂解30 min后收集细胞,Nanodrop 2000检测蛋白浓度。加入5×loading buffer后95 ℃水浴变性5 min。取50 μg蛋白进行SDS-PAGE电泳,转移至0.22 μm PVDF膜上,5%脱脂奶粉封闭1 h,加入Bax、Bcl-2、Cleaved-Caspase-8、Cleaved-Caspase-3一抗(1∶1 000),以及内参β-actin一抗(1∶10 000),4 ℃冰箱孵育过夜。次日使用TBST漂洗3次,加入1∶5 000稀释的山羊抗兔/鼠二抗,室温孵育1 h,ECL发光液显色,用Image J软件分析灰度值,比较各组蛋白相对表达量的变化。
1.3.6 GEO数据库分析miR-1260a在hUC-MSCs-exos中的表达 从美国国家生物技术信息中心高通量基因表达(gene expression omnibus,GEO)数据库(http://www.ncbi.nlm.nih.gov/geo/)下载关于hUC-MSCs-exos的miRNAs数据集(GSE69909),进一步从数据库中获取2 589个miRNAs,分析miR-1260a在hUC-MSCs-exos中的表达,并分析其与凋亡的关系。
1.3.7 外泌体miRNA的提取 使用exoRNeasy Maxi Kit试剂盒,严格按照说明书提取外泌体总RNA(包括miRNAs)。
1.3.8 qPCR检测miR-1260a和CASP8 mRNA的表达水平 miR-1260a反转录引物:5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTGGTGG-3′;內参U6:5′-GGAACGATACAGAGAAGATTAGC-3′。将1 μg RNA加至20 μL混合反应体系中反转录至cDNA,然后进行qPCR检测及分析。PCR反应体系总体积20 μL,包括cDNA模板1 μL,上、下游引物各0.8 μL,SYBR premix Ex Taq 10 μL,ddH2O 7.4 μL。PCR扩增反应条件:95 ℃预变性5 min;95 ℃ 10 s,60 ℃ 20 s,72 ℃ 20 s,40个循环。分别以β-actin和U6为内参,以2-ΔΔCt值表示miR-1260a、CASP8相对表达量。定量引物序列见表1。
1.3.9 细胞转染 将KGN细胞置于含10%FBS的DMEM/F-12培养基中,37 ℃含5%CO2培养箱中培养,取对数生长期的细胞接种于6孔板中,每孔接种细胞2×105个,待细胞密度达到60%时,利用转染试剂Lipofectamine 2000将miR-1260a mimics和mimics NC转染至细胞中,培养6 h后,换液,继续培养至48 h,具体转染过程参考转染试剂说明书操作。
1.4 流式细胞术检测颗粒细胞凋亡 2组细胞转染48 h后用胰蛋白酶消化并收集细胞,然后用预冷的PBS洗涤,按AnnexinV-PE/7-AAD细胞凋亡检测试剂盒操作说明分别加入5 μL Annexin V-PE和5 μL 7-AAD至各组细胞中,室温避光孵育15 min,1 h内流式细胞仪上机检测2组细胞凋亡情况。
1.5 双荧光素酶报告基因检测 利用Target Scan Human 7.2在线预测miR-1260a的靶点,确认miR-1260a与CASP8 3′非翻译区(UTR)的特异结合区。将含有miR-1260a结合位点的野生型(wt)和突变型(mut)CASP8 3′UTR基因序列插入荧光素酶报告基因的载体pGL3上,构建相应的质粒载体,然后将wt-CASP8、mut-CASP8分别与miR-1260a mimics、NC共转染至KGN细胞中,24 h后收集细胞,使用双荧光素酶检测试剂盒检测CASP8的荧光活性,以海肾的荧光活性作为内参。
1.6 统计学方法 采用GraphPad Prism 7.0进行数据分析。实验所得数据重复3次,符合正态分布的计量资料采用均数±标准差(x ±s)表示,2组间比较采用独立样本t检验,多组间比较采用单因素方差分析(ANOVA),组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 hUC-MSCs的分离与鉴定 提取健康足月胎儿脐带中的hUC-MSCs,细胞生长状态如图1A所示。传至第3代,经鉴定95%以上的细胞CD34和CD45为阴性,CD73和CD90为阳性,证实为hUC-MSCs,见图1B。
2.2 hUC-MSCs-exos提取与鉴定 透射电镜观察hUC-MSCs-exos为直径30~150 nm的圆形或椭圆形囊泡状结构,与外泌体结构一致,见图2A。Western blot结果显示该囊泡高表达外泌体膜表面标志性蛋白HSP70和TSG101,见图2B。PKH67荧光标记提取的外泌体,并将其与颗粒细胞共孵育12 h,发现PKH67标记的外泌体可被PCOS GCs摄取,见图2C。
2.3 hUC-MSCs-exos对PCOS GCs凋亡的影响 加入hUC-MSCs上清液或者外泌体后,PCOS GCs中Cleaved-Caspase-8、Cleaved-Caspase-3和Bax的表达下降,抗凋亡蛋白Bcl-2表达升高,差异有统计学意义(P<0.05),见表2、图3。
2.4 miR-1260a在hUC-MSCs-exos中的表达水平分析 GSE69909临床样本数据分析结果显示,miR-1260a在hUC-MSCs-exos中高度富集(图4A)。qPCR结果显示miR-1260a在hUC-MSCs及hUC-MSCs-exos中的表达均高于PCOS GCs(均P<0.05),见图4B。
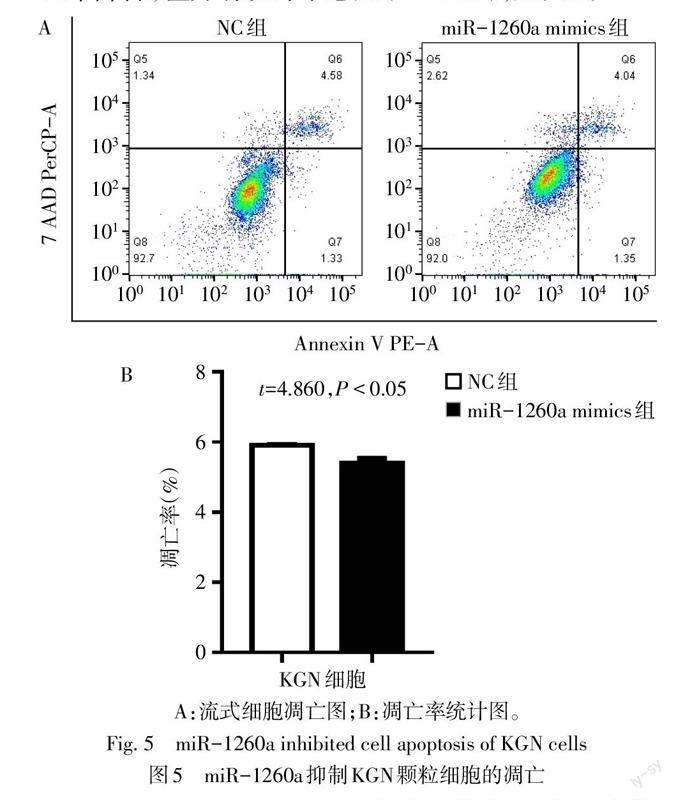
2.5 miR-1260a对KGN颗粒细胞凋亡的影响 与NC组相比,miR-1260a mimics组KGN颗粒细胞的凋亡率降低,差异有统计学意义(P<0.05),见图5。
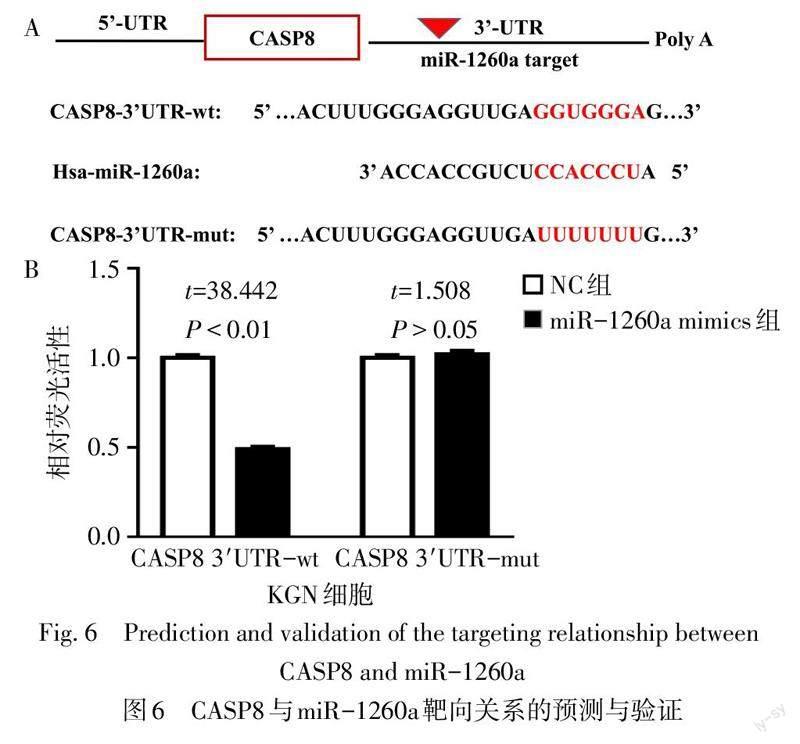
2.6 miR-1260a对CASP8基因的靶向调节 生物信息学预测结果显示,CASP8 3′-UTR序列上存在miR-1260a的结合位点(图6A)。与NC组相比,miR-1260a mimics与CASP8 3′UTR野生型质粒共转染KGN细胞后,细胞荧光素酶活性明显下降(P<0.01),miR-1260a mimics与CASP8 3′UTR突变型质粒共转染后,荧光素酶活性与NC组相比差异无统计学意义(P>0.05),见图6B。
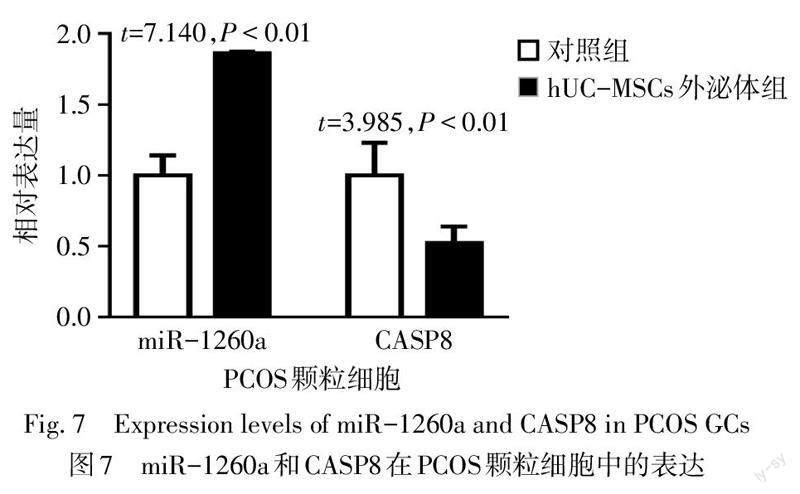
2.7 PCOS颗粒细胞摄取hUC-MSCs-exos后miR-1260a和CASP8表达情况 qPCR检测结果显示,与PBS对照组相比,加入hUC-MSCs外泌体后PCOS颗粒细胞中miR-1260a表达升高,CASP8表达降低,差异有统计学意义(P<0.01),见图7。
3 讨论
PCOS是导致育龄期女性生殖障碍的常见疾病之一,其确切的发病机制尚不清楚。PCOS存在卵巢病变,其卵泡发育异常,即早期卵泡生长过多,发育停滞[13]。笔者前期研究[7]显示,PCOS患者卵巢GCs中促凋亡蛋白Bax的表达显著上调,抗凋亡蛋白Bcl-2表达显著下调;与正常对照组相比,PCOS患者的获卵数多,但MⅡ卵率、受精率及优胚数低,提示PCOS患者GCs功能异常可能影响其卵泡发育,导致卵母细胞成熟率、受精率及优质胚胎数降低。
外泌体作为MSCs的重要活性成分,具有良好的生物相容性、低毒和低免疫原性特点。本课题组前期在人脐带中分离培养出hUC-MSCs,并进一步成功提取了hUC-MSCs-exos。但目前MSCs方面的研究主要涉及卵巢早衰、卵巢功能不全、宫腔黏连等,在PCOS中的研究相对较少[14-15]。Yin等[16]研究发现,在卵巢早衰小鼠体内移植人胎盘MSCs后,血清中促性腺激素和雌激素表达水平显著增加,颗粒细胞凋亡率降低,小鼠卵巢功能得到明显改善。Ding等[17]利用人羊膜MSCs与自然衰老的GCs共培养,发现GCs增殖率显著升高,将其移植到自然衰老的小鼠模型中,小鼠的卵巢功能得到明显改善,提示人羊膜MSCs可能通过调控GCs的功能阻止自然衰老卵巢功能的减退。Ling等[18]研究发现,将人羊膜MSCs注射入卵巢功能不全的大鼠体内,大鼠的卵巢功能得到明显改善。Kalhori等[19]研究发现,在PCOS小鼠模型中,小鼠骨髓MSCs能够通过调控免疫细胞抑制其炎症反应,有效改善PCOS小鼠症状,改善其卵巢功能。Xie等[20]也发现hUC-MSCs可抑制PCOS小鼠卵巢局部和全身炎症反应,改善卵巢功能。以上研究提示MSCs可能通过调控PCOS微环境中不同细胞的功能,有效改善PCOS患者症状。GCs作为卵巢中重要细胞组分,在PCOS的发生发展过程中起重要作用。笔者前期已经证实hUC-MSCs-exos可以改善PCOS患者GCs的炎癥状态[21],提示hUC-MSCs-exos除影响PCOS患者GCs炎症状态外,还可能影响PCOS患者GCs的功能。本研究结果显示,hUC-MSCs-exos可抑制PCOS患者GCs凋亡,表现为Cleaved-Caspase-8、Cleaved-Caspase-3和Bax表达下降,抗凋亡蛋白Bcl-2表达升高。通过分析GSE69909临床样本,发现miR-1260a在hUC-MSCs-exos中高度富集。据报道,miR-1260a在多种肿瘤组织及细胞中呈高表达,并可通过多种途径调控肿瘤进展[22]。miR-1260b可通过靶向CASP8促进乳腺癌进展[23]。Matsuda等[5]的研究表明PCOS卵泡发育与GCs功能密切相关,PCOS患者颗粒细胞功能失调将导致其卵泡发育异常。因此,hUC-MSCs-exos中miR-1260a可能通过影响GCs功能,进而改善PCOS患者的卵泡发育。笔者进一步通过生物信息分析网站找到miR-1260a调控的关键靶基因CASP8,并初步证实了miR-1260a与CASP8的靶向关系。Caspase-8是细胞凋亡外源激活途径的关键启动蛋白,激活的Caspase-8可导致Caspase蛋白水解级联反应,并进一步激活Caspase-3和Caspase-6等蛋白,最终诱导细胞凋亡[24]。有研究表明,Fas/FasL/Caspase-8信号通路在脱氢表雄酮诱导的PCOS大鼠卵泡闭锁过程中发挥关键作用[25]。本研究后续将会进一步探究CASP8在PCOS进展中的作用,详细阐明hUC-MSCs-exos中miR-1260a影响PCOS进展的作用机制。
綜上,hUC-MSCs-exos中miR-1260a通过靶向CASP8抑制PCOS卵巢GCs凋亡,进而改善PCOS患者的卵泡发育,有望成为替代MSCs的一种无细胞治疗策略,对改善PCOS发挥积极作用。
参考文献
[1] AZZIZ R. PCOS in 2015:New insights into the genetics of polycystic ovary syndrome[J]. Nat Rev Endocrinol,2016,12(3):183. doi:10.1038/nrendo.2016.9.
[2] ESCOBAR-MORREALE H F. Polycystic ovary syndrome:Definition,aetiology,diagnosis and treatment[J]. Nat Rev Endocrinol,2018,14(5):270-284. doi:10.1038/nrendo.2018.24.
[3] DIAO F Y,XU M,HU Y,et al. The molecular characteristics of polycystic ovary syndrome(PCOS)ovary defined by human ovary cDNA microarray[J]. J Mol Endocrinol,2004,33(1):59-72. doi:10.1677/jme.0.0330059.
[4] BOZDAG G,MUMUSOGLU S,ZENGIN D,et al. The prevalence and phenotypic features of polycystic ovary syndrome:A systematic review and meta-analysis[J]. Hum Reprod,2016,31(12):2841-2855. doi:10.1093/humrep/dew218.
[5] MATSUDA F,INOUE N,MANABE N,et al. Follicular growth and atresia in mammalian ovaries:Regulation by survival and death of granulosa cells[J]. J Reprod Dev,2012,58(1):44-50. doi:10.1262/jrd.2011-012.
[6] ALAM M H,MIYANO T. Interaction between growing oocytes and granulosa cells in vitro[J]. Reprod Med Biol,2020,19(1):13-23. doi:10.1002/rmb2.12292.
[7] ZHAO Y,PAN S,LI Y,et al. Exosomal miR-143-3p derived from follicular fluid promotes granulosa cell apoptosis by targeting BMPR1A in polycystic ovary syndrome[J]. Sci Rep,2022,12(1):4359. doi:10.1038/s41598-022-08423-6.
[8] YOON S Y. Mesenchymal stem cells for restoration of ovarian function[J]. Clin Exp Reprod Med,2019,46(1):1-7. doi:10.5653/cerm.2019.46.1.1.
[9] ESFANDYARI S,CHUGH R M,PARK H S,et al. Mesenchymal stem cells as a bio organ for treatment of female infertility[J]. Cells,2020,9(10):2253. doi:10.3390/cells9102253.
[10] XU S,LIU C,JI H L. Concise review:Therapeutic potential of the mesenchymal stem cell derived secretome and extracellular vesicles for radiation-induced lung injury:Progress and hypotheses[J]. Stem Cells Transl Med,2019,8(4):344-354. doi:10.1002/sctm.18-0038.
[11] ZHANG X,YUAN X,SHI H,et al. Exosomes in cancer:Small particle,big player[J]. J Hematol Oncol,2015,8:83. doi:10.1186/s13045-015-0181-x.
[12] O'LOUGHLIN A J,WOFFINDALE C A,WOOD M J. Exosomes and the emerging field of exosome-based gene therapy[J]. Curr Gene Ther,2012,12(4):262-274. doi:10.2174/156652312802083594.
[13] JARRETT B Y,VANDEN BRINK H,OLDFIELD A L,et al. Ultrasound characterization of disordered antral follicle development in women with polycystic ovary syndrome[J]. J Clin Endocrinol Metab,2020,105(11):e3847-3861. doi:10.1210/clinem/dgaa515.
[14] LIU R,ZHANG X,FAN Z,et al. Human amniotic mesenchymal stem cells improve the follicular microenvironment to recover ovarian function in premature ovarian failure mice[J]. Stem Cell Res Ther,2019,10(1):299. doi:10.1186/s13287-019-1315-9.
[15] TAKAHASHI A,YOUSIF A,HONG L,et al. Premature ovarian insufficiency:pathogenesis and therapeutic potential of mesenchymal stem cell[J]. J Mol Med(Berl),2021,99(5):637-650. doi:10.1007/s00109-021-02055-5.
[16] YIN N,ZHAO W,LUO Q,et al. Restoring ovarian function with human placenta-derived mesenchymal stem cells in autoimmune-induced premature ovarian failure mice mediated by treg cells and associated cytokines[J]. Reprod Sci,2018,25(7):1073-1082. doi:10.1177/1933719117732156.
[17] DING C,ZOU Q,WANG F,et al. Human amniotic mesenchymal stem cells improve ovarian function in natural aging through secreting hepatocyte growth factor and epidermal growth factor[J]. Stem Cell Res Ther,2018,9(1):55. doi:10.1186/s13287-018-0781-9.
[18] LING L,FENG X,WEI T,et al. Human amnion-derived mesenchymal stem cell (hAD-MSC) transplantation improves ovarian function in rats with premature ovarian insufficiency(POI)at least partly through a paracrine mechanism[J]. Stem Cell Res Ther,2019,10(1):46. doi:10.1186/s13287-019-1136-x.
[19] KALHORI Z,AZADBAKHT M,SOLEIMANI MEHRANJANI M,et al. Improvement of the folliculogenesis by transplantation of bone marrow mesenchymal stromal cells in mice with induced polycystic ovary syndrome[J]. Cytotherapy,2018,20(12):1445-1458. doi:10.1016/j.jcyt.2018.09.005.
[20] XIE Q,XIONG X,XIAO N,et al. Mesenchymal stem cells alleviate dhea-induced polycystic ovary syndrome (PCOS) by inhibiting inflammation in mice[J]. Stem Cells Int,2019,2019:9782373. doi:10.1155/2019/9782373.
[21] ZHAO Y,PAN S,WU X. Human umbilical cord mesenchymal stem cell-derived exosomes inhibit ovarian granulosa cells inflammatory response through inhibition of NF-κB signaling in polycystic ovary syndrome[J]. J Reprod Immunol,2022,152:103638. doi:10.1016/j.jri.2022.103638.
[22] SAID R,GARCIA-MAYEA Y,TRABELSI N,et al. Expression patterns and bioinformatic analysis of miR-1260a and miR-1274a in Prostate Cancer Tunisian patients[J]. Mol Biol Rep,2018,45(6):2345-2358. doi:10.1007/s11033-018-4399-x.
[23] PARK S,KIM J,CHO Y,et al. Promotion of tumorigenesis by miR-1260b-targeting CASP8:Potential diagnostic and prognostic marker for breast cancer[J]. Cancer Sci,2022,113(6):2097-2108. doi:10.1111/cas.15345.
[24] LI X,ZHANG Y,WANG N,et al. CircRNA.0007127 triggers apoptosis through the miR-513a-5p/CASP8 axis in K-562 cells[J]. J Zhejiang Univ Sci B,2022,23(9):732-746. doi:10.1631/jzus.B2200048.
[25] HONNMA H,ENDO T,HENMI H,et al. Altered expression of Fas/Fas ligand/caspase 8 and membrane type 1-matrix metalloproteinase in atretic follicles within dehydroepiandrosterone-induced polycystic ovaries in rats[J]. Apoptosis,2006,11(9):1525-1533. doi:10.1007/s10495-006-9148-2.
(2022-07-06收稿 2022-10-21修回)
(本文編辑 李国琪)
