人参皂苷Rg3通过抑制mTOR通路介导的磷酸戊糖途径对肺癌细胞的放射增敏作用
2023-11-08黄琳李彬胡作为
黄琳 李彬 胡作为
摘要:目的 探讨人参皂苷Rg3通过抑制哺乳动物雷帕霉素靶蛋白(mTOR)通路介导的磷酸戊糖途径(PPP),对肺癌细胞放射敏感性的影响。方法 以0、10、20、40、60、80 mg/L的人参皂苷Rg3处理肺癌细胞A549;MTT法检测细胞增殖情况;将细胞分为对照组(正常培养,不照射)、放射组(X射线照射处理)、人参皂苷Rg3组(60 mg/L人参皂苷Rg3,不照射)、联合组(X射线照射+60 mg/L人参皂苷Rg3)、激活剂组(X射线照射+60 mg/L人参皂苷Rg3+100 nmol/L mTOR通路激活剂MHY1485);均为加入相对应药物培养48 h后放射组、联合组和激活剂组采用8 Gy X射线照射。平板克隆实验检测各组细胞克隆形成率;酶联免疫吸附试验(ELISA)测定各组细胞葡萄糖-6-磷酸脱氢酶(G6PD)、还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)水平;DCFH-DA荧光探针法检测细胞内活性氧(ROS)水平;流式细胞仪检测细胞凋亡;γ-H2AX免疫荧光染色分析DNA损伤修复情况;Western blot检测细胞中mTOR、p-mTOR、增殖细胞核抗原(PCNA)、Bcl-2相关X蛋白(Bax)、胱天蛋白酶3(caspase-3)、γ-H2AX蛋白的表达。结果 人参皂苷Rg3以剂量依赖性的方式抑制A549细胞的增殖(P<0.05);与对照组比较,放射组、人参皂苷Rg3组细胞克隆形成率、G6PD、ROS、NADPH水平下降,p-mTOR/mTOR、PCNA蛋白表达水平降低,细胞凋亡率、γ-H2AX焦点数、Bax、caspase-3、γ-H2AX蛋白表达水平升高(P<0.05);与放射组、人参皂苷Rg3组比较,联合组细胞克隆形成率、G6PD、ROS、NADPH水平下降,p-mTOR/mTOR、PCNA蛋白表达水平降低,细胞凋亡率、γ-H2AX焦点数、Bax、caspase-3、γ-H2AX蛋白表达升高(P<0.05);与联合组比较,激活剂组细胞克隆形成率、G6PD、ROS、NADPH水平升高,p-mTOR/mTOR、PCNA蛋白表达水平升高,细胞凋亡率、γ-H2AX焦点数、Bax、caspase-3、γ-H2AX蛋白表达水平降低(P<0.05)。结论 人参皂苷Rg3发挥抑制肺癌作用可能是通过抑制mTOR介导的PPP实现的。
关键词:人参皂苷Rg3;肺肿瘤;辐射耐受性;辐射增敏药;磷酸戊糖途径;哺乳动物雷帕霉素靶蛋白
中圖分类号:R285,R734.2 文献标志码:A DOI:10.11958/20222018
The radiosensitizing effect of ginsenoside Rg3 on lung cancer cells by inhibiting mTOR pathway-mediated pentose phosphate pathway
HUANG Lin, LI Bin, HU Zuowei
Department of Oncology, Wuhan NO.1 Hospital, Wuhan 430000, China
Corresponding Author E-mail: 827823053@qq.com
Abstract: Objective To investigate the influence of ginsenoside Rg3 on the radiosensitivity of lung cancer cells by inhibiting the pentose phosphate pathway (PPP) mediated by mammalian target of rapamycin (mTOR) pathway. Methods A549 lung cancer cells were treated with 0, 10, 20, 40, 60, 80 mg/L ginsenoside Rg3. The proliferation of A549 cells was detected by MTT method. Cells were divided into the control group (normal culture, no irradiation), the radiation group (X-ray irradiation), the ginsenoside Rg3 group (60 mg/L ginsenoside Rg3, no irradiation), the combination group (X-ray irradiation +60 mg/L ginsenoside Rg3) and the activator group (X-ray irradiation +60 mg/L ginsenoside Rg3+100 nmol/L mTOR pathway activator MHY1485). All of groups were irradiated by 8 GyX ray after 48 h of culture with corresponding drugs. Plate cloning experiment was applied to detect the formation rate of cell clones in each group. Enzyme-linked immunosorbent assay (ELISA) was applied to determine levels of glucose-6-phosphate dehydrogenase (G6PD) and reduced nicotinamide adenine dinucleotide phosphate (NADPH) in cell supernatant of each group. DCFH-DA fluorescent probe method was applied to detect the level of intracellular reactive oxygen species (ROS). Cell apoptosis was detected by flow cytometry. γ-H2AX immunofluorescence staining was applied to analyze DNA damage repair. Western blot assay was applied to detect expression levels of mTOR, p-mTOR, proliferating cell nuclear antigen (PCNA), Bcl-2-associated X protein (Bax), caspase-3 and γ-H2AX protein in cells. Results Ginsenoside Rg3 inhibited the proliferation of A549 cells in a dose-dependent manner (P<0.05). Compared with the control group, the cell clone formation rate, G6PD, ROS, NADPH levels, p-mTOR/mTOR and PCNA protein expressions were significantly decreased in the radiation group and the ginsenoside Rg3 group, and the cell apoptosis rate, γ-H2AX foci number, Bax, caspase-3, γ-H2AX protein expressions were significantly increased (P<0.05). Compared with the radiation group and the ginsenoside Rg3 group, the cell clone formation rate, G6PD, ROS, NADPH levels, p-mTOR/mTOR, and PCNA protein expressions were significantly decreased in the combination group, the cell apoptosis rate, γ-H2AX foci number, Bax, caspase-3, γ-H2AX protein expressions were significantly increased (P<0.05). Compared with the combination group, the cell clone formation rate, G6PD, ROS, NADPH levels, p-mTOR/mTOR and PCNA protein expressions were significantly increased in the activator group, and the cell apoptosis rate, γ-H2AX foci number, Bax, caspase-3, γ-H2AX protein expressions were significantly decreased (P<0.05). Conclusion The inhibitory effect of ginsenoside Rg3 on lung cancer cells may be realized through inhibition of PPP mediated by mTOR.
Key words: Ginsenoside Rg3; lung neoplasms; radiation tolerance; radiation-sensitizing agents; pentose phosphate pathway; mammalian target of rapamycin
肺癌是全球最常见的恶性疾病之一,近年来,其发病率和死亡率迅速上升[1]。肺癌分为小细胞肺癌和非小细胞肺癌(NSCLC),其中以NSCLC较为多见[2]。放疗是肺癌的主要治疗方法之一,手术切除加放疗可延长患者无病生存期和总生存期[3]。放疗效果会受各方面影响,如何在不增加不良反应的前提下进一步增强放射治疗效果,提高患者的生活质量是国内外研究热点[4-5]。研究发现,人参皂苷Rg3是一种潜在的治疗NSCLC的天然药物[6-7]。人参皂苷Rg3能减弱放化疗不良反应,增强肺癌细胞对放射的敏感性[8-9]。此外,抑制哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路介导的糖酵解作用可增强NSCLC细胞的放疗敏感性[10]。Tsouko等[11]发现,mTOR介导的磷酸戊糖途径(pentose phosphate pathway,PPP)在前列腺癌细胞的生长中发挥促进作用。下调mTOR通路可抑制PPP和脂肪生成,从而降低黑色素瘤对维穆拉非尼的耐药性[12]。但人参皂苷Rg3能否通过抑制mTOR通路介导的PPP影响肺癌细胞对放射的敏感性尚不明确。本研究旨在探讨人参皂苷Rg3通过抑制mTOR通路介导的PPP,对肺癌细胞放射增敏的影响。
1 材料与方法
1.1 主要试剂及仪器
人肺癌细胞A549购于上海匹拓生物科技有限公司。人参皂苷Rg3、mTOR通路激活剂MHY1485购于北京伊塔生物科技有限公司;MTT试剂购于美国Sigma公司;兔源一抗Bcl-2相关X蛋白(Bax)、胱天蛋白酶3(caspase-3)、增殖细胞核抗原(PCNA)及辣根过氧化物酶标记的羊抗兔二抗均购于英国Abcam公司;兔源一抗磷酸化γ-H2AX组蛋白H2AX、mTOR、p-mTOR均购于Proteintech中国公司;葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate de-hydrogenase,G6PD)、酶联免疫吸附试验(ELISA)试剂盒、还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)ELISA試剂盒购于上海富雨生物科技有限公司;DCFH-DA活性氧(ROS)荧光探针购于北京索莱宝科技有限公司;蛋白提取试剂盒购自亚科因(武汉)生物公司;DNA损伤检测试剂盒(γ-H2AX免疫荧光法)购于广州威佳科技有限公司;多功能全自动酶标仪购于南京德铁实验设备有限公司;离心机购于艾本德中国有限公司;电泳仪购于美国Bio-Rad公司;流式细胞仪购于美国BD公司;srt100放疗剂量仪购于北京康科达有限公司。
1.2 细胞培养
将A549细胞置于DMEM的培养基中,在恒温培养箱中常规培养,培养条件为37 ℃、5%CO2。定期观察,及时更换新的培养基,当细胞融合度达到85%以上时,用0.25%胰蛋白酶消化传代,收集对数生长期的细胞进行实验。
1.3 MTT法检测细胞增殖情况
将对数生长期A549细胞以1×104个/孔,接种到96孔板中,放入5%CO2、37 ℃细胞培养箱中孵育,设6个复孔,培养24 h后吸去原培养液,加入含0、10、20、40、60、80 mg/L人参皂苷Rg3[13]的培养液48 h后,加入MTT溶液20 μL/孔,再培养4 h后,加入二甲基亚砜150 μL/孔,在摇床上充分振荡后,在酶标仪上于490 nm波长处检测各孔的吸光度(A490)值,细胞增殖抑制率(%)=[(A对照-A实验)/(A对照-A空白)]×100%。
1.4 平板克隆实验检测各组细胞克隆形成能力
将对数生长期A549细胞接种在直径60 mm细胞培养板中,将A549细胞分为对照组(正常培养,不照射)、放射组(X射线照射)、人参皂苷Rg3组(60 mg/L人参皂苷Rg3,不照射)、联合组(X射线照射+60 mg/L人参皂苷Rg3)、激活剂组(X射线照射+60 mg/L人参皂苷Rg3+100 nmol/L MHY1485[14])。培养24 h,待细胞贴壁后加入相对应药物培养48 h后,放射组、联合组及激活剂组给予8 Gy X射线照射,照射后立即更换培养液,继续培养14 d,甲醇固定细胞10 min,吉姆萨液染色30 min,水洗,干燥,计数克隆细胞数。计算细胞克隆形成率=克隆细胞数/接种细胞数×100%。
1.5 细胞G6PD、ROS、NADPH水平测定
将各组A549细胞悬液制成匀浆后按照G6PD、NADPH ELISA试剂盒检测说明书,检测细胞内G6PD、NADPH水平,用DCFH-DA探针通过流式细胞术检测细胞ROS的水平。
1.6 流式细胞仪检测细胞凋亡
将各组A549细胞以预冷的PBS洗涤2次,添加100 μL结合缓冲液悬浮各组A549细胞,再分别添加Annexin V-FITC和PI染液5 μL,充分混匀,于室温下避光染色15 min,离心弃上清液,加入0.5 mL PBS重悬细胞,使用流式细胞仪检测细胞凋亡情况。
1.7 γ-H2AX免疫荧光染色分析DNA损伤修复情况
将对数生长期A549细胞爬片接种至培养皿中,培养24 h后,待细胞贴壁后按1.4描述的方法对各组进行相应处理,再培养48 h,用4 Gy X射线照射各组细胞,照射结束记为0 h,照射后立即更换培养液,3 h后收集细胞进行固定和免疫荧光染色。用含DAPI的抗荧光淬灭封片液进行封片,利用荧光显微镜观察并拍照,计算每个细胞γ-H2AX平均焦点数。
1.8 Western blot检测细胞中mTOR、p-mTOR、PCNA、Bax、caspase-3、γ-H2AX蛋白表达
提取各组A549细胞的总蛋白,定量后进行聚丙烯酰胺凝胶电泳。转膜后室温条件下封闭2 h,最后再分别加入mTOR(1∶1 000)、p-mTOR(1∶1 000)、PCNA(1∶2 000)、Bax(1∶2 000)、caspase-3(1∶2 000)、γ-H2AX(1∶1 000)一抗在4 ℃条件下孵育过夜,加入二抗(1∶4 000)在室温条件下孵育90 min,使用GAPDH作为内源性对照。最后分析各个蛋白条带的灰度值,计算各蛋白的相对表达水平。
1.9 统计学方法
采用Graphpad Prism 7.0软件进行数据分析。计量资料以x±s表示。多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 人参皂苷Rg3对细胞的增殖的影响
经0、10、20、40、60、80 mg/L人参皂苷Rg3处理的A549细胞增殖抑制率(%)分别为0、10.21±2.16、14.89±2.48、28.57±3.48、42.58±4.21和58.64±4.38,10、20、40、60、80 mg/L人参皂苷Rg3处理的A549细胞增殖抑制率相比0 mg/L人参皂苷Rg3处理下,以剂量依赖性的方式升高(n=6,F=288.244,P<0.05),人参皂苷Rg3对A549细胞的IC50为69.18 mg/L,本研究选取60 mg/L人参皂苷Rg3进行后续实验。
2.2 各组细胞克隆形成率变化
对照组、放射组、人参皂苷Rg3组、联合组、激活剂组细胞克隆形成率(%)分别为98.23±4.82、76.54±3.74、54.31±3.58、37.82±3.43和58.61±3.66,差异有统计学意义(n=6,F=212.563,P<0.05)。与对照组比较,放射组、人参皂苷Rg3组细胞克隆形成率降低(P<0.05);与放射组、人参皂苷Rg3组比较,联合组细胞克隆形成率降低(P<0.05);与联合组比较,激活剂组细胞克隆形成率升高(P<0.05)。
2.3 各组细胞凋亡水平变化
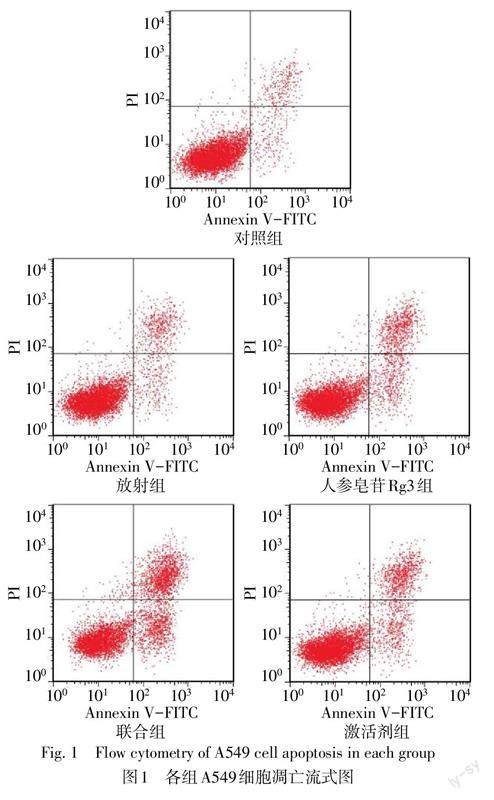
对照组、放射组、人参皂苷Rg3组、联合组和激活剂组细胞凋亡率(%)分别为10.36±2.14、18.48±3.10、23.25±2.68、45.58±3.45和24.65±3.21,差异有统计学意义(n=6,F=117.396,P<0.05)。与对照组相比较,放射组、人参皂苷Rg3组细胞凋亡率升高(P<0.05);与放射组、人参皂苷Rg3组比较,联合组细胞凋亡率升高(P<0.05),与联合组比较,激活剂组细胞凋亡率降低(P<0.05),见图1。
2.4 各组细胞内G6PD、ROS、NADPH水平比较
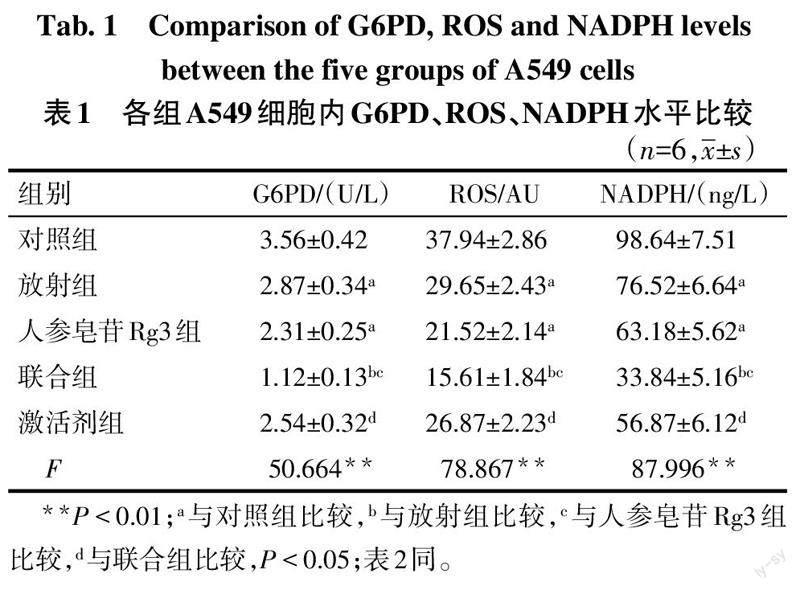
与对照组比较,放射组、人参皂苷Rg3组G6PD、ROS、NADPH水平降低(P<0.05);与放射组、人参皂苷Rg3组比较,联合组G6PD、ROS、NADPH水平降低(P<0.05);与联合组比较,激活剂组G6PD、ROS、NADPH水平升高(P<0.05)。见表1。
2.5 各组细胞中γ-H2AX焦点数比较
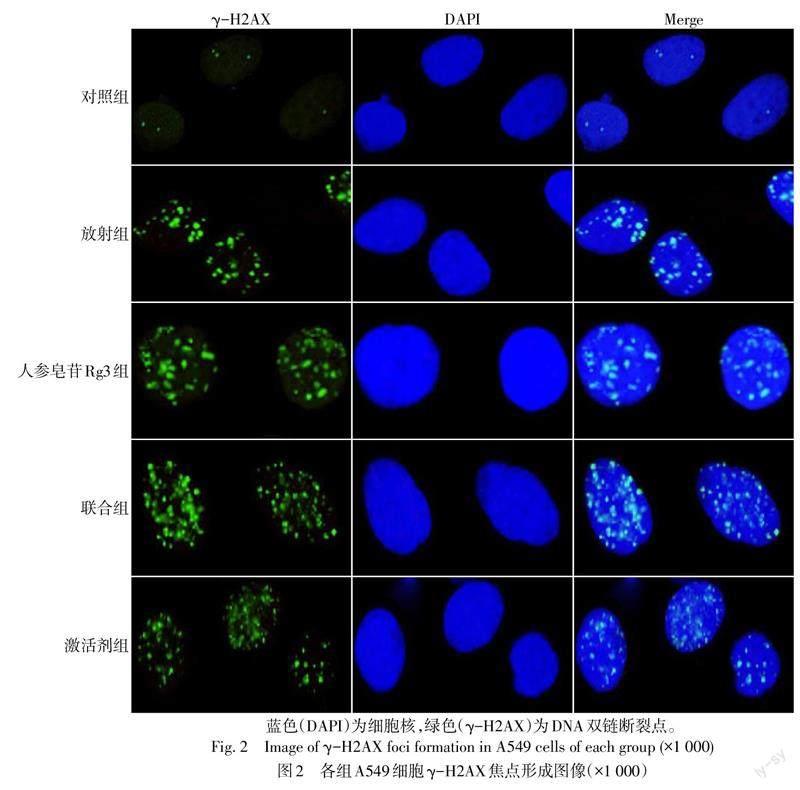
对照组、放射组、人参皂苷Rg3组、联合组和激活剂组γ-H2AX焦点数(个/视野)分别为3.14±0.70、22.15±2.17、27.68±2.54、43.32±3.46和25.71±2.68,差异有统计学意义(n=6,F=201.470,P<0.05)。与对照组比较,放射组、人参皂苷Rg3组细胞内γ-H2AX焦点数增加(P<0.05);与放射组、人参皂苷Rg3组比较,联合组细胞内γ-H2AX焦点数增加(P<0.05);与联合组比较,激活剂组细胞内γ-H2AX焦点数减少(P<0.05),见图2。
2.6 各组细胞mTOR、p-mTOR、PCNA、Bax、caspase-3、γ-H2AX蛋白表达水平比较
与对照组比较,放射组、人参皂苷Rg3组p-mTOR/mTOR、PCNA蛋白表达水平降低,Bax、caspase-3、γ-H2AX蛋白表达水平升高(P<0.05);与放射组、人参皂苷Rg3组比较,联合组p-mTOR/mTOR、PCNA蛋白表达水平降低,Bax、caspase-3、γ-H2AX蛋白表达水平升高(P<0.05);与联合组比较,激活剂组p-mTOR/mTOR、PCNA蛋白表达水平升高,Bax、caspase-3、γ-H2AX蛋白表达水平降低(P<0.05)。见图3、表2。
3 讨论
肺癌已成为人类癌症死亡的主要原因之一,严重威胁着患者的生活质量和生命安全[15]。寻找安全有效的治疗肺癌药物具有重要意义。人参皂苷Rg3是人参中的主要活性成分,具有广泛药理作用,如抗疲劳、抗氧化、降血糖、增强免疫功能等[7]。此外,人參皂苷Rg3在肿瘤的预防和治疗中发挥重要的作用,不仅可以抑制乳腺癌[16]、消化系统肿瘤[17]、肺癌等癌症的发生发展,还可提高肺癌对放疗的敏感性[8-9,18]。γ-H2AX蛋白是DNA损伤标志物,其产生的数量与DNA双链断裂呈正相关[19]。PCNA蛋白可以反映细胞增殖状态,其表达水平越高,表明细胞增殖越快。caspase-3是细胞凋亡过程中的剪切酶,Bax是细胞中的凋亡蛋白,在细胞发生凋亡时,Bax、caspase-3蛋白表达量水平显著升高[20-21]。本研究发现,人参皂苷Rg3通过抑制A549细胞的增殖,降低PCNA蛋白表达和细胞克隆形成率,提高Bax、caspase-3、γ-H2AX蛋白表达和细胞凋亡率,增加γ-H2AX焦点数,从而发挥抑制肺癌作用,联合X射线照射效果更强。
G6PD是PPP的限速酶,PPP产生的NADPH作为供氢体参与脂肪酸、氧化还原等代谢过程。G6PD在正常细胞的表达及活性被严格控制,而在肿瘤细胞其活性被异常激活,G6PD稳定敲低可以抑制癌细胞的迁移[22]。PPP通过提供DNA损伤修复原料及NADPH,在DNA损伤修复过程中起重要作用[23]。研究发现,清燥救肺汤(主要成分枇杷叶、麦冬、党参片等)通过抑制G6PD和NADPH氧化酶表达、减少ROS含量,抑制PPP,从而发挥抑制肺癌的作用[24]。本研究中人参皂苷Rg3与X射线照射抑制DNA损伤修复可能是通过降低G6PD、NADPH及ROS水平来实现的。另有研究表明,抑制mTOR介导的PPP在抑制肿瘤生长,克服耐药性方面发挥重要作用[11-12]。Marquard等[25]研究发现,激活的mTOR信号通路可能通过增强DNA修复机制,与放疗敏感性和细胞抑制药物的耐药性有关,而使用mTOR的抑制剂后,可显著抑制细胞和小鼠模型中的肿瘤细胞增殖,增强放射敏感性。本研究发现,使用mTOR激活剂不但可以减弱人参皂苷Rg3联合X射线照射对A549细胞增殖及DNA损伤修复的抑制作用,而且还能减弱对细胞凋亡的促进及放射敏感性的增强作用,提示人参皂苷Rg3发挥抑制肺癌的作用可能是通过抑制mTOR介导的PPP实现的。
综上所述,人参皂苷Rg3可能通过抑制mTOR介导的PPP,抑制A549细胞增殖、促进细胞凋亡、加速细胞DNA损伤,进而增强A549细胞对放疗的敏感性。但本研究仅在细胞水平上进行验证,后续将在体内进行进一步探索。
参考文献
[1] BADE B C,DELA CRUZ C S. Lung Cancer 2020:epidemiology,etiology,and prevention[J]. Clin Chest Med,2020,41(1):1-24. doi:10.1016/j.ccm.2019.10.001.
[2] HOWLADER N,FORJAZ G,MOORADIAN M J,et al. The effect of advances in lung-cancer treatment on population mortality[J]. N Engl J Med,2020,383(7):640-649. doi:10.1056/NEJMoa1916623.
[3] HUI Z,MEN Y,HU C,et al. Effect of postoperative radiotherapy for patients with pIIIA-N2 non-small cell lung cancer after complete resection and adjuvant chemotherapy:the phase 3 PORT-C randomized clinical trial[J]. JAMA Oncol,2021,7(8):1178-1185. doi:10.1001/jamaoncol.2021.1910.
[4] JIE X,FONG W P,ZHOU R,et al. USP9X-mediated KDM4C deubiquitination promotes lung cancer radioresistance by epigenetically inducing TGF-β2 transcription[J]. Cell Death Differ,2021,28(7):2095-2111. doi:10.1038/s41418-021-00740-z.
[5] LIU Y,CROWE W N,WANG L,et al. An inhalable nanoparticulate STING agonist synergizes with radiotherapy to confer long-term control of lung metastases[J]. Nat Commun,2019,10(1):5108. doi:10.1038/s41467-019-13094-5.
[6] 王愛华,刘维,金玥,等. 人参皂苷Rg3:一种潜在的治疗非小细胞肺癌的天然药物[J]. 中华中医药学刊,2022,40(2):156-159,272. WANG A H,LIU W,JIN Y,et al. Ginsenoside Rg3:a potential natural drug in treatment of non-small cell lung cancer[J]. Chinesearchives of traditional chinese medicine,2022,40(2):156-159,272. doi:10.13193/j.issn.1673-7717.2022.02.03.
[7] 乔雪涵,岳丽玲,朱文斌. 人参皂苷Rg3的抗肿瘤作用研究现状[J]. 中国临床药理学杂志,2021,37(10):272-1276. QIAO X H,YUE L L,ZHU W B. Research progress of ginsenoside Rg3 in anticancer effects[J]. Chin J Clin Pharmacol,2021,37(10):272-1276. doi:10.13699/j.cnki.1001-6821.2021.10.032.
[8] 黄琳,李彬,胡作为. 人参皂苷Rg3通过调控PXN-AS1促进肺癌放射增敏的机制探讨[J]. 中西医结合研究,2022,14(4):239-242,252. HUANG L,LI B,HU Z W. Mechanism of ginsenoside Rg3 promoting radiosensitization in lung cancer by regulating PXN-AS1[J]. Research of Integrated Traditional Chinese and Western MedicineAug,2022,14(4):239-242,252. doi:10.3969/j.issn.1674-4616.2022.04.006.
[9] YANG M,SHEN C,ZHU S J,et al. Chinese patent medicine Aidi injection for cancer care:an overview of systematic reviews and meta-analyses[J]. J Ethnopharmacol,2022,282:114656. doi:10.1016/j.jep.2021.114656.
[10] 張朴花,徐志广. 苦参碱通过抑制mTOR通路介导的糖酵解作用增强非小细胞肺癌细胞的放疗敏感性[J]. 中药材,2020,43(10):2559-2564. ZHANG P H,XU Z G. Matrine enhances the radiosensitivity of non-small cell lung cancer cells by inhibiting mTOR pathway-mediated glycolysis[J]. Journal of Chinese Medicinal Materials,2020,43(10):2559-2564. doi:10.13863/j.issn1001-4454.2020.10.040.
[11] TSOUKO E,KHAN A S,WHITE M A,et al. Regulation of the pentose phosphate pathway by an androgen receptor-mTOR-mediated mechanism and its role in prostate cancer cell growth[J]. Oncogenesis,2014,3(5):e103. doi:10.1038/oncsis.2014.18.
[12] WANG L,OTKUR W,WANG A,et al. Norcantharidin overcomes vemurafenib resistance in melanoma by inhibiting pentose phosphate pathway and lipogenesis via downregulating the mTOR pathway[J]. Front Pharmacol,2022,13:906043. doi:10.3389/fphar.2022.906043.
[13] 孟子琪,张睿,吴旭微,等. 人参皂苷Rg3靶向Wnt/β-连环蛋白信号通路调控胃癌顺铂耐药性[J]. 中国医学科学院学报,2022,44(3):366-376. MENG Z Q,ZHANG R,WU X W,et al. Ginsenoside Rg3 regulates cisplatin resistance in gastrsc cancer by Wnt/β-catenin signaling pathway[J]. Acta Academiae Medicinae Sinicae,2022,44(3):366-376. doi:10.3881/j.issn.1000-503X.14775
[14] 姚刘旭,滕文彬,黄素琴,等. mTOR/P70S6K/HIF-1α信号通路在脂多糖诱导Caco-2细胞屏障损伤中的作用及机制[J]. 中国病理生理杂志,2022,38(1):122-129. YAO L X,TENG W B,HUANG S Q,et al. Role of mTOR/P70S6K/HIF-1α signaling pathway in Caco-2 cell barrier injury induced by lipopolysaccharide[J]. Chinese Journal of Pathophysiology,2022,38(1):122-129. doi:10.3969/j.issn.1000-4718.2022.01.016.
[15] TOUMAZIS I,BASTANI M,HAN S S,et al. Risk-based lung cancer screening:a systematic review[J]. Lung Cancer,2020,147:154-186. doi:10.1016/j.lungcan.2020.07.007.
[16] NAKHJAVANI M,HARDINGHAM J E,PALETHORPE H M,et al. Ginsenoside Rg3:potential molecular targets and therapeutic indication in metastatic breast cancer[J]. Medicines(Basel),2019,6(1):17-36. doi:10.3390/medicines6010017.
[17] PAN L,ZHANG T,SUN H,et al. Ginsenoside Rg3(Shenyi Capsule) combined with chemotherapy for digestive system cancer in China:a meta-analysis and systematic review[J]. Evid Based Complement Alternat Med,2019,2019:2417418. doi:10.1155/2019/2417418.
[18] LIANG Y,ZHANG T,JING S,et al. 20(S)-Ginsenoside Rg3 inhibits lung cancer cell proliferation by targeting EGFR-mediated Ras/Raf/MEK/ERK pathway[J]. Am J Chin Med,2021,49(3):753-765. doi:10.1142/S0192415X2150035X.
[19] PLAPPERT-HELBIG U,LIBERTINI S,FRIEAUFF W,et al. Gamma-H2AX immunofluorescence for the detection of tissue-specific genotoxicity in vivo[J]. Environ Mol Mutagen,2019,60(1):4-16. doi:10.1002/em.22238.
[20] GONZáLEZ-MAGA?A A,BLANCO F J. Human PCNA structure,function and interactions[J]. Biomolecules,2020,10(4):570-588. doi:10.3390/biom10040570.
[21] WANG Z,CHEN X,LIU N,et al. A nuclear long non-coding RNA LINC00618 accelerates ferroptosis in a manner dependent upon apoptosis[J]. Mol Ther,2021,29(1):263-274. doi:10.1016/j.ymthe.2020.09.024.
[22] 白宏刚,张巧,况应敏,等. 葡萄糖-6-磷酸脱氢酶稳定敲低对肾透明细胞癌细胞迁移的抑制作用[J]. 医学研究生學报,2018,31(7):697-702. BAI H G,ZHANG Q,KUANG Y M,et al. Stable G6PD knockdown inhibits the migration of renal cell carcinoma cells[J].J Med Postgra,2018,31(7):697-702. doi:10.16571/j.cnki.1008-8199.2018.07.006.
[23] 郭翠,唐然,江世杰,等. 耐辐射异常球菌磷酸戊糖途径对DNA损伤修复的影响[J]. 核农学报,2016,30(2):252-258. GUO C,TANG R,JIANG S J,et al. Effects of pentose phosphate pathway on DNA damage repair in deinococcus radiodurans[J]. Journal of Nuclear Agricultural Sciences,2016,30(2):252-258. doi:10.11869/j.issn.100-8551.2016.02.0252.
[24] 陈江涛,余功,谢斌. 清燥救肺汤对肺癌磷酸戊糖能量代谢途径的关键酶G6PD活性及其调控因子的影响[J]. 中国实验方剂学杂志,2020,26(4):59-63. CHEN J T,XU G,XIE B. Effect of Qingzao Jiufei Tang on enzymatic activity and regulatory factor of key enzyme G6PD in pentose phosphate energy metabolism pathway in lung cancer[J]. Chinese Journal of Experimental Traditional Medical Formulae,2020,26(4):59-63. doi:10.13422/j.cnki.syfjx.20200426.
[25] MARQUARD F E,J?CKER M. PI3K/AKT/mTOR signaling as a molecular target in head and neck cancer[J]. Biochem Pharmacol,2020,172:113729. doi:10.1016/j.bcp.2019.113729.
(2022-12-08收稿 2023-02-10修回)
(本文编辑 李志芸)
