m6a甲基转移酶METTL3调控KAI1/CD82表达介导垂体神经内分泌肿瘤细胞生物学行为的机制研究
2023-11-08郑锴罗秀玲张玮豪刘宇利李玉明廖尚高
郑锴 罗秀玲 张玮豪 刘宇利 李玉明 廖尚高
摘要:目的 研究m6a甲基转移酶METTL3调控KAI1/CD82表达介导垂体神经内分泌肿瘤细胞增殖、迁移与侵袭的机制。方法 通过实时荧光聚合酶链反应(qPCR)和蛋白免疫印迹测定大鼠垂体细胞、大鼠垂体神经内分泌肿瘤细胞系GH3和MMQ中的METTL3与KAI1/CD82表达水平。体外培养GH3细胞,将其随机分为对照组、METTL3过表达质粒组、METTL3空质粒组、METTL3 siRNA组、METTL3 siRNA阴性对照组,经分组转染后,通过qPCR和蛋白免疫印迹检测各组细胞METTL3与KAI1/CD82表达;通过CCK-8实验检测各组细胞活力;通过细胞划痕、Transwell侵袭实验检测各组细胞迁移侵袭情况;通过甲基化RNA免疫共沉淀(MeRIP)实验检测各组细胞KAI1/CD82 m6A甲基化修饰情况。结果 相比大鼠垂体细胞,大鼠垂体神经内分泌肿瘤细胞系GH3及MMQ中的METTL3蛋白及mRNA表達水平明显升高,KAI1/CD82蛋白及mRNA表达水平明显降低(P<0.05)。与对照组相比,METTL3空质粒组、METTL3 siRNA阴性对照组细胞各指标差异无统计学意义;与对照组、METTL3空质粒组相比,METTL3过表达质粒组细胞活力、迁移距离、侵袭细胞数、METTL3蛋白及mRNA表达水平、KAI1/CD82 m6A甲基化水平升高(P<0.05),KAI1/CD82蛋白及mRNA表达水平降低(P<0.05);与对照组、METTL3 siRNA阴性对照组相比,METTL3 siRNA组细胞活力、迁移距离、侵袭细胞数、METTL3蛋白及mRNA表达水平、KAI1/CD82 m6A甲基化水平降低(P<0.05),KAI1/CD82蛋白及mRNA表达水平升高(P<0.05)。结论 下调METTL3表达可降低KAI1/CD82 m6A甲基化水平,促进KAI1/CD82 mRNA转录表达,抑制垂体神经内分泌肿瘤细胞增殖、侵袭及迁移。
关键词:垂体肿瘤;神经内分泌瘤;甲基转移酶类;Kangai-1蛋白质;甲基化;m6a甲基转移酶;甲基转移酶样3
中图分类号:R739.4 文献标志码:A DOI:10.11958/20221753
Mechanism of m6a methyltransferase METTL3 mediating the biological behavior of pituitary neuroendocrine tumor cells by regulating the expression of KAI1/CD82
ZHENG Kai LUO Xiuling ZHANG Weihao LIU Yuli LI Yuming LIAO Shanggao
1 Department of Neurosurgery, 2 Department of Head and Neck Oncology, Affiliated Hospital of Guizhou Medical University, Guiyang 550004, China; 3 School of Pharmacy, Guizhou Medical University
Abstract: Objective To study the mechanism of m6a methyltransferase METL3 mediated proliferation, migration and invasion of pituitary neuroendocrine tumor cells by regulating the expression of KAI1/CD82. Methods The expression levels of METTL3 and KAI1/CD82 in rat pituitary cells, rat pituitary tumor cell lines GH3, and MMQ were determined by qPCR and Western blot assay. GH3 cells were cultured in vitro and randomly divided into the control group, the METL3 overexpression plasmid group, the METL3 empty plasmid group, the METL3 siRNA group and the METL3 siRNA negative control group. After grouping and transfection, the expression levels of METL3 and KAI1/CD82 of each cell group were detected by qPCR and Western blot assay. The cell viability of each group was detected by CCK-8 experiment. The cell migration and invasion in each group were detected by cell scratch and Transwell invasion experiment. The methylation modification of KAI1/CD82 m6A in each group was detected by methylated RNA immunoprecipitation (MeRIP) experiment. Results Compared with rat pituitary cells, the METL3 protein and mRNA expression level in rat pituitary tumor cell lines GH3 and MMQ were significantly increased (P<0.05). KAI1/CD82 protein and mRNA expression levels were significantly reduced (P<0.05). There were no significant differences in cell indicators between the control group, the METTL3 empty plasmid group and the METTL3 siRNA negative control group (P>0.05). Compared with the control group and the METTL3 empty plasmid group, the cell viability, migration distance, number of invaded cells, METL3 protein and mRNA expression level, KAI1/CD82 m6A methylation level increased in the METL3 overexpression plasmid group (P<0.05), and the KAI1/CD82 protein and mRNA expression levels decreased (P<0.05). Compared with the control group and the METTL3 siRNA negative control group, the cell viability, migration distance, number of invaded cells, METTL3 protein and mRNA expression level and KAI1/CD82 m6A methylation level decreased in the METTL3 siRNA group (P<0.05), and KAI1/CD82 protein and mRNA expression levels increased (P<0.05). Conclusion Down-regulating the expression of METTL3 can reduce the level of KAI1/CD82 m6A methylation, promote the transcriptional expression of KAI1/CD82 mRNA, reduce the proliferation, invasion and migration of pituitary tumor cells, and inhibit the occurrence and development of pituitary tumors.
Key words: pituitary neoplasms; neuroendocrine tumors; methyltransferases; Kangai-1 protein; methylation; m6a methyltransferase; methyltransferase-like 3
垂体神经内分泌肿瘤是一种常见的神经系统肿瘤,发生于脑垂体,多数是良性肿瘤;过度生长的垂体细胞可导致内分泌紊乱,且随着瘤体增大,会造成颅内压升高,压迫视神经,特别是难治性垂体神经内分泌肿瘤,不仅预后差,还可能发展成恶性肿瘤,转移至其他器官[1-2]。甲基转移酶样3(METTL3)是一种介导RNA N6-甲基腺苷(N6-methyladenosine,m6A)修饰的甲基转移酶,在mRNA的生成、翻译和降解过程中发挥着关键的调控作用,参与介导大肠癌[3]、卵巢癌[4]等多种恶性肿瘤的发生发展,过表达METTL3可加速肿瘤的形成、转移及恶性进展[5]。有研究表明,METTL3在垂体神经内分泌肿瘤组织中高表达,在GH3细胞系中敲除METTL3基因,可明显抑制垂体神经内分泌肿瘤细胞的增殖,减少生长激素的分泌,揭示METTL3可作为一个有前景的垂体神经内分泌肿瘤治疗靶点[6]。转移侵袭是肿瘤的特征之一,也是造成其恶性进展的重要因素。KAI1/CD82是一种肿瘤转移抑制基因,其基因产物CD82属于糖蛋白四跨膜蛋白超家族成员,KAI1/CD82在多种类型癌症中呈低表达,导致预后不良[7],KAI1/CD82可通过调节多种信号介导细胞凋亡、运动、侵袭和细胞间黏附过程,抑制乳腺癌、结肠腺癌、非小细胞肺癌、喉癌等多种肿瘤转移[8-9]。研究显示,METTL3可增加与上皮-间充质转化相关基因的RNA的m6A修饰,增强癌细胞的迁移潜能[10]。笔者通过查阅SRAMP数据库,预测KAI1/CD82基因存在多个m6A甲基化修饰位点,因而推测m6A甲基转移酶METTL3可能通过调控KAI1/CD82表达参与垂体神经内分泌肿瘤的发生发展。本研究通过体外培养大鼠垂体神经内分泌肿瘤细胞系GH3,并进行初步探究。
1 材料与方法
1.1 主要材料
大鼠垂体细胞购自上海圻明生物科技有限公司;大鼠垂体神经内分泌肿瘤细胞GH3、MMQ,以及Ham's F-12K、马血清、特级胎牛血清、青霉素-链霉素溶液、0.25%胰蛋白酶溶液(含EDTA)购自武汉普诺赛生命科技有限公司;β-actin、METTL3及KAI1/CD82基因引物,METTL3过表达质粒、METTL3空载质粒、METTL3 siRNA、METTL3 siRNA阴性对照购自上海吉玛基因有限公司;PolyATtract? mRNA Isolation System试剂盒购自翌圣生物科技(上海)股份有限公司;LipofectamineTM2000、RNA fragmentation Reagents购自美国invitrogen公司;CCK-8试剂盒、Opti-MEM培养基、伊红染色液、总RNA提取试剂盒购自北京索莱宝科技有限公司;一步法反转录荧光定量试剂盒购自生工生物工程(上海)股份有限公司;Magna甲基化RNA免疫共沉淀(methylated RNA Immunoprecipitation,MeRIP)m6A试剂盒购自艾德科技(北京)有限公司;兔源抗大鼠METTL3一抗、兔源抗大鼠KAI1/CD82一抗、HRP偶聯山羊抗兔二抗购自英国Abcam公司。CKX41光学显微镜购自日本Olympus公司;Multiskan SkyHigh全波长酶标仪、NanoDrop 2000超微量分光光度计购自美国Thermo Fisher Scientific公司;C1000实时荧光定量PCR仪购自美国Bio-Rad公司。
1.2 研究方法
1.2.1 细胞培养、实时荧光聚合酶链反应(qPCR)实验
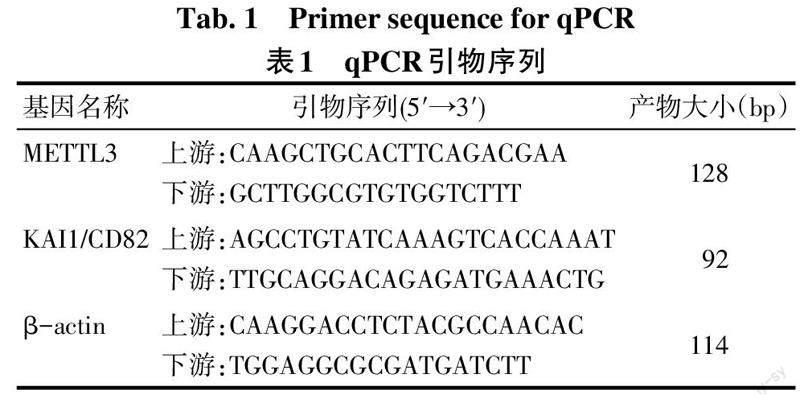
培养液配制:向Ham's F-12K培养基中加入15%的马血清、2.5%特级胎牛血清、1%青霉素-链霉素溶液,混匀。复苏大鼠垂体细胞及垂体神经内分泌肿瘤细胞系GH3、MMQ,以上述培养液分别重悬后,接种于T25培养瓶中无菌培养。传代后收集细胞,以试剂盒提取上述3种细胞总RNA,经超微量分光光度计测量出浓度,使用一步法反转录荧光定量试剂盒将其逆转录后进行qPCR反应,反应体系(20 μL):1 μL cDNA(50 mg/L)、10 μL 2×SYBR qPCR Mix,各0.5 μL上下游引物(均为10 μmol/L),8 μL dd H2O;反应条件:95 ℃ 30 s;95 ℃ 5 s,55 ℃ 10 s,72 ℃ 15 s,40个循环。所得到的各个基因Ct值采用2-ΔΔCt法进行分析,以β-actin为内参基因,各基因引物序列见表1。
1.2.2 蛋白免疫印迹实验
收集传代后的大鼠垂体细胞及GH3、MMQ,分别加入RIPA裂解液混匀、裂解、离心后提出其中总蛋白,测量各自浓度后每种细胞取20 ?g总蛋白,100 ℃煮沸变性后混匀上样,120 V恒压电泳后40 mA恒流湿转,以3%牛血清白蛋白封闭非特异性抗原后裁剪下蛋白条带,孵育兔源抗大鼠METTL3、KAI1/CD82、β-actin一抗和HRP偶联山羊抗兔二抗后洗膜、显色、摄片,采用Image J软件定量图片中各蛋白灰度值;以目的蛋白和β-actin蛋白条带灰度值的比值表示目的蛋白的相对表达水平。
1.2.3 GH3细胞分组处理
将传代的GH3细胞接种于24孔板中,无菌培养24 h后弃去细胞培养液,加入Opti-MEM培养基。按照随机数字表法分为对照组、METTL3过表达质粒组、METTL3空质粒组、METTL3 siRNA组、METTL3 siRNA阴性对照组,后4组以LipofectamineTM2000分别转染METTL3过表达质粒、METTL3空载质粒、METTL3 siRNA及METTL3 siRNA阴性对照,具体浓度和转染步骤参照文献[11],6 h后将Opti-MEM培养基更换为正常的细胞培养液,继续无菌培养。
1.2.4 GH3细胞METTL3与KAI1/CD82蛋白及mRNA表达
将按照1.2.3分组转染的GH3细胞接种于12孔板中,每组设6个复孔,无菌培养24 h后分别收集各组细胞,按照1.2.1和1.2.2方法通过qPCR和免疫印迹实验检测各组细胞中METTL3与KAI1/CD82 mRNA及蛋白表达水平。
1.2.5 GH3细胞增殖、迁移及侵袭检测
(1)增殖。将按照1.2.3方法分组转染的GH3细胞接种于96孔板中,另选出6个孔作为空白对照组,只加入培养液,不接种细胞。无菌培养24 h,然后每孔加适量CCK-8试剂,2 h后用全自动酶标仪测量每孔于450 nm波长下的吸光度(A),计算各组细胞活力(%)=(A实验组-A空白对照组)/(A对照组-A空白对照组)×100%。(2)迁移。将按照1.2.3方法分组转染的GH3细胞以5×105个/mL接种于12孔板中,无菌培养24 h。使用200 μL枪头在每孔中心位置划一条直线,将划痕中细胞以PBS缓冲液漂洗干净,于光镜下观察拍照后,运用Image Pro Plus软件测量划痕距离(测量各孔多个位点之间距离,取平均值),24 h后再次测量划痕距离,计算细胞迁移距离(?m)=转染前划痕距离-转染后划痕距离。(3)侵袭。将按照1.2.3方法分组转染的GH3细胞接种于12孔板中,无菌培养24 h后分别收集各组细胞,通过细胞计数板对各组细胞计数后,将其浓度调至5×105个/mL,加入被基质胶包被过的Transwell上室中培养(此时培养基为不含胎牛血清的Ham's F-12K),同时在Transwell下室中加入细胞培养液(含有10%胎牛血清),24 h后对下室细胞进行漂洗、固定、伊红染色处理,于光镜下观察拍照并计数细胞数目。
1.2.6 GH3细胞KAI1/CD82 m6A甲基化修饰情况检测
通过SRAMP数据库预测KAI1/CD82基因的m6A甲基化修饰位点。将按照1.2.3分组转染的GH3细胞接种于12孔板中,无菌培养24 h后分别收集各组细胞,以试剂盒提取其中的总RNA,参考文献[12]的方法,以PolyATtract? mRNA Isolation System试剂盒富集多聚腺苷酸阳性的RNA,然后使用RNA fragmentation Reagents对其片段化,各组预留一部分做Input对照,剩余RNA通过Magna MeRIP m6A试剂盒中的m6A抗体进行免疫共沉淀,具体步骤参照各自说明指导书进行,沉淀后的RNA按照1.2.1中的方法进行qPCR实验,检测各组细胞KAI1/CD82 m6A甲基化水平。
1.3 统计学方法
采用SPSS 24.0软件进行数据分析,计量资料符合正态分布,以x±s表示,多组间比较采用单因素方差分析,组间多重比较行LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 垂体神经内分泌肿瘤与正常垂体组织细胞中METTL3、KAI1/CD82表达比较
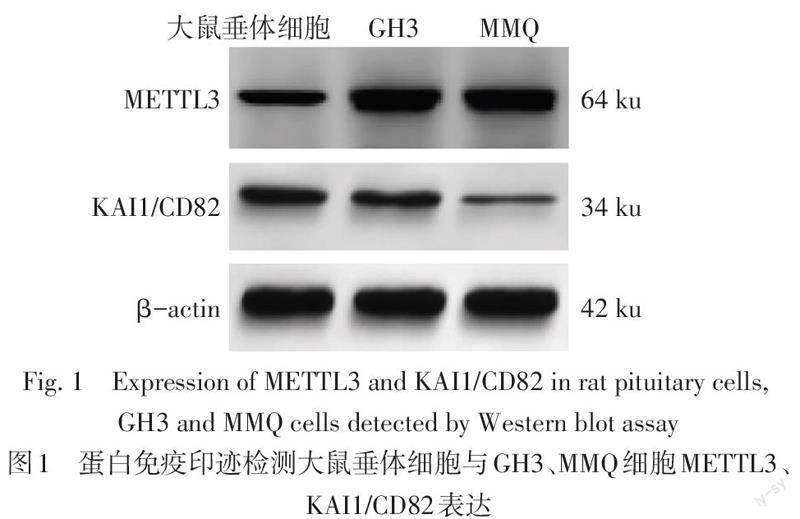
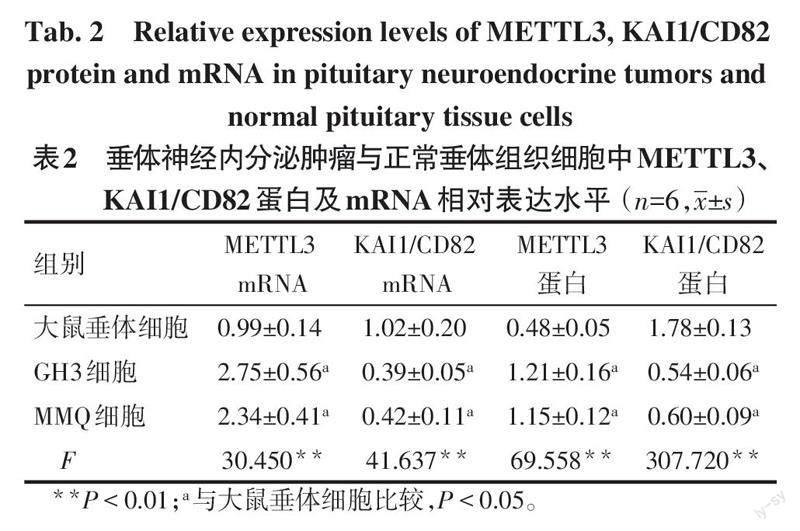
相比大鼠垂体细胞,大鼠垂体神经内分泌肿瘤细胞系GH3、MMQ中METTL3蛋白及mRNA表達水平升高,KAI1/CD82蛋白及mRNA表达水平降低(P<0.05),见图1、表2。由于GH3细胞中METTL3蛋白及mRNA表达水平高于MMQ细胞,因此选择GH3细胞用于后续实验。
2.2 各组GH3细胞METTL3与KAI1/CD82表达水平比较
与对照组相比,METTL3空质粒组、METTL3 siRNA阴性对照组METTL3、KAI1/CD82蛋白及mRNA表达水平差异无统计学意义;与对照组、METTL3空质粒组相比,METTL3过表达质粒组METTL3蛋白及mRNA表达水平升高(P<0.05),KAI1/CD82蛋白及mRNA表达水平降低(P<0.05);与对照组、METTL3 siRNA阴性对照组相比,METTL3 siRNA组METTL3蛋白及mRNA表达水平降低(P<0.05),KAI1/CD82蛋白及mRNA表达水平升高(P<0.05)。见图2、表3。
2.3 各组GH3细胞增殖情况比较
与对照组相比,METTL3空质粒组、METTL3 siRNA阴性对照组细胞活力差异无统计学意义;与对照组、METTL3空质粒组相比,METTL3过表达质粒组细胞活力升高(P<0.05);与对照组、METTL3 siRNA阴性对照组相比,METTL3 siRNA组细胞活力降低(P<0.05),见表4。
2.4 各组GH3细胞迁移情况比较
与对照组相比,METTL3空质粒组、METTL3 siRNA阴性对照组迁移距离差异无统计学意义;与对照组、METTL3空质粒组相比,METTL3过表达质粒组迁移距离增大(P<0.05);与对照组、METTL3 siRNA阴性对照组相比,METTL3 siRNA组迁移距离减小(P<0.05);见表4、图3。
2.5 各组GH3细胞侵袭情况比较
与对照组相比,METTL3空质粒组、METTL3 siRNA阴性对照组侵袭细胞数差异无统计学意义;与对照组、METTL3空质粒组相比,METTL3过表达质粒组侵袭细胞数增多(P<0.05);与对照组、METTL3 siRNA阴性对照组相比,METTL3 siRNA组侵袭细胞数减少(P<0.05);见表4、图4。
2.6 GH3细胞中METTL3对KAI1/CD82 m6A甲基化修饰的影响
通过SRAMP数据库预测显示,KAI1/CD82基因存在多个m6A甲基化修饰位点,见图5。与对照组相比,METTL3空质粒组、METTL3 siRNA阴性对照组KAI1/CD82 m6A甲基化水平差异无统计学意义;与对照组、METTL3空质粒组相比,METTL3过表达质粒组KAI1/CD82 m6A甲基化水平升高(P<0.05);与对照组、METTL3 siRNA阴性对照组相比,METTL3 siRNA组KAI1/CD82 m6A甲基化水平降低(P<0.05),见表4。
3 討论
目前,临床治疗垂体神经内分泌肿瘤,特别是难治性垂体神经内分泌肿瘤,主要以手术、放射治疗、服药为主,不仅易损伤大脑其他重要组织,还可能引起一系列后遗症,治疗效果并不理想,因而探讨垂体神经内分泌肿瘤发生发展的分子机制,寻找更有效的治疗手段具有重要意义[13-14]。
m6A修饰在癌症的发病及进展过程中起到重要的调控作用。甲基转移酶METTL3可介导多种致癌、抑癌基因的mRNA m6A修饰,调控大肠癌、肝细胞癌等多种肿瘤的发生发展[15-16]。研究表明,降低METTL3表达可抑制胃癌细胞增殖、迁移和侵袭,同时促进其凋亡[17],还能抑制垂体神经内分泌肿瘤细胞体外增殖生长[6]。本研究结果显示,相比正常垂体细胞,METTL3在垂体神经内分泌肿瘤细胞中高表达,以METTL3 siRNA下调GH3细胞中METTL3表达,可降低细胞活力、迁移距离、侵袭细胞数,而过表达METTL3起相反作用,提示METTL3参与介导垂体神经内分泌肿瘤细胞的增殖、迁移与侵袭过程,与以前研究结果一致,提示METTL3可作为治疗垂体神经内分泌肿瘤的重要作用靶点。
KAI1/CD82是一种抑癌基因,主要通过抑制肿瘤细胞生长、侵袭等生理过程而发挥抗癌作用,KAI1/CD82低表达时,其肿瘤抑制功能减弱,有利于肿瘤的进展和转移,是造成肿瘤患者预后不良的重要因素[18-20]。笔者查询SRAMP数据库显示,KAI1/CD82基因存在多个m6A甲基化修饰位点,因而推测METTL3介导垂体神经内分泌肿瘤发生发展的分子机制可能与调控KAI1/CD82的表达有关。本研究结果显示,相比正常垂体细胞,KAI1/CD82在垂体神经内分泌肿瘤细胞中低表达,下调GH3细胞中METTL3表达可降低KAI1/CD82 m6A甲基化水平,升高其mRNA表达水平,抑制细胞的增殖、迁移、侵袭,过表达METTL3时作用相反;提示METTL3可能通过对KAI1/CD82基因进行m6A mRNA甲基化修饰,下调KAI1/CD82表达,促进垂体神经内分泌肿瘤的发生及进展;而下调METTL3表达可降低KAI1/CD82 m6A甲基化水平,促进KAI1/CD82表达,抑制垂体神经内分泌肿瘤细胞迁移及侵袭,发挥抑癌作用。
总之,METTL3基因可能通过调控甲基化修饰介导KAI1/CD82基因表达,在垂体神经内分泌肿瘤的发生发展中发挥重要作用。本研究表明,敲低METTL3表达可促进KAI1/CD82基因表达并抑制KAI1/CD82 m6A甲基化,进而抑制垂体神经内分泌肿瘤细胞迁移及侵袭,提示敲低METTL3可能是一种有前景的垂体神经内分泌肿瘤治疗策略,后续会通过敲低KAI1/CD82表达进行验证,深入探究METTL3作为垂体神经内分泌肿瘤治疗靶点的潜力。
参考文献
[1] FENG Z,MAO Z,WANG Z,et al. Non-adenomatous pituitary tumours mimicking functioning pituitary adenomas[J]. Br J Neurosurg,2020,34(5):487-491. doi:10.1080/02688697.2018.1464121.
[2] KOBALKA P J,HUNTOON K,BECKER A P. Neuropathology of pituitary adenomas and sellar lesions[J]. Neurosurgery,2021,88(5):900-918. doi:10.1093/neuros/nyaa548.
[3] ZHOU D,TANG W,XU Y,et al. METTL3/YTHDF2 m6A axis accelerates colorectal carcinogenesis through epigenetically suppressing YPEL5[J]. Mol Oncol,2021,15(8):2172-2184. doi:10.1002/1878-0261.12898.
[4] MA Z,LI Q,LIU P,et al. METTL3 regulates m6A in endometrioid epithelial ovarian cancer independently of METTl14 and WTAP[J]. Cell Biol Int,2020,44(12):2524-2531. doi:10.1002/cbin.11459.
[5] 王天工,叶孟. m~6A甲基化与肿瘤研究进展[J]. 遗传,2018,40(12):1055-1065. WANG T G,YE M. Advances on the roles of m6A in tumorigenesis[J]. Hereditas,2018,40(12):1055-1065. doi:10.16288/j.yczz.18-098.
[6] CHANG M,WANG Z,GAO J,et al. METTL3-mediated RNA m6A hypermethylation promotes tumorigenesis and GH secretion of pituitary somatotroph adenomas[J]. J Clin Endocrinol Metab,2022,107(1):136-149. doi:10.1210/clinem/dgab652.
[7] YAN W,HUANG J,ZHANG Q,et al. Role of metastasis suppressor KAI1/CD82 in different cancers[J]. J Oncol,2021,2021:9924473. doi:10.1155/2021/9924473.
[8] AL-KHATER K M,ALMOFTY S,RAVINAYAGAM V,et al. Role of a metastatic suppressor gene KAI1/CD82 in the diagnosis and prognosis of breast cancer[J]. Saudi J Biol Sci,2021,28(6):3391-3398. doi:10.1016/j.sjbs.2021.03.001.
[9] HE X,MA X,WANG C,et al. The peptide mimicking small extracellular ring domain of CD82 inhibits tumor cell migration in vitro and metastasis in vivo[J]. J Cancer Res Clin Oncol,2021,147(7):1927-1934. doi:10.1007/s00432-021-03595-6.
[10] WANNA-UDOM S,TERASHIMA M,LYU H,et al. The m6A methyltransferase METTL3 contributes to transforming growth factor-beta-induced epithelial-mesenchymal transition of lung cancer cells through the regulation of JUNB[J]. Biochem Biophys Res Commun,2020,524(1):150-155. doi:10.1016/j.bbrc.2020.01.042.
[11] LIU Y,LIU Z,TANG H,et al. The N6-methyladenosine (m6A)-forming enzyme METTL3 facilitates M1 macrophage polarization through the methylation of STAT1 mRNA[J]. Am J Physiol Cell Physiol,2019,317(4):C762-C775. doi:10.1152/ajpcell.00212.2019.
[12] LIU L,WU Y,LI Q,et al. METTL3 promotes tumorigenesis and metastasis through BMI1 m6A methylation in oral squamous cell carcinoma[J]. Mol Ther,2020,28(10):2177-2190. doi:10.1016/j.ymthe.2020.06.024.
[13] P?REZ-L?PEZ C,?LVAREZ-ESCOL? C,ISLA GUERRERO A. Therapeutic approach to non-functioning pituitary adenomas[J]. Med Clin (Barc),2021,156(6):284-289. doi:10.1016/j.medcli.2020.08.019.
[14] LAMBACK E B,GUTERRES A,BARBOSA M A,et al. Cyclin A in nonfunctioning pituitary adenomas[J]. Endocrine,2020,70(2):380-387. doi:10.1007/s12020-020-02402-5.
[15] YANG N,WANG T,LI Q,et al. HBXIP drives metabolic reprogramming in hepatocellular carcinoma cells via METTL3-mediated m6A modification of HIF-1α[J]. J Cell Physiol,2021,236(5):3863-3880. doi:10.1002/jcp.30128.
[16] CHEN H,GAO S,LIU W,et al. RNA N6-methyladenosine methyltransferase METTL3 facilitates colorectal cancer by activating the m6A-GLUT1-mTORC1 axis and is a therapeutic target[J]. Gastroenterology,2021,160(4):1284-1300.e16. doi:10.1053/j.gastro.2020.11.013.
[17] YANG Z,JIANG X,LI D,et al. HBXIP promotes gastric cancer via METTL3-mediated MYC mRNA m6A modification[J]. Aging (Albany NY),2020,12(24):24967-24982. doi:10.18632/aging.103767.
[18] MILLER J,DREYER T F,B?CHER A S,et al. Differential tumor biological role of the tumor suppressor KAI1 and its splice variant in human breast cancer cells[J]. Oncotarget,2018,9(5):6369-6390. doi:10.18632/oncotarget.23968.
[19] KRISHNA LATHA T,VERMA A,THAKUR G K,et al. Down regulation of KAI1/CD82 in lymph node positive and advanced T-stage group in breast cancer patients[J]. Asian Pac J Cancer Prev,2019,20(11):3321-3329. doi:10.31557/APJCP.2019.20.11.3321.
[20] HUANG C,HAYS F A,TOMASEK J J,et al. Tetraspanin CD82 interaction with cholesterol promotes extracellular vesicle-mediated release of ezrin to inhibit tumour cell movement[J]. J Extracell Vesicles,2020,9(1):1692417. doi:10.1080/20013078.2019.1692417.
(2022-10-27收稿 2022-12-02修回)
(本文編辑 李国琪)
