白皮杉醇调控miR-106b-5p/RUNX3轴对宫颈癌细胞迁移及侵袭的影响
2023-11-08王玉宁宋聚星田志刚郝国荣申浩
王玉宁 宋聚星 田志刚 郝国荣 申浩
摘要:目的 探究白皮杉醇(PIC)調控微小RNA-106b-5p(miR-106b-5p)/RUNT相关转录因子3(RUNX3)轴对宫颈癌(CC)细胞迁移及侵袭的影响。方法 使用不同浓度PIC(0、20、40、80和160 μmol/L)培养液处理人CC Hela细胞,通过CCK-8法检测PIC对细胞增殖活力的影响,以确定PIC最佳使用浓度。将Hela细胞分为Control组、PIC组、PIC+NC mimics组、PIC+miR-106b-5p mimics组、NC inhibitor组、miR-106b-5p inhibitor组、miR-106b-5p inhibitor+si-RNA组及miR-106b-5p inhibitor+si-RUNX3组。实时荧光定量PCR检测各组Hela细胞miR-106b-5p表达水平;Transwell法检测各组Hela细胞迁移及侵袭能力;Western blot法检测各组Hela细胞中RUNX3、基质金属蛋白酶(MMP)2和MMP9蛋白表达水平;双萤光素酶报告基因实验检测miR-106b-5p与RUNX3靶向关系。结果 Hela细胞增殖活力随着PIC处理浓度的增高而呈现降低趋势(P<0.05),其中80 μmol/L PIC对Hela细胞的抑制作用接近半数抑制浓度(IC50),故选择80 μmol/L为后续研究的PIC浓度。与Control组相比,PIC组miR-106b-5p、MMP2和MMP9表达水平均降低,迁移和侵袭细胞数量减少,RUNX3表达水平增加(P<0.05);与PIC+NC mimics组相比,PIC+miR-106b-5p mimics组miR-106b-5p、MMP2和MMP9表达水平增加,迁移和侵袭细胞数量增多,RUNX3表达水平降低(P<0.05)。双萤光素酶报告基因实验证实RUNX3为miR-106b-5p的靶基因。与NC inhibitor组相比,miR-106b-5p inhibitor组RUNX3表达水平增加,miR-106b-5p、MMP2与MMP9表达水平降低,迁移和侵袭细胞数量减少(P<0.05);与miR-106b-5p inhibitor+si-RNA组相比,miR-106b-5p inhibitor+si-RUNX3组RUNX3表达水平降低,miR-106b-5p、MMP2和MMP9表达水平增加,迁移和侵袭细胞数量增多(P<0.05)。结论 PIC通过抑制miR-106b-5p表达、促进RUNX3表达来抑制CC细胞迁移及侵袭。
关键词:微RNAs;核心结合因子α3亚基;宫颈肿瘤;细胞运动;肿瘤浸润;白皮杉醇;miR-106b-5p;RUNT相关转录因子3
中图分类号:R285,R349.5文献标志码:ADOI:10.11958/20221529
The effect of piceatannol on the migration and invasion of cervical cancer cells by regulating miR-106b-5p/RUNX3 axis
WANG Yuning SONG Juxing TIAN Zhigang HAO Guorong SHEN Hao
1 Department of Gynecology, Shijiazhuang No.4 Hospital, Shijiazhuang 050035, China; 2 Department of Pathology,
3 Department of Clinical Laboratory, Baoding Second Central Hospital
Abstract: Objective To explore the effect of piceatannol (PIC) on migration and invasion of cervical cancer (CC) cells by regulating microRNA-106b-5p (miR-106b-5p)/RUNT-related transcription factor 3 (RUNX3) axis. Methods Firstly, human CC cells Hela were treated with culture media of different concentrations of PIC (0, 20, 40, 80 and 160 μmol/L), and the effect of PIC on cell proliferation was detected by CCK-8 assay to determine the optimal concentration of PIC. Hela cells were divided into the control group, the PIC group, the PIC+NC mimics group, the PIC+ miR-106b-5p mimics group, the NC inhibitor group, the miR-106b-5p inhibitor group, the miR-106b-5p inhibitor+si-RNA group and the miR-106b-5p inhibitor+si-RUNX3 group. qRT-PCR was used to detect the expression level of miR-106b-5p in Hela cells in each group. Transwell method was used to detect the migration and invasion abilities of Hela cells in each group. Western blot assay was used to detect the protein levels of RUNX3, MMP2 and MMP9 in Hela cells of each group. Dual luciferase reporter gene experiment was used to detect the targeting relationship between miR-106b-5p and RUNX3. Results The proliferation activity of Hela cells decreased with the increase of PIC treatment concentration (P<0.05). The inhibitory effect of 80 μmol/L PIC on Hela cells was nearly to half inhibitory concentration (IC50), so 80 μmol/L was selected as the PIC concentration for subsequent study. Compared with the control group, the expression levels of miR-106b-5p, MMP2 and MMP9 decreased in the PIC group, the numbers of migrating and invasive cells decreased, and the expression level of RUNX3 increased (P<0.05). Compared with the PIC+NC mimics group, the expression levels of miR-106b-5p, MMP2 and MMP9 increased in the PIC+miR-106b-5p mimics group, numbers of migrating and invasive cells increased, and the expression level of RUNX3 decreased (P<0.05). Double luciferase reporter gene assay confirmed RUNX3 as the target gene of miR-106b-5p. Compared with the NC inhibitor group, the expression level of RUNX3 increased in the miR-106b-5p inhibitor group, and the expression levels of miR-106b-5p, MMP2 and MMP9 decreased, and numbers of migrating and invasive cells decreased (P<0.05). Compared with the miR-106b-5p inhibitor+si-RNA group, the miR-106b-5p inhibitor+si-RUNX3 group showed lower RUNX3 expression level, increased miR-106b-5p, MMP2 and MMP9 expression levels, and increased numbers of migrating and invading cells (P<0.05). Conclusion PIC inhibits the miR-106b-5p expression and promotes RUNX3 expression to inhibit CC cell migration and invasion.
Key words: microRNAs; core binding factor alpha 3 subunit; uterine cervical neoplasms; cell movement; neoplasm invasiveness; piceatannol; miRNA-106b-5p; RUNT-related transcription factor 3
宮颈癌(cervical cancer,CC)是一种常见的女性恶性肿瘤,并且是全球癌症相关死亡的主要原因之一[1]。由于其病因复杂,对化疗药物的耐药性和高转移潜力,晚期CC患者预后较差[2-3]。因此,迫切需要开发一种高效、低毒的新型CC治疗药物。白皮杉醇(piceatannol,PIC)是一种酚类化合物和白藜芦醇的类似物,具有抗炎、抗氧化、调节免疫等多种药理特性[4],且对不同类型的肿瘤,如骨肉瘤[5]、膀胱癌[6]、结肠癌[7]具有抗癌活性。然而,其在CC中的作用和分子机制尚不清楚。微小RNAs(miRNAs)的发现为癌细胞转移和进展的分子机制研究提供了新的方法和见解。有研究发现,miR-106b在CC组织中高表达,可能与CC的发展有关[8]。miRNAs可通过调控靶基因的翻译或降解参与细胞增殖、凋亡、迁移及侵袭等多种过程。如在肝癌中,miR-106b-5p通过靶向下调RUNT相关转录因子3(RUNT-related transcription factor 3,RUNX3)表达促进肿瘤细胞的侵袭[9]。已知RUNX3在CC组织中低表达,为抑癌基因[10]。本研究旨在探究PIC对CC细胞增殖、迁移及侵袭的影响,并分析其潜在机制,以期为寻找新型CC化疗药物提供参考。
1 材料与方法
1.1 实验材料
人CC Hela细胞购于中国科学院细胞库;DMEM培养基、胎牛血清、青/链霉素、LipofectamineTM 2000转染试剂均购自美国Invitrogen公司。PIC购自成都麦得生物科技公司,纯度>99%。miR-106b-5p模拟物(miR-106b-5p mimics)和其阴性对照(NC mimics)、miR-106b-5p抑制物(miR-106b-5p inhibitor)和其阴性对照(NC inhibitor)、RUNX3小干扰RNA(si-RUNX3)和其阴性对照(si-RNA)、野生型RUNX3(RUNX3-WT)和突变型RUNX3(RUNX3-MUT)及miR-106b-5p和U6引物均由生工生物工程(上海)股份有限公司设计合成。CCK-8细胞增殖检测试剂盒购自日本Dojindo;细胞总RNA提取试剂盒(Trizol法)、逆转录试剂盒、实时荧光定量聚合酶链反应(qPCR)试剂盒购自南京Vazyme公司。Transwell小室、基质胶购自美国Corning公司;高效RIPA细胞快速裂解液购自北京Solarbio公司;兔源RUNX3、基质金属蛋白酶(MMP)2、MMP9、甘油醛-3-磷酸脱氢酶(GAPDH)抗体均购自英国Abcam公司;双萤光素酶活性检测试剂盒购自北京百奥莱博科技有限公司。HERAcell 240i型二氧化碳细胞培养箱、Varioskan LUX型酶标仪购自美国Thermo Fisher公司;CFX96型荧光定量PCR仪、OI100 Touch型凝胶成像系统购自美国Bio-Rad公司;CKX53型倒置显微镜购自日本OLYMPUS公司。
1.2 研究方法
1.2.1 细胞培养与分组
Hela细胞接种在含有10%胎牛血清和1%青/链霉素的DMEM培养基,置于37 ℃、5%CO2培养箱中培养。取对数生长期的Hela细胞进行实验,首先采用含不同浓度PIC(0、20、40、80和160 μmol/L)的培养液处理Hela细胞24 h,通过CCK-8法检测不同浓度的PIC对Hela细胞增殖活力的影响,以确定最佳PIC使用浓度。将细胞分为:Control组(正常培养Hela细胞)、PIC组(含有80 μmol/L PIC的培养基处理)、PIC+NC mimics组(转染NC mimics后采用80 μmol/L PIC处理)、PIC+miR-106b-5p mimics组(转染miR-106b-5p mimics后采用80 μmol/L PIC处理)、NC inhibitor组(转染NC inhibitor)、miR-106b-5p inhibitor组(转染miR-106b-5p inhibitor)、miR-106b-5p inhibitor+si-RNA组(转染miR-106b-5p inhibitor和si-RNA)及miR-106b-5p inhibitor+si-RUNX3组(转染miR-106b-5p inhibitor和si-RUNX3),细胞转染严格遵循LipofectamineTM 2000说明书流程。
1.2.2 CCK-8检测不同浓度PIC处理后的Hela细胞增殖活力
将对数生长期的Hela细胞以1×104个/孔的密度接种于96孔板中,采用含不同浓度PIC(0、20、40、80和160 μmol/L)培养液处理Hela细胞24 h,每孔中添加10 μL CCK-8溶液混匀后继续培养4 h,在酶标仪中测定450 nm波长处的吸光度(A)值,计算细胞增殖活力。细胞增殖活力(%)=APIC加药组/APIC 0 μmol/L组×100%,确定PIC最佳使用浓度。
1.2.3 qPCR检测各组Hela细胞中miR-106b-5p表达水平
参照1.2.1中分组方法处理Hela细胞后,弃去培养基,使用Trizol试剂提取各组细胞总RNA,将RNA通过逆转录试剂盒逆转录为cDNA,随后采用qPCR试剂盒进行PCR扩增。miR-106b-5p引物:上游5′-TGCGGCAACACCAGTCGATGG-3′,下游5′-CCAGTGCAGGGTCCGAGGT-3′;内参U6引物:上游5′-CTCGCTTCGGGCAGCACA-3′,下游5′-AACGCTTCACGAATTTGCGT-3′。反应体系:2 ?L cDNA(200 μg/L),上、下游引物(10 ?mol/L)各0.8 ?L,10 ?L SYBR Premix Ex Taq(2×),6.4 ?L ddH2O。反应条件:95 ℃预变性30 s;95 ℃变性5 s,55 ℃退火10 s,72 ℃延伸15 s,共40个循环。以U6为内参基因,使用2-ΔΔct法计算miR-106b-5p的相对表达水平。
1.2.4 Transwell法检测各组Hela细胞迁移及侵袭能力
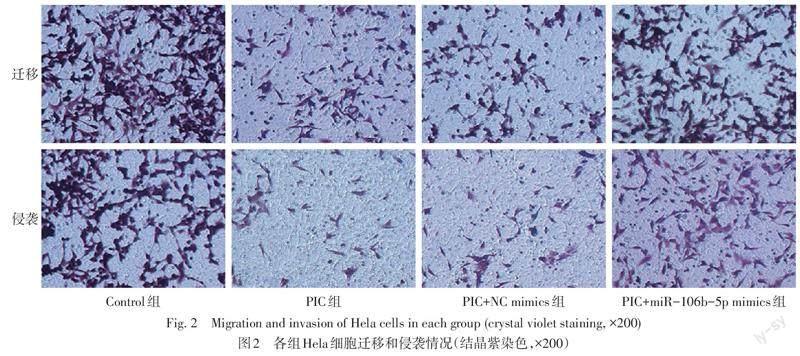
参照1.2.1中的分组方法处理Hela细胞后,弃去培养基,使用无血清的培养基悬浮细胞,吸取200 μL细胞悬浮液(1×106个/mL)加入Transwell小室上室中,下室中添加500 μL正常培养基。培养24 h后,取出小室,拭去上室中未迁移的细胞。4%多聚甲醛固定10 min,1%结晶紫染色5 min,晾干后于倒置显微镜下拍照记录。随机对5个视野细胞进行计数,取均值表示迁移细胞数量。侵袭实验将Transwell小室提前用基质胶包被后使用,其余步骤同上。
1.2.5 Western blot检测各组Hela细胞中RUNX3、MMP2和MMP9蛋白水平
参照1.2.1中分组方法处理Hela细胞后,弃去培养基,使用RIPA法提取各组细胞的总蛋白,并通过Bradford法定量。通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离蛋白质并转移到PVDF膜上。脱脂牛奶封闭1 h,添加一抗RUNX3(1︰500)、MMP2(1︰1 000)、MMP9(1︰1 000)及内参GAPDH(1︰2 000),在4 ℃下孵育过夜。隔日使用辣根过氧化物酶偶联的二抗(1︰4 000)在室温下孵育2 h。最后使用凝胶成像系统拍照记录蛋白印迹,使用Image J分析蛋白条带的灰度值,量化蛋白表达数据。目的蛋白的相对表达量=目的蛋白的灰度值/内参蛋白的灰度值。
1.2.6 双萤光素酶报告基因实验检测miR-106b-5p与RUNX3靶向关系
将Hela细胞以1×105个/孔的密度接种于24孔细胞培养板中,分别使用RUNX3-WT或RUNX3-MUT和miR-106b-5p mimics或NC mimics共同转染24 h。使用双萤光素酶活性检测试剂盒检测各组Hela細胞荧光素酶活性。
1.3 统计学方法
采用SPSS 25.0进行数据分析。符合正态分布的计量资料以x±s表示,使用单因素方差分析比较多组间的差异,组间多重比较使用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
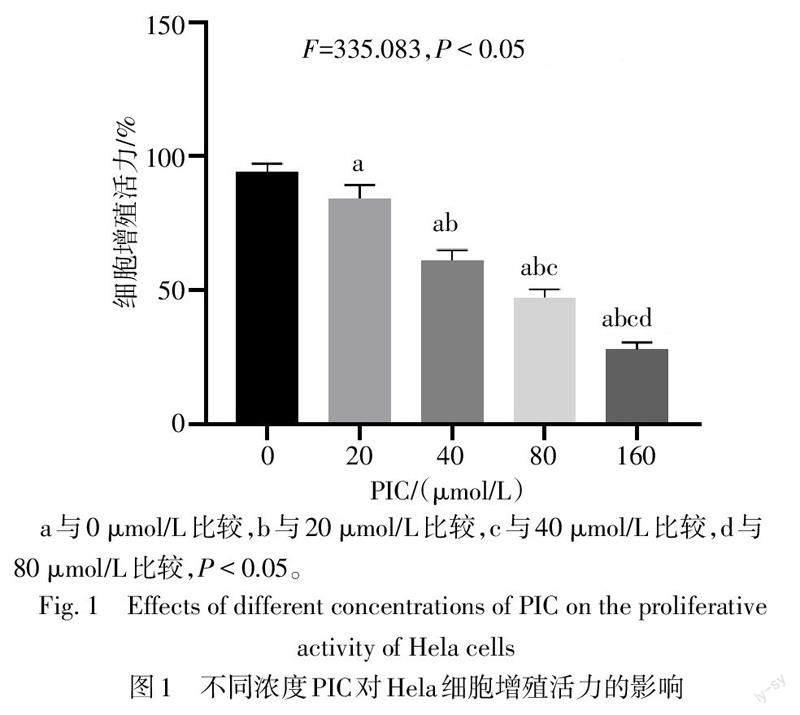
2.1 不同浓度PIC对Hela细胞增殖活力的影响
与0 μmol/L相比,20、40、80和160 μmol/L PIC处理后Hela细胞增殖活力降低(P<0.05),且随着PIC浓度的增高,其对Hela细胞增殖活力的抑制作用也随之增强,见图1。PIC对Hela细胞增殖活力的半数抑制浓度(IC50)为75.858 μmol/L,因80 μmol/L PIC对Hela细胞的抑制率接近IC50,故选择此浓度作为后续研究的PIC浓度。
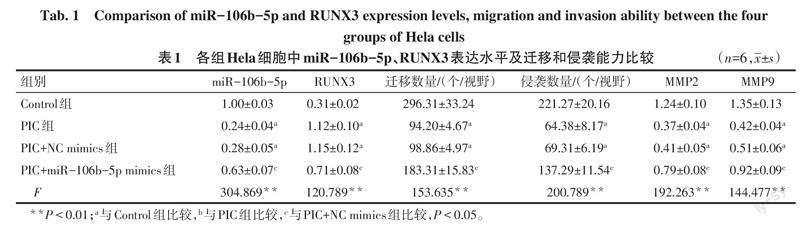
2.2 过表达miR-106b-5p对PIC抑制Hela细胞迁移及侵袭和促进RUNX3表达的影响
与Control组相比,PIC组miR-106b-5p、MMP2和MMP9表达水平均降低,迁移和侵袭细胞数量减少,RUNX3表达水平增加(P<0.05);与PIC+NC mimics组相比,PIC+miR-106b-5p mimics组miR-106b-5p、MMP2和MMP9表达水平均增加,迁移和侵袭细胞数量增多,RUNX3表达水平降低(P<0.05);而PIC+NC mimics组与PIC组细胞中miR-106b-5p、RUNX3、MMP2、MMP9表达水平及迁移和侵袭细胞数量差异均无统计学意义(P>0.05),见表1,图2、3。
2.3 miR-106b-5p与RUNX3靶向关系验证
经miRTarBase网站预测(http://mirtarbase.mbc.nctu. edu.tw/php/index.php)发现,miR-106b-5p与RUNX3存在靶向结合位点,见图4。双萤光素酶实验结果显示,上调miR-106b-5p表达可有效降低转染RUNX3-WT后的细胞相对萤光素酶活性(P<0.05),而对转染RUNX3-MUT后的细胞相对萤光素酶活性则无明显影响(P>0.05),见表2。
2.4 RUNX3对miR-106b-5p调控Hela细胞迁移及侵袭的影响
与NC inhibitor组相比,miR-106b-5p inhibitor组RUNX3表达水平增加,miR-106b-5p、MMP2与MMP9表达水平均降低,迁移和侵袭细胞数量减少(P<0.05);与miR-106b-5p inhibitor+si-RNA组相比,miR-106b-5p inhibitor+si-RUNX3组RUNX3表达水平降低,miR-106b-5p、MMP2和MMP9表达水平均增加,迁移和侵袭细胞数量增多(P<0.05);而miR-106b-5p inhibitor+si-RNA组与miR-106b-5p inhibitor组细胞中miR-106b-5p、RUNX3、MMP2与MMP9表达水平及迁移和侵袭细胞数量差异均无统计学意义(P>0.05),见表3,图5、6。
3 讨论
白藜芦醇通过抑制细胞生长在CC中发挥抗癌作用[11],而PIC是一种天然的白藜芦醇类似物。Wang等[5]研究发现,PIC以剂量依赖性方式抑制骨肉瘤细胞增殖,并诱导骨肉瘤细胞凋亡。Li等[6]发现PIC以浓度和时间依赖性方式抑制膀胱癌细胞的增殖,诱导细胞凋亡和细胞周期停滞。本研究发现,PIC以剂量依赖性方式抑制Hela细胞增殖,且PIC可降低Hela细胞的迁移和侵袭能力。这些数据表明PIC很有可能是CC的潜在治疗剂。
miRNAs可以通过靶向调控其靶基因来参与肿瘤细胞增殖、迁移及侵袭,发挥抑癌基因或促癌基因的作用[12]。以往研究表明,白藜芦醇及其类似物可调控miRNA表达来介导前列腺癌的治疗[13]。Du等[14]研究发现,PIC通过上调miR-181a的表达诱导黑色素瘤细胞凋亡。因此,笔者推测PIC可能通过介导miRNA对CC细胞发挥抗癌作用。本研究发现PIC可抑制miR-106b-5p表达。已知miR-106b-5p在结直肠癌[15]、肝癌[16]等肿瘤组织及细胞中高表达,可通过调控其靶基因发挥促癌作用。为了进一步研究PIC的抗癌作用是否受miR-106b-5p表达的调节,本研究在上调miR-106b-5p的同时使用PIC处理Hela细胞,发现上调miR-106b-5p可逆转PIC的抗肿瘤效应,提示PIC可能通过下调miR-106b-5p表达对CC细胞发挥抗癌作用。然而,其潜在分子机制还需进一步研究。
本研究通過在线网站预测发现,RUNX3存在miR-106b-5p靶向结合位点。Gu等[9]报道,miR-106b-5p通过靶向调控RUNX3表达促进肝癌细胞的发展。研究显示,RUNX3作为TGF-β介导信号通路的重要转录因子发挥作用,在多种癌症中发挥抑癌作用[17]。Song等[18]发现,RUNX3在胃癌组织和细胞中下调,上调其表达可抑制癌细胞的增殖和侵袭。Qin等[19]研究显示,miR-20a过表达会抑制RUNX3表达,进而激活TGF-β信号通路,促进非小细胞肺癌的增殖、迁移和侵袭。在本研究中,PIC促进了Hela细胞中RUNX3表达,提示RUNX3可能参与PIC对Hela细胞抗癌作用。随后,通过双荧光素酶报告基因检测发现,RUNX3可能为miR-106b-5p的靶基因;Western blot证实抑制miR-106b-5p表达可有效促进RUNX3表达,抑制RUNX3表达可逆转敲低miR-106b-5p表达对Hela细胞的迁移和侵袭的抑制作用。以上结果提示miR-106b-5p可能靶向负调控RUNX3的表达。
综上所述,PIC可抑制Hela细胞增殖、迁移和侵袭,其分子机制可能与抑制miR-106b-5p表达、促进RUNX3表达有关。本研究表明PIC可能是CC的一种有效治疗选择,为探索CC发展的分子机制研究提供了参考。但本研究仅选择了一种CC细胞系进行研究,且并未探究PIC调控miR-106b-5p/RUNX3轴抑制CC迁移和侵袭是否还有其他因子参与,在后续的研究中将结合体内动物实验进行更深入更全面的探索。
参考文献
[1] SUNG H,FERLAY J,SIEGEL R L,et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2021,71(3):209-249. doi:10.3322/caac.21660.
[2] LEI J,ARROYO-M?HR L S,LAGHEDEN C,et al. Human papillomavirus infection determines prognosis in cervical cancer[J]. J Clin Oncol,2022,40(14):1522-1528. doi:10.1200/JCO.21.01930.
[3] MAYADEV J S,KE G,MAHANTSHETTY U,et al. Global challenges of radiotherapy for the treatment of locally advanced cervical cancer[J]. Int J Gynecol Cancer,2022,32(3):436-445. doi:10.1136/ijgc-2021-003001.
[4] WANG K J,ZHANG W Q,LIU J J,et al. Piceatannol protects against cerebral ischemia/reperfusion?induced apoptosis and oxidative stress via the Sirt1/FoxO1 signaling pathway[J]. Mol Med Rep,2020,22(6):5399-5411. doi:10.3892/mmr.2020.11618.
[5] WANG B,LI J. Piceatannol suppresses the proliferation and induced apoptosis of osteosarcoma cells through PI3K/AKT/mTOR pathway[J]. Cancer Manag Res,2020,12(3):2631-2640. doi:10.2147/CMAR.S238173.
[6] LI X G,ZHANG W S,YAN X P. Piceatannol inhibits proliferation and induces apoptosis of bladder cancer cells through regulation of the PTEN/AKT signal pathway[J]. Cell Mol Biol (Noisy-le-grand),2020,66(3):181-184.
[7] ALJABALI A A A,BAKSHI H A,HAKKIM F L,et al. Albumin nano-encapsulation of piceatannol enhances its anticancer potential in colon cancer via downregulation of nuclear p65 and HIF-1α[J]. Cancers (Basel),2020,12(1):113-118. doi:10.3390/cancers12010113.
[8] FAN Y,SHENG W,MENG Y,et al. LncRNA PTENP1 inhibits cervical cancer progression by suppressing miR-106b[J]. Artif Cells Nanomed Biotechnol,2020,48(1):393-407. doi:10.1080/21691401.2019.1709852.
[9] GU H,GU S,ZHANG X,et al. miR-106b-5p promotes aggressive progression of hepatocellular carcinoma via targeting RUNX3[J]. Cancer Med,2019,8(15):6756-6767. doi:10.1002/cam4.2511.
[10] 戴云峰. RUNX3和VEGF在宫颈癌组织中的表达分析[J]. 中国医药指南,2020,18(9):51-52. DAI Y F. Expression analysis of RUNX3 and VEGF in cervical carcinoma[J]. Guide of China Medicine,2020,18(9):51-52. doi:10.15912/j.cnki.gocm.2020.09.028.
[11] SUN X,FU P,XIE L,et al. Resveratrol inhibits the progression of cervical cancer by suppressing the transcription and expression of HPV E6 and E7 genes[J]. Int J Mol Med,2021,47(1):335-345. doi:10.3892/ijmm.2020.4789.
[12] 王旭,徐文举,袁五营. miRNA-4262通过靶向神经调节蛋白1调控非小细胞肺癌细胞增殖,侵袭,迁移的作用机制[J]. 癌症进展,2020,18(2):133-137. WANG X,XU W J,YUAN W Y. Mechanism of miRNA-4262 regulating the proliferation, invasion and migration of non-small cell lung cancer cells by targeting NRG1[J]. Oncology Progress,2020,18(2):133-137. doi:10.11877/j.issn.1672-1535.2020.18.02.07.
[13] KUMAR A, RIMANDO A M, LEVENSON A S. Resveratrol and pterostilbene as a microRNA-mediated chemopreventive and therapeutic strategy in prostate cancer[J]. Ann N Y Acad Sci,2017,1403(1):15-26. doi:10.1111/nyas.13372.
[14] DU M,ZHANG Z,GAO T. Piceatannol induced apoptosis through up-regulation of microRNA-181a in melanoma cells[J]. Biol Res,2017,50(1):36-45. doi:10.1186/s40659-017-0141-8.
[15] PAN M,CHEN Q,LU Y,et al. MiR-106b-5p regulates the migration and invasion of colorectal cancer cells by targeting FAT4[J]. Biosci Rep,2020,40(11):98-105. doi:10.1042/BSR20200098.
[16] YU L X,ZHANG B L,YANG M Y,et al. MicroRNA-106b-5p promotes hepatocellular carcinoma development via modulating FOG2[J]. Onco Targets Ther,2019,12(5):5639-5647. doi:10.2147/OTT.S203382.
[17] XIAO Z,TIAN Y,JIA Y,et al. RUNX3 inhibits the invasion and migration of esophageal squamous cell carcinoma by reversing the epithelial-mesenchymal transition through TGF-β/Smad signaling[J]. Oncol Rep,2020,43(4):1289-1299. doi:10.3892/or.2020.7508.
[18] SONG J,LIU Y,WANG T,et al. MiR-17-5p promotes cellular proliferation and invasiveness by targeting RUNX3 in gastric cancer[J]. Biomed Pharmacother,2020,128(4):110246-110253. doi:10.1016/j.biopha.2020.110246.
[19] QIN X,WANG X Y,FEI J W,et al. MiR-20a promotes lung tumorigenesis by targeting RUNX3 via TGF-β signaling pathway[J]. J Biol Regul Homeost Agents,2020,34(2):12-20. doi:10.23812/20-12A.
(2022-09-22收稿 2023-03-03修回)
(本文編辑 李鹏)
