急性时相反应蛋白SAA和CRP对川崎病静脉注射免疫球蛋白无应答的预测价值
2023-11-06黄晓碧赵胜郑丽云祁晓慧
黄晓碧 赵胜 郑丽云 祁晓慧

摘要:目的 探討急性时相反应蛋白血清淀粉样蛋白A(SAA)和C反应蛋白(CRP)对川崎病(KD)患儿静脉注射免疫球蛋白(IVIG)无应答的预测价值。方法 根据IVIG无应答的定义将358例KD患儿分为IVIG无应答组(41例)和IVIG应答组(317例)。检测血清中SAA、CRP水平并计算SAA/CRP的值,比较2组患儿IVIG治疗前后的临床和实验室检测指标。二分类Logistic回归分析IVIG无应答的影响因素,通过受试者工作特征(ROC)曲线探讨SAA、CRP对预测IVIG无应答的临床价值。结果 IVIG无应答组CRP、SAA、总胆红素、丙氨酸转氨酶和天冬氨酸转氨酶水平高于IVIG应答组(P<0.05),淋巴细胞计数、血小板计数、血清钠和使用IVIG前发热时间低于IVIG应答组(P<0.05)。二分类Logistic回归分析显示,CRP(OR=1.008,95%CI:1.001~1.015)、SAA(OR=1.002,95%CI:1.001~1.003)、总胆红素(OR=1.030,95%CI:1.009~1.051)、血清钠(OR=0.862,95%CI:0.762~0.975)、淋巴细胞计数(OR=0.733,95%CI:0.567~0.947)和IVIG前发热时间(OR=0.688,95%CI:0.513~0.922)是IVIG无应答的独立影响因素(P<0.05)。治疗后,IVIG无应答组冠状动脉病变发生率高于IVIG应答组(P<0.05)。ROC曲线分析显示,SAA和CRP预测IVIG无应答的最佳截断值分别为252.45 mg/L和82.80 mg/L,约登指数分别为0.325和0.382,两者联合预测的约登指数为0.423。SAA、CRP及两者联合预测IVIG无应答的ROC曲线下面积分别为0.681、0.703和0.761,联合预测效能良好。结论 急性时相反应蛋白SAA和CRP升高是KD患儿IVIG无应答的危险因素,联合检测可辅助预测IVIG的无应答。
关键词:黏膜皮肤淋巴结综合征;免疫球蛋白类;血清淀粉样蛋白A;C反应蛋白质;ROC曲线;危险因素
中图分类号:R725.41文献标志码:ADOI:10.11958/20221011
Predictive value of acute phase proteins SAA and CRP in non-response to intravenous immunoglobulin in Kawasaki disease
HUANG Xiaobi, ZHAO Sheng, ZHENG Liyun, QI Xiaohui
Department of Pediatric Cardiology, Anhui Provincial Childrens Hospital, Hefei 230051, China
Abstract: Objective To evaluate the predictive value of acute phase proteins serum amyloid A protein (SAA) and C-reactive protein (CRP) for non-response to intravenous immunoglobulin (IVIG) in children with Kawasaki disease (KD). Methods According to the IVIG resistant definition, a total of 358 KD patients were assigned into the IVIG resistant group (n=41) and the IVIG responsive group (n=317). Serum levels of SAA and CRP were tested, and SAA/CRP ratio was calculated. Clinical and laboratory data before and after treatment were compared between the two groups. Binary Logistic regression analysis was used to identify influencing factors for resistance to IVIG. The diagnostic value of SAA and CRP in predicting IVIG resistance in KD was investigated by the receiver operating characteristic (ROC) curve. Results The levels of CRP, SAA, total bilirubin, alanine aminotransferase and asparate aminotransferase were significantly higher in the IVIG resistant group than those of the IVIG responsive group (P<0.05), whereas levels of lymphocyte count, platelet count, serum sodium and duration of fever before IVIG were significantly lower in the IVIG resistant group (P<0.05). The binary Logistic regression analysis showed that CRP (OR=1.008, 95%CI: 1.001-1.015), SAA (OR=1.002, 95%CI: 1.001-1.003), total bilirubin (OR=1.030, 95%CI: 1.009-1.051), serum sodium (OR=0.862, 95%CI: 0.762-0.975), lymphocyte count (OR=0.733, 95%CI: 0.567-0.947) and duration of fever before IVIG (OR=0.688, 95%CI: 0.513-0.922) were the independent influencing factors for IVIG resistance (P<0.05). The incidence of coronary artery lesion was significantly higher after therapy in the IVIG resistant group than that in the IVIG responsive group (P<0.05). ROC curve showed that the Youden index of SAA (cut-off value 252.45 mg/L), CRP (cut-off value 82.80 mg/L) and combined SAA and CRP were 0.325, 0.382 and 0.423. The area under the ROC curve of SAA, CRP and two items were 0.681, 0.703 and 0.761, respectively. The predictive efficiency of combined application was larger. Conclusion The increased SAA and CRP levels are independent risk factors of IVIG resistance, which can be utilized as combined biomarkers for the prediction of IVIG resistance in KD patients.
Key words: mucocutaneous lymph node syndrome; immunoglobulins; serum amyloid a protein; C-reactive protein; ROC curve; risk factors
川崎病(Kawasaki disease,KD)是一种以全身非特异性中小血管炎为主要病理特征的急性发热疾病,一些KD患儿可发生冠状动脉病变,导致心肌梗死、缺血性心脏病等。静脉注射免疫球蛋白(intravenous immunoglobulin,IVIG)联合口服阿司匹林是KD的标准治疗方案,但仍有10%~20%的KD患儿对IVIG无应答[1]。目前IVIG无应答的机制尚不清楚。IVIG无应答患儿发生冠状动脉病变的概率更高[2]。因此,早期准确预测IVIG无应答和个体化治疗对改善KD患儿预后至关重要。血清淀粉样蛋白A(serum amyloid a protein,SAA)和C反应蛋白(C-reactive protein,CRP)是肝细胞合成的正向急性时相反应蛋白,在感染性疾病、心血管疾病、自身免疫性疾病中被广泛使用,可作为多种疾病诊断治疗监测的生物标志物[3]。SAA和CRP在KD的急性期会升高[4]。目前SAA联合CRP与KD患儿IVIG无应答关系的研究少见报道。本研究探讨急性时相反应蛋白SAA和CRP对KD患儿IVIG无应答的预测价值,以期为临床预测IVIG无应答提供参考。
1 对象与方法
1.1 研究对象 选取2019年1月—2022年5月于安徽省儿童医院心血管科就诊的KD患儿441例。纳入标准:(1)符合《川崎病诊断和急性期治疗专家共识》[4]诊断标准,包括完全性和不完全性KD。(2)发病10 d内(以发热第1天作为发病开始)给予IVIG 2 g/kg和阿司匹林30~50 mg/(kg·d)的标准治疗方案。(3)临床资料完整。排除标准:(1)因感染性疾病、自身免疫性疾病和肝脏疾病等影响SAA、CRP检测结果者。(2)接受糖皮质激素等初始治疗者。最终共纳入358例KD患儿,其中男227例,女131例,年龄1~132个月,中位年龄23.0(12.0,36.0)个月。根据IVIG无应答定义分为IVIG无应答组41例和IVIG应答组317例。本研究通过医院伦理委员会批准(批准号:EYLL-2021-002),符合伦理学标准并获监护人知情同意。
1.2 研究方法
1.2.1 IVIG无应答的判定标准 在完成标准治疗36 h后体温仍持续或反复>38 ℃;或用药后2周内再次发热,并出现至少1项KD主要临床表现者,排除其他疾病导致发热[4]。
1.2.2 基线资料收集 通过病案管理系统,查阅电子病历,收集患儿在标准治疗前的一般情况,包括年龄、体质量、性别、IVIG前发热时间、是否为不完全性KD。
1.2.3 实验室指标检测 检测白细胞计数(WBC)、淋巴细胞计数(LYM)、血红蛋白(Hb)、血小板计数(PLT)、红细胞沉降率(ESR)、总胆红素(TBIL)、血清白蛋白(ALB)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、血清钠、SAA、CRP,并计算SAA/CRP的值。所有指标由我院检验科统一按照仪器操作手册和试剂盒说明书执行检测。其中SAA和CRP检测采用乙二胺四乙酸二钾抗凝全血,用Astep PLUS及SAA定量检测试剂盒(深圳国赛生物技术有限公司,批号:0651200714)和CRP定量检测试剂盒(深圳国赛生物技术有限公司,批号:0652200714)对患儿血清中SAA和CRP进行检测。SAA以>10 mg/L为异常,CRP以>8 mg/L为异常。所有标本检测均在患儿入院24 h内完成,如果标准治疗前有多次检查结果,选择IVIG输注前最近1次结果。
1.2.4 冠状动脉内径检测 采用彩色多普勒超声诊断仪(Philips公司)iE33测量患儿在IVIG使用前和使用后3 d冠状动脉内径。冠状动脉病变参考文献[5]:根据所有冠状动脉中最大z值分为冠脉动脉扩张(2.0≤z值<2.5)、小型冠状动脉瘤(2.5≤z值<5)、中型冠状动脉瘤(5.0≤z值<10)和大型冠状动脉瘤(z值≥10)。
1.3 统计学方法 应用SPSS 23.0软件进行数据分析。符合正态分布且方差齐的计量资料采用x±s表示,2组间比较采用独立样本t检验,不符合正态分布的计量资料用M(P25,P75)表示,2组间比较采用非参数Mann-Whitney U检验;计数资料采用例或例(%)表示,组间比较采用χ2检验或者Fisher确切概率法。二分类Logistic回归分析IVIG无应答的影响因素。绘制受试者工作特征(ROC)曲线,判断SAA、CRP对KD患儿发生IVIG无应答的预测价值。以P<0.05为差异有统计学意义。
2 结果
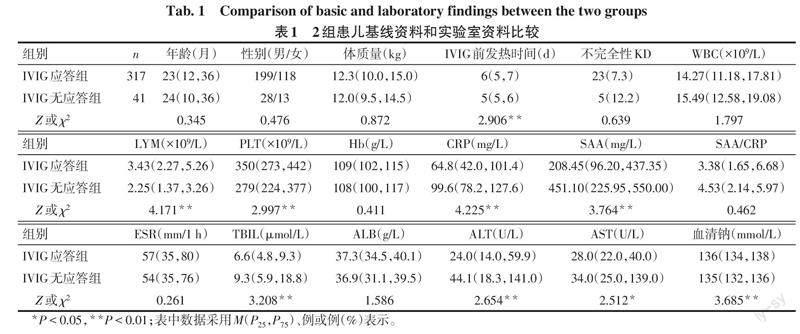
2.1 2组患儿基线资料和实验室资料比较 2组患儿月龄、性别、体质量、不完全性KD、WBC、Hb、SAA/CRP、ESR、ALB值差异均无统计学意义(P>0.05);IVIG无应答组CRP、SAA、TBIL、ALT、AST水平高于IVIG应答组,IVIG前发热时间、LYM、PLT、血清钠水平低于IVIG应答组(P<0.05)。见表1。
2.2 KD患儿发生IVIG无应答的影响因素分析 以是否发生IVIG无应答为因变量(是=1,否=0),将表1中差异有统计学意义的指标作为自变量纳入二分类Logistic回归分析模型。结果显示,CRP、SAA、TBIL水平升高,血清钠、LYM水平降低和IVIG前发热时间短是IVIG无应答的危险因素(P<0.05),见表2。
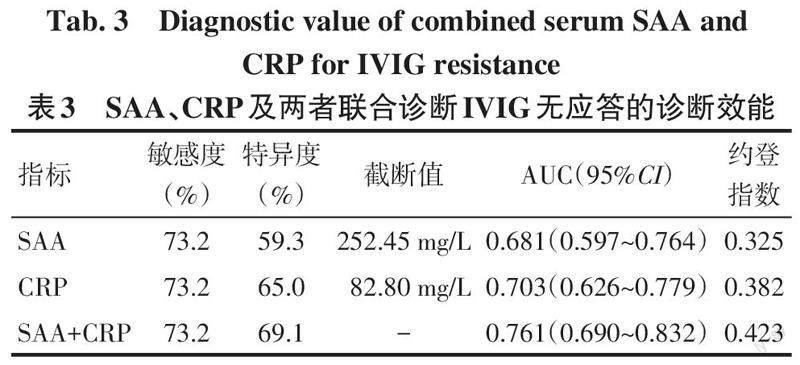
2.3 SAA和CRP对IVIG无应答的预测效能评价 以是否发生IVIG无应答为结局指标,采用ROC曲线分析,SAA、CRP和两者聯合(串联)预测IVIG无应答的敏感度、特异度、最佳截断值、AUC及其95%CI和约登指数见表3、图1。结果显示,两者联合应用对IVIG无应答的诊断效能较优。
2.4 2组患儿治疗前后冠状动脉病变比较 IVIG治疗前,IVIG无应答组和IVIG应答组分别有3例(7.3%)和14例(4.4%)发生冠状动脉病变,差异无统计学意义(χ2=0.186,P>0.05)。IVIG治疗后,IVIG无应答组和IVIG应答组分别有7例(17.1%)和16例(5.0%)发生冠状动脉病变,无应答组发生率更高(χ2=6.848,P<0.01)。其中IVIG无应答组1例9岁患儿并发大型冠状动脉瘤并导致急性心肌梗死,IVIG应答组无患儿并发大型冠状动脉瘤。
3 讨论
3.1 IVIG治疗的局限性 IVIG可抑制KD患儿的炎症反应,显著降低冠状动脉病变的发生率。部分KD患儿对IVIG治疗无应答,本研究中IVIG无应答发生率为11.45%(41/358),与国内学者[6]报道类近。针对不同种族[7]和不同年龄段[8]的多种IVIG无应答预测模型已经建立,仍然没有适用于所有KD患儿的预测评分系统。对IVIG无应答常导致严重的冠状动脉病变,故仍需要探索快速而便捷的生物标志物来预测IVIG无应答。SAA和CRP联合检测有望成为预测IVIG无应答的指标。
3.2 SAA和CRP的生物学意义及研究现状 SAA是一种由多基因编码的蛋白质,其水平不受抗炎药物、免疫抑制剂、糖皮质激素等因素的影响,在炎症反应急性期4~6 h内升高,10 d后水平逐渐下降[9]。KD急性期病理生理改变表现为各种炎性因子和化学因子的释放,这些因素导致发热和产生大量急性时相蛋白。白细胞介素-6及肿瘤坏死因子-α可以协同促进SAA和CRP水平在KD急性期明显升高。本研究中,SAA和CRP水平在KD急性期明显升高,与既往研究类似[4]。已有研究表明SAA和CRP的水平与KD患儿的持续冠状动脉病变有关[10]。SAA1基因rs4638289位点多态性与KD并发冠状动脉病变有关[11]。本研究显示IVIG无应答组血清SAA和CRP水平高于IVIG应答组。SAA和CRP的达峰时间不一致,且CRP的半衰期较长,推测可能是2组间SAA/CRP值差异无统计学意义的原因之一。进一步Logistic回归分析结果显示CRP和SAA水平越高,KD患儿出现IVIG无应答的可能性越大。CRP和SAA水平升高提示炎症反应明显,IVIG不能完全抑制KD患儿的炎症反应。同为肝脏合成的CRP已被广泛用于IVIG无应答的预测指标。SAA在之前的研究中没有被用于IVIG无应答的预测。本研究中,SAA和CRP单独预测IVIG无应答的约登指数均大于0.3,提示均有一定的预测效能。SAA和CRP预测IVIG无应答的最佳截断值分别是252.45 mg/L和82.80 mg/L,联合预测的ROC曲线下面积为0.761,高于SAA和CRP单独检测。本研究中CRP的截断值低于Kobayashi等[7]研究,该研究认为CRP≥100.0 mg/L为IVIG无应答的危险因素,分析原因与研究方法及样本量大小等因素有关。因此,联合两种急性时相反应蛋白更能准确预测IVIG无应答的发生,便于临床应用。
3.3 IVIG无应答的其他影响因素 本研究结果显示IVIG前发热时间短,血清钠、LYM降低和TBIL升高是发生IVIG无应答的危险因素。有研究证实在发热早期使用IVIG会增加无应答的发生[12]。TBIL升高是IVIG无应答的危险因素,与国内学者[13]报道一致,但其机制尚不清楚。有研究表明血清钠水平是KD患儿IVIG无应答的预测指标[8];其机制可能为促进抗利尿激素分泌增多,使机体血容量增加导致血清钠降低[14]。有研究证实LYM<3×109/L是IVIG无应答的预测指标[15],故可结合这些因素綜合评估IVIG无应答的可能性。
3.4 冠状动脉病变 本研究中,在治疗后IVIG无应答组冠状动脉病变发生率高于IVIG应答组,与Lio等[16]结论一致。IVIG无应答组中1例患儿因并发巨大冠状动脉瘤,虽给予挽救治疗,但仍导致心肌梗死,最终行冠状动脉旁路移植术。
综上所述,急性时相反应蛋白SAA和CRP可能对评估KD患儿IVIG应答情况有重要意义,治疗前SAA和CRP的水平越高,IVIG无应答的可能性越大,两者联合可提高IVIG无应答预测的准确性。然而,IVIG治疗KD作用机制尚未阐明,需进一步研究和验证,以便更好地对IVIG无应答患儿进行早期预测及改善预后。
参考文献
[1] MCCRINDLE B W,ROWLEY A H,NEWBURGER J W,et al. Diagnosis,treatment,and long-term management of Kawasaki disease:A scientific statement for health professionals from the American Heart Association[J]. Circulation,2017,135(17):e927-e999. doi:10.1161/CIR.0000000000000484.
[2] FUKAZAWA R,KOBAYASHI J,AYUSAWA M,et al. JCS/JSCS 2020 Guideline on Diagnosis and Management of Cardiovascular Sequelae in Kawasaki Disease[J]. Circ J,2020,84(8):1348-1407. doi:10.1253/circj.CJ-19-1094.
[3] SORIC HOSMAN I,KOS I,LAMOT L. Serum amyloid A in inflammatory rheumatic diseases:a compendious review of a renowned biomarker[J]. Front Immunol,2020,11:631299. doi:10.3389/fimmu.2020.631299.
[4] 中华医学会儿科学分会心血管学组,中华医学会儿科学分会风湿学组,中华医学会儿科学分会免疫学组,等. 川崎病诊断和急性期治疗专家共识[J]. 中华儿科杂志,2022,60(1):6-13. The Subspecialty Group of Cardiology,the Society of Pediatrics,Chinese Medical Association,the Subspecialty Group of Rheumatology,the Society of Pediatrics, Chinese Medical Association,the Subspecialty Group of Immunology,the Society of Pediatrics,Chinese Medical Association,et al. The expert consensus on diagnosis and acute?phase treatment of Kawasaki disease[J]. Chin J Pediatr,2022,60(1):6-13. doi:10.3760/cma.j.cn112140-20211018-00879.
[5] 中华医学会儿科学分会心血管学组,中华儿科杂志编辑委员会. 川崎病冠状动脉病变的临床处理建议(2020年修订版)[J]. 中华儿科杂志,2020,58(9):718-724. The Subspecialty Group of Cardiology,the Society of Pediatrics,Chinese Medical Association, the Editorial Board of Chinese Journal of Pediatrics. Recommendations for clinical management of Kawasaki disease with coronary artery lesions(2020 revision)[J]. Chin J Pediatr,2020,58(9):718-724.doi:10.3760/cma.j.cn112140-20200422-00421.
[6] XIE L P,YAN W L,HUANG M,et al. Epidemiologic features of Kawasaki disease in Shanghai from 2013 through 2017[J]. J Epidemiol,2020,30(10):429-435. doi:10.2188/jea.JE20190065.
[7] KOBAYASHI T,INOUE Y,TAKEUCHI K,et al. Prediction of intravenous immunoglobulin unresponsiveness in patients with Kawasaki disease[J]. Circulation,2006,113(22):2606-2612. doi:10.1161/CIRCULATIONAHA.105.592865.
[8] WU S,LONG Y,CHEN S,et al. A new scoring system for prediction of intravenous immunoglobulin resistance of Kawasaki disease in infants under 1-year old[J]. Front Pediatr,2019,7:514. doi:10.3389/fped.2019.00514.
[9] 刘锦燕,赵珺涛,项明洁. 血清淀粉样蛋白A在疾病中的作用机制及应用研究进展[J]. 检验医学,2021,36(7):756-760. LIU J Y,ZHAO J T,XIANG M J. Mechanism and application of serum amyloid A in clinical diseases[J]. Laboratory Medicine,2021,36(7):756-760. doi:10.3969/j.issn.1673-8640.2021.07.017.
[10] MITANI Y,SAWADA H,HAYAKAWA H,et al. Elevated levels of high-sensitivity C-reactive protein and serum amyloid-A late after Kawasaki disease: association between inflammation and late coronary sequelae in Kawasaki disease[J]. Circulation,2005,111(1):38-43. doi:10.1161/01.CIR.0000151311.38708.29.
[11] 陈颖,王成,纪青,等. SAA1基因rs4638289及rs7131332位点多态性与川崎病的相关性研究[J]. 中国当代儿科杂志,2020,22(6):614-619. CHEN Y,WANG C,JI Q,et al. Association of rs4638289 and rs7131332 polymorphisms of the serum amyloid A1gene with Kawasaki disease[J]. Chin J Contemp Pediatr,2020,22(6):614-619. doi:10.7499/j.issn.1008-8830.1912093.
[12] YAN F,ZHANG H,XIONG R,et al. Effect of early intravenous immunoglobulin therapy in Kawasaki disease:a systematic review and meta-analysis[J]. Front Pediatr,2020,8:593435. doi:10.3389/fped.2020.593435.
[13] LI C,WU S,SHI Y,et al. Establishment and validation of a multivariate predictive scoring model for intravenous immunoglobulin-resistant Kawasaki disease:a study of children from two centers in China[J]. Front Cardiovasc Med,2022,9:883067. doi:10.3389/fcvm.2022.883067.
[14] MIURA K,HARITA Y,TAKAHASHI N,et al. Nonosmotic secretion of arginine vasopressin and salt loss in hyponatremia in Kawasaki disease[J]. Pediatr Int,2020,62(3):363-370. doi:10.1111/ped.14036.
[15] WU S,LIAO Y,SUN Y,et al. Prediction of intravenous immunoglobulin resistance in Kawasaki disease in children[J]. World J Pediatr,2020,16(6):607-613. doi:10.1007/s12519-020-00348-2.
[16] LIO K,MORIKAWA Y,MIYATA K,et al. Risk factors of coronary artery aneurysms in Kawasaki disease with a low risk of intravenous immunoglobulin resistance:an analysis of post RAISE[J]. J Pediatr,2022,240:158-163.e4. doi:10.1016/j.jpeds.2021.08.065.
(2022-07-21收稿 2022-11-11修回)
(本文編辑 李鹏)
