基于PI3K/Akt/mTOR信号通路探讨黄芪多糖对结直肠癌自噬的影响
2023-11-06郅强张楠冯光玲孙维义赵媛媛杨世发
郅强 张楠 冯光玲 孙维义 赵媛媛 杨世发
摘要:目的 探討黄芪多糖(APS)对结直肠癌自噬的影响及其机制。方法 采用CCK-8法检测APS各剂量(0.25 g/L、0.5 g/L、0.75 g/L、1 g/L)组对人结直肠癌HCT-116细胞增殖的影响,通过细胞划痕实验检测APS对HCT-116细胞迁移的影响,通过单丹磺酰尸胺染色检测APS对结直肠癌细胞自噬的影响,采用Western blot法检测APS对HCT-116细胞和结直肠癌荷瘤裸鼠肿瘤中自噬及PI3K/Akt/mTOR信号通路相关蛋白LC3B、p62、p-PI3K、p-Akt、p-mTOR、PI3K、Akt及mTOR表达的影响;通过免疫组化染色检测APS对结直肠癌肿瘤中自噬相关蛋白p62表达的影响。结果 APS可抑制HCT-116细胞增殖,且呈剂量依赖性(P<0.05);APS可通过诱导细胞自噬抑制HCT-116细胞增殖和迁移,而自噬抑制剂3-MA(2 mmol/L)不仅可减弱APS对HCT-116细胞自噬的诱导作用,也可减弱APS对HCT-116细胞增殖和迁移的抑制作用(P<0.05);APS可上调HCT-116细胞及结直肠癌小鼠肿瘤中自噬相关蛋白LC3BⅡ/Ⅰ的表达,下调p62蛋白的表达(P<0.05);3-MA则可减弱APS对HCT-116细胞LC3BⅡ/Ⅰ蛋白表达的上调作用,降低APS对p62蛋白表达的抑制作用(P<0.05);APS可抑制HCT-116细胞及结直肠癌小鼠肿瘤中PI3K/Akt/mTOR信号通路相关蛋白p-PI3K/PI3K、p-Akt/Akt及p-mTOR/mTOR的表达(P<0.05);而通路激动剂740Y-P(10 ?mol/L)可减弱APS对HCT-116细胞PI3K/Akt/mTOR信号通路相关蛋白表达的抑制作用(P<0.05)。结论 APS可诱导结直肠癌肿瘤和细胞自噬,并通过诱导自噬抑制细胞的增殖及迁移,其机制可能与抑制PI3K/Akt/mTOR信号通路有关。
关键词:黄芪多糖;结直肠癌;自噬;PI3K/Akt/mTOR信号通路
中图分类号:R285.5文献标志码:ADOI:10.11958/20220463
Study on the mechanism of astragalus polysaccharides regulating autophagy of colorectal cancer cells based on PI3K/Akt/mTOR signaling pathway
ZHI Qiang ZHANG Nan FENG Guangling SUN Weiyi ZHAO Yuanyuan YANG Shifa
1 Henan University of Traditional Chinese Medicine, Zhengzhou 450000, China; 2 Department of General Minimally Invasive Surgery, the First Affiliated Hospital of Henan University of Traditional Chinese Medicine
△Corresponding Author E-mail: znhnzyydx@163.com
Abstract: Objective To investigate the effect and mechanism of astragalus polysaccharides (APS) on autophagy in colorectal cancer. Methods The effects of various concentrations of APS (0.25 g/L, 0.5 g/L, 0.75 g/L and 1 g/L) on the proliferation of human colorectal cancer HCT-116 cells were detected by CCK-8 test. The effect of APS on the migration of HCT-116 cells was detected by cell scratch assay. The effect of APS on autophagy of colorectal cancer cells was detected by dansylcadaverine staining technique. Effects of APS on autophagy and PI3K/Akt/mTOR signaling pathway related proteins LC3B, p62, p-PI3K, p-Akt, p-mTOR, PI3K, Akt and mTOR in HCT-116 cells and colorectal cancer tumor-bearing nude mice were detected by Western blot assay. The expression of autophagy-related protein p62 in colorectal cancer tumors was detected by immunohistochemistry. Results APS inhibited HCT-116 cell proliferation in a dose-dependent manner (P<0.05). APS could inhibit the proliferation and migration of HCT-116 cells by inducing autophagy (P<0.05). The autophagy inhibitor 3-MA (2 mmol/L) not only attenuated the autophagy induction effect of APS on HCT-116 cells, but also attenuated the inhibitory effect of APS on the proliferation and migration of HCT-116 cells (P<0.05). APS could increase the expression ratio of autophagy-related protein LC3BⅡ/Ⅰ and reduce the expression level of p62 protein in HCT-116 cells and colorectal cancer mice (P<0.05). 3-MA could attenuate the increasing effect of APS on the expression ratio of LC3BⅡ/Ⅰ protein and reduce the inhibitory effect of APS on the expression of p62 protein in HCT-116 cells (P<0.05). APS could reduce the expression ratio of PI3K/Akt/mTOR signaling pathway related proteins p-PI3K/PI3K, p-Akt/Akt and p-mTOR/mTOR in HCT-116 cells and colorectal cancer tumor (P<0.05). The pathway agonist 740Y-P (10 μmol/L) could attenuate the inhibitory effect of APS on expression levels of PI3K/Akt/mTOR signaling pathway-related proteins in HCT-116 cells (P<0.05). Conclusion APS can induce autophagy activation in colorectal cancer tumor tissue and cells, and inhibit cell proliferation and migration of HCT-116 cells by inducing autophagy. The mechanism of action may be related to the inhibition of PI3K/Akt/mTOR signaling pathway.
Key words: astragalus polysaccharides; colorectal cancer; autophagy; PI3K/Akt/mTOR signaling pathway
結直肠癌(colorectal cancer,CRC)是最常见的胃肠道恶性肿瘤,尽管早期诊断方法和现代医学手段不断发展,其发病率及病死率呈逐年升高趋势[1],因此寻找结直肠癌新疗法意义重大。黄芪多糖(astragalus polysaccharides,APS)是黄芪的重要活性成分,具有广谱抗肿瘤效果,近些年用于抗癌尤其是结直肠癌的研究日益受到重视[2-4]。自噬是细胞维持体内平衡的重要机制,在结直肠癌发生发展过程中可以发挥双向作用,用于结直肠癌治疗研究颇有前景[5]。有研究发现,在结直肠癌细胞自噬的调节中,磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路发挥着重要的负向调控作用[6]。PI3K/Akt/mTOR信号传导亦作为肿瘤进展中的关键转导途径,调节癌细胞增殖[7]。本课题组前期研究表明,APS对结直肠癌荷瘤小鼠的肿瘤生长具有显著的抑制作用[8],但其作用机制尚不明确。本研究通过探索APS对人结直肠癌HCT-116细胞和结直肠癌荷瘤小鼠肿瘤自噬的影响,研究APS对PI3K/Akt/mTOR信号通路的调节作用,进一步探讨APS抗结直肠癌的作用机制。
1 材料与方法
1.1 实验材料及仪器
1.1.1 细胞株及结直肠癌肿瘤组织 人结直肠癌HCT-116细胞系购自北纳生物科技有限公司,货号BNCC342188。结直肠癌荷瘤小鼠肿瘤组织系课题组前期实验留存的肿瘤组织蜡块和冰冻肿瘤组织标本[8]。实验动物生产许可证号:SCXK(豫)2019-0002。
1.1.2 药物及试剂 黄芪多糖标准品(SA9790)、RPMI 1640培养基(31800)、免疫组化试剂盒(SP0041)、细胞自噬染色检测试剂盒(G0170)、CCK-8试剂(CA1210)均购自北京索莱宝科技有限公司;自噬抑制剂3-MA(GC10710)、PI3K激动剂740Y-P(GC16157)均购自美国Glpbio公司,胎牛血清(11011-8611)购自浙江天杭生物科技有限公司,p-PI3K兔多抗(4228T)、mTOR兔单抗(2983T)均购自美国CST公司,LC3B兔多抗(GTX127375)购自美国GeneTex公司,PI3K鼠单抗(67644-1-Ig)、Akt鼠单抗(60203-2-Ig)、p-Akt鼠单抗(66444-1-Ig)、p-mTOR兔重组抗体(80596-1-RR)、p62兔多抗(18420-1-AP)、GAPDH鼠单抗(60004-1-Ig)、辣根过氧化物酶(HRP)标记的山羊抗鼠IgG(H+L,SA00001-1)及HRP标记的山羊抗兔IgG(H+L,SA00001-2)均购自武汉三鹰生物技术有限公司。
1.1.3 实验仪器 超净工作台(SW-CS-IFD,苏州净化设备公司),细胞培养箱(ROC-3000TVBB,美国REVCO公司),倒置相差显微镜(CK40,日本Olympus公司),倒置荧光显微镜(DM3000型,德国Leica公司),酶标仪(MK3型,美国Thermo Fisher公司),凝胶成像分析系统(Bio-Rad ChemiDoc XRS+型,美国Bio-Rad公司)。
1.2 实验方法
1.2.1 细胞培养 在37 ℃恒温水浴锅中复苏HCT-116细胞,置于25 cm2细胞培养瓶中,加入1640完全培养基(含10%胎牛血清、100 U/mL青霉素和100 mg/L链霉素),移入37 ℃、5%CO2细胞培养箱中培养。待细胞汇合度达80%~90%时进行1∶3传代或冻存。取培养3代后的细胞进行后续实验。
1.2.2 CCK-8法检测APS对HCT-116细胞增殖的影响 取对数生长期HCT-116细胞,以2×104个/孔接种于96孔培养板中,设置5组:control组(1640完全培养基)及0.25、0.5、0.75、1 g/L APS组,另设仅添加基础培养基的空白孔,每组设置3个复孔。培养板外围各孔加入PBS防止培养板液蒸发,放入37 ℃、5%CO2细胞培养箱中培养至贴壁后,加入上述浓度APS分别干预12、24、48 h。加入CCK-8工作液,避光孵育1 h,使用酶标仪于450 nm波长处检测光密度(OD)值。计算细胞增殖活性=(APS组OD值?空白孔OD值)/(control组OD值?空白孔OD值)×100%。为探究APS对HCT-116细胞增殖的影响是否与调控自噬有关,按照上述方法设置control组(1640完全培养基干预)、APS组(1 g/L)、3-MA组(2 mmol/L)、APS+3-MA组(1 g/L APS+2 mmol/L 3-MA)共4组,另设仅添加培养基的空白孔,每组设置3个复孔。干预24 h后,检测各组OD值。
1.2.3 细胞划痕实验检测APS对HCT-116细胞迁移的影响 取培养3代后并处于对数生长期的HCT-116细胞,以2×105个/孔接种于6孔培养板,置于37 ℃、5%CO2的细胞培养箱中培养。设置4组,包括control组(1640完全培养基)、APS组(1 g/L)、3-MA组(2 mmol/L)以及APS+3-MA组(1 g/L APS+2 mmol/L 3-MA)。当细胞汇合度达90%时,使用200 μL枪头垂直划痕,PBS清洗,置于倒置显微镜下观察拍照。然后各组加入相应药物试剂继续培养24 h。干预结束后,使用PBS清洗,置于40倍显微镜下拍照,测距并计算迁移率=(干预前划痕宽度?干预后划痕宽度)/(干预前划痕宽度)×100%。
1.2.4 单丹磺酰尸胺(Dansylcadaverine,MDC)染色检测APS对HCT-116细胞自噬的影响 取培养3代后处于对数生长期的细胞,设置control组(1640完全培养基)、APS組(1 g/L)及APS+3-MA组(1 g/L APS+2 mmol/L 3-MA)。以2×105个/孔接种于6孔培养板,置于37 ℃、5%CO2的细胞培养箱中培养,待细胞贴壁后加药干预24 h。弃去6孔板中液体,加入300 μL 1× wash buffer洗2次,而后每孔加入600 μL MDC工作液,室温避光染色25 min,弃掉染色液,以300 μL 1× wash buffer洗3次。置于荧光显微镜下观察细胞自噬体生成情况,设置激发滤光片波长355 nm,阻断滤光片波长512 nm。选取3个视野拍照,使用Image J软件检测平均荧光强度。
1.2.5 结直肠癌荷瘤小鼠肿瘤组织的分组及干预 雄性SPF级BALB/C裸鼠肿瘤组织设3组:control组(腹腔注射生理盐水,20 mL/kg),APS低剂量组(APS L组,腹腔注射APS,50 mg/kg),APS高剂量组(APS H组,腹腔注射APS,250 mg/kg);每日1次,连续21 d。
1.2.6 Western blot检测LC3B和p62蛋白表达 取培养3代后并处于对数生长期的HCT-116细胞,以2×105个/孔接种于6孔培养板,置于37 ℃、5%CO2的细胞培养箱中培养。设置control组(1640完全培养基)、APS组(1 g/L)、3-MA组(2 mmol/L)、APS+3-MA组(1 g/L APS+2 mmol/L 3-MA)。培养至细胞贴壁后,各组加入相应药物干预24 h,裂解HCT-116细胞。将冻存的结直肠癌小鼠肿瘤组织解冻、剪碎,加入裂解液,使用磁珠及振荡器研磨组织,离心后提取上清液。使用BCA试剂盒测定肿瘤细胞及肿瘤组织蛋白浓度。进行10% SDS-PAGE凝胶电泳,80 V 30 min行浓缩胶电泳,120 V 1 h行分离胶电泳。电泳结束将目的蛋白转移到PVDF膜上,使用5%脱脂奶粉封闭1 h。一抗LC3B(1∶1 000)、p62(1∶1 000)、GAPDH(1∶50 000)于4 ℃条件下孵育过夜。TBST洗涤3次,使用HRP标记的山羊抗鼠、山羊抗兔IgG二抗(1∶2 000)于摇床室温孵育1 h。TBST洗涤后使用ECL超敏发光液对PVDF膜增强发光,显影仪器对目的条带进行扫描显影,使用Image J检测条带灰度值。
1.2.7 Western blot检测p-PI3K、p-Akt、p-mTOR、PI3K、Akt及mTOR蛋白表达 方法同1.2.6。实验设置control组(1640完全培养基)、APS组(1 g/L)、740Y-P组(10 μmol/L)、APS+740Y-P组(1 g/L APS+10 μmol/L 740Y-P)。抗体为p-PI3K(1∶1 000)、p-Akt(1∶2 000)、p-mTOR(1∶5 000)、PI3K(1∶1 000)、Akt(1∶5 000)、mTOR(1∶1 000)和GAPDH(1∶50 000)。
1.2.8 免疫组化染色检测肿瘤组织p62蛋白表达情况 检查并挑选保存良好的肿瘤组织石蜡包埋块,制作4 μm厚度的肿瘤组织石蜡切片。使用二甲苯、无水乙醇、梯度乙醇和PBS对切片常规脱蜡至水。使用柠檬酸钠抗原修复液对切片进行抗原热修复,PBS洗3次。将切片上附着的目的组织用免疫组化笔圈住,于湿盒中滴加3% H2O2反应5~10 min以阻断内源性过氧化物酶,PBS漂洗。滴加山羊血清封闭液覆盖组织,于室温下反应30 min。滴加p62抗体(1∶100)于4 ℃条件下孵育过夜。PBS清洗后,滴加Bio-抗小鼠/兔IgG二抗工作液(1∶100),室温孵育30 min,PBS清洗3遍。滴加链霉亲和素-POD工作液,室温反应30 min,反应结束后PBS清洗3次。使用DBA工作液于室温下避光使切片显色,待3 min后在显微镜下观察目的组织呈现黄褐色后,使用超纯水终止反应,将切片浸入苏木素工作液中复染2 min。滴加分化液反应10 s,放入自来水中10 min。使用梯度乙醇、无水乙醇和二甲苯对切片透明脱水,滴加中性树脂封片。显微镜下观察切片p62蛋白表达情况,拍照,使用Image J软件检测积分光密度(IOD)值。
1.3 统计学方法 采用SPSS 20.0和GraphPad Prism 8.0.2软件进行数据分析和绘图。符合正态分布的计量资料以[[x] ±s
]表示,多组间比较采用单因素方差分析或重复测量设计的方差分析,组间多重比较行Tukey检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用Wilcoxon符号秩和检验。P<0.05为差异有统计学意义。
2 结果
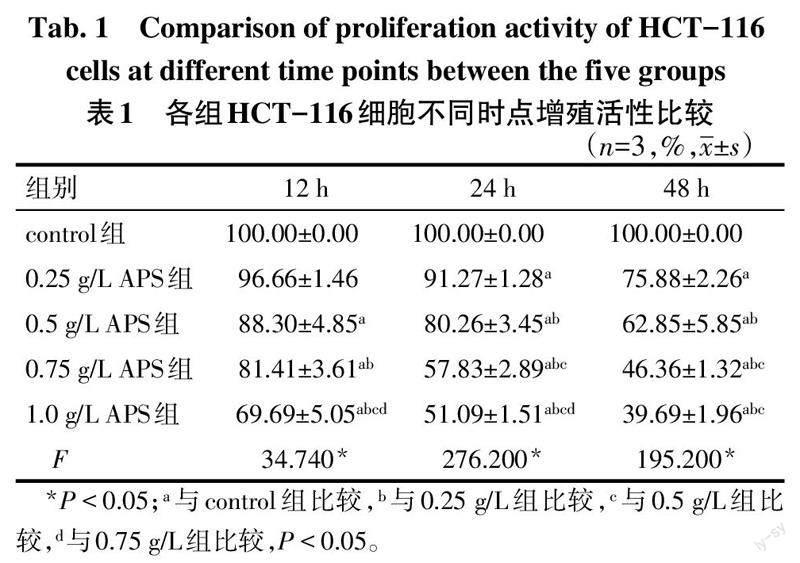
2.1 各组HCT-116细胞增殖活性变化 组间比较:除0.25 g/L APS组12 h时细胞增殖活性与control组差异无统计学意义(P>0.05)外,APS各剂量组细胞增殖活性均降低;随APS剂量增高,细胞增殖活性基本呈降低趋势(P<0.05)。见表1。
2.2 各组HCT-116细胞自噬水平变化 APS组细胞内绿色点状荧光强度(0.85±0.10)较control组(0.48±0.09)和APS+3-MA组(0.51±0.10)明显增强(n=3,F=14.320,P<0.05),APS+3-MA组与control组差异无统计学意义(P>0.05)。见图1。
2.3 各组HCT-116细胞增殖和迁移能力变化 与control组相比,APS组和APS+3-MA组细胞增殖活性和细胞迁移率均降低(P<0.05),3-MA组变化差异无统计学意义(P>0.05);与APS组相比,3-MA组和APS+3-MA组细胞增殖活性和细胞迁移率均增高(P<0.05);与3-MA组相比,APS+3-MA组细胞增殖活性和细胞迁移率降低(P<0.05),见图2、表2。
2.4 各组HCT-116细胞自噬相关蛋白p62及LC3B表达变化 与control组相比,APS组LC3BⅡ/Ⅰ蛋白表达水平增高,p62蛋白表达水平降低(P<0.05);3-MA组LC3BⅡ/Ⅰ蛋白表达水平降低,p62蛋白表达水平增高(P<0.05);APS+3-MA组LC3BⅡ/Ⅰ、p62蛋白表达水平差异无统计学意义(P>0.05)。与APS组相比,3-MA组和APS+3-MA组LC3BⅡ/Ⅰ蛋白表达水平均降低,p62蛋白表达水平均增高(P<0.05)。与3-MA组相比,APS+3-MA组LC3BⅡ/Ⅰ蛋白表达水平增高(P<0.05),p62蛋白表达水平差异无统计学意义(P>0.05)。见表3、图3。
2.5 各组HCT-116细胞PI3K/Akt/mTOR信号通路相关蛋白表达变化 与control组相比,APS组p-PI3K/PI3K、p-Akt/Akt和p-mTOR/mTOR蛋白的相对表达量均降低(P<0.05),740Y-P组p-PI3K/PI3K、p-Akt/Akt和p-mTOR/mTOR蛋白的相对表达量均增高(P<0.05),APS+740Y-P组p-PI3K/PI3K、p-Akt/Akt和p-mTOR/mTOR蛋白的相对表达量差异无统计学意义(P>0.05);与APS组相比,740Y-P组和APS+740Y-P组p-PI3K/PI3K、p-Akt/Akt及p-mTOR/mTOR蛋白的相对表达量均增高(P<0.05);与740Y-P组相比,APS+740Y-P组p-PI3K/PI3K、p-Akt/Akt和p-mTOR/mTOR蛋白的相对表达量均降低(P<0.05),见表4、图4。
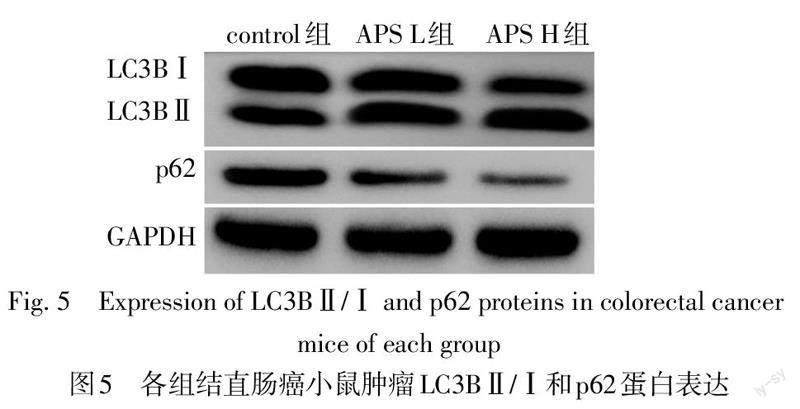
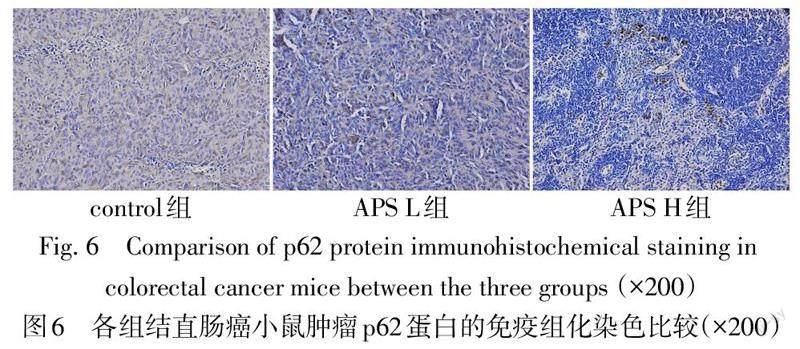
2.6 各组结直肠癌荷瘤小鼠肿瘤自噬相关蛋白p62及LC3B表达变化 Western blot与免疫组化染色结果显示,与control组相比,APS L组和APS H组LC3BⅡ/Ⅰ蛋白表达水平增高,p62蛋白表达水平降低(P<0.05);与APS L组相比,APS H组LC3BⅡ/Ⅰ蛋白表达水平增高,p62蛋白表达水平降低(P<0.05),见表5,图5、6。
2.7 APS对结直肠癌荷瘤小鼠肿瘤PI3K/Akt/mTOR信号通路相关蛋白表达的影响 APS L组和APS H组p-PI3K/PI3K、p-Akt/Akt及p-mTOR/mTOR蛋白相对表达量低于control组,APS H组p-PI3K/PI3K、p-Akt/Akt及p-mTOR/mTOR蛋白相对表达量低于APS L组(P<0.05),见表5、图7。
3 讨论
结直肠癌具有发病率高、预后差和病死率高的特点[9]。APS是黄芪的主要活性成分,常用于结直肠癌患者的辅助治疗[10-11]。本课题组前期研究表明,APS对结直肠癌荷瘤小鼠的肿瘤生长具有明显的抑制作用[8]。本研究旨在进一步探讨APS抗结直肠癌的作用机制。
自噬是一种真核细胞中发生的溶酶体降解胞内蛋白质和细胞器等成分的生理过程,包括癌症在内的多种疾病都与自噬密切相关[12]。近些年,靶向自噬治疗癌症越来越受到重视。研究表明自噬在结直肠癌的发生发展中具有双重作用,一方面,自噬激活可抑制结直肠癌的发生发展,甚至诱导结直肠癌细胞出现自噬性死亡;另一方面,自噬也可在恶劣环境(如饥饿)下维持结直肠癌的细胞活性[13-14]。本研究结果显示,APS可以促使人结直肠癌细胞HCT-116和结直肠癌小鼠肿瘤发生自噬,诱导HCT-116细胞自噬体的形成,且自噬抑制剂3-MA可减弱APS对HCT-116细胞诱导自噬、抑制增殖和迁移的作用。LC3及p62是自噬相关的标志性蛋白,在自噬被激活时,LC3会被转化为胞浆型LC3(LC3Ⅰ),进而被修饰成膜结合型LC3(LC3Ⅱ)并结合到自噬体膜上,同时选择性自噬的接头蛋白p62可连接LC3Ⅱ和泛素化底物,并在自噬溶酶体内被降解[15]。本研究结果显示,APS可以促进HCT-116细胞及结直肠癌小鼠肿瘤自噬相关蛋白LC3BⅠ向LC3BⅡ转化,并减少p62蛋白的聚集,进一步证明APS对结直肠癌自噬的激活作用。
研究表明,PI3K/Akt/mTOR信号通路作为细胞内重要的信号传导通路,参与了结直肠癌的发生发展,抑制PI3K/Akt/mTOR信号通路的信号传导是目前结直肠癌重要的潜在治疗策略[6,16]。另有研究表明,PI3K/Akt/mTOR信號通路亦是自噬的负向调控通路,当该通路以磷酸化形式激活时,会抑制自噬的发生[17]。本研究结果显示,APS可以抑制HCT-116细胞及小鼠肿瘤组织中PI3K/Akt/mTOR信号通路相关蛋白p-PI3K/PI3K、p-Akt/Akt及p-mTOR/mTOR的表达,并诱导自噬的发生,提示APS通过诱导自噬发挥抗结直肠癌作用的机制可能与APS抑制PI3K/Akt/mTOR信号通路有关。
综上所述,APS可通过诱导自噬及抑制PI3K/Akt/mTOR信号通路发挥抗结直肠癌作用。
参考文献
[1] SUNG H,FERLAY J,SIEGEL R L,et al. Global Cancer Statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 Countries[J]. CA Cancer J Clin,2021,71(3):209-249. doi:10.3322/caac.21660.
[2] 招志辉,丘振文,招远明. 黄芪多糖通过调控miR-20a/TGFBR2分子轴降低结直肠癌HT-29/DDP细胞的顺铂耐药性[J]. 中国肿瘤生物治疗杂志,2019,26(4):417-425. ZHAO Z H,QIU Z W,ZHAO Y M. Astragalus polysaccharide reduces cisplatin resistance in colorectal cancer HT-29/DDP cells by regulating the miR-20a/TGFBR2 molecular axis[J]. Chinese Journal of Cancer Biotherapy,2019,26(4):417-425. doi:10.3872/j.issn.1007-385x.2019.04.008.
[3] SONG J,CHEN Y,HE D,et al. Astragalus polysaccharide promotes adriamycin-induced apoptosis in gastric cancer cells[J]. Cancer Manag Res,2020,12:2405-2414. doi:10.2147/CMAR.S237146.
[4] YANG S,SUN S,XU W,et al. Astragalus polysaccharide inhibits breast cancer cell migration and invasion by regulating epithelial-mesenchymal transition via the Wnt/β-catenin signaling pathway[J]. Mol Med Rep,2020,21(4):1819-1832. doi:10.3892/mmr.2020.10983.
[5] ZHU X,CHEN Y,LIN M,et al. Qingjie Fuzheng Granule inhibits EMT and induces autophagy in colorectal cancer via mTOR signaling pathways[J]. Evid Based Complement Alternat Med,2021,2021:9950499. doi:10.1155/2021/9950499.
[6] WANG J,LIANG D,ZHANG X P,et al. Novel PI3K/Akt/mTOR signaling inhibitor,W922,prevents colorectal cancer growth via the regulation of autophagy[J]. Int J Oncol,2021,58(1):70-82. doi:10.3892/ijo.2020.5151.
[7] POLIVKA J Jr,JANKU F. Molecular targets for cancer therapy in the PI3K/AKT/mTOR pathway[J]. Pharmacol Ther,2014,142(2):164-175. doi:10.1016/j.pharmthera.2013.12.004.
[8] 赵媛媛,张楠,孙维义,等. 黄芪多糖对裸鼠结直肠癌移植瘤的抑制作用[J]. 郑州大学学报(医学版),2021,56(3):375-379. ZHAO Y Y,ZHANG N,SUN W Y. Inhibitory effects of astragalus polysaccharides on colorectal cancer xeno-grafted tumors in nude mice[J]. Journal of Zhengzhou University(Medical Sciences),2021,56(3):375-379. doi:10.13705/j.issn.1671-6825.2020.11.071.
[9] 中华人民共和国国家卫生健康委员会. 中国结直肠癌诊疗规范(2020年版)[J]. 中华外科杂志,2020,58(8):561-585. National Health Commission of the People's Republic of China. Chinese protocol of diagnosis and treatment of colorectal cancer (2020 edition)[J]. Chinese Journal of Surgery,2020,58(8):561-585. doi:10.3760/cma.j.cn112139-20200518-00390.
[10] CHEN Z,LIU L,GAO C,et al. Astragali Radix (Huangqi):A promising edible immunomodulatory herbal medicine[J]. J Ethnopharmacol,2020,258:112895. doi:10.1016/j.jep.2020.112895.
[11] 赵媛媛,张楠,孙维义,等. 黄芪多糖联合新辅助化疗与新辅助化疗对结直肠癌患者血清外泌体表达水平影响的对比研究[J]. 河南外科学杂志,2021,27(4):15-18. ZHAO Y Y,ZHANG N,SUN W Y,et al. Effects of astragalus polysaccharide combined with neoadjuvant chemotherapy on serum exosomes in patients with colorectal cancer[J]. Henan Journal of Surgery,2021,27(4):15-18. doi:10.16193/j.cnki.hnwk.2021.04.006.
[12] GALLUZZI L,GREEN D R. Autophagy-independent functions of the autophagy machinery[J]. Cell,2019,177(7):1682-1699. doi:10.1016/j.cell.2019.05.026.
[13] AMARAVADI R K,KIMMELMAN A C,DEBNATH J. Targeting autophagy in cancer:Recent advances and future directions[J]. Cancer Discov,2019,9(9):1167-1181. doi:10.1158/2159-8290.CD-19-0292.
[14] LI S,WANG X,WANG G,et al. Ethyl acetate extract of selaginella doederleinii hieron induces cell autophagic death and apoptosis in colorectal cancer via PI3K-Akt-mTOR and AMPKα-signaling pathways[J]. Front Pharmacol,2020,11:565090. doi:10.3389/fphar.2020.565090.
[15] DYSHLOVOY S A. Blue-print autophagy in 2020:A critical review[J]. Mar Drugs,2020,18(9):482. doi:10.3390/md18090482.
[16] SANAEI M J,BAGHERY SAGHCHY KHORASANI A,POURBAGHERI-SIGAROODI A,et al. The PI3K/Akt/mTOR axis in colorectal cancer:Oncogenic alterations,non-coding RNAs,therapeutic opportunities,and the emerging role of nanoparticles[J]. J Cell Physiol,2022,237(3):1720-1752. doi:10.1002/jcp.30655.
[17] DUAN Y,HAYBAECK J,YANG Z. Therapeutic potential of PI3K/AKT/mTOR pathway in gastrointestinal stromal tumors:Rationale and progress[J]. Cancers (Basel),2020,12(10):2972. doi:10.3390/cancers12102972.
(2022-04-01收稿 2022-09-02修回)
(本文編辑 陈丽洁)
