转录因子EB在衰老心肌细胞自噬中的作用机制研究
2023-11-06盛思琪谢琳姜怡邓熊建团杨安宁吴凯杨勇杨晓明
盛思琪 谢琳 姜怡邓 熊建团 杨安宁 吴凯 杨勇 杨晓明

摘要:目的 探討转录因子EB(TFEB)在衰老心肌细胞自噬中的作用机制。方法 动物实验:将20只老年Wistar大鼠采取随机数字表法分为假手术组(Sham组)和缺血再灌注组(I/R组)。细胞实验:(1)体外培养大鼠心肌细胞,采用8 g/L D-半乳糖孵育8 d后分为常氧(Normoxia)组和缺氧/复氧(H/R)组。(2)在衰老心肌细胞中分别转染过表达和干扰TFEB腺病毒分为过表达对照(Ad-GFP)组、过表达对照+缺氧/复氧(Ad-GFP+H/R)组、过表达TFEB(Ad-TFEB)组、过表达TFEB+缺氧/复氧(Ad-TFEB+H/R)组、干扰对照(sh-NC)组、干扰对照+缺氧/复氧(sh-NC+H/R)组、干扰TFEB(sh-TFEB)组、干扰TFEB+缺氧/复氧(sh-TFEB+H/R)组。(3)分别用DNMT1、DNMT3a、DNMT3b的特异性抑制剂DC-05、TFD、NA处理缺氧/复氧后的衰老心肌细胞分为H/R组、DC-05组、TFD组、NA组。(4)在衰老心肌细胞中转染干扰DNMT3b腺病毒分为干扰对照(sh-NC)组、干扰对照缺氧/复氧(sh-NC+H/R)组、干扰DNMT3b(sh-DNMT3b)组、干扰DNMT3b缺氧/复氧(sh-DNMT3b+H/R)组。实时荧光定量PCR(qPCR)检测TFEB的mRNA表达水平;Western blot检测衰老心肌细胞中自噬相关蛋白TFEB、LC3B和p62的蛋白表达;巢式甲基化特异性PCR(nMS?PCR)检测TFEB启动子区的DNA甲基化水平。结果 与Sham组或Normoxia组比较,I/R组和H/R组中TFEB的mRNA和蛋白表达水平降低(P<0.01);过表达TFEB后,与Ad-GFP组比较,Ad-TFEB组LC3B-Ⅱ/Ⅰ的蛋白表达水平降低,p62的蛋白表达水平升高(P<0.01),而干扰TFEB后得到相反的结果(P<0.01)。与Sham组或Normoxia组比较,I/R组和H/R组中TFEB启动子区DNA甲基化水平升高(P<0.05)。与H/R组比较,NA组TFEB mRNA和蛋白表达水平升高(P<0.01);干扰DNMT3b后,与sh-NC组比较,sh-DNMT3b组TFEB mRNA和蛋白表达水平升高(P<0.01)。结论 DNMT3b通过调控TFEB启动子区DNA甲基化抑制TFEB的表达,进而促进衰老心肌细胞自噬。
关键词:肌细胞,心脏;细胞衰老;转录因子EB;细胞自噬;DNA甲基化;DNMT3b
中图分类号:R542.2文献标志码:ADOI:10.11958/20220920
Study on the mechanism of transcription factor EB in autophagy of aging cardiomyocytes
SHENG Siqi XIE LinJIANG Yideng XIONG Jiantuan YANG Anning WU Kai YANG Yong YANG Xiaoming
1 School of Basic Medical Sciences, Ningxia Medical University, Yinchuan 750004, China; 2 NHC Key Laboratory of Metabolic Cardiovascular Diseases Research, Ningxia Medical University; 3 Ningxia Key Laboratory of Vascular
Injury and Repair Research, Ningxia Medical University; 4 Ningxia Hui Autonomous Region People's Hospital
Corresponding Author E-mail: xmyang327@126.com
Abstract: Objective To explore the mechanism of transcription factor EB (TFEB) in autophagy of aging cardiomyocytes. Methods Animal experiment: Twenty aged Wistar rats were randomly divided into the sham operation group (Sham group) and the ischemia-reperfusion injury group (I/R group). Cell experiments: (1) Aging cardiomyocytes were cultured in vitro, incubated with 8 g/L D-galactose for 8 days, and then divided into the normoxia group and the hypoxia/reoxygenation group (H/R group). (2) Aging cardiomyocytes transfected by adenovirus overexpressing and interfering with TFEB were divided into the Ad-GFP group, the Ad-GFP+H/R group, the Ad-TFEB group, the Ad-TFEB+H/R group, the sh-NC group, the sh-NC+H/R group, the sh-TFEB group and the sh-TFEB+H/R group. (3) Aging cardiomyocytes treated with specific inhibitors of DNMT1, DNMT3a and DNMT3b after hypoxia/reoxygenation were divided into the H/R group, the DNMT1 specific inhibitor (DC-05) group, the DNMT3a specific inhibitor (TFD) group and the DNMT3b specific inhibitor (NA) group. (4) Aging cardiomyocytes transfected by adenovirus interfering with DNMT3b were divided into the sh-NC group, the sh-NC+H/R group, the sh-DNMT3b group and the sh-DNMT3b+H/R group. Quantitative real-time PCR (qPCR) was used to detect the mRNA level of TFEB, and Western blot assay was used to detect the autophagy related proteins TFEB, LC3B and p62 in aging cardiomyocytes. The DNA methylation levels of TFEB promoter in aging myocardium and cardiomyocytes were detected by nested methylation specific PCR (nMS-PCR). Results Compared with the Sham group or the normoxia group, the mRNA and protein expression of TFEB were decreased in the I/R group and the H/R group (P<0.01). The protein expression of LC3B-Ⅱ/Ⅰ was decreased in aging cardiomyocytes after overexpression of TFEB in the Ad-TFEB group compared with the Ad-GFP group, while the protein expression of p62 was increased (P<0.01). The opposite results were obtained after interfering with TFEB (P<0.01). Compared with the Sham group or the normoxia group, the DNA methylation level of the TFEB promoter was increased in the I/R group and the H/R group (P<0.05). Compared with the H/R group, it was found that the mRNA and protein expression level of TFEB were increased in the NA group (P<0.01). And the TFEB mRNA and protein expression were increased in aging cardiomyocytes after overexpressed interference with DNMT3b (P<0.01). Conclusion DNMT3b inhibits the TFEB expression by regulating DNA methylation of TFEB promoter, thus to promote autophagy of aging cardiomyocytes.
Key words: myocytes, cardiac; cell aging; transcription factor EB; autophagy; DNA methylation; DNMT3b
目前,心血管疾病的发病率在全球呈上升趋势,而心肌缺血再灌注(I/R)损伤是一个复杂且多因素的病理过程,与急性心肌梗死(AMI)等缺血性心脏病的发生关系密切[1-2]。研究发现,在老年人和患病心脏中存在大量衰老细胞,最终促使心脏结构和功能变化,引起左心室肥厚和舒张功能下降,细胞外基质重构、心肌纤维化增加,传导阻滞等病理改变[3-4]。缺血性心脏疾病主要以衰老心肌细胞损伤为主,进而引起收缩功能和内源性抗不可逆损伤能力的丧失[5-6]。自噬(autophagy)是真核生物细胞内溶酶体降解的途径,通过溶酶体或胞液进行“饥饿”状态下的营养动员,从而清除受损蛋白质,受到自噬相关蛋白(ATG)和转录因子的严格调控[7]。研究显示,自噬参与I/R损伤病理过程,且与老年个体的心脏功能紊乱、抗损伤能力降低密切相关[8-9]。转录因子EB(transcription factor EB,TFEB)可维持细胞自噬稳定,与自噬基因的启动子区结合,诱导自噬体的生物合成,并调控关键因子自噬体-溶酶体的转录[10-11]。然而,TFEB影响衰老心肌细胞自噬的机制尚不明确,亦鲜见相关研究。本研究旨在探讨TFEB对衰老心肌自噬的影响及可能调控机制,以期为老年心肌损伤的防治提供新的理论支持。
1 材料与方法
1.1 主要材料 大鼠心肌H9c2细胞购自中国科学院细胞库(上海,中国)。20只SPF级雄性Wistar大鼠购自宁夏医科大学实验动物中心[动物生产许可证号:SCXK(宁)2020-0001],22~24个月,体质量600~700 g。胎牛血清、DMEM高糖培养基购自美国Gibco公司;D-(+)半乳糖购自北京金克隆公司;DNMT1特异性抑制剂DC-05、DNMT3a特异性抑制剂(theaflavin 3,3-digallate,TFD)、DNMT3b特异性抑制剂(nanaomycin A,NA)购自美国MCE公司;DNA甲基化修饰试剂盒购自美国ZYMO公司;胰蛋白酶消化液购自上海碧云天公司;BCA蛋白定量试剂盒、蛋白提取试剂盒购自南京凯基公司;实时荧光定量PCR(qPCR)试剂盒、反转录试剂盒购自日本Takara公司;总RNA提取试剂盒购自北京天根公司;兔源一抗p62、兔源一抗LC3B均购自英国Abcam公司;兔源一抗TFEB购自上海Abmart公司;鼠源一抗内参蛋白β-actin、羊抗兔二抗、羊抗鼠二抗购自北京中杉金桥公司;TFEB和GAPDH引物由上海生工公司合成;过表达TFEB腺病毒(Ad-TFEB)、干扰TFEB腺病毒(sh-TFEB)及干扰DNMT3b腺病毒(sh-DNMT3b)购自上海吉玛制药技术有限公司。
1.2 动物实验 20只大鼠按随机数字表法分为假手术(Sham)组和I/R组,每组10只。I/R组大鼠麻醉后行气管插管,连接小动物呼吸机,监测大鼠心電图。沿胸骨左缘平左腋线处切开皮肤约2 cm,于左心耳根部下方2 mm处用5-0无创缝合针穿过心肌表层,在肺动脉圆锥旁出针。观察心电图,心率稳定15 min后,用缝合针的两头穿过压迫管,止血钳在压迫管另一头夹闭,以终止左冠状动脉前降支血流,30 min后松结扎线,然后松开止血钳恢复血流灌注2 h。心肌缺血成功的标志:心电图Ⅱ导联ST段弓背向上抬高0.4 mV以上。心电监护截取缺血波,再灌注波证实模型成功。Sham组只穿线不结扎,再灌注2 h,2组大鼠均存活。造模结束后,麻醉处死并取大鼠心尖部,迅速切除并冷冻在液氮中用于后续实验。
1.3 细胞实验
1.3.1 细胞培养 H9c2细胞在10%胎牛血清和1%双抗的DMEM高糖培养基中培养。当细胞密度占培养瓶底面积80%时用胰蛋白酶消化进行传代,传至第3代时取对数生长期细胞进行后续实验。采用8 g/L D-半乳糖诱导其衰老8 d后,分为常氧(Normoxia)组和缺氧/复氧(H/R)组,其中H/R组的衰老心肌细胞置于缺氧(1%O2,5%CO2)培养箱中180 min,再复氧(5%CO2和37 ℃)120 min[12]。
1.3.2 腺病毒转染 (1)TFEB腺病毒转染:将携带绿色荧光蛋白(GFP)的Ad-TFEB和sh-TFEB分别转染衰老心肌细胞后,分为过表达对照(Ad-GFP)组、过表达对照+缺氧/复氧(Ad-GFP+H/R)组、过表达TFEB(Ad-TFEB)组、过表达TFEB+缺氧/复氧(Ad-TFEB+H/R)组、干扰对照(sh-NC)组、干扰TFEB+缺氧/复氧(sh-TFEB+H/R)组,用于TFEB表达自身验证及自噬相关指标检测。(2)DNMT3b腺病毒转染:将干扰DNMT3b腺病毒(sh-DNMT3b)转染衰老心肌细胞后,分为干扰对照(sh-NC)组、干扰对照缺氧/复氧(sh-NC+H/R)组、干扰DNMT3b(sh-DNMT3b)组、干扰DNMT3b缺氧/复氧(sh-DNMT3b+H/R)组,用于TFEB启动子区甲基化水平检测。
1.3.3 药物处理 分别使用DNMT1特异性抑制剂DC-05、DNMT3a特异性抑制剂TFD、DNMT3b特异性抑制剂NA处理衰老心肌细胞,缺氧/复氧后分为H/R组、DC-05组、TFD组、NA组,用于TFEB启动子区甲基化水平检测。
1.4 qPCR检测TFEB表达 提取1.2、1.3.1、1.3.2和1.3.3中各组的总RNA并反转录为cDNA。使用qPCR试剂盒在FTC3000反应系统进行扩增。总反应体系:PCR Mix 10 μL、H2O 6 μL、上下游引物各1 μL、cDNA 2 μL,共20 μL。TFEB引物序列:上游5'-GTTCACTTCCAGTCGCCACCAC-3',下游5'-GTTCACTTCCAGTCGCCACCAC-3';GAPDH引物序列:上游5'-GACCTGACCTGCCGTCTA-3',下游5'-AGGAGTGGGTGTCGCTGT-3'。TFEB和GAPDH引物由生工生物工程股份有限公司(中国上海)合成,反应条件:95 ℃ 2 min;95 ℃ 5 s,60 ℃ 10 s,共40个循环。以GAPDH为内参,2-ΔΔCt法计算TFEB相对表达量。
1.5 Western blot检测TFEB、LC3B和p62的蛋白表达 提取1.2和1.3中各组蛋白。根据BCA法进行蛋白定量调整上样体积。每组30 ?g总蛋白进行SDS-PAGE凝胶电泳、转膜,5%脱脂奶粉室温封闭2 h后,4 ℃一抗孵育过夜:TFEB(1∶500)、p62(1∶10 000)、LC3B(1∶2 000)及β-actin(1∶1 000)。加入辣根过氧化物酶(HRP)标记的羊抗兔和羊抗鼠二抗(1∶5 000)室温孵育2 h,使用ECL化学发光试剂显影曝光。应用Image Lab软件对检测结果的灰度值进行分析,以β-actin为内参,计算目的蛋白相对表达水平。
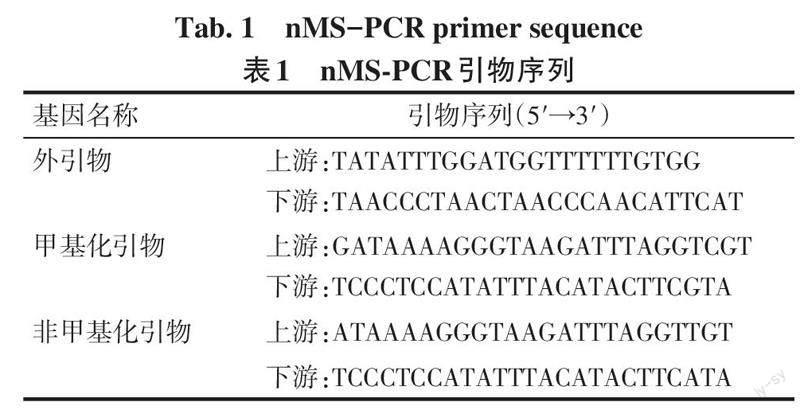
1.6 巢式甲基化特异性PCR(nMS-PCR)检测TFEB启动子区DNA甲基化水平 按DNA提取试剂盒说明書分别提取1.2和1.3.1各组中的全基因组DNA,亚硫酸盐修饰法对全基因组DNA进行甲基化修饰。nMS-PCR法检测TFEB启动子区DNA甲基化水平的改变,反应体系:PCR Mix 12.5 μL、H2O 7 μL、上下游引物各1 μL、已修饰的DNA 3.5 μL,共25 μL。外引物扩增的反应条件:95 ℃ 5 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,20个循环,72 ℃ 7 min,4 ℃ 保温。以外引物的PCR产物为模板,进行内外引物的扩增,反应条件:95 ℃ 5 min;95 ℃ 30 s,59.5 ℃ 30 s,72 ℃ 30 s,20个循环;72 ℃ 7 min,4 ℃ 保温。取5 μL PCR产物于2%琼脂糖凝胶上电泳,用凝胶成像分析仪成像分析,按如下公式进行计算:甲基化=(甲基化OD值)/(甲基化OD值+非甲基化OD值)×100%。针对TFEB启动子区,由在线(http://www.urogene.org/cgi?bin/methprimer/methprimer.cgi)设计一对外引物及两对内引物,引物序列见表1。
1.7 统计学方法 采用GraphPad Prism 8.0进行数据分析。符合正态分布的计量资料以x±s表示,2组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
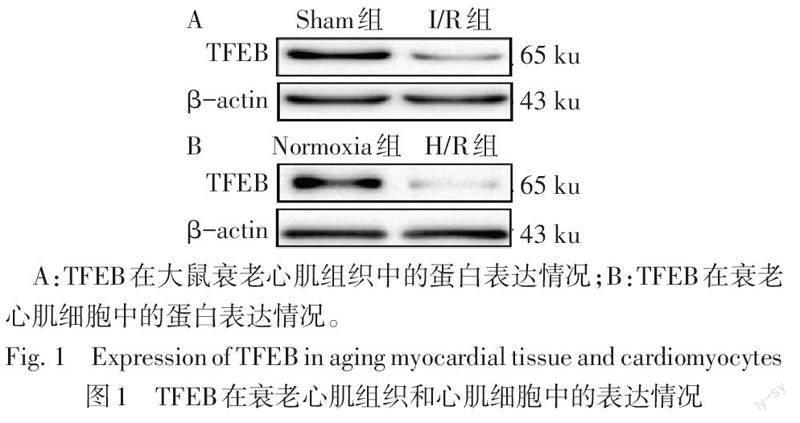
2.1 TFEB在衰老心肌组织和心肌细胞中的表达情况 动物实验中,与Sham组(1.785±0.938)比较,I/R组心肌组织TFEB的mRNA(0.509±0.300)表达水平均降低(n=10,t=4.098,P<0.01);与Sham组(0.690±0.178)比较,I/R组心肌组织TFEB蛋白(0.266±0.047)表达水平亦降低(n=10,t=7.276,P<0.01)。细胞实验中,与Normoxia组(1.375±0.161)比较,H/R组TFEB mRNA(0.790±0.074)表达水平降低(n=3,t=5.713,P<0.01);与Normoxia组(0.674±0.012)比较,H/R组TFEB蛋白(0.231±0.084)表达水平亦降低(n=3,t=9.077,P<0.01),见图1。
2.2 干扰和过表达TFEB对衰老心肌细胞自噬的影响
2.2.1 过表达和干扰TFEB后自身验证 细胞实验中,与Ad-GFP组(0.265±0.012)比较,Ad-TFEB组的TFEB蛋白(0.724±0.167)表达水平增加(n=3,t=4.733,P<0.01);与sh-NC组(1.201±0.044)比较,sh-TFEB组的TFEB蛋白(0.804±0.083)表达水平降低(n=3,t=7.312,P<0.01),见图2。
2.2.2 TFEB对衰老心肌细胞自噬的影响 过表达TFEB后,与Ad-GFP组比较,Ad-TFEB组中LC3B-Ⅱ/Ⅰ的蛋白表达水平降低,p62的蛋白表达水平升高(P<0.01);与Ad-GFP+H/R组比较,Ad-TFEB+H/R组中LC3B-Ⅱ/Ⅰ表达水平降低,p62的蛋白表达水平升高(P<0.01)。干扰TFEB后,与sh-NC组比较,sh-TFEB组中LC3B-Ⅱ/Ⅰ的蛋白表达水平升高,而p62的蛋白表达水平降低(P<0.01);与sh-NC+H/R组相比,sh-TFEB+H/R组中LC3B-Ⅱ/Ⅰ的表达水平升高,而p62的蛋白表达水平降低(P<0.01),见图3、表2。
2.3 TFEB启动子区的DNA甲基化对TFEB表达的影响
2.3.1 衰老心肌组织和心肌细胞中TFEB启动子区的DNA甲基化水平 Methprimer在线预测发现,TFEB启动子区具有3个CPG岛,nMS-PCR法检测结果显示:在动物实验中,与Sham组(0.495±0.040)比较,I/R组TFEB启动子区的DNA甲基化水平(0.683±0.078)升高(n=10,t=6.797,P<0.01);在细胞实验中,与Normoxia组(0.483±0.015)比较,H/R组TFEB启动子区的DNA甲基化水平(0.690±0.108)亦升高(n=3,t=3.277,P<0.05),见图4。
2.3.2 DNA甲基化转移酶抑制剂对衰老心肌细胞中TFEB表达的影响 与H/R组比较,NA组TFEB mRNA和蛋白表达均升高(P<0.05),而DC-05组和TFD组TFEB的mRNA和蛋白水平差异无统计学意义,见图5、表3。
2.4 DNMT3b对衰老心肌细胞中TFEB表达的影响 与sh-NC组比较,sh-DNMT3b组的TFEB mRNA和蛋白表达水平均升高(P<0.05);与sh-NC+H/R组比较,sh-DNMT3b+H/R组的TFEB mRNA和蛋白表达水平亦升高(P<0.05),见图6、表4。
3 讨论
随着我国老龄化进程的加速,老年人心血管事件发生率增加,探寻防治老年人心血管疾病的潜在靶点是亟待解决的临床问题[13]。心肌细胞衰老导致的心肌损伤是影响心血管病发生的主要因素,深入探讨衰老心肌损伤的机制具有重要的临床意义[14]。心肌I/R损伤是心肌长时间缺血后恢复供血心肌损伤更加严重的一种病理现象[15]。然而,目前尚无有效防治心肌I/R损伤的方法。在心肌I/R损伤过程中,自噬发挥着重要作用。Li等[16]通过体内和体外研究发现,Caspase招募域含蛋白9(CARD9)可激活自噬和恢复自噬通量,对心肌I/R损伤起保护作用。本课题组前期通过体外培养衰老心肌细胞,缺氧/复氧后模拟I/R的病理环境,发现衰老心肌细胞自噬水平升高,提示抑制其自噬可能是减轻心肌I/R损伤的潜在作用机制[17]。
TFEB是MITF-TFE家族成员之一,属于碱性螺旋-环-螺旋亮氨酸拉链类转录因子[18]。研究显示,TFEB是溶酶体-自噬途径最重要的转录调节因子,负责控制溶酶体生物发生和功能、自噬和囊泡通量,可直接调控自噬相关基因表达[19]。在哺乳动物体内,TFEB去磷酸化后,核易位激活自噬信号通路,自噬体与溶酶体融合发挥降解作用,大分子释放到细胞质中被重新利用,维持了细胞内环境的稳定[20]。本研究发现,I/R处理的衰老心肌组织和H/R处理的衰老心肌细胞与正常衰老心肌组织和细胞相比TFEB表达水平均降低,提示TFEB可能与衰老心肌细胞自噬有关。细胞自噬是Atg、Rubicon等多种自噬相关基因和关键蛋白参与的动态过程,可通过这些分子的表达水平来评估自噬活性[21]。LC3分为Ⅰ型、Ⅱ型,自噬未发生时,可溶性的LC3-Ⅰ型蛋白分布于细胞表面;当自噬发生时,位于细胞表面的LC3-Ⅰ与磷脂酰乙醇胺耦联形成LC3-Ⅱ并附着在自噬体膜上,由于LC3-Ⅱ始终稳定地定位在自噬体膜上,直到与溶酶体融合,理论上可以通过计算LC3-Ⅱ或LC3-Ⅱ/Ⅰ的比值来评价自噬水平的高低[22]。p62也是自噬反应发生过程中的重要衔接分子,其水平变化与自噬强弱呈负相关,常与LC3共同用于判断自噬反应活性[23]。本研究结果显示,在缺氧/复氧条件下,过表达TFEB后衰老心肌细胞中LC3B-Ⅱ/Ⅰ的表达水平较Ad-GFP+H/R组降低,而p62的蛋白表达水平升高,表明TFEB可以通过调控自噬标志物LC3B和p62的表达抑制衰老心肌细胞自噬,进而保护I/R损伤的心肌,但其具体机制还有待进一步研究。
DNA甲基化是一种在原核和真核生物基因组中常见的复制后表观遗传修饰[24]。DNA甲基化常发生在富含CPG島序列的胞嘧啶5'端,可使被修饰的DNA空间结构或染色体结构发生改变而导致基因表达改变[25]。本研究通过Methprimer在线预测TFEB的CPG岛发现,TFEB启动子区具有3个CPG岛,这为TFEB启动子区发生DNA甲基化提供结构基础。目前,DNA甲基化作为一种调控TFEB表达的机制日益成为研究的热点,但是关于TFEB启动子区DNA异常甲基化与衰老心肌细胞自噬的相关性研究尚属于全新的领域。本研究发现,I/R处理的衰老心肌组织和H/R处理的衰老心肌细胞中TFEB启动子区的DNA甲基化水平与正常衰老心肌组织和细胞相比均提高,提示TFEB的表达水平受到DNA甲基化调控。DNA甲基化主要是在甲基化转移酶的催化下,DNA序列中的腺嘌呤或胞嘧啶与甲基发生共价结合,而哺乳动物细胞中DNA甲基转移酶主要分为DNMT1、DNMT3a和DNMT3b[26]。其中,DNMT1为持续性甲基转移酶,主要参与DNA复制新合成链的完全甲基化,DNMT3a和DNMT3b主要参与从头甲基化[27]。本研究中分别用甲基转移酶特异性抑制剂DC-5、TFD、NA处理衰老心肌细胞,发现用NA处理后,衰老心肌细胞中TFEB的表达上升,提示DNMT3b可参与衰老心肌细胞中TFEB启动子区的DNA甲基化,进一步干扰DNMT3b后发现TFEB的表达亦上升,证实了DNMT3b参与衰老心肌细胞自噬过程中TFEB表达的调控。
综上所述,TFEB在衰老心肌细胞自噬过程中表达降低,DNMT3b通过调节TFEB启动子区的DNA甲基化水平,从而抑制衰老心肌细胞自噬过程中TFEB的表达,TFEB可作为治疗心肌I/R损伤的潜在分子靶点,有望为临床上老年心肌I/R损伤的防治提供更多参考。
参考文献
[1] GUIEU R,RUF J,MOTTOLA G,et al. Hyperhomocysteinemia and cardiovascular diseases[J]. Ann Biol Clin (Paris),2022,80(1):7-14. doi:10.1684/abc.2021.1694.
[2] 王丽艳,徐哲龙. 线粒体功能障碍在心血管疾病中作用机制的研究进展[J]. 天津医药,2020,48(2):146-151. WANG L Y,XU Z L. Research progress on the mechanism of mitochondrial dysfunction in cardiovascular disease[J]. Tianjin Med J,2020,48(2):146-151. doi:10.13885/j.issn.1000-2812.2022.04.007.
[3] MESQUITA T,LIN Y N,IBRAHIM A. Chronic low-grade inflammation in heart failure with preserved ejection fraction[J]. Aging Cell,2021,20(9):e13453. doi:10.1111/acel.13453.
[4] LYU G,GUAN Y,ZHANG C,et al. TGF-β signaling alters H4K20me3 status via miR-29 and contributes to cellular senescence and cardiac aging[J]. Nat Commun,2018,9(1):2560. doi:10.1038/s41467-018-04994-z.
[5] 师莹,赵莉莉,秦勤. 细胞衰老:心脏疾病治疗新思路[J]. 中国分子心脏病学杂志,2022,22(3):4725-4730. SHI Y,ZHAO L L,QIN Q. Cell senescence:Bew ideas for the treatment of heart disease[J]. Chinese Journal of Molecular Cardiology,2022,22(3):4725-4730. doi:10.16563/j.cnki.1671-6272.2022.06.016.
[6] HU C,ZHANG X,TENG T,et al. Cellular senescence in cardiovascular diseases:a systematic review[J]. Aging Dis,2022,13(1):103-128. doi:10.14336/AD.2021.0927.
[7] XUE X,LI F,CAI M,et al. Interactions between endoplasmic reticulum stress and autophagy:implications for apoptosis and neuroplasticity-related rroteins in palmitic acid-treated prefrontal cells[J]. Neural Plasticity,2021,10(4):8851327. doi:10.1155/2021/8851327.
[8] LI J,LU K,ZHANG X,et al. SIRT3-mediated mitochondrial autophagy in refeedingsyndrome-related myocardial injury in sepsis rats[J]. Ann Transl Med,2022,10(4):211. doi:10.21037/atm-22-222.
[9] YU Y W,QUE J Q,LIU S,et al. Sodium-glucose co-transporter-2 inhibitor of dapagliflozin attenuates myocardial ischemia/reperfusion injury by limiting NLRP3 inflammasome activation and modulating autophagy[J]. Front Cardiovasc Med,2022,8:768214. doi:10.3389/fcvm.2021.768214.
[10] PARK K,LIM H,KIM J,et al. Lysosomal Ca2+-mediated TFEB activation modulatesmitophagy and functional adaptation of pancreatic β-cells to metabolic stress[J]. Nat Conmmun,2022,13(1):1300. doi:10.1038/s41467-022-28874-9.
[11] KIM S,SONG G,LEE T,et al. PARsylated transcription factor EB (TFEB) regulates the expression of a subset of Wnt target genes by forming a complex with β-catenin-TCF/LEF1[J]. Cell Death Differ,2021,28(9):2555-2570. doi:10.1038/s41418-021-00770-7.
[12] WANG Y,HAO Y,ZHANG H,et al. DNA hypomethylation of miR-30a mediated the protection of hypoxia postconditioning against aged cardiomyocytes hypoxia/reoxygenation injury through inhibiting autophagy[J]. Circ J,2020,84(4):616-625. doi:10.1253/circj.CJ-19-0915.
[13] 劉聘选,张嘉禾,毕金淼,等. 心血管衰老的机制和干预综述[J]. 中国基础科学,2021,23(6):46-58. LIU P X,ZHANG J H,BI J M,et al. Review of cardiovascular aging mechanisms and interventions[J]. China Basic Science,2021,23(6):46-58. doi:10.3969/j.issn.1009-2414.2021.06.005.
[14] CALCINOTTO A,KOHLI J,ZAGATO E,et al. Cellular senescence:Aging,cancer,and injury[J]. Physiol Rev,2019,99(2):1047-1078. doi:10.1152/physrev.00020.2018.
[15] 陈玉,苏建军,韩允,等. 富马酸二甲酯调控 Nrf2-GPX4 介导的铁死亡途径对大鼠心肌缺血/再灌注损伤的保护作用研究[J]. 天津医药,2022,50(6):601-607. CHEN Y,SU J J,HAN Y,et al. Study on the protective effect of dimethyl fumarate regulating Nrf2-GPX4-mediated ferroptosis pathway on myocardial ischemia/reperfusion injury in rats[J]. Tianjin Med J,2022,50(6):601-607. doi:10.11958/20212639.
[16] LI Y,LIANG P,JIANG B,et al. CARD9 promotes autophagy in cardiomyocytes inmyocardial ischemia/reperfusion injury via interacting with rubicon directly[J]. Basic Res Cardiol,2020,115(3):29. doi:10.1007/s00395-020-0790-6.
[17] 王睿,王艳华,柴丽芬,等. 组蛋白去乙酰化酶2在衰老心肌细胞自噬水平降低中的作用[J]. 实用医学杂志,2020,36(9):1157-1163. WANG R,WANG Y H,CHAI L F,et al. The role of histone deacetylase 2 in the reduction of autophagy levels in aging cardiomyocytes[J]. Journal of Practical Medicine,2020,36(9):1157-1163. doi:10.3969/j.issn.1006-5725.2020.09.009.
[18] FANG S,WAN X,ZOU X ,et al. Arsenic trioxide induces macrophage autophagy and atheroprotection by regulating ROS-dependent TFEB nuclear translocation and AKT/mTOR pathway[J]. Cell Death Dis,2021,12(1):88. doi:10.1038/c41419-020-03357-1.
[19] NEZICH C L,WANG C,FOGEL A I,et al. MiT/TFE transcription factors are activatedduring mitophagy downstream of Parkin and Atg5[J]. The Journal of cell biology,2015,210(3):435-50. doi:10.1083/jcb.201501002.
[20] GUO H,PU M,TAI Y,et al. Nuclear miR-30b-5p suppresses TFEB-mediated lysosomal biogenesis and autophagy[J]. Cell Death Differ,2021,28(1):320-336. doi:10.1038/s41418-020-0602-4.
[21] KMA L,BARUAH T J. The interplay of ROS and the PI3K/Akt pathway in autophagy regulation[J]. Biotechnol Appl Biochem,2022,69(1):248-264. doi:10.1002/bab.2104.
[22] VISHNUPRIYA S,PRIYA DHARSHINI L C,SAKTHIVEL K M,et al. Autophagy markers as mediators of lung injury-implication for therapeutic intervention[J]. Life Sci,2020,260:118308. doi:10.1016/j.lfs.2020.118308.
[23] 宋鹏书,张燕华,张奕梅,等. 自噬相关蛋白LC3-Ⅱ和p62在不明原因复发性流产患者绒毛组织中的表达和临床意义[J]. 国际检验医学杂志,2021,42(13):1602-1605. SONG P S,ZHANG Y H,ZHANG Y M,et al. Expression and clinical significance of autophagy-related proteins LC3-II and p62 in villus tissue of patients with unexplained recurrent miscarriage[J]. International Journal of Laboratory Medicine,2021,42(13):1602-1605. doi:10.3969/j.issn.1673-4130.2021.13.016.
[24] K?HLER F,RODRíGUEZ-PAREDES M. DNA methylation in epidermal differentiation,aging,and cancer[J]. J Invest Dermatol,2020,140(1):38-47. doi:10.1016/j.jid.2019.05.011.
[25] MORGAN A E,DAVIAES T J,MCAULEY M T. The role of DNA methylation in ageing and cancer[J]. Proc Nutr Soc,2018,77(4):412-422. doi:10.1017/S0029665118000150.
[26] HUANG J,WANG J,WU Z,et al. Profiling demethylase activity using epigeneticallyin activated DNAzyme[J]. Biosens Bioelectron,2022,207(1):114186. doi:10.1016/j.bios.2022.114186.
[27] MENSAH I,KNORVIL A B,ALABDI L,et al. Misregulation of the expression and activity of DNA methyltransferases in cancer[J]. NAR Cancer,2021,12(1):zcab045. doi:10.1093/narcan/zcab045.
(2022-06-21收稿 2022-08-16修回)
(本文編辑 陆荣展)
