杜仲叶总黄酮通过RhoA/ROCK信号通路参与脑出血大鼠神经功能修复
2023-11-06张秀峰李小菲刘明王慧静
张秀峰 李小菲 刘明 王慧静
摘要:目的 从Ras同源基因家族成员A(RhoA)/Rho相关卷曲螺旋蛋白激酶(ROCK)通路探讨杜仲叶总黄酮促进脑出血大鼠神经功能修复的机制。方法 取SD雄性大鼠,用改良二次注血法建立脑出血模型,并按随机数字表法分为假手术组、模型组、杜仲叶总黄酮组、RhoA抑制剂组、RhoA激动剂组、杜仲叶总黄酮+RhoA激动剂组,每组20只。杜仲叶总黄酮组灌胃200 mg/kg杜仲叶总黄酮,RhoA抑制剂组腹腔注射1 mg/kg的RhoA抑制剂Y27632,RhoA激动剂组腹腔注射30 μg/kg的RhoA激动剂U-46619,杜仲叶总黄酮+RhoA激动剂组灌胃200 mg/kg杜仲叶总黄酮的同时腹腔注射30 μg/kg U-46619,模型组及假手术组灌胃10 mL/kg生理盐水,1次/d,连续7 d。给药结束后,观察大鼠行为变化,采用改良神经功能缺损评分(mNSS)对神经功能缺损症状进行评估;取脑组织后称质量,计算脑组织含水量,然后制备脑组织切片并计算脑血肿体积百分比;透射电镜观察血肿周围组织神经突触结构变化;TUNEL染色法观察血肿周围组织神经元凋亡;鬼笔环肽染色观察血腫周围组织神经元骨架变化;蛋白免疫印迹法检测血肿周围组织RhoA、ROCK、细胞骨架蛋白(F-actin)、丝切蛋白(cofilin)、磷酸化cofilin(p-cofilin)、促神经元及突触生长相关蛋白[神经生长因子(NGF)、神经营养因子3(NT3)、突触后致密蛋白-95(PSD-95)、突触素(SYP)]的表达。结果 与假手术组相比,模型组大鼠神经功能缺损评分、脑组织含水量、脑血肿体积百分比升高,血肿周围组织神经元凋亡及骨架结构损伤,神经突触结构改变严重,RhoA/ROCK通路激活,促神经元及突触生长相关蛋白表达降低(P<0.05)。杜仲叶总黄酮或RhoA抑制剂干预治疗均可抑制RhoA/ROCK通路激活介导的神经元骨架结构改变,提高促神经元及突触生长相关蛋白表达,缓解脑出血后血肿周围组织神经元损伤及凋亡,促进神经功能修复(P<0.05)。RhoA激动剂可促进RhoA/ROCK通路激活,加重脑出血后神经功能损伤,并削弱杜仲叶总黄酮的促神经功能修复作用(P<0.05)。结论 杜仲叶总黄酮可通过抑制RhoA/ROCK通路活化来改善脑出血大鼠出血症状,促进神经功能修复。
关键词:脑出血;ρA GTP结合蛋白质;rho相关激酶类;杜仲叶总黄酮;神经功能修复
中图分类号:R285.5文献标志码:ADOI:10.11958/20221033
Eucommia ulmoides leaves total flavonoids participate in the repair of neural function in rats with cerebral hemorrhage through RhoA/ROCK signaling pathway
ZHANG Xiufeng, LI Xiaofei, LIU Ming△, WANG Huijing
Department of Neurosurgery, the First Hospital Affiliated to Hebei North University, Zhangjiakou 075000, China
△Corresponding Author E-mail: lmltx2009@126.com
Abstract: Objective To explore the possible mechanism of eucommia ulmoides leaves total flavonoids promoting neurological repair in rats with cerebral hemorrhage from the Ras homolog gene family member A (RhoA)/Rho-associated coiled-coil protein kinase (ROCK) pathway. Methods SD male rats were used to establish cerebral hemorrhage model by the modified double injection method, and they were randomly divided into the sham operation group, the model group, the eucommia ulmoides leaves total flavonoids group, the RhoA inhibitor group, the RhoA agonist group, and the eucommia ulmoides leaves total flavonoids + RhoA agonist group, with 20 rats in each group. The eucommia ulmoides leaves total flavonoids group was intragaically treated with 200 mg/kg eucommia ulmoides leaves total flavonoids. The RhoA inhibitor group was intraperitoneally injected with 1 mg/kg RhoA inhibitor Y27632. The RhoA agonist group was intraperitoneally injected with 30 ?g/kg RhoA agonist U-46619, and the eucommia ulmoides leaves total flavonoids + RhoA agonist group was intraperitoneally injected with 200 mg/kg eucommia ulmoides leaves total flavonoids and 30 ?g/kg RhoA agonist U-46619. The model group and sham operation group were given 10 mL/kg normal saline once a day for 7 consecutive days. After the administration, the behavioral changes of rats were observed with the naked eye and the neurological deficit symptoms were assessed by the modified neurological severity score (mNSS). Brain tissue was taken and weighed, and the water content of the brain tissue was calculated according to the formula to evaluate the cerebral edema, then the brain tissue slices were prepared and the volume percentage of the cerebral hematoma was calculated according to the formula. Changes in the structure of nerve synapses in perihematoma tissue were observed by transmission electron microscope. Changes of neuronal apoptosis of perihematoma tissue were observed by TUNEL staining method. Changes in neuron skeleton of perihematoma tissue were detected by phalloidin staining. The expression levels of RhoA, ROCK, cytoskeleton protein (F-actin), filament protein (cofilin), phosphorylated cofilin (p-cofilin), neuron and synapse growth promoting proteins [nerve growth factor (NGF), neurotrophic factor 3 (NT3), postsynaptic dense protein-95 (PSD-95), synaptophysin (SYP)] in perihematoma tissue were detected by Western blot assay. Results Compared with the sham operation group, the neurological deficit scores, water content of brain tissue and the percentage of cerebral hematoma volume were increased in the model group, the neuronal apoptosis, skeleton structure damage, and changes in the structure of nerve synapses in the surrounding tissue of the hematoma were severer, the activation of RhoA/ROCK pathway increased, and the expression of neuron and synapse growth promoting proteins decreased (P<0.05). Eucommia ulmoides leaves total flavonoids or RhoA inhibitor intervention treatment could inhibit changes in neuron skeleton structure mediated by RhoA/ROCK pathway activation, increase the expression of neuron and synapse growth promoting proteins, alleviate neuronal damage and apoptosis in surrounding tissues of the hematoma after cerebral hemorrhage, and promote nerve function repair (P<0.05). RhoA agonist could promote the activation of RhoA/ROCK pathway, aggravate the neurological damage after cerebral hemorrhage, and weaken the nerve function repairing effect of eucommia ulmoides leaves total flavonoids (P<0.05). Conclusion Eucommia ulmoides leaves total flavonoids can improve the symptoms of cerebral hemorrhage in rats and promote the nerve function repair by inhibiting the activation of RhoA/ROCK pathway.
Key words: cerebral hemorrhage; rhoA GTP-binding protein; rho-associated kinases; eucommia ulmoides leaves total flavonoids; nerve function repair
脑出血是由非外伤性脑血管破裂引起的出血,常导致神经系统继发性损伤,具有较高的致死率及致残率[1]。促进脑出血后神经元再生及修复,对促进脑出血患者神经功能恢复、降低致残发生率具有重要意义。Ras同源基因家族成员A(Ras homolog gene family member A,RhoA)及其效应分子,如Rho相关卷曲螺旋蛋白激酶(Rho-associated coiled-coil protein kinase,ROCK)活化后可影响细胞骨架重排,导致神经生长锥塌陷进而阻断神经再生及重塑[2]。已有研究发现,脑出血后RhoA/ROCK信号通路处于活化状态[3],提示干预RhoA/ROCK信号通路活化可能是缓解脑出血后神经元损伤、促进神经功能恢复的潜在治疗机制。杜仲叶总黄酮是从杜仲中提取的一种生物活性成分。有研究显示杜仲雄花能通过抑制氧化应激减轻小鼠脑损伤[4]。但目前鲜有杜仲叶总黄酮在脑出血方面作用的研究。本研究拟通过建立脑出血大鼠模型,探讨杜仲叶总黄酮通过RhoA/Rock通路促进脑出血神经功能修复的机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 125只SD雄性大鼠购自郑州市惠济区华兴实验动物养殖场[动物生产许可证号:SCXK(豫)2019-0023],SPF级,8周龄,体质量180~200 g,分笼饲养,温度23~25.5 ℃,湿度55%~60%,光照条件设定为明暗各12 h循环交替,保持通风。本研究经医院伦理委员会批准(伦理号:LSD2021第041号)。
1.1.2 主要试剂与仪器 杜仲叶总黄酮(原料药,纯度98%,货号ZLS309-24-3)购自湖南天下康生物科技有限公司;RhoA抑制剂Y27632(货号B6693)购自北京康瑞纳生物科技有限公司;RhoA激动剂U-46619(货号ajci10652)购自武汉安捷凯生物医药科技有限公司。TUNEL染色试剂盒(货号CA2915)、鬼笔环肽染色液(货号CA1317)、DAB显色液(货号CA6307)均购自上海吉至生化科技有限公司;兔源微管相关蛋白2(MAP2,货号ab254264)、RhoA(货号ab187027)、ROCK(货号ab125025)、细胞骨架蛋白(F-actin,货号ab15135)、丝切蛋白(cofilin,货号ab50127)、磷酸化cofilin(p-cofilin,货号ab50129)、突触素(SYP,货号ab41125)、突触后致密蛋白-95(PSD-95,货号ab49503)、神经营养因子3(NT3,货号ab13274)、神经生长因子(NGF,货号ab80273)、β-肌动蛋白(β-actin,货号ab106497)一抗、羊抗兔免疫球蛋白G(IgG)二抗(货号ab112548)均购自英国Abcam公司。电子显微镜(型号SIGMA 500)、光学显微镜(型号SIGMA 1700)均购自昆山友硕新材料有限公司;化学发光仪(型号BHP9504)购自先锋科技(香港)股份有限公司。
1.2 方法
1.2.1 造模、分组及给药 取105只SD大鼠,参照文献[5]的方法制备脑出血大鼠模型。腹腔注射2 mL/kg戊巴比妥钠麻醉大鼠后,暴露颅骨前囟及冠状缝,用改良二次注血法,于右侧尾状核部位注入自体静脉血50 μL(鼠尾静脉取血50 μL):将注射器固定于脑立体定位仪上,进针至尾状核,先在2 min内注入20 μL血,留针7 min,继续缓慢注入30 μL血(4 min内完成),留针10 min,然后缓慢退出注射器。缝合切口后2 h,用Zea-longa评分法[6]对大鼠神经功能缺损症状进行评分,评分为1~3分,视为造模成功(共成功100只,有3只开颅后死亡,有2只麻醉时死亡)。按随机数字表法分为:模型组、杜仲叶总黄酮组、RhoA抑制剂组、RhoA激动剂组、杜仲叶总黄酮+RhoA激动剂组,每组20只。另取20只大鼠,于右侧尾状核部位注入等量生理盐水,设为假手术组。
杜仲叶总黄酮组参照文献[7]按200 mg/kg杜仲叶总黄酮灌胃给药(生理盐水稀释成20 g/L,10 mL/kg給药);RhoA抑制剂组参照文献[8]经腹腔注射1 mg/kg RhoA抑制剂Y27632;RhoA激动剂组参照文献[9]经腹腔注射30 μg/kg RhoA激动剂U-46619;杜仲叶总黄酮+RhoA激动剂组灌胃给予200 mg/kg的杜仲叶总黄酮同时,经腹腔注射30 μg/kg U-46619;模型组及假手术组灌胃给予10 mL/kg生理盐水。各组连续给药7 d,1次/d。
1.2.2 大鼠神经功能缺损评分 末次给药结束后,观察大鼠运动及精神状况,并参照文献[10]采用改良神经功能缺损评分(mNSS)对大鼠神经功能缺损症状进行评估。评分项目包括提尾试验0~3分,行走试验0~3分、感觉试验0~2分、平衡木试验0~6分、反射丧失和不正常运动0~4分,总分以18分计,评分越高预示神经功能缺损越严重。
1.2.3 脑组织含水量、脑血肿体积百分比检测 各组随机取6只大鼠,麻醉处死后取脑组织,滤纸吸干脑组织表面液体后精密称质量(湿质量),100 ℃烘干至恒重(干质量)。根据公式计算脑组织含水量:脑组织含水量=(湿质量-干质量)/湿质量×100%,以此评价脑水肿严重程度。
另外随机取6只大鼠,麻醉处死,取完整脑组织,测量完整脑组织体积,之后切成厚度为10 μm的连续冠状切片,用Image Pro Plus软件计算每张切片的脑血肿面积,根据公式:脑血肿体积=每张切片脑血肿面积×切片厚度(10 μm)×切片数,测得脑血肿体积,并计算脑血肿体积百分比。脑血肿体积百分比=脑血肿体积/完整脑组织体积×100%。
1.2.4 透射电镜观察血肿周围组织神经突触结构变化 麻醉处死各组剩余8只大鼠后,剥离完整脑组织,剪取血肿周围约1 mm×1 mm×1 mm组织块,送入电镜室处理后,于5 000倍电镜下观察神经突触结构变化。
1.2.5 TUNEL染色法观察血肿周围组织神经元凋亡 取血肿周围约2 mm×2 mm×2 mm组织块2块,其中一块放入-80 ℃冰箱保存备用。另一块切成厚度20 μm的冰冻切片,取部分切片,进行TUNEL染色后,于光镜下观察神经元损伤及染色变化,每张切片随机读取5个视野,用Image Pro Plus 6.0软件计算染色为棕黄色的凋亡细胞数目,计算神经元凋亡率。神经元凋亡率=凋亡神经元/总神经元×100%。
1.2.6 鬼笔环肽染色观察血肿周围组织神经元骨架变化 取相同部位血肿周围组织冰冻切片,复温、抗原修复、0.1%曲拉通透化后,滴加IgG标记的MAP2(1︰100)及羊抗兔IgG二抗溶液(1︰200)孵育来标记神经元,异硫氰酸荧光素标记的鬼笔环肽溶液标记F-actin。室温避光孵育后,激光共聚焦显微镜观察F-actin阳性染色情况。用Image Pro Plus 6.0计算每视野下单位面积内F-actin阳性染色的平均光密度值。
1.2.7 蛋白免疫印迹法检测血肿周围组织RhoA/ROCK通路相关蛋白和促神经元及突触生长相关蛋白表达 取冰冻血肿周围组织,4 ℃解冻后,机械粉碎及匀浆处理后提取匀浆液中蛋白。BCA法测浓度后,取40 μg蛋白行电泳及转膜反应,4 ℃滴加兔源RhoA(1︰200)、ROCK(1︰200)、F-actin(1︰200)、p-cofilin(1︰200)、cofilin(1︰200)、SYP(1︰400)、PSD-95(1︰400)、NT3(1︰400)、NGF(1︰400)及β-actin(1︰800)一抗孵育过夜,滴加羊抗兔IgG二抗(1︰1 300)孵育1.5 h。添加化学发光剂显色,化学发光仪拍照。Image J软件分析蛋白条带的相对灰度值。
1.3 统计学方法 采用SPSS 25.0软件分析数据,计量资料以均数±标准差[([x] ±s)
]表示,多组间比较用单因素方差分析,进一步两两比较行SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠神经功能缺损评分比较 假手术组、模型组、杜仲叶总黄酮组、RhoA抑制剂组、RhoA激动剂组、杜仲叶总黄酮+RhoA激动剂组大鼠的神经功能缺损评分分别为0分、(10.17±1.03)分、(4.98±0.45)分、(5.04±0.51)分、(14.79±1.37)分、(10.09±0.97)分,除假手术组外的5组比较差异有统计学意义(n=20,F=391.139,P<0.01)。假手术组大鼠活动灵敏,饮食及精神状态正常;与假手术组相比,模型组大鼠精神萎靡,行动迟缓及跛行严重,神经功能缺损评分升高(P<0.05);与模型组相比,杜仲叶总黄酮组及RhoA抑制剂组大鼠行动迟缓、跛行缓解,神经功能缺损评分降低(P<0.05),RhoA激动剂组大鼠部分出现瘫痪现象,神经功能缺损评分进一步升高(P<0.05);与杜仲叶总黄酮组相比,杜仲叶总黄酮+RhoA激动剂组大鼠神经功能缺损评分升高(P<0.05);与RhoA激动剂组相比,杜仲叶总黄酮+RhoA激动剂组大鼠神经功能缺损评分降低(P<0.05)。
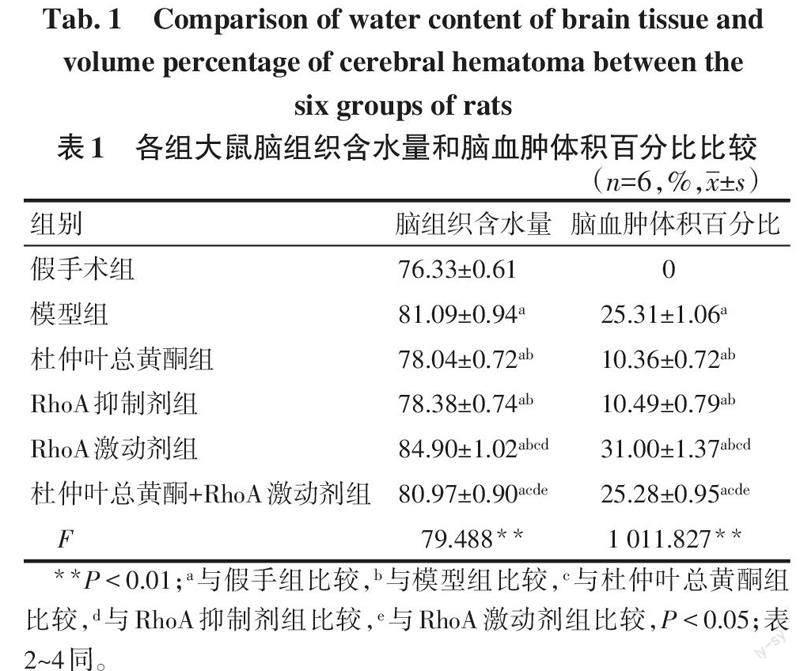
2.2 各组大鼠脑组织含水量、脑血肿体积百分比比较 与假手术组相比,模型组大鼠脑组织含水量、脑血肿体积百分比升高(P<0.05);与模型组相比,杜仲叶总黄酮组及RhoA抑制剂组大鼠脑组织含水量、脑血肿体积百分比降低(P<0.05),RhoA激动剂组大鼠脑组织含水量、脑血肿体积百分比进一步升高(P<0.05);与杜仲叶总黄酮组相比,杜仲叶总黄酮+RhoA激动剂组大鼠脑组织含水量、脑血肿体积百分比升高(P<0.05);与RhoA激动剂组相比,杜仲叶总黄酮+RhoA激动剂组大鼠脑组织含水量、脑血肿体积百分比降低(P<0.05),见表1。
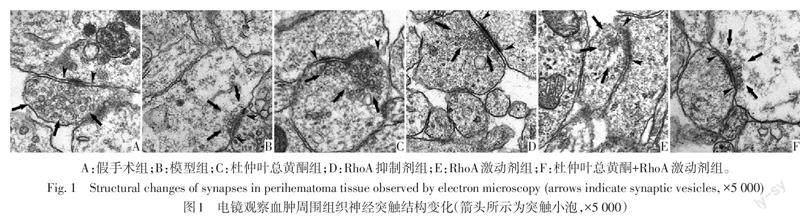
2.3 各组大鼠血肿周围组织神经突触结构损伤比较 假手术组大鼠突触结构清晰,突触小泡大小均匀,囊泡致密;模型组大鼠突触结构轮廓不清,突触小泡变形、破裂或融合明显;与模型组相比,杜仲叶总黄酮组及RhoA抑制剂组大鼠可见部分完整突触小泡,且小泡变形、破裂或融合等结构损伤较轻,RhoA激动剂组大鼠突触结构损伤进一步加重;杜仲叶总黄酮+RhoA激动剂组大鼠突触结构损伤较杜仲叶总黄酮组加重,见图1。
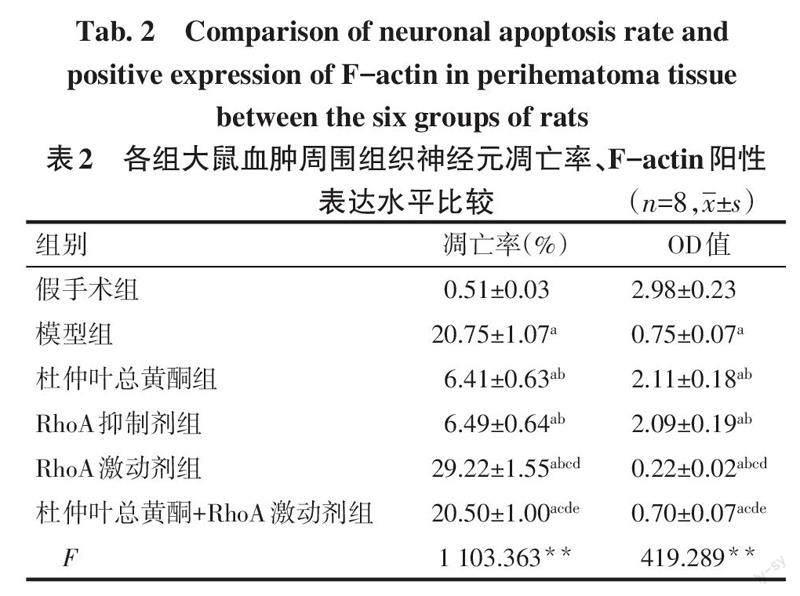
2.4 各组大鼠血肿周围组织神经元凋亡及骨架损伤比较 假手术组大鼠神经元染色均匀,仅有少量染成棕黄色的凋亡细胞,F-actin分布在整个神经元中;与假手术组相比,模型组可见黄棕色凋亡細胞染色加深,F-actin在神经元中分布减少,细胞形态及大小也发生变化,神经元凋亡率升高,F-actin阳性表达降低(P<0.05);与模型组相比,杜仲叶总黄酮组及RhoA抑制剂组大鼠神经元凋亡率降低,F-actin阳性表达升高,RhoA激动剂组大鼠神经元凋亡率升高,F-actin阳性表达降低(P<0.05);与杜仲叶总黄酮组相比,杜仲叶总黄酮+RhoA激动剂组大鼠神经元凋亡率升高,F-actin阳性表达降低(P<0.05);与RhoA激动剂组相比,杜仲叶总黄酮+RhoA激动剂组大鼠神经元凋亡率降低,F-actin阳性表达升高(P<0.05),见表2、图2。
2.5 各组大鼠血肿周围组织RhoA/ROCK通路蛋白表达比较 与假手术组相比,模型组大鼠血肿周围组织RhoA、ROCK蛋白表达升高,F-actin、p-cofilin/cofilin蛋白表达降低(P<0.05);与模型组相比,杜仲叶总黄酮组及RhoA抑制剂组大鼠血肿周围组织RhoA、ROCK蛋白表达降低,F-actin、p-cofilin/cofilin蛋白表达升高,RhoA激动剂组大鼠血肿周围组织RhoA、ROCK蛋白表达升高,F-actin、p-cofilin/cofilin蛋白表达降低(P<0.05);与杜仲叶总黄酮组相比,杜仲叶总黄酮+RhoA激动剂组大鼠血肿周围组织RhoA、ROCK蛋白表达升高,F-actin、p-cofilin/cofilin蛋白表达降低(P<0.05);与RhoA激动剂组相比,杜仲叶总黄酮+RhoA激动剂组大鼠血肿周围组织RhoA、ROCK蛋白表达降低,F-actin、p-cofilin/cofilin蛋白表达升高(P<0.05),见图3、表3。
2.6 各组大鼠血肿周围组织促神经元及突触生长相关蛋白表达比较 与假手术组相比,模型组大鼠血肿周围组织NGF、NT3、PSD-95、SYP蛋白表达降低(P<0.05);与模型组相比,杜仲叶总黄酮组及RhoA抑制剂组大鼠血肿周围组织NGF、NT3、PSD-95、SYP蛋白表达升高,RhoA激动剂组大鼠血肿周围组织NGF、NT3、PSD-95、SYP蛋白表达进一步降低(P<0.05);与杜仲叶总黄酮组相比,杜仲叶总黄酮+RhoA激动剂组大鼠血肿周围组织NGF、NT3、PSD-95、SYP蛋白表达降低(P<0.05);与RhoA激动剂组相比,杜仲叶总黄酮+RhoA激动剂组大鼠血肿周围组织NGF、NT3、PSD-95、SYP蛋白表达升高(P<0.05),见图4、表4。
3 讨论
3.1 脑出血模型大鼠构建成功 脑出血后,血液中的细胞毒性成分可导致神经元损伤及凋亡,另外脑出血后形成的血肿压迫周围组织血管,也会导致脑水肿及神经系统损伤[11]。本研究用改良的二次注血法建立脑出血模型,发现大鼠出现行动迟缓、运动困难等神经功能缺损症状,且神经功能缺损评分、脑组织含水量、脑血肿体积百分比均显著升高,血肿周围组织神经元凋亡、神经突触变形、破裂及融合等损伤严重,提示造模成功。
3.2 杜仲叶总黄酮促进脑出血大鼠的神经功能修复 近年来研究发现,天然总黄酮类成分对各种脑损伤后神经功能的修复有促进作用[12-13]。杜仲叶中总黄酮为天然黄酮类成分,具有降压、降脂及抗氧化等多种药理作用[14]。已有研究发现,其对铅中毒所致的神经损伤有改善作用[15]。另有文献显示杜仲提取物可通过抑制炎性因子分泌改善大鼠脑缺血再灌注损伤[16],说明其对脑部疾病有一定的治疗作用。而且,包含杜仲在内的益气复健汤对脑出血患者有明显的治疗效果[17]。本研究发现,杜仲叶总黄酮干预治疗脑出血大鼠后,大鼠神经功能缺损评分降低,血肿周围组织神经元凋亡、神经突触变性、破裂及融合等结构损伤现象明显缓解,表明杜仲叶总黄酮对脑出血后神经功能修复有一定的促进作用。本研究对其促神经功能修复的具体机制继续进行探究。
3.3 RhoA/ROCK通路介导杜仲叶总黄酮的促脑出血后神经功能修复作用 RhoA/ROCK通路是参与神经元再生、神经突触重塑,介导神经功能修复的关键通路之一[18-19]。Li等[20]研究證实,阻断RhoA/ROCK通路活化,可减轻神经树突、轴突的生长抑制作用,促进神经再生及轴突发芽,促进神经的内在修复,改善脑卒中模型大鼠运动功能的缺损。本研究发现脑出血模型大鼠RhoA/ROCK通路处于活化状态,其表现为血肿周围组织RhoA、ROCK蛋白表达升高,与张昆仑等[21]的研究一致。本研究还发现,阻断脑出血大鼠RhoA/ROCK通路活化,可促进神经功能修复,改善出血症状,反之可加重脑出血症状,不利于神经元功能恢复。而杜仲叶总黄酮干预后,大鼠血肿周围组织中RhoA/ROCK通路处于抑制状态,其脑出血症状及神经功能损伤得以改善,而在杜仲叶总黄酮干预的基础上激活RhoA/ROCK通路后,其改善脑出血症状、促进神经功能恢复作用被显著削弱,提示杜仲叶总黄酮可能通过抑制RhoA/ROCK通路活化来改善脑出血模型大鼠的脑出血症状、促进神经功能恢复。
大量研究证实,RhoA在神经元发育、迁移及可塑性中发挥重要作用,RhoA不仅可激活效应分子ROCK,引起细胞骨架解聚成分cofilin活化并切割F-actin,导致细胞骨架解聚破坏及重排、肌丝收缩,造成神经元及突触结构改变、生长锥塌陷、轴突再生困难,还能够影响神经元及突触生长、发育相关的因子,如NGF、NT3、PSD-95及SYP等表达来抑制神经元及突触的再生修复[22-23]。本研究显示,杜仲叶总黄酮可显著提高脑出血大鼠血肿周围组织NGF、NT3、PSD-95及SYP蛋白表达,激活RhoA/ROCK通路可使杜仲叶总黄酮对NGF、NT3、PSD-95及SYP蛋白表达的促进作用得以缓解,提示杜仲叶总黄酮可能通过抑制RhoA/ROCK通路增加促神经元及突触生长相关蛋白表达,进而减轻脑出血症状,加速神经功能恢复。
综上所述,杜仲叶总黄酮可抑制RhoA/ROCK通路活化,从而改善脑出血大鼠的出血症状,促进神经功能修复。这为杜仲叶总黄酮在脑损伤领域的开发应用提供了一定参考,但信号通路对神经功能修复的调控是一个极其复杂的过程,可能需要机体内多条细胞信号通路来协同调节,杜仲叶总黄酮促进神经功能修复的其他机制还有待深入探究。
参考文献
[1] APOSTOLAKI-HANSSON T,ULLBERG T,PIHLSG?RD M,et al. Prognosis of intracerebral hemorrhage related to antithrombotic use:An observational study from the swedish stroke register (riksstroke)[J]. Stroke,2021,52(3):966-974. doi:10.1161/STROKEAHA. 120.030930.
[2] 陈琪,贾瑞丹,陈霏霏,等. Rho/ROCK信号通路与神经可塑性[J]. 生命的化学,2019,39(1):159-164. CHEN Q,JIA R D,CHEN F F,et al. Rho/ROCK signaling pathway and neural plasticity[J]. Chemistry of Life,2019,39(1):159-164. doi:10.13488/j.smhx.20181304.
[3] 周子薇,郑晓梅,先耀,等. 虾青素对脑出血大鼠的神经保护作用及机制[J]. 山东医药,2020,60(26):6-9. ZHOU Z W,ZHENG X M,XIAN Y,et al. Neuroprotective effect and mechanism of astaxanthin on rats with intracerebral hemorrhage[J]. Shandong Med,2020,60(26):6-9. doi:10.3969/j.issn.1002-266X.2020.26.002.
[4] DING Y,WU Y,CHEN J,et al. Protective effect of Eucommia ulmoides Oliver male flowers on ethanol-induced DNA damage in mouse cerebellum and cerebral cortex[J]. Food Sci Nutr,2022,10(8):2794-2803. doi:10.1002/fsn3.2882.
[5] 刘茂春,刘亮,普娟,等. ApoJ基因修饰的骨髓间充质干细胞移植治疗大鼠脑出血的作用机制[J]. 医学研究生学报,2018,31(5):470-475. LIU M C,LIU L,PU J,et al. Therapeutic effect of transplantation of ApoJ-modified bone marrow mesenchymal stem cells on intracere-bral hemorrhage in rats and its action mechanism[J]. Journal of Medical Postgraduates,2018,31(5):470-475. doi:10.16571/j.cnki.1008-8199.2018.05.005.
[6] 卢小叶,吕倩忆,李棋龙,等. Zea-longa评分与改良Garcia评分应用于针刺治疗CIRI大鼠神经功能缺损评估的研究[J]. 湖南中医药大学学报,2021,41(9):1356-1360. LU X Y,LYU Q Y,LI Q L,et al. Evaluation research of Zea-longa score and modified Garcia score applied to acupuncture treatment of neurological deficits in CIRI rats[J]. Journal of Hunan University of Chinese Medicine,2021,41(9):1356-1360. doi:10.3969/j.issn.1674-070X.2021.09.008.
[7] 田硕,白明,苗明三. 杜仲叶总黄酮对围绝经期大鼠模型的影响[J]. 中华中医药杂志,2018,33(12):5386-5391. TIAN S,BAI M,MIAO M S. Effects of total flavonoids of Eucommia ulmoides leaf on the rat model of perimenopause[J]. China Journal of Traditional Chinese Medicine and Pharmacy,2018,33(12):5386-5391.
[8] 李军华,张昆,刘雅芳,等. RhoA抑制剂Y27632对丙泊酚致新生大鼠海马神经细胞凋亡的影响[J]. 中华行为医学与脑科学杂志,2018,27(2):139-144. LI J H,ZHANG K,LIU Y F,et al. Effect of RhoA inhibitor Y27632 on propofol-induced apoptosis of hippocampal neurons in neonatal rats[J]. Chin J Behav Med & Brain Sci,2018,27(2):139-144. doi:10.3760/cma.j.issn.1674-6554.2018.02.008.
[9] 李濤,徐竞,杨光明,等. 调控RhoA/Rac平衡对失血性休克大鼠血管双相反应性的影响[J]. 第三军医大学学报,2008,30(21):1976-1979. LI T,XU J,YANG G M,et al. Effects of balancing RhoA/Rac on biphasic vascular reactivity after hemorrhagic shock in rats[J]. Acta Academiae Medicinae Militaris Tertiae,2008,30(21):1976-1979. doi:10.3321/j.issn:1000-5404.2008.21.003.
[10] LI L,GUO Y,ZHAO Y,et al. Effect of astragaloside IV on cognitive dysfunction in rats with cerebrally infarcted via TGF-β/Smad signaling pathway[J]. Cell Mol Biol (Noisy-le-grand),2020,66(2):87-92. doi:10.14715/cmb/2020.66.2.14.
[11] 陈斌,成宜军,陈正鸿,等. 脑出血后神经细胞死亡机制的研究进展[J]. 中国脑血管病杂志,2018,15(3):153-156. CHEN B,CHENG Y J,CHEN Z H,et al. Mechanism of neuronal cell death after cerebral hemorrhage[J]. Chin J Cerebrovasc Dis,2018,15(3):153-156. doi:10.3969/j.issn.1672-5921.2018.03.009.
[12] 魏珍珍,方晓艳,王灿,等. 败酱总黄酮对局灶性脑缺血再灌注大鼠的神经保护作用及炎症因子的影响[J]. 中药新药与临床药理,2019,30(4):396-402. WEI Z Z,FANG X Y,WANG C,et al. Effects of total flavonoids from patriniae on neuroprotective effect and inflammatory factors of focal cerebral ischemia reperfusion injured rats[J]. Traditional Chinese Drug Research & Clinical Pharmacology,2019,30(4):396-402. doi:10.19378/j.issn.1003-9783.2019.04.002.
[13] 李艳,宋亚刚,苗明三,等. 月季花总黄酮对局灶性脑缺血再灌注模型大鼠的影响[J]. 中国实验方剂学杂志,2019,25(12):64-70. LI Y,SONG Y G,MIAO M S,et al. Effect of rosae chinensis flos total flavones on focal cerebral ischemia-reperfusion in rats[J]. Chinese Journal of Experimental Traditional Medical Formulae,2019,25(12):64-70. doi:10.13422/j.cnki.syfjx.20190804.
[14] PENG M F,TIAN S,SONG Y G,et al. Effects of total flavonoids from Eucommia ulmoides Oliv. leaves on polycystic ovary syndrome with insulin resistance model rats induced by letrozole combined with a high-fat diet[J]. J Ethnopharmacol,2021,273:113947. doi:10.1016/j.jep.2021.113947.
[15] 劉梦姣,袁带秀,聂红,等. 杜仲总黄酮对铅中毒小鼠学习记忆能力的影响[J]. 广州化工,2016,44(1):75-77. LIU M J,YUAN D X,NIE H,et al. Effects of total flavonoids of eucommia ulmoides on learning memory impairment induced by lead in mice[J]. Guangzhou Chemical Industry,2016,44(1):75-77.
[16] 邓江,王义为,张洁,等. 杜仲提取物对大鼠脑缺血再灌注损伤的保护作用及其机制研究[J]. 药物评价研究,2014,37(6):498-501. DENG J,WANG Y W,ZHANG J,et al. Inhibition of Eucommiae Cortex extracts on iNOS,TNF-α,and IL-1β mRNA expression in cerebral ischemia-reperfusion injury of rats[J]. Drug Evaluation Research,2014,37(6):498-501. doi:10.7501/j.issn.1674-6376.2014.06.004.
[17] 郭新侠. 中西医结合治疗脑出血偏瘫临床研究[J]. 中医学报,2017,32(8):1540-1542. GUO X X. Clinical study on treatment of cerebral hemorrhage patients with hemiplegia by combination of chinese and western medicine[J]. Acta Chinese Medicine,2017,32(8):1540-1542. doi:10.16368/j.issn.1674-8999.2017.08.405.
[18] CHEN S,WANG H,XU H,et al. Electroacupuncture promotes axonal regrowth by attenuating the myelin-associated inhibitors-induced RhoA/ROCK pathway in cerebral ischemia/reperfusion rats[J]. Brain Res,2020,1748:147075. doi:10.1016/j.brainres.2020.147075.
[19] KIM M L,SUNG K R,KWON J,et al. Statins suppress TGF-β2-mediated MMP-2 and MMP-9 expression and activation through RhoA/ROCK inhibition in astrocytes of the human optic nerve head[J]. Invest Ophthalmol Vis Sci,2020,61(5):29. doi:10.1167/iovs.61.5.29.
[20] LI B,XU Y,QUAN Y,et al. Inhibition of RhoA/ROCK pathway in the early stage of hypoxia ameliorates depression in mice via protecting myelin sheath[J]. ACS Chem Neurosci,2020,11(17):2705-2716. doi:10.1021/acschemneuro.0c00352.
[21] 张昆仑,李雪莹,赵迎春,等. 脑出血大鼠脑组织ROCK2与脑水肿、炎性损伤及细胞凋亡的关系[J]. 脑与神经疾病杂志,2019,27(6):375-380. ZHANG K L,LI X Y,ZHAO Y C,et al. Relationship between ROCK2 and cerebral edema,inflammatory injury and apoptosis in rats after intracerebral hemorrhage[J]. Journal of Brain and Nervous Diseases,2019,27(6):375-380.
[22] LU W,CHEN Z,WEN J. RhoA/ROCK signaling pathway and astrocytes in ischemic stroke[J]. Metab Brain Dis,2021,36(6):1101-1108. doi:10.1007/s11011-021-00709-4.
[23] JOSHI A R,MUKE I,BOBYLEV I,et al. ROCK inhibition improves axonal regeneration in a preclinical model of amyotrophic lateral sclerosis[J]. J Comp Neurol,2019,527(14):2334-2340. doi:10.1002/cne.24679.
(2022-07-12收稿 2022-09-25修回)
(本文编辑 李鹏)
