基于网络药理学-分子对接的藤椒精油抗解淀粉芽孢杆菌生物被膜机理
2023-11-06张莹凡吕昕昱肖瑀晗申光辉
张莹凡, 吕昕昱, 肖瑀晗, 杨 露, 申光辉
(四川农业大学 食品学院/农业农村部农产品加工与营养健康重点实验室(部省共建), 四川 雅安 625014)
生物被膜是细菌菌体被自分泌的胞外多糖、蛋白质、核酸等基质大分子聚合物包裹构成的高度结构化的细菌群体[1],难以彻底杀灭和清除,给食品安全生产和流通带来严重威胁[2]。因此,开发高效安全的生物被膜控制技术,对保障食品安全生产和品质稳定具有重要意义。
植物精油作为天然来源的抗菌分子资源,在食品抗菌保鲜技术领域备受关注[3-4]。藤椒是花椒属竹叶花椒(ZanthoxylumarmatumDC.)的果实,富含芳樟醇、柠檬烯等组分。藤椒精油具有良好的抗菌抗生物被膜活性。Manoharan等[5]研究发现,芳樟醇可抑制白色念珠菌生物被膜的形成;Park等[6]发现,桧烯通过抑制致龋毒力因子来抑制变形链球菌的生物被膜及其细胞黏附能力;Subramenium等[7]证实了柠檬烯通过结合链球菌表面相关毒力因子来抑制生物被膜的形成。解淀粉芽孢杆菌(Bacillusamyloliquefaciens)DY1a是非发酵豆制品的优势腐败菌,具有抗逆性强[8]、代谢产生有毒生物胺[9]、生物被膜形成速度快[10]等特点,给生产设备清洗消毒和产品贮藏安全带来了严重威胁。本团队前期研究表明,藤椒精油对解淀粉芽孢杆菌DY1a生物被膜的形成具有良好的抑制效果[11],但由于藤椒精油的组分复杂性及细菌生物被膜调控通路的多样性,目前对藤椒精油抗细菌生物被膜的分子作用机理了解不够深入。
分子对接是采用计算机辅助分子模拟技术,对活性小分子与靶点分子之间的作用模式、结合位点和影响因素等进行预测的虚拟研究手段[12]。网络药理学是以系统生物学等多学科为理论基础,利用互作网络和可视化等技术揭示生命活动与活性药物分子之间互作机理的学科[13-14]。网络药理学结合分子对接技术在药物靶点发现、活性物质筛选及功能食品分子挖掘等领域凸显出良好的方法学优势[15-16]。
本研究拟借助网络药理学和分子对接技术,揭示藤椒精油抑制解淀粉芽孢杆菌生物被膜的关键潜在活性分子及其胞内作用靶点,并验证关键小分子的抗生物被膜活性,以解析藤椒精油抗细菌生物被膜的作用机制。
1 材料与方法
1.1 材料与试剂
解淀粉芽孢杆菌DY1a,四川农业大学食品学院。氯化钠、甲醇、结晶紫、草酸铵、无水乙醇、冰乙酸、吐温-80,均为分析纯,成都市科隆化学品有限公司;金合欢醇乙酸酯(色谱纯)、反式金合欢醇(色谱纯),上海迈瑞尔生化科技有限公司。肉汤培养基(LB)、胰蛋白胨大豆肉汤(TSB)培养基,青岛海博生物技术有限公司。
1.2 仪器与设备
ZWY-211B型恒温摇床,上海智城分析仪器制造有限公司;QL-901型涡旋仪,江苏海门市其林贝尔仪器制造有限公司;ST16R型高速冷冻离心机、Varioskan Flash型荧光酶标仪,美国赛默飞世尔科技公司;SW-CJ-2FD型超净工作台,苏州安泰空气技术有限公司。
1.3 实验方法
1.3.1藤椒精油主要组分的收集整理
以“ZanthoxylumarmatumDC. essential oil”和“藤椒精油”为主要关键词检索中外相关研究文献,整理收集后得到藤椒精油小分子相关信息,通过Pubchem数据库(https:∥pubchem.ncbi.nlm.nih.gov/)下载小分子sdf格式文件,构建藤椒精油主要组分数据库。
1.3.2潜在靶点的筛选与小分子-潜在靶点互作网络的构建
将藤椒精油小分子sdf格式文件上传至PharmMapper反向对接服务器(http:∥www.lilab-ecust.cn/pharmmapper/)进行小分子-靶点分子对接,以标准化得分(normalized fit score)大于0.4为选择指标进行潜在作用靶点初筛,STITCH数据库(http:∥stitch.embl.de/)寻找靶点作补充。通过UniProt数据库(https:∥www.uniprot.org/)查找筛选结果的基因名(gene name)。通过产生物被膜菌株BacillusamyloliquefaciensL-17基因组(https:∥www.ncbi.nlm.nih.gov/nuccore/CP074391.1)[17]进一步查询筛选得到与解淀粉芽孢杆菌有关的靶点。
根据藤椒精油小分子与潜在靶点的关系制作网络(network)文件和类型(type)文件,将2个文件导入Cytoscape软件绘制PPI(蛋白相互作用)网络。
1.3.3KEGG和GO靶点通路分析
通过STRING数据库(https:∥string-db.org/)进行基因本体(gene ontology,GO)功能富集,分析藤椒精油小分子与靶点结合过程中可能影响的生物学过程(biological process,BP)、细胞组分(cell component,CC)和分子功能(molecular function,MF)。通过京都基因和基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)通路分析,获得藤椒精油小分子与靶点结合过程中的潜在信号通路。使用Chiplot在线可视化工具(https:∥www.chiplot.online/)绘制GO功能富集与KEGG通路分析气泡图。
1.3.4核心靶点的筛选
将潜在靶点导入STITCH (http:∥stitch.embl.de/)数据库,以置信度大于0.9为选择指标[16],得到潜在靶点分子相互作用的网络关联图,下载tsv格式文件导入Cytoscape 3.7.2软件,通过互作网络拓扑分析获得潜在靶点的节点度值、特征向量中心性、介数中心度和接近中心度的平均值,以大于各节点的平均值为标准获得核心靶点。
1.3.5藤椒精油小分子与核心靶点的分子对接
通过UniProt数据库获取核心靶点的一级结构序列信息,提交至SWISS-MODEL在线服务器(https:∥swissmodel.expasy.org/)进行靶点蛋白3D建模。以核心靶点为受体,藤椒精油小分子为配体,利用基于AutoDock Vina 软件的CB-DOCK2在线分子对接服务器(https:∥cadd.labshare.cn/cb-dock2/php/index.php)依次进行对接位口袋检测和盲对接,配体分子通过加氢和部分电荷处理,并由RDKit生成初始3D构象。受体蛋白质缺失的侧链原子和氢原子的添加,去除结晶水等操作均由在线服务器采用OpenBabel和MGL程序工具自动处理[18]。对接结合能以AutoDock Vina score函数[19]计算并表示,单位kJ/mol。采用Discovery Studio 2021对最佳对接复合物进行相互作用分析和可视化[20]。
1.3.6潜在小分子抗生物被膜活性的验证
1.3.6.1 培养基制备
TSBS培养基:A液为胰蛋白胨大豆肉汤(TSB)培养基(30.0 g/L),B液为豆浆粉(50.0 g/L)。将灭菌后的A、B液按体积比1∶1混合均匀。A液121 ℃灭菌15 min,B液115 ℃灭菌20 min。
1.3.6.2 细菌生物被膜的培养
将本课题组实验室保存的解淀粉芽孢杆菌DY1a[8]接种至LB培养基,37 ℃、160 r/min振荡培养24 h,4 ℃、4 000 r/min 离心10 min,弃去培养基,PBS缓冲液轻轻冲洗菌体沉淀3次,并调节菌悬液600 nm吸光度至0.10。根据小分子化合物与靶点的结合能力,综合考虑小分子化合物的可获得性,选择金合欢醇乙酸酯和反式法尼醇进行抗生物被膜活性验证。用体积分数0.20%的吐温-80进行乳化,分别加入到灭菌TSBS培养基[11],再接入制备好的菌悬液,使2种小分子化合物最终添加体积比分别为0.32、0.64、1.28 μL/mL,初始接菌量为106CFU/mL,同时以未添加精油组分培养体系为对照组,用涡旋仪混合均匀后分装至5 mL的灭菌小烧杯,用封口膜封口,37 ℃静置培养48 h,观察生物被膜形成情况并拍照。
1.3.6.3 生物被膜的定量检测
1.3.6.4 细菌运动能力测定
参考杨露等[10]的方法并略加修改。配制金合欢醇乙酸酯和反式法尼醇添加体积比分别为0.32、0.64、1.28 μL/mL的泳动、丛集TSB培养基,泳动培养基琼脂质量分数为0.475%,丛集培养基琼脂质量分数为0.600%,同时以未添加精油组分的TSB培养基为对照组。泳动实验:待泳动培养基凝固后,在培养基中心滴入5 μL 106CFU/mL的菌悬液,待菌液吸干,37 ℃培养24 h,测量泳动圈直径大小。丛集实验:待丛集培养基凝固后,用接种针挑取少量单菌落刺入培养基中心,37 ℃培养 24 h,测量泳动圈直径大小,并按式(1)计算藤椒精油小分子对细菌泳动或丛集运动的抑制率。
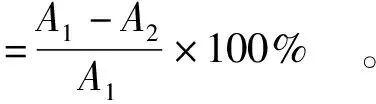
(1)
式(1)中,A1为对照组泳动或丛集圈面积;A2为处理组泳动或丛集圈面积。
1.4 数据处理
所得数据利用IBM SPSS 20.0软件进行显著性分析,P<0.05表示存在显著性差异。采用Cytoscape软件绘制互作网络,采用Chiplot在线可视化工具绘制富集分析图和分组对接结合能的2D热图,采用Origin Pro 2019软件绘制生物被膜定量实验结果。
2 结果与分析
2.1 藤椒精油主要组分
通过Web of Science和CNKI等国内外学术文献数据库检索整理,共收集到60种藤椒精油组分,见表1。
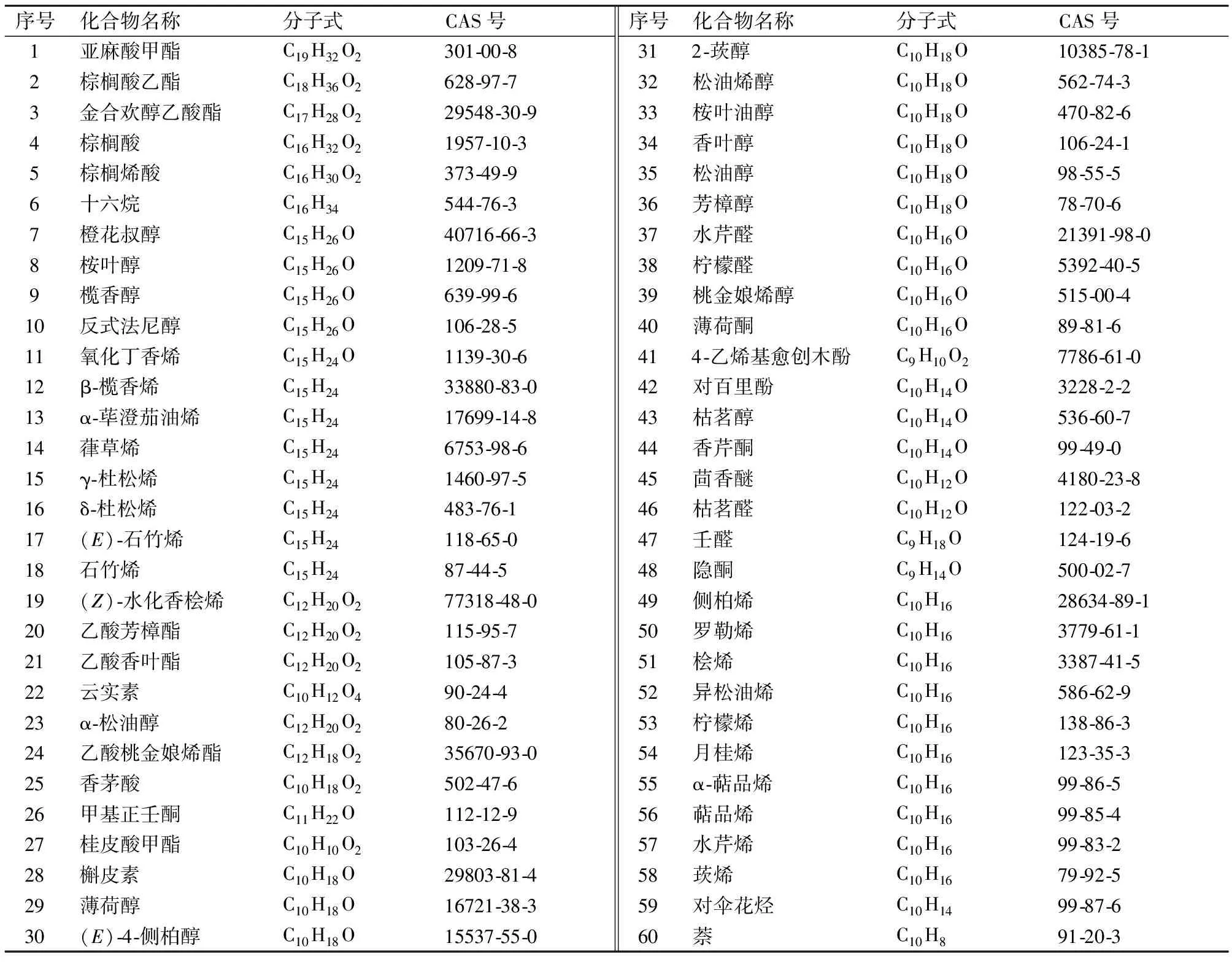
表1 藤椒精油主要化学组分
2.2 藤椒精油小分子的潜在靶点筛选
通过PharmMapper、L-17基因组信息的寻找和筛选,以标准化得分大于0.4为标准,共得到54种藤椒精油小分子对应的720个潜在靶点,去除重复得到133个靶点。用STITCH 数据库共筛选到18种藤椒精油小分子对应的56个靶点。合并整理2个数据库的靶点,使用Cytoscape软件进行数据可视化分析,获得藤椒精油小分子-潜在靶点互作网络(图1)。
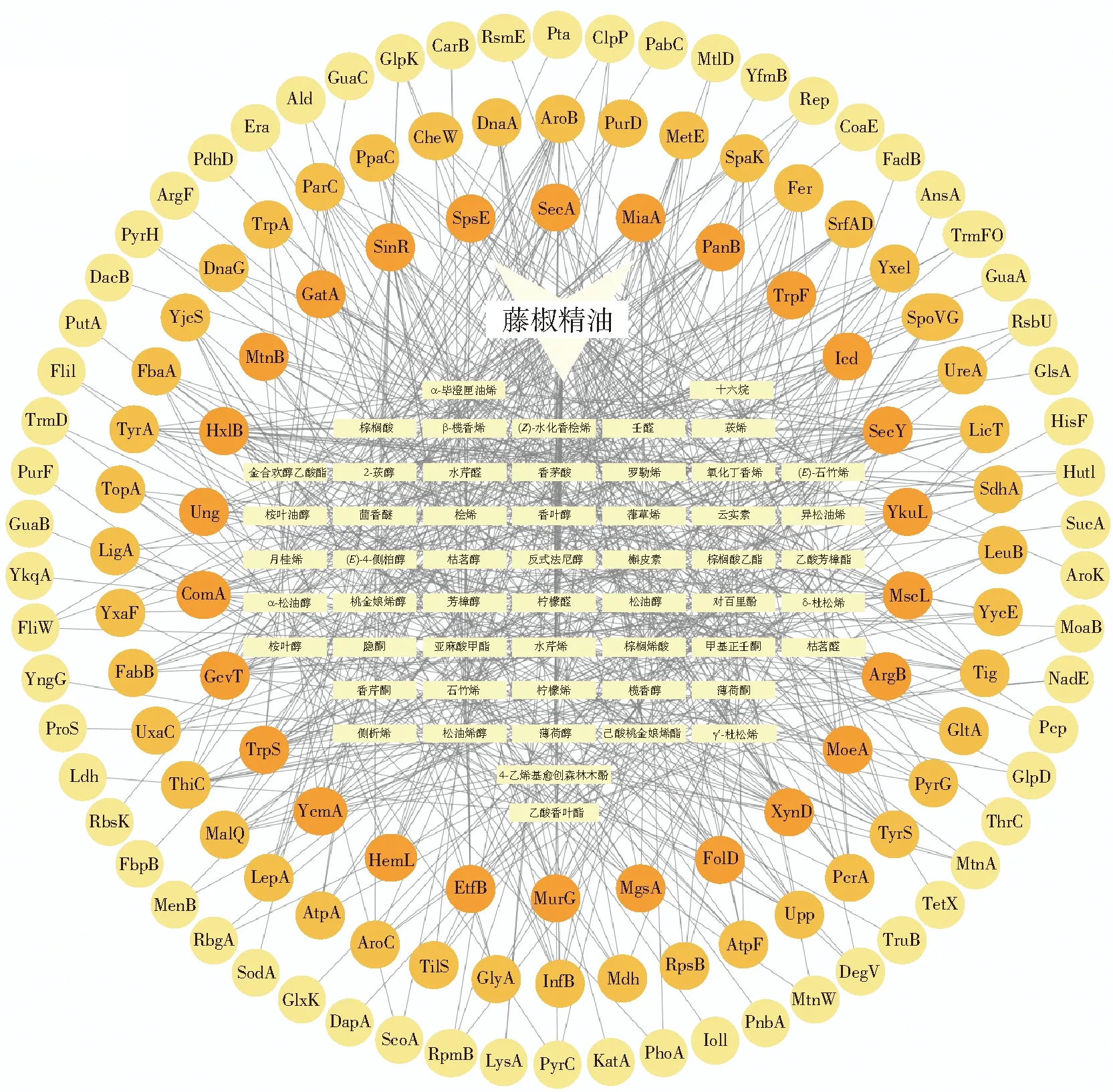
黄色矩形节点代表藤椒精油小分子;橙色圆形节点代表潜在靶点,颜色越深表示拓扑学参数值越大。图1 藤椒精油小分子-潜在靶点互作网络Fig.1 Interaction network of Zanthoxylum armatum DC. essential oil compounds-potential targets
藤椒精油60种化合物中有54种小分子与潜在靶点存在互作关系,且绝大部分精油小分子存在多个潜在靶点,表明藤椒精油小分子作用的多靶点性。
2.3 潜在靶点功能富集分析
藤椒精油组分的133个潜在抗生物被膜作用靶点的GO富集和KEGG代谢通路富集分析结果见图2。由图2(a)可知,GO富集分析共获得了17条GO二级条目,包含生物学过程、分子功能和细胞组分。藤椒精油小分子与相关潜在靶点的作用可能与细胞代谢过程(cellular metabolic process)、初级代谢过程(primary metabolic process)等生物学过程,离子结合(ion binding)、小分子结合(small molecule binding)等分子功能,及细胞内(intracellular)、细胞质(cytoplasm)等细胞组分有关。这些涉及生物代谢过程、分子结合功能及细胞组分构建的核心靶点,在藤椒精油调节细菌生物被膜发育和形成过程中起着重要作用。

气泡大小与富集的靶点基因数目成正比,气泡颜色由蓝变红代表富集的显著程度提高。图2 潜在靶点的GO和KEGG通路富集分析Fig.2 GO and KEGG pathway enrichment analysis of potential targets
进一步对解淀粉芽孢杆菌的133个潜在靶点进行KEGG代谢通路富集分析,得到排名前8的显著富集信号通路[图2(b)],表明藤椒精油小分子与相关潜在靶点的作用可能与次级代谢产物的生物合成(biosynthesis of secondary metabolites)、氨基酸的生物合成(biosynthesis of amino acids)、不同环境下的微生物代谢(microbial metabolism in diverse environments)等二级代谢通路有关。在三级代谢通路中,精油活性分子与相关潜在靶点的作用主要涉及丙氨酸、天冬氨酸和谷氨酸代谢(alanine, aspartate and glutamate metabolism),甘氨酸、丝氨酸和苏氨酸代谢(glycine, serine and threonine metabolism),及苯丙氨酸、酪氨酸和色氨酸合成(phenylalanine, tyrosine and tryptophan biosynthesis)等相关代谢通路。
2.4 藤椒精油小分子的核心靶点筛选
为获得藤椒精油组分中抗生物被膜的关键核心靶点,进一步通过STITCH数据库,以置信度大于0.9为标准,获得潜在靶点相互作用网络(图3)。图3中涉及节点数126、边数70、平均节点数1.11。根据网络的拓扑学筛选节点度值、特征向量中心性、介数中心度、接近中心度值大于平均数的核心靶点,分别为GuaA、GltA、PurF、GlyA、CarB、OdhA、PdhD、FolD,核心靶点拓扑参数见表2。利用表2绘制核心靶点的PPI互作网络,结果见图4。

图3 潜在靶点相互作用网络Fig.3 Interactions network of potential targets
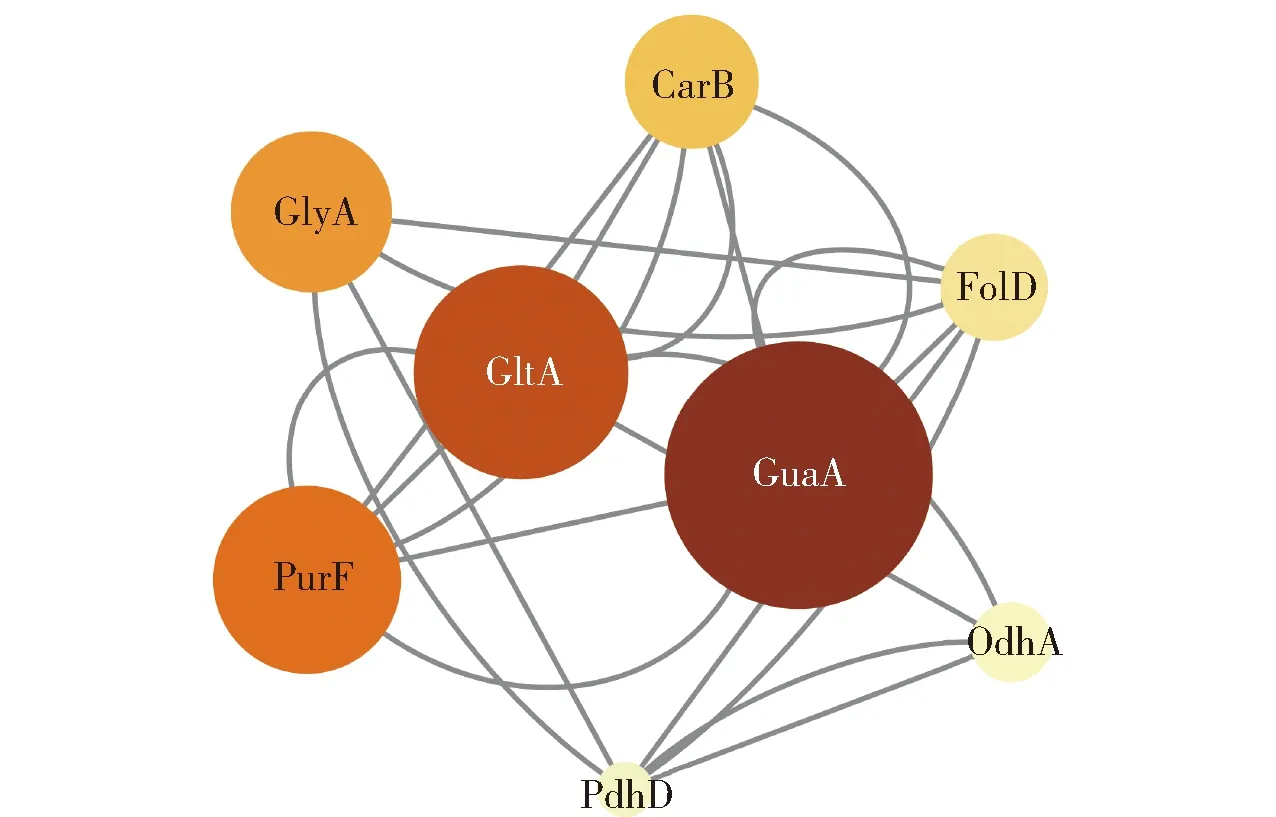
图4 生物被膜形成密切相关的核心靶点互作网络Fig.4 Interaction network of core targets closely associated with biofilm formation
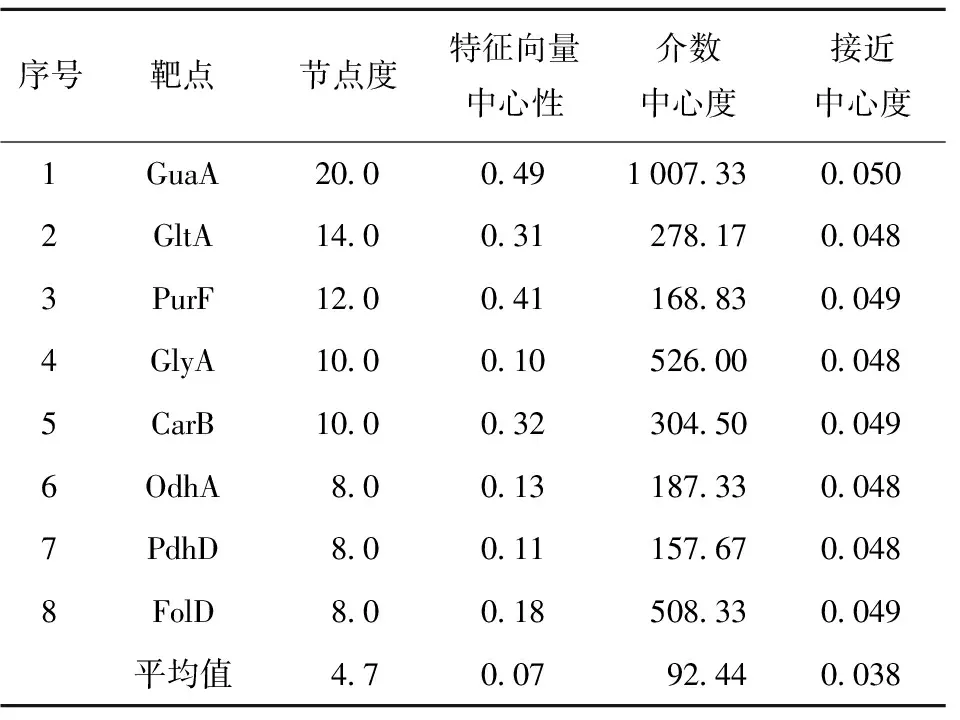
表2 核心靶点互作网络拓扑学参数
2.5 藤椒精油小分子与核心靶点分子对接分析
为验证网络药理学预测研究结果的可靠性,将8个核心靶点3D模型pdb文件及与核心靶点存在互作的21种藤椒精油活性分子的sdf文件,提交至CB-DOCK2在线服务器依次进行分子对接,对接结合能的2D热图见图5。由图5可知,大部分对接结合能均小于等于-20.93 kJ/mol,表明网络药理学分析结果可靠性较高[22]。其中桉叶醇与OdhA、CarB、PurF结合能分别为-28.88、-31.81、-31.81 kJ/mol,金合欢醇乙酸酯与OdhA、CarB、PurF结合能分别为-32.23、-29.72、-31.39 kJ/mol,反式法尼醇与OdhA、CarB、PurF结合能分别为-31.39、-29.72、-28.88 kJ/mol,表明桉叶醇、金合欢醇乙酸酯、反式法尼醇与靶点OdhA、CarB、PurF相互间结合能力较强,进一步证明这些靶点是藤椒精油发挥抗生物被膜活性的核心靶点。
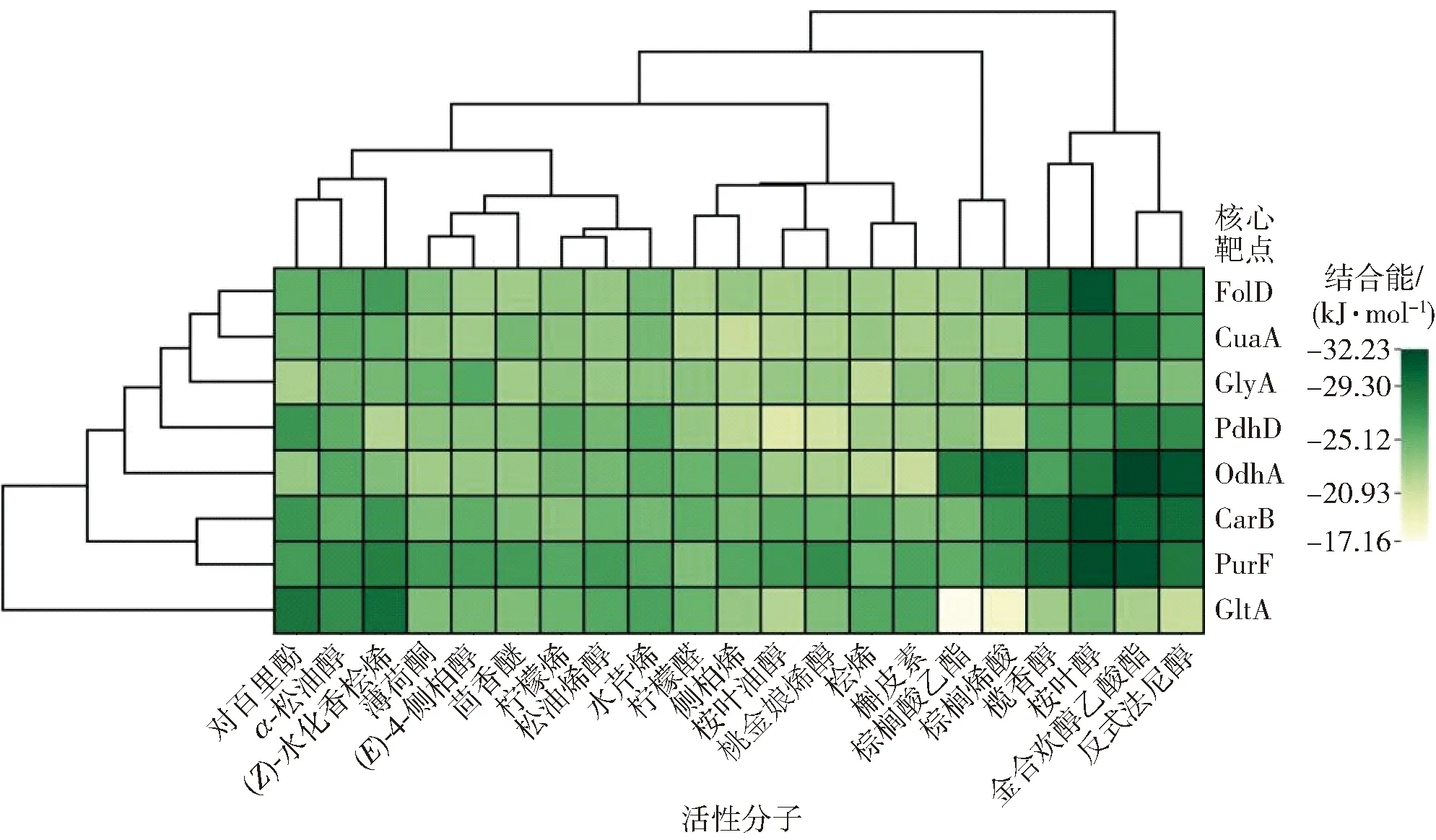
图5 藤椒精油活性分子与核心靶点分子对接结合能的2D热图Fig.5 2D Heatmap of molecular docking binding energy of Zanthoxylum armatum DC.essential oil compounds and core targets
为进一步分析精油活性分子与核心靶点的相互作用情况,选择藤椒精油活性分子与核心靶点结合较稳定的对接复合物,绘制分子对接相互作用图,部分藤椒精油活性分子与核心靶点之间的相互作用见图6,形成稳定对接构象的结合口袋组成氨基酸残基、口袋体积和氢键数量见表3。图6(a)表明,反式法尼醇能够同CarB的关键氨基酸残基GLY175、GLU299形成典型氢键,同时与THR173形成非典型氢键(碳氢键),与ILE298、LEU210、ILE167、MET240、ALA144、ARG169、HIS243、PRO170通过烷基或π-烷基产生疏水相互作用。图6(b)表明,金合欢醇乙酸酯能够同CarB的关键氨基酸残基SER935形成典型氢键,同时与LEU895、LEU907、TYR1040、ALA793、PHE928通过烷基或π-烷基产生疏水相互作用。图6(c)表明,反式法尼醇主要与OdhA的氨基酸残基LEU323、LEU659、VAL695、HIS260、HIS322、HIS460通过烷基或π-烷基产生疏水相互作用,与PHE689通过π-σ疏水堆积作用连接,配体与受体间无氢键作用。图6(d)表明,金合欢醇乙酸酯能够与OdhA的关键氨基酸残基GLN363、LEU323形成典型氢键,同时与GLU661形成非典型氢键(碳氢键),与LEU659、ALA359、ALA358、HIS260、HIS460通过烷基或π-烷基产生疏水相互作用,与PHE689通过π-σ疏水堆积作用连接。图6(e)表明,反式法尼醇能够同PurF链A中的关键氨基酸残基LEU99形成典型氢键,与链C中的氨基酸残基LEU99通过烷基产生疏水相互作用,同时与氨基酸残基LEU98、TYR92、LYS56、PHE100通过烷基或π-烷基产生疏水相互作用。图6(f)表明,金合欢醇乙酸酯能够同PurF的关键氨基酸残基LEU99、LYS56形成典型氢键,同时与氨基酸残基TYR92通过π-烷基产生疏水相互作用。
PdhD与桉叶油醇结合能较弱,桉叶油醇能与PdhD的氨基酸残基通过烷基或π-烷基产生疏水相互作用,但无典型氢键。GltA与棕榈酸乙酯和棕榈烯酸结合能也较弱,棕榈酸乙酯和棕榈烯酸与GltA的氨基酸残基虽存在典型氢键,但存在盐桥和静电相互作用力。而结合能高的靶点-小分子复合物中不存在盐桥和静电相互作用力,因此推测盐桥和静电相互作用力可能会影响分子的几何构型,导致对接结合能较低。
2.6 藤椒精油小分子抗生物被膜活性验证结果
根据虚拟计算对接结果,选择金合欢醇乙酸酯、反式法尼醇进行抗生物被膜活性验证。图7是解淀粉芽孢杆菌DY1a在添加0.32、0.64、1.28 μL/mL金合欢醇乙酸酯或反式法尼醇的TSBS培养基培养 48 h 后形成的气液界面生物被膜。由图7可知,对照组气液面生物被膜较为致密厚实,且在空气一侧形成了明显的肉眼可见的皱褶。添加金合欢醇乙酸酯的培养基界面虽形成了明显的生物被膜,但生物被膜较单薄松散,且无肉眼可见的皱褶,易被外界机械力分散破坏,表明藤椒精油活性分子金合欢醇乙酸酯在实验体积比范围内对菌株生物被膜的发育和成熟均有良好的延缓作用。添加不同体积比的金合欢醇乙酸酯对菌株生物被膜的抑制活性无明显差异,而添加1.28 μL/mL反式法尼醇的培养体系气液界面未见明显的生物被膜形成,表明在该体积比下反式法尼醇对解淀粉芽孢杆菌DY1a气液面生物被膜的形成具有完全抑制作用。

图7 金合欢醇乙酸酯、反式法尼醇对解淀粉芽孢杆菌DY1a生物被膜的抑制作用Fig.7 Antibiofilm effects of farnesol acetate and trans-farnesol on Bacillus amyloliquefaciens DY1a
通过结晶紫染色法进一步对不同培养条件下形成的生物被膜进行定量分析,结果见图8。由 图8 可知,添加金合欢醇乙酸酯和反式法尼醇的培养基形成的生物被膜生物量(以OD595 nm表示)均低于对照组,说明这2种化合物对于解淀粉芽孢杆菌DY1a气液面生物被膜生长均有抑制活性。在1.28、0.64 μL/mL 条件下,添加反式法尼醇的培养基的生物被膜形成量低于添加相同体积比的金合欢醇乙酸酯的培养基的生物被膜生物量,说明反式法尼醇的抗生物被膜活性强于金合欢醇乙酸酯。
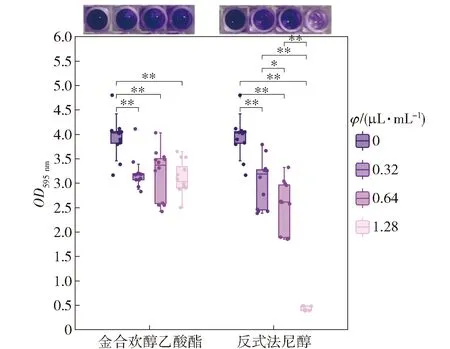
*表示组间数据差异显著(P<0.05),**表示组间数据差异极显著(P<0.01)。图8 生物被膜定量结果Fig.8 Results of biofilm biomass quantification
细菌运动能力测定结果见图9、表4。随着精油组分添加量的提高,细菌泳动圈直径逐渐减小,表明金合欢醇乙酸酯和反式法尼醇对解淀粉芽孢杆菌DY1a泳动能力均有抑制作用。与泳动结果相似,丛集圈直径也随着精油组分含量的升高而减小,表明金合欢醇乙酸酯和反式法尼醇对细菌丛集能力均有抑制作用。在相同添加量下,添加反式法尼醇的丛集培养基形成的丛集圈直径比添加金合欢醇乙酸酯的丛集培养基形成的丛集圈直径小,表明反式法尼醇抑制细菌丛集的能力强于金合欢醇乙酸酯。添加1.28 μL/mL反式法尼醇的TSB培养基无肉眼可见丛集圈生成,表明该添加量能完全抑制丛集圈的形成,与结晶紫结果一致。
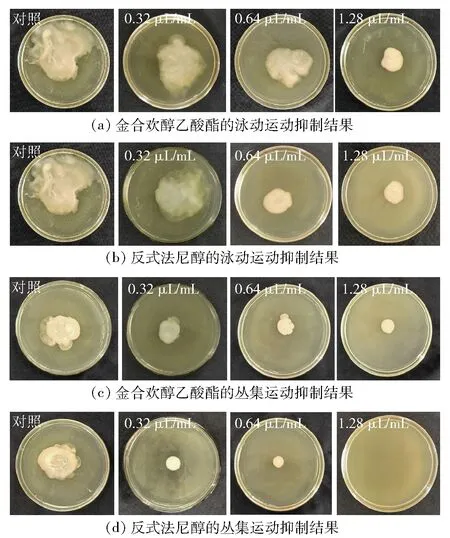
图9 金合欢醇乙酸酯、反式法尼醇对解淀粉芽孢杆菌DY1a泳动和丛集能力的抑制作用Fig.9 Inhibitory effects of farnesol acetate and trans-farnesol on swimming and swarming motilities of Bacillus amyloliquefaciens DY1a
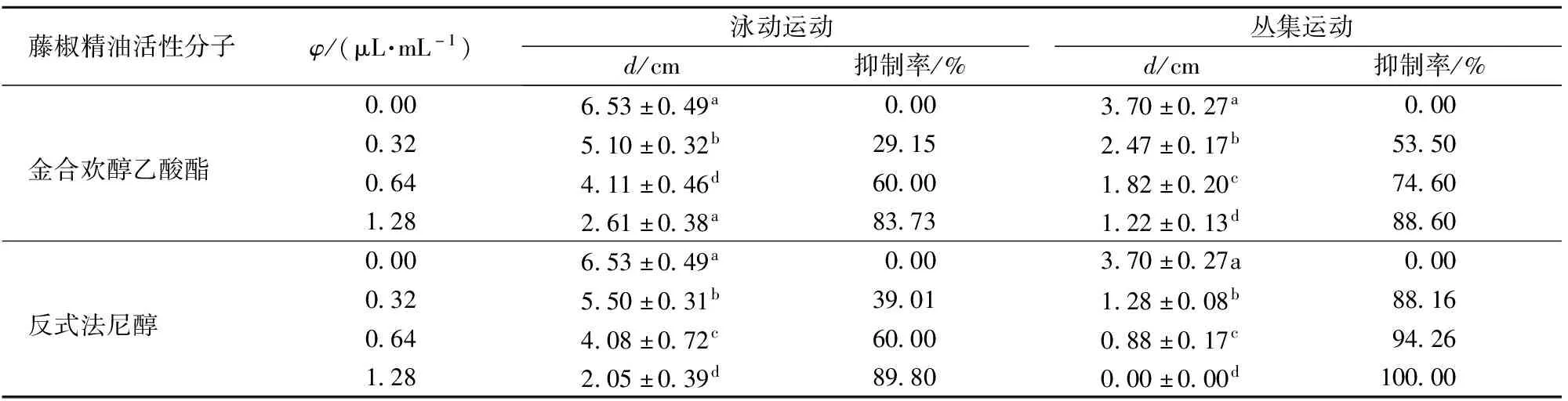
表4 金合欢醇乙酸酯和反式法尼醇对解淀粉芽孢杆菌DY1a泳动和丛集能力的抑制率
3 讨 论
藤椒精油对解淀粉芽孢杆菌气液界面生物被膜的形成具有良好的抑制与清除活性,在食源性致病菌和腐败菌生物被膜绿色防控领域具有良好的应用潜力[11]。细菌生物被膜形成过程复杂,涉及菌体黏附能力、运动能力和胞外基质多糖和蛋白质合成分泌等过程[2,23]。同时,植物精油组分复杂,不同化合物可能在抗生物被膜形成方面发挥不同的生物活性功能[4]。因此,采用常规实验方法逐一分析精油单一组分的抗生物被膜活性及相关机理是一项十分庞大的研究工作,往往难以找到切入点和突破口。为进一步阐明藤椒精油抗细菌生物被膜的分子机理,本研究借助网络药理学-分子对接技术,从分子层面解析精油中起抗生物被膜作用的关键活性组分及其胞内作用靶点。
温泽文等[24]的研究表明,奥替溴铵通过抑制细菌初级代谢,降低其蛋白质合成能力从而表现出良好的生物被膜抑制效应;黄宁[25]通过Pathway分析发现,次生代谢产物的生物合成、氨基酸的生物合成、各种环境中的微生物代谢通路与细菌生物被膜的形成有关;刘琳等[26]发现,某些信号分子可以调控一些次级代谢,从而维持细菌生物被膜结构;Pisithkul等[27]发现生物被膜的生长与初级生物合成途径、发酵途径和次级代谢的代谢有关,生物被膜生长过程中三羧酸循环的活性会增强。本研究通过网络药理学研究方法同代谢通路富集分析相结合,揭示了藤椒精油小分子是通过影响细胞代谢和生物合成等生物功能,以及通过多靶点-多成分-多通路来抑制解淀粉芽孢杆菌生物被膜的形成。
同时,本研究采用分子对接技术,验证了藤椒精油中金合欢醇乙酸酯、反式法尼醇、桉叶醇、茴香醚、柠檬烯等21种主要活性组分与解淀粉芽孢杆菌DY1a的8个核心靶点的结合能力及相互作用模式,结果表明,大部分对接复合物结合能低于-20.93 kJ/mol,其中金合欢醇乙酸酯、反式法尼醇与OdhA、CarB和PurF 这3个靶点的结合能力强于其他靶点。OdhA是三羧酸循环中2-氧代戊二酸脱氢酶复合物的组分之一,该复合物在催化2-氧代戊二酸氧化脱羧为琥珀酰辅酶A过程中起着重要作用[28];PurF为谷氨酰胺磷酸核糖焦磷酸盐酰胺转移酶,作为嘌呤生物合成关键酶,可促进钾离子的依赖性扩散,从而对枯草芽孢杆菌表现出菌落的广泛扩散效应[29];CarB为精氨酸特异性氨甲酰磷酸合成酶,是柑橘黄单胞菌泳动和生物被膜形成必需的基因[30]。因此,藤椒精油活性分子通过与OdhA、PurF、CarB等靶点结合,从而干扰与生命活动相关的大分子合成代谢,最终抑制细菌生物被膜的形成和成熟。
结果表明,金合欢醇乙酸酯和反式法尼醇在实验添加量范围内对菌株生物被膜的发育和成熟均有良好的延缓作用。同时在相同添加量下反式法尼醇的抗生物被膜活性强于金合欢醇乙酸酯。然而,分子对接结果显示,金合欢醇乙酸酯结合的核心靶点数目更多。这可能是由于金合欢醇乙酸酯对部分调控靶点的基因表达存在上调作用,致使金合欢醇乙酸酯抑制生物被膜的总体活性比反式法尼醇低。从细菌群体感应调控机制层面进行分析,金合欢醇乙酸酯可能需要与多种信号分子的含量同时达到阈值,才可协调调控与生物被膜形成有关的基因表达[31]。同时,由于网络药理学方法是基于已有实验研究证据构建的数据库进行预测分析,可能还存在一些尚未研究解析的生物被膜靶点与反式法尼醇具有更强的结合能力。分子对接环境与实际生命代谢胞内环境存在差异也会导致分子对接和生物被膜活性验证结果存在差异。尽管网络药理学和分子对接技术存在一些不足,但在当前技术条件下,仍然值得被用于复杂生命代谢活动有关机理的辅助解析工作。
4 结 论
本研究借助网络药理学,对藤椒精油抗解淀粉芽孢杆菌生物被膜作用的关键活性分子、关键靶点、代谢通路信息和拓扑网络进行分析,共筛选出21种主要精油活性组分及8个核心靶点,证明了藤椒精油抗细菌生物被膜的多组分、多靶点、多通路的特点。结合分子对接技术,验证了3种藤椒精油活性组分桉叶醇、金合欢醇乙酸酯、反式法尼醇可通过氢键、疏水作用与核心靶点OdhA、CarB、PurF结合。抗生物被膜活性实验验证结果进一步表明,金合欢醇乙酸酯和反式法尼醇对解淀粉芽孢杆菌DY1a生物被膜的形成和细菌运动能力具有显著抑制活性。研究结果希望为藤椒精油抗细菌生物被膜的胞内分子机理提供新的见解,同时为利用藤椒精油开发抗细菌生物被膜新策略奠定理论依据。
