沙棘降解多糖结构表征和功能特性研究
2023-11-06孔志强赵玉红
孔志强, 赵玉红,2,*
(1.东北林业大学 生命科学学院, 黑龙江 哈尔滨 150040;2.黑龙江省森林食品资源利用重点实验室, 黑龙江 哈尔滨 150040)
植物多糖具有抗衰老[1]、抗炎[2]、降血糖[3]、降血脂[4]和抗氧化[5]等生理功能,其生物活性受到其分子质量和结构特征 (单糖组成、异构碳构型、糖单元顺序、聚合度和分支特性) 等影响[6-9]。研究表明,高分子质量多糖不容易穿透生物体的细胞膜屏障,从而导致生物学效应减弱[7, 10]。通过降解处理降低多糖分子质量,为提高其生物利用率提供了可行的方法[11]。
多糖降解方法有物理、化学和生物降解[9]。物理降解高效且环保,但需要专门的设备[12]。生物降解反应温和,但需要基于复杂多糖结构对酶和微生物进行筛选[11]。化学降解包括酸降解、碱降解和H2O2降解[13]。H2O2降解因其条件温和且绿色环保而被广泛应用[14]。 H2O2主要是通过Fenton反应生成羟基活性自由基与氢原子,导致多糖解聚[15]。使用单一H2O2降解多糖通常不会导致分子质量显著降低,必须激活H2O2以增加其解聚能力[16]。 Fe2+是一种还原剂,对H2O2促进多糖的降解有很强的催化能力[17]。与天然多糖相比,经H2O2联合Fe2+(H2O2-Fe2+)降解得到的多糖具有更好的生物活性[11,18]。因此,基于 H2O2-Fe2+体系的Fenton降解是提高多糖生物活性的一种有效方法[8]。
沙棘(HippophaerhamnoidesL.),胡颓子科沙棘属,是广泛种植于亚欧大陆的一种多刺落叶灌木植物[19],富含维生素、多酚、不饱和脂肪酸和多糖等多种生物活性物质[20]。沙棘多糖(sea buckthorn polysaccharides, SBP)具有降血糖[21]、抗氧化[22]和缓解肝损伤[10]等药理活性,但其分子质量较高,水溶性较差,影响其生物活性的发挥与应用[23]。有研究证明高分子质量多糖经降解处理后其生物活性可显著提高[24]。目前,有关沙棘多糖降解及其理化功能特性方面的研究鲜见报道。
本研究拟采用 H2O2-Fe2+法对SBP进行降解,研究沙棘降解多糖(sea buckthorn degraded polysaccharides, SBDP)的结构、功能特性及抗氧化活性,旨在为拓展SBPD在食品领域的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
沙棘果渣,黑龙江省黑河市孙吴县长乐山地大果沙棘开发有限公司,经粉碎、过筛(60目)、脱脂、干燥,得到沙棘果渣粉,备用。 DPPH、ABTS,上海远业生物科技有限公司;单糖标准品和葡聚糖标准品(分子质量为5.000×103、1.160×104、2.380×104、4.860×104、8.090×104、1.480×105、2.730×105、4.098×105、6.678×105Da) ,扬州博睿糖生物科技有限公司;其他化学品均为分析纯。
1.2 仪器与设备
EPOCH12型酶标仪,美国伯腾仪器有限公司;LC-10A型高效液相色谱仪,日本岛津公司;RI-10A型示差检测器,日本岛津公司;ICS5000型离子色谱仪,美国马萨诸塞州沃尔瑟姆赛默飞世尔科技公司;FD5-2.5E型冷冻干燥机,北京金西盟仪器有限公司;AR2000ex型动态旋转流变仪,美国TA公司;FTIR-650型傅里叶变换红外光谱仪,天津港东科技发展股份有限公司;Zeta plus型激光粒度分析仪,美国布鲁克海文仪器有限公司;AVANCE Ⅲ HD 500MHz型核磁共振波谱仪,瑞士布鲁克公司。
1.3 实验方法
1.3.1SBP的制备
参照裴晋红等[25]的方法进行多糖提取。准确称量沙棘果渣粉,按料液比1∶30(g/mL)[m(沙棘果渣粉)∶V(提取流)=1 g∶30 mL]加入蒸馏水,90 ℃ 提取2 h,4 000 r/min离心15 min,收集上清液,重复2次,合并提取液。提取液浓缩后用Sevage法除蛋白9次,醇沉静置48 h,抽滤、取沉淀,分别用丙酮和无水乙醇洗2次,冻干后得到沙棘粗多糖。
1.3.2SBDP的制备
参照Zhang等[11]的方法并加以修改。分别将12.5 mL H2O2(1.0 mol/L)、12.5 mL FeSO4(1.0 mol/L)加到100 mL的SBP溶液(质量浓度为0.5 mg·mL-1)中,25 ℃ 搅拌2 h。多糖溶液经72 h透析(截留分子质量3 500 Da) 后,真空浓缩、冻干,得到SBDP。
1.3.3多糖分离纯化
参照李顺峰等[26]的方法,采用DEAE-52纤维素色谱柱对SBP和SBDP进行分离纯化,自动采集器收集 (流速为1 mL/min,每管收集10 mL)并测定各组分多糖的回收率。
1.3.4多糖分子质量及单糖组成测定
参照张嘉园[27]的方法并加以修改。采用高效液相色谱法测定SBP和SBDP的分子质量。参照Wang等[28]方法处理样品,采用离子色谱法分析SBP和SBDP的单糖组成。
1.3.5多糖溶解度、粒径和pH值的测定
样品用质量浓度为1.0 mg·mL-1的多糖溶液制备,室温下用pH计测定其pH值。将10 mg多糖样品溶于10 mL去离子水中,离心后得上清液,用激光粒度仪对样品进行粒径评价。测定温度为25 ℃ (折射率为1.543,散射角为90°)。参照Chen等[29]的方法测定SBP和SBDP的水溶性。
1.3.6多糖化学键分析
参照齐奇等[30]的方法,将干燥的多糖样品和溴化钾 (光谱级) 按质量比1∶100混合研磨成粉末,然后压成薄片,用傅里叶变换红外光谱仪进行扫描。扫描范围为400~4 000 cm-1,以4 cm-1的分辨率扫描16次。
1.3.7多糖结构测定
参照Ma等[24]的方法并加以修改。将多糖(15 mg)室温下溶解在D2O(0.5 mL)中,并转移到核磁管中,使用AVANCE Ⅲ HD 500 MHz核磁共振波谱仪获得1H NMR和13C NMR谱图。
1.3.8多糖流变特性测定
通过流变仪在(25.0±0.1)℃下,将多糖溶液与平板(d=40 mm)结合。在0.1~100.0 s-1的剪切速率内测试多糖溶液的表观黏度,在1%的恒定应变和1~100 rad/s的角频率下测量其储能模量(G′)和损耗模量(G″)。
1.3.9多糖吸湿性和保湿性测定
参照Li等[31]的方法。取一定量的多糖样品置于105 ℃中烘至恒重,精密称取50 mg,放入相对湿度81%(饱和硫酸铵溶液)的干燥器中。多糖样品在室温下每1 h称重一次,甘油作为阳性对照。吸湿性根据式(1)计算。
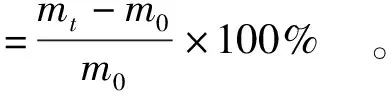
(1)
将吸湿饱和的样品置于装有变性硅胶的干燥器中。在室温下进行保湿实验,每1 h称重一次。保湿性根据式 (2) 计算。
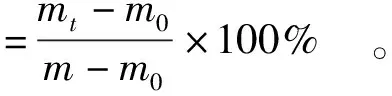
(2)
式(1)、(2)中,m代表饱和的样品质量,mg;mt是处理一定时间后的样品质量,mg;m0是质量恒定的样品质量,mg。
1.3.10多糖的体外抗氧化活性测定
1.3.10.1 DPPH自由基清除活性测定
参照Xu等[8]的方法,将1.0 mL的DPPH溶液(0.2 mmol/L)与1.0 mL的SBP或SBDP溶液(质量浓度为0.2~2.0 mg·mL-1) 混合,25 ℃避光孵育 30 min, 于517 nm处测定吸光度,以抗坏血酸(VC) 为阳性对照。根据式(3)计算多糖清除率。
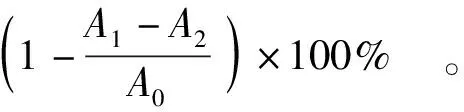
(3)
式(3)中,A0为用去离子水代替样品时,溶液的吸光度;A1为样品溶液和标准液混合物的吸光度;A2为用乙醇代替标准液与样品溶液混合物的吸光度。
1.3.10.2 ABTS+自由基清除活性测定
参照魏晨业等[32]的方法,取4.0 mL ABTS工作液,加入1.0 mL不同质量浓度(0.2~2.0 mg·mL-1) 的多糖溶液,混合,避光反应6 min,于734 nm波长处测定吸光度。以VC为阳性对照,按式(4)计算样品ABTS+自由基清除率。
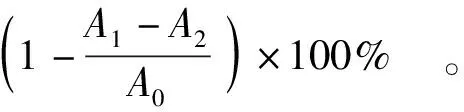
(4)
式(4)中,A0为用去离子水代替样品时对照溶液的吸光度;A1为样品溶液和标准液混合物的吸光度;A2为用乙醇代替标准液与样品溶液混合物的吸光度。
1.3.10.3 羟基自由基清除活性测定
参照谭诗敏[33]的方法,将1.0 mL硫酸亚铁溶液(9 mmol/L)和1.0 mL水杨酸-乙醇溶液(9 mmol/L) 完全混合,加入不同质量浓度 (0.2~2.0 mg·mL-1)的多糖溶液,混匀后加入1.0 mL H2O2溶液 (9 mmol/L) 启动反应,37 ℃水浴30 min,于510 nm波长处测定吸光值。以VC作为阳性对照,根据 式 (5) 计算自由基清除率。
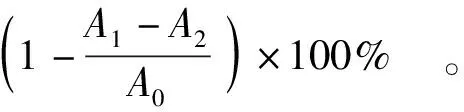
(5)
式(5)中,A0为用去离子水代替样品时对照溶液的吸光度;A1为样品溶液和标准液混合物的吸光度;A2为用乙醇代替标准液与样品溶液混合物的吸光度。
1.4 数据处理
每个样品进行3次独立重复实验,使用SPSS 22.0对所有实验数据进行统计学分析。结果使用平均值±标准差表示,P<0.05表示结果差异具有显著性。采用Origin Pro 2021软件绘制图表。
2 结果与分析
2.1 多糖纯化结果及回收率分析
SBP和SBDP经 DEAE-52纤维素树脂分级洗脱实验,结果如图1。由图1可知,SBP分离得到5个组分,分别为SBP-0、SBP-0.1、SBP-0.2、SBP-0.3、SBP-0.4。SBDP分离得到3个组分,分别为SBDP-0、SBDP-0.1、SBDP-0.2。SBP-0和SBDP-0是通过蒸馏水洗脱下来的,为中性多糖,其余组分通过盐溶液洗脱,为酸性多糖。所得的各组分含量及回收率,见表1。由表1可知,SBP与SBDP的蒸馏水洗脱组分回收率最高,质量分数分别为38.92%和49.10%。后续实验均选择收集蒸馏水洗脱的组分制备SBP和SBDP。
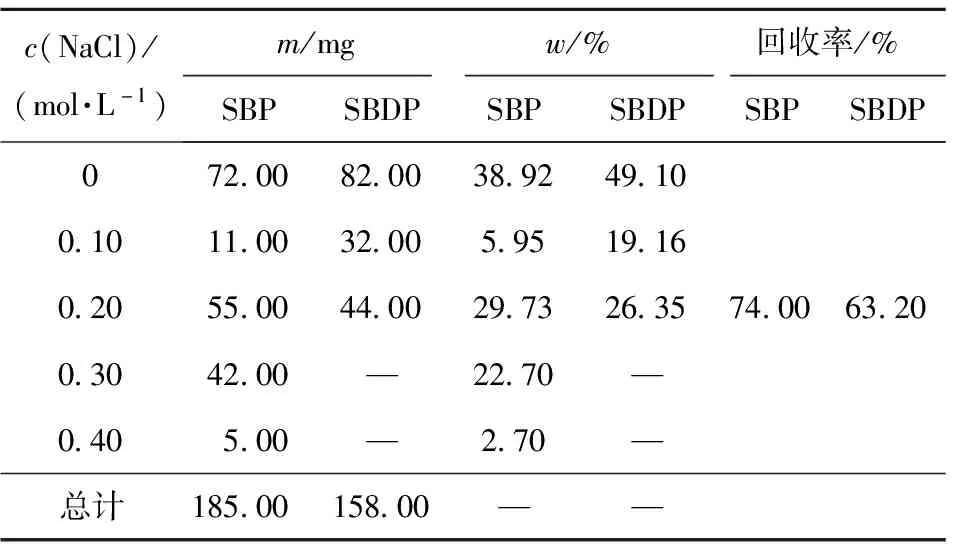
表1 多糖洗脱回收率
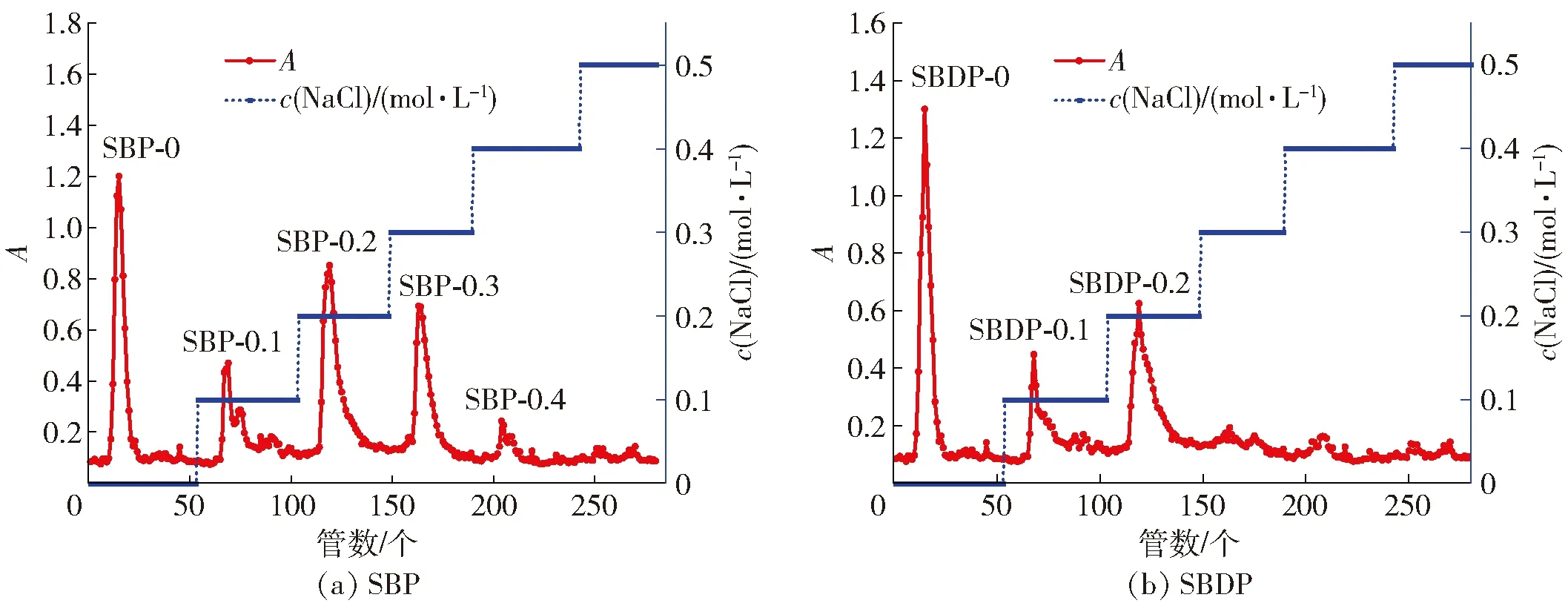
图1 SBP与SBDP洗脱曲线Fig.1 Elution curves of SBP and SBDP
2.2 降解对SBP的理化性质分析
多糖理化性质分析结果见表2。由表2可知,与SBP相比,SBDP分子质量由3.016×105Da下降到2.902×104Da,平均粒径由(302.46±3.63)nm下降到(237.30±1.76)nm。H2O2-Fe2+降解多糖是基于Fenton反应生成大量羟自由基,通过羟自由基攻击分子间或分子内的氢键,破坏多糖的聚集[15],显著降低多糖分子质量和粒径。相比SBP,SBDP的溶解度增加了20.72%,可能是SBDP糖环上的碳1(C1)、碳4(C4)及碳5(C5)处的氢原子被羟自由基提取,使SBDP含有更多的羟基、羧基等亲水基团[34]。通过H2O2-Fe2+降解多糖,可有效提高多糖溶解度[35]。
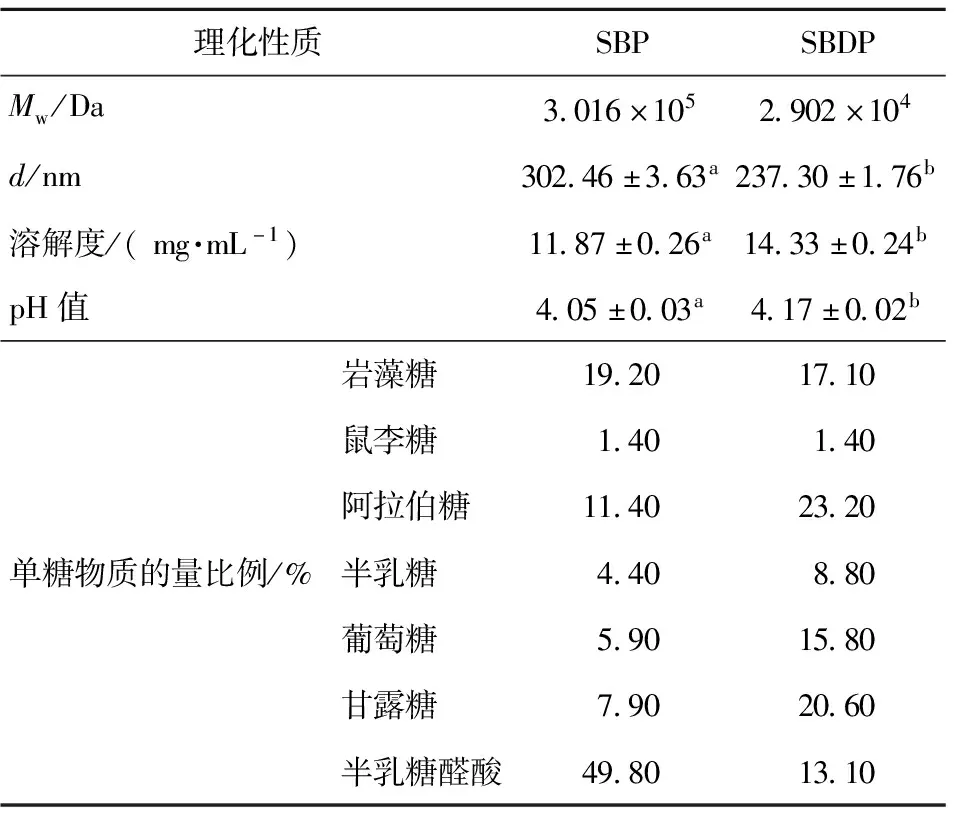
表2 SBP和SBDP理化性质
单糖组成的分析结果如表2。SBDP的单糖组成与SBP相似,主要由岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、甘露糖、半乳糖醛酸组成,其中半乳糖醛酸是SBP主要成分,甘露糖是SBDP主要成分。半乳糖醛酸含量经H2O2-Fe2+处理后降低,说明SBP中高半乳糖醛酸区的糖苷键和半乳糖醛酸残基可能被羟自由基攻击,产生半乳糖醛酸含量占比更低的组分,并暴露出更多的甘露糖[36]。 H2O2-Fe2+降解多糖具有高效且温和的特点且几乎不破坏多糖一级结构[8]。
2.3 降解对SBP的结构特征的影响
2.3.1红外光谱分析


图2 SBP和SBDP的红外光谱Fig.2 Infrared spectra of SBP and SBDP
2.3.2核磁共振波谱分析
SBP和SBDP的1H和13C谱图如图3。由图3可知,2种多糖在δH3.0~5.5和δC60~110处出现了几乎相同的典型多糖峰的分布[23],其中δH为4.3~5.3和δC为90~110的多糖峰信号表明,存在α和β构型糖苷键[18]。根据文献[14]和[44]的研究结果对单糖残基的信号进行了归属,氢-1/碳-1的异常区(H-1/C-1)所对应的糖苷键,组成分析结果如表3[9,23,45]。表3结果表明,SBP和SBDP的主链由7种相同的糖苷键组成,证明这2种多糖具有相似的主干结构。此外,δH为1.10和δC为16.75 附近的共振信号归因于鼠李糖的CH3基团,δH为2.07和δC为20.23附近的共振信号证明多糖中存在乙酰基团,而δC在170附近的化学位移表明,糖链中存在糖醛酸[46]。
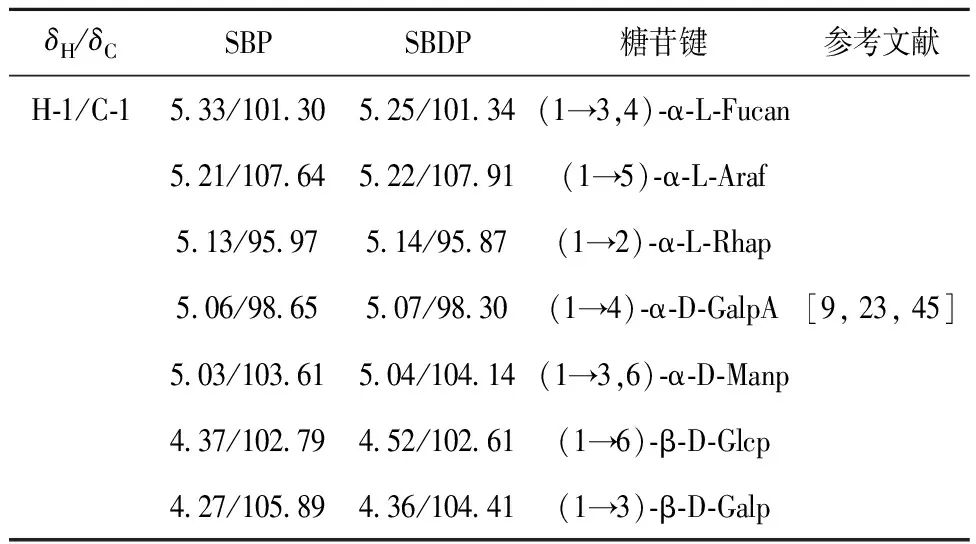
表3 SBP和SBDP的糖苷键组成
图3 SBP和SBDP的核磁共振1H谱和13C谱Fig.3 1H and 13C NMR spectra of SBP and SBDP
从单糖组成、FT-IR光谱和核磁共振光谱来看,甘露糖是SBDP中主要的多糖组分,可能以(1→3,6)-α-D-Manp为骨架,(1→4)-α-D-GalpA和(1→2)-α-L-Rhap为主要侧链。研究结果证明,H2O2-Fe2+处理并没有改变SBP的一级结构。
2.4 降解对SBP的吸湿性和保湿性的影响
多糖吸湿性和保湿性检测结果,见图4。由 图4(a) 可知,多糖和甘油的吸湿率随时间延长而增大,且SBDP吸湿率一直高于SBP。当吸湿时间达到12 h时,SBP和SBDP的吸湿能力趋于饱和,最大吸湿率分别为40.67%±0.35%和 42.67%±0.12%,证明SBDP吸湿性能远强于SBP。由 图4(b) 可知,多糖和甘油的保湿率均随时间的延长而下降。保湿4 h内,甘油保湿能力明显高于SBP和SBDP。保湿5 h后,SBP和SBDP的保湿能力趋于稳定,最大保湿率分别为24.24%±0.94%和26.56%±0.69%,均高于甘油(17.36%±0.07%)。多糖的吸湿性和保湿性是由多糖分子中亲水基团与水分子形成氢键所表现的效果,与多糖分子中的亲水基含量相关[46]。同时,多糖链可以相互交织,形成网状结构,这对保持水分含量很重要[47]。H2O2-Fe2+处理使得SBDP具有更多羟基、羧基等亲水基团,并且SBDP多糖链更容易形成网状结构。基于此结果,SBDP有望开发为保湿剂。
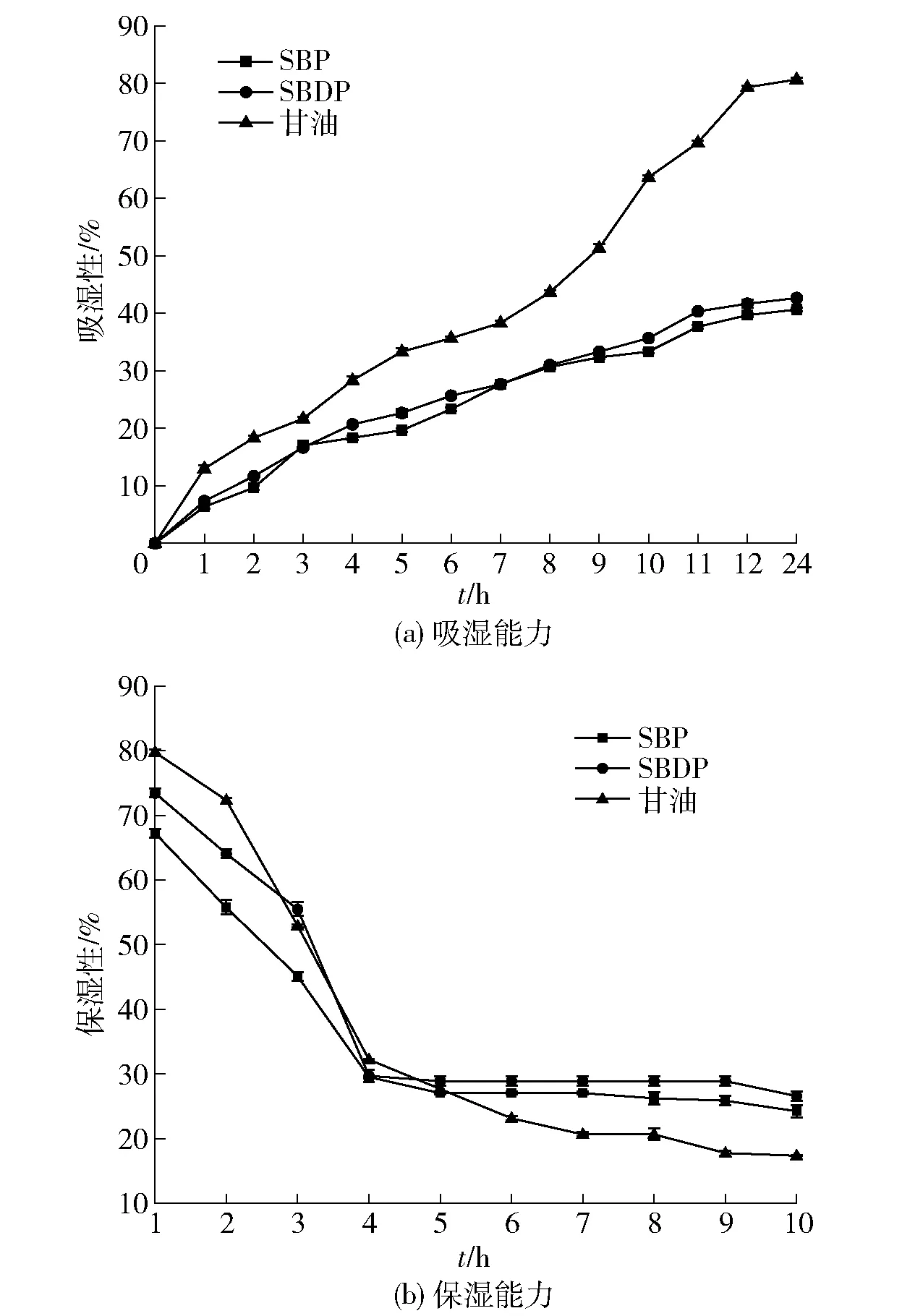
图4 SBP和SBDP的吸湿和保湿能力Fig.4 Hygroscopicity and moisturizing property of SBP and SBDP
2.5 降解对SBP的流变特性的影响
具有良好流变性的多糖可以用作食品行业的增稠剂、凝胶剂、混悬剂和乳化剂[48]。多糖的流变特性检测结果,见图5。由图5可知,2种多糖溶液均表现出剪切稀化特性和牛顿流体行为,且SBDP的溶液黏度始终低于SBP。在低剪切速率下,多糖黏度随着剪切速率的增加而降低,多糖溶液表现出典型的剪切稀化行为。这种现象是由于多糖分子的链-链结构被剪切力破坏,导致黏度下降[48]。同时,高分子质量多糖的分子间相互作用力强于低分子量多糖,导致多糖链更容易缠结[49]。在高剪切速率下,较长的多糖链可能解开缠绕,2种多糖的表观黏度保持稳定,多糖溶液性质更接近牛顿流体[23]。
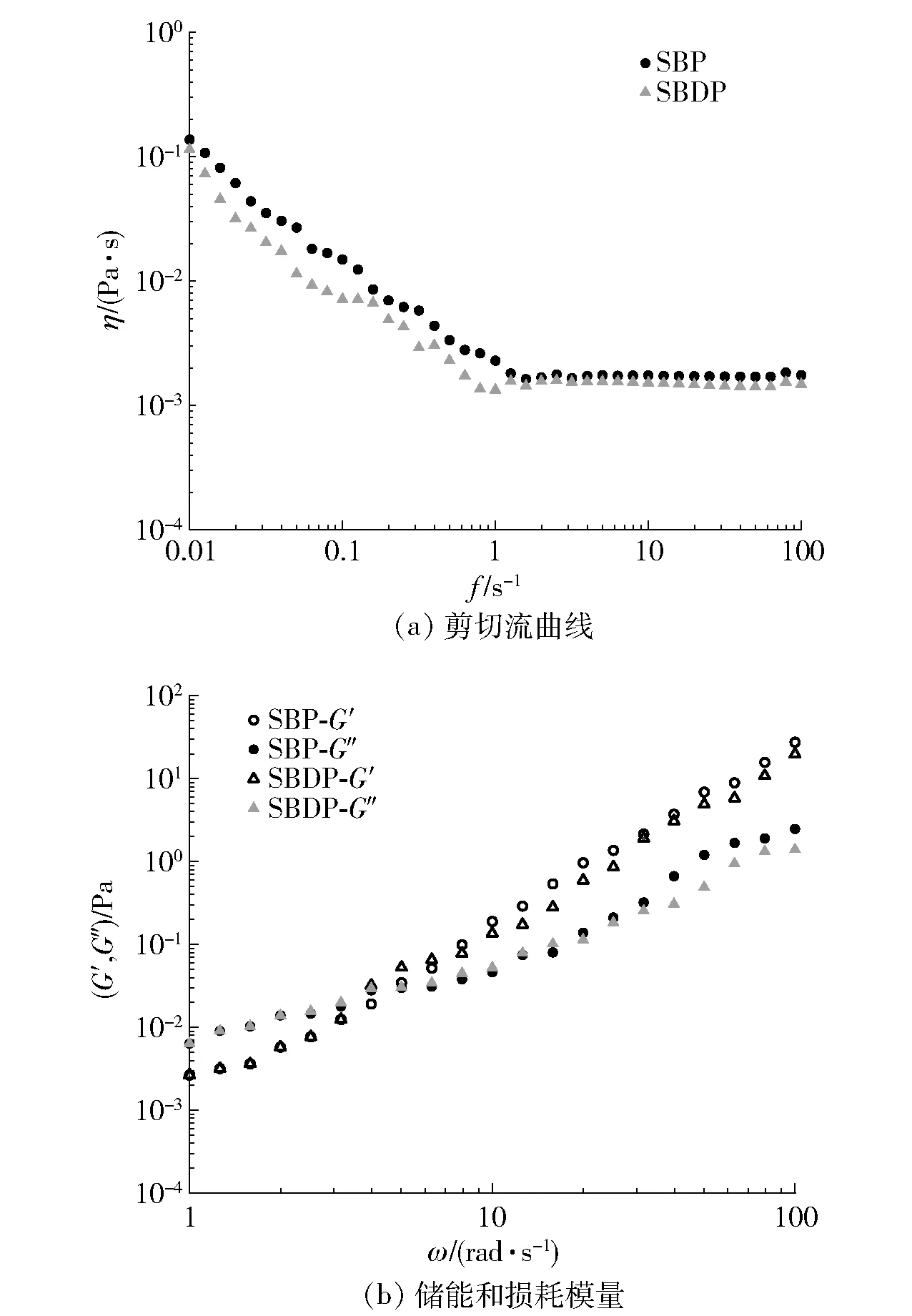
图5 SBP和SBDP的流变特性Fig.5 Rheological characterization of SBP and SBDP
储能模量(G′)为弹性应力应变之比,损耗模量(G″)为黏性应力应变之比。G′和G″的交叉点可用于确定多糖溶液的线性黏弹性区域[50]。由图5可知,2种多糖的G′和G″均随角频率的升高而增加。在低频区域,G″大于G′,表示多糖呈现液体黏性[49]。而在高频区域,G′大于G″,此时多糖溶液表现出弱凝胶状特性[48]。SBDP交汇点 (3.98 rad/s) 低于SBP交汇点(5.12 rad/s),由于多糖链之间连接点的数量和复杂性增加,SBDP更有可能在水溶液中形成强大的分子间(或分子内)相互作用力和纠缠网络[48]。实验结果表明,降解处理使多糖具有更好的凝胶性能和体系稳定性[23-24]。
2.6 降解对SBP体外抗氧化活性的影响
将所得到的SBP和SBDP按比例稀释进行体外抗氧化活性测定,并与VC的抗氧化活性进行对比,研究结果如图6。由图6可知,SBP对DPPH自由基清除能力具有浓度依赖性。当多糖质量浓度为0.4 mg·mL-1时,SBP和SBDP对DPPH自由基清除能力无明显差异。但随着多糖质量浓度增加(0.6~2.0 mg·mL-1),SBDP的DPPH自由基清除能力明显高于相同质量浓度的SBP(P<0.05)。在质量浓度为2.0 mg·mL-1时,SBDP对DPPH自由基的清除能力显著高于SBP(P<0.05),达到89.44%±0.12%。同时,SBP和SBDP的半抑制浓度(IC50值)分别为1.06 mg·mL-1和0.71 mg·mL-1,证明SBDP对DPPH自由基清除效果更好。H2O2-Fe2+处理提高了多糖供氢能力,使SBDP更容易与DPPH自由基反应生成稳定的产物,从而提高了对DPPH自由基清除能力[35]。
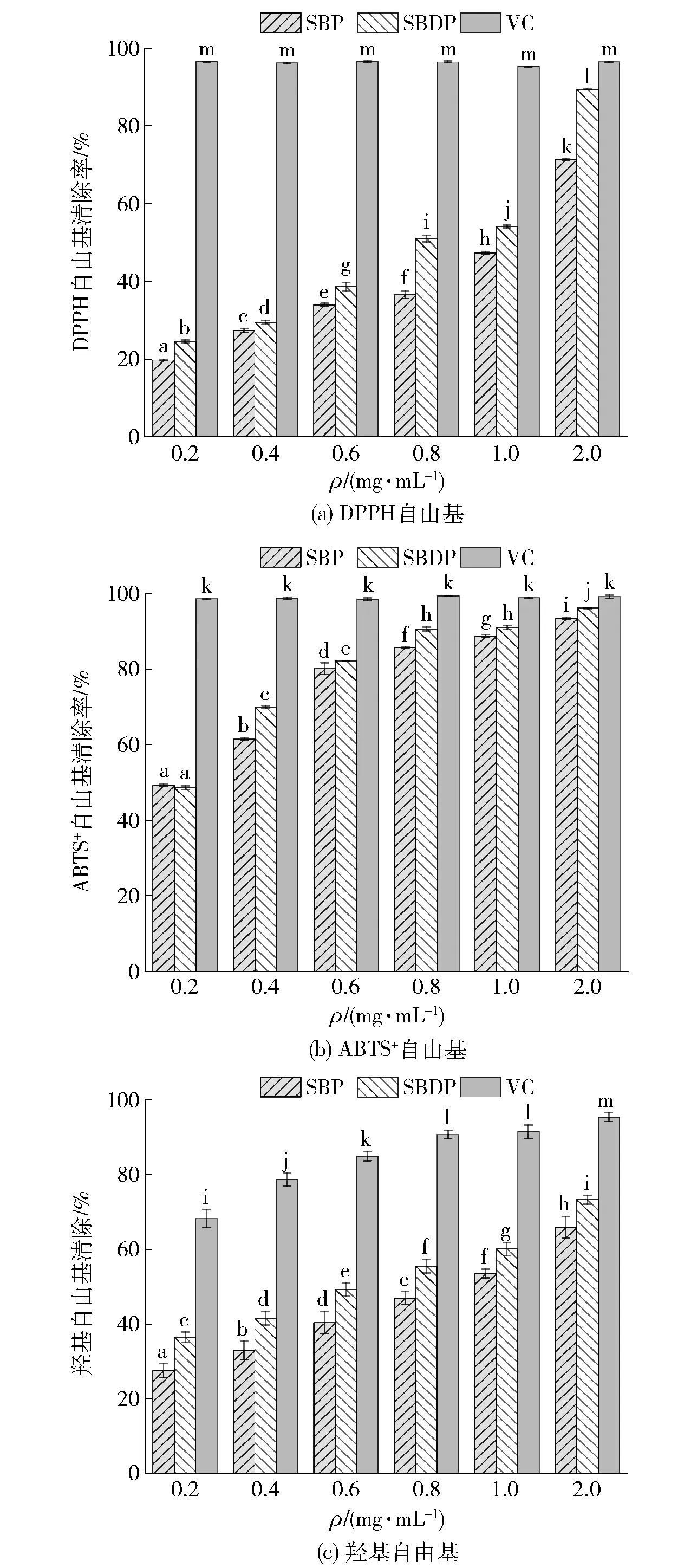
不同字母表示组间数据差异显著(P<0.05)。图6 SBP和SBDP对自由基的清除活性Fig.6 Scavenging activities of SBP and SBDP on radical
由图6可知,ABTS+自由基清除能力与多糖质量浓度的增加具有良好的相关性,自由基清除能力与多糖质量浓度成正比。当多糖质量浓度达到2.0 mg·mL-1时,SBP和SBDP的ABTS+自由基清除率分别为93.37%±0.13%和96.09%±0.22%,IC50值分别为0.22 mg·mL-1和0.21 mg·mL-1。SBDP的自由基清除能力更好,清除效果接近VC(99.15%±0.37%)。研究表明多糖的官能团中,自由羟基可能通过提供电子将自由基还原为更稳定的形式,或者通过直接与自由基反应终止自由基连锁反应而参与抗氧化作用[15]。结果说明,SBP糖环中C5处的氢原子可能被H2O2-Fe2+产生的羟自由基提取,SBP糖环被打开,暴露出更多的自由羟基[51],从而显著提高SBDP的ABTS+自由基清除能力。
由图6可知,随着多糖浓度的提高,2种多糖的羟基自由基清除能力均呈现上升趋势,且在相同浓度下,SBDP的清除能力始终高于SBP。SBP和SBDP对羟基自由基清除的IC50值分别为0.90 mg·mL-1和0.56 mg·mL-1。多糖质量浓度为2.0 mg·mL-1时,SBDP的羟基清除能力显著增强 (P<0.05),达到73.26%±1.16%。与SBP相比,SBDP具有更强的羟基自由基清除活性。在清除羟基自由基反应中,多糖作为电子供体或氢供体参与反应中[52],而H2O2-Fe2+处理导致SBDP的分子质量更低,使其成为更好的电子或氢的供体,同时,SBDP具有更好的水溶性,这可能导致SBDP中的化学基团与羟基自由基相互作用的机会增加,提升SBDP分子的反应效率,使得SBDP表现出更强的羟基自由基清除能力[11]。
通过上述结果可知,经H2O2-Fe2+降解所得到的SBDP具有良好的抗氧化活性,且随着浓度的提升,对DPPH自由基、ABTS+自由基及羟基自由基的清除能力均优于SBP。
3 结 论
本研究对SBDP的结构表征、功能特性和抗氧化活性进行了分析。SBDP和SBP是含有相同单糖的杂多糖,其主链主要由相同的7种糖苷键组成。SBDP(2.902×104Da)的分子质量明显低于SBP(3.016×105Da),说明H2O2-Fe2+法是制备低分子质量SBDP的有效方法。SBDP水溶性更高,表观黏度更低,低剪切速率下为假塑性流体,表现出黏弹性行为,具有较强的抗氧化活性。但SBDP的体内生物活性和构效关系有待进一步研究。
