辣木籽抗菌肽对金黄色葡萄球菌生物膜的影响
2023-11-06黄志远董文明黄艾祥王雪峰
黄志远, 董文明, 田 洋, 黄艾祥, 王雪峰
(云南农业大学 食品科学技术学院, 云南 昆明 650201)
近年来,食品安全已成为全球公共卫生关注的焦点问题。微生物污染是最常见的食品安全问题之一,可引起食品腐败和食源性疾病,从而影响人类的健康,并造成巨大的经济损失[1]。金黄色葡萄球菌(Staphylococcusaureus,S.aureus)是一种革兰氏阳性共生细菌[2],作为世界上第三大食源性致病菌,可引起菌血症、败血症等疾病[3],在中国超过25%的食源性疾病都与S.aureus有关[4]。而导致感染的毒力因子受细菌生长阶段的调控,细菌在早期对数期时会产生细胞因子,这些因子使细菌能够逃避宿主的防御并建立生物膜[5]。生物膜是一种具有良好结构和多样性的动态细菌胞外聚集物,对抗生素的耐药性是原菌株的10~1 000倍[6]。因此,有必要寻找新型抑制剂进一步抵抗细菌生物膜的形成。
抗菌肽(antimicrobial peptides,AMPs)是一类具有天然生物活性的多肽,对细菌、病毒、真菌都有抑制作用[7]。它们是生物体(如两栖动物、哺乳动物、昆虫和植物)用来对抗病原体入侵的天然免疫屏障,被称为“第二防御系统”[8]。与传统抗生素不同,AMPs具有多靶点的抑菌机制,一些AMPs可以通过破坏细胞壁膜、作用于DNA和RNA、抑制蛋白质合成以及增加细胞内活性氧的水平来发挥作用,因此不易产生耐药性[9]。并且AMPs对环境友好,具有良好的稳定性,可以在食品工业中作为一种新型食品防腐剂保存原料与产品[10]。同时,有研究表明,一些AMPs可以有效抑制生物膜的形成,甚至对成熟的生物膜造成破坏[11]。如来自舌兰蛙的抗菌肽brevin-gr23可显著抑制胞外多糖的产生、金黄色葡萄球菌生物膜的附着和形成[12]。螺旋肽G3可以在不同阶段干扰变形链球菌生物膜的形成,在初始阶段,G3通过降低细菌表面电荷、疏水性、膜完整性和黏附相关基因转录来抑制细菌黏附;在后期,G3与胞外聚合物中的胞外DNA(eDNA)相互作用,破坏成熟生物膜的3D稳定性结构,从而分散它们[13]。
MOp2和MOp3是本课题组前期从辣木籽蛋白水解物中分离鉴定到的2种新型阴离子抗菌肽。MOp2相对分子质量为907.06,MOp3相对分子质量为712.81,都带1个负电荷,固体状态下结构以β-转角为主,具有良好的稳定性,使用胃蛋白酶和胰蛋白酶处理1 h后仍保留70%以上的活性。它们对S.aureus表现出了良好的抑菌活性,并且对S.aureus造成一定的膜损伤[14-15]。但MOp2、MOp3是否会对S.aureus的生物膜产生抑制作用鲜有研究。因此,本研究拟通过分析MOp2、MOp3对S.aureus生物膜的形成能力以及成熟生物膜的影响,结合分子对接技术解析2种辣木籽抗菌肽对S.aureus生物膜的抑制作用。
1 材料与方法
1.1 材料与试剂
S.aureus(CICC 10384),中国工业培养收集中心。结晶紫(分析纯)、DAPI荧光染料(分析纯),中国碧云天生物技术有限公司;刃天青(分析纯),中国索莱宝科技有限公司。MOp2(肽序列:HVLDTPLL)、MOp3(肽序列:HVLDTPLL),肽段纯度98%以上,安徽省国平药业有限公司。
1.2 仪器与设备
Multiskan Go型酶标仪,美国Thermo Scientific公司;Dmi3000B型荧光显微镜,德国Carl Zeiss AG公司;DHp-600型电热恒温培养箱,北京市永光明医疗仪器有限公司;TGL20M型台式高速离心机,北京中兴伟业仪器有限公司;LDZM-60KCS型立式压力蒸汽灭菌锅,上海申安医疗器械厂。
1.3 实验方法
1.3.1S.aureus生物膜形成能力测定
参照Ommen等[16]方法并稍加修改。在24孔板中分别加入2 mL无菌胰蛋白胨大豆培养基(TSB)和体积分数1%的细菌菌悬液(108CFU/mL),在37 ℃下分别培养4、8、12、24、48、72、96、120 h。培养完成后,弃去培养基,并用PBS清洗以除去浮游细菌。然后向各孔添加500 μL甲醇,固定1 h后弃去甲醇并用PBS洗涤。向各孔加入体积分数1%结晶紫染色15 min后用PBS洗涤。干燥后,加入200 μL乙醇-丙酮溶液(体积比4∶1),然后在595 nm处测定吸光度。
1.3.2辣木籽抗菌肽处理后S.aureus最小抑制生物膜质量浓度和最小清除生物膜质量浓度测定
参照Zhang等[17]方法并稍加修改。最小抑制生物膜质量浓度(MBIC)测定:在24孔板中分别加入2 mL无菌TSB和体积分数1%的细菌菌悬液(108CFU/mL),随后加入抗菌肽,使之终质量浓度分别为0.5、1.0、2.0、3.0、4.0、6.0、8.0 mg/mL,37 ℃培养48 h以形成生物膜。然后在每孔中加入噻唑蓝(MTT)溶液20 μL(5 mg/mL),2 h后吸去上清液,用PBS清洗以除去游离菌,乙醇脱色后测定OD570 nm。以无菌TSB孔为空白对照组,OD值与空白组相比无显著变化的最小质量浓度定为MBIC。最小清除生物膜质量浓度(MBEC)测定:生物膜在24孔板中培养完成后,用PBS洗去游离菌,加入与测定MBIC相同质量浓度的抗菌肽,然后在37 ℃下培养24 h。MTT染色后测定OD570 nm,OD值与对照组相比无明显变化的最小质量浓度定为MBEC。
1.3.3辣木籽抗菌肽对S.aureus生物膜的清除作用测定
参照Ommen等[16]方法并稍加修改。在24孔板中分别加入2 mL无菌TSB和体积分数1%的细菌菌悬液(108CFU/mL)。37 ℃培养48 h以形成生物膜,随后弃去TSB并使用无菌PBS清洗,然后加入MOp2与MOp3(2、4、8 mg/mL),空白对照组中加入无菌水,在37 ℃下培养12 h。在0、2、4、6、8、10、12 h时,参照1.3.1节中结晶紫染色法测定各组样品的OD595 nm。
1.3.4辣木籽抗菌肽处理后S.aureus生物膜微观形态的变化
参照Lin等[18]方法并稍加修改。在6孔板中分别加入5 mL无菌TSB、体积分数1%的细菌菌悬液(108CFU/mL)及1片无菌盖玻片(2 cm×2 cm)。37 ℃培养48 h以形成生物膜,随后弃去TSB并使用无菌PBS清洗,然后加入MOp2与MOp3(4 mg/mL),空白对照组中加入无菌水。37 ℃培养12 h后,取出盖玻片,并加入DAPI(10 μg/mL)在黑暗中染色20 min,随后用荧光显微镜观察生物膜结构。
1.3.5辣木籽抗菌肽处理后S.aureus生物膜内细菌新陈代谢的变化
将不锈钢片(1 cm×1 cm)在体积分数75%乙醇中浸泡24 h,并超声处理1 h以除去表面杂质。随后用无菌去离子水彻底清洗,并将不锈钢片121 ℃高压灭菌30 min备用。在24孔板中分别加入2 mL无菌TSB、体积分数1%的细菌菌悬液(108CFU/mL)及1片灭菌不锈钢片。37 ℃下培养48 h以形成生物膜,随后弃去TSB并用无菌PBS清洗,然后加入抗菌肽MOp2与MOp3(2、4、8 mg/mL),空白对照组中加入无菌水。处理4 h,取出不锈钢片置于无菌均质袋,加入10 mL PBS超声15 min,使生物膜细菌从不锈钢片上分离并收集菌悬液,在菌悬液中加入体积分数10%的刃天青溶液,37 ℃黑暗中振荡2 h,4 ℃下10 000 r/min离心10 min取得上清液,用酶标仪分别检测其在560 nm激发波长和590 nm发射波长处的荧光值。
1.3.6辣木籽抗菌肽处理后S.aureus生物膜初期形成的变化
1.3.6.1 细菌初期黏附实验
参照Bai等[19]方法并稍加修改。体积分数1%的细菌菌悬液(108CFU/mL)接种于含3 mL葡萄糖(质量分数0.5%)、氯化钠(质量分数3%)的脑心浸液培养基中,并加入抗菌肽MOp2与MOp3(2、4、8 mg/mL),空白对照组中加入无菌水,在37 ℃下培养至对数期。以5 000 r/min冷冻离心5 min,得细菌沉淀物,将细菌沉淀物置于37 ℃下,并加到含纤维蛋白原的96孔板中,孵育1 h后,用体积分数25%的甲醛固定,然后进行结晶紫染色,用酶标仪测定OD595 nm。相对黏附率计算见式(1)。
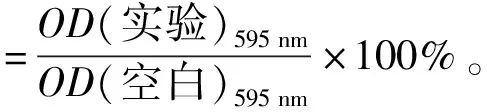
(1)
1.3.6.2 辣木籽抗菌肽处理后S.aureus表面疏水性的变化
体积分数1%的细菌菌悬液(108CFU/mL)接种于3 mL的TSB肉汤,并加入抗菌肽MOp2与MOp3(2、4、8 mg/mL),空白对照组中加入无菌水,在37 ℃下培养24 h。之后向试管中加入500 μL甲苯,剧烈旋转3 min,然后静止10 min,以获得相分离。最后,仔细吸取下层水相,并在涡流前后测定600 nm处吸光度。疏水率计算见式(2)。

(2)
1.3.7辣木籽抗菌肽处理后S.aureus生物膜胞外聚合物的变化
1.3.7.1 酶解实验
在48孔板中分别加入2 mL无菌TSB和体积分数1%的细菌菌悬液(108CFU/mL)。37 ℃下培养48 h以形成生物膜,培养后弃掉培养基。实验共设置4组样品,其中1组为空白组,其余3组为实验组,每组设置10个复孔。空白组中加入无菌水,实验组分别加入高碘酸钠(10 μmol/L)、脱氧核糖核酸酶(2 mg/mL)和蛋白酶K(100 μg/mL)。将48孔板在37 ℃培养2 h,并用结晶紫染色。乙醇脱色30 min后,用酶标仪测定595 nm处的吸光度。
1.3.7.2 细菌胞外多糖含量测定
参照崔海英等[20]方法并稍加修改。将不锈钢片(1 cm×1 cm)在体积分数75%的乙醇中浸泡24 h,并超声处理1 h以除去表面杂质。随后用无菌去离子水彻底清洗,并将不锈钢片在121 ℃下高压灭菌30 min备用。在24孔板中分别加入2 mL无菌TSB、体积分数1%的细菌菌悬液(108CFU/mL)及1片灭菌的不锈钢片。37 ℃下培养48 h以形成生物膜,培养开始时加入抗菌肽MOp2与MOp3(2、4、8 mg/mL),空白组加入等量无菌水。培养完成后,弃去TSB,并用PBS冲洗以除去表面游离菌。将清洗后的不锈钢片置于PBS中超声处理1 h,收集菌悬液,10 000 r/min离心10 min取上清液作为胞外聚合物(extracellular polymeric substance,EPS)样本备用。
采用苯酚-硫酸法测定上清液中胞外多糖的含量,将1 mL上清液和1 mL苯酚(50 g/L)溶液混合,混合均匀后振荡30 s,之后加入15 mL硫酸(体积分数95%)溶液,在黑暗中反应15 min后,将溶液涡旋振荡10 s,置于恒温水浴中反应20 min。使用紫外分光光度计检测溶液在490 nm处的吸光度,以分析胞外多糖的质量浓度。
1.3.7.3 细菌胞外蛋白含量测定
使用考马斯亮蓝蛋白测定试剂盒测定样品蛋白质含量。取1.3.7.2节中制备的EPS样本40 μL于试管中,按照蛋白质加样量(表1)加样,静置10 min,用酶标仪在波长595 nm处测定各管的吸光度,按式(3)计算蛋白质含量。
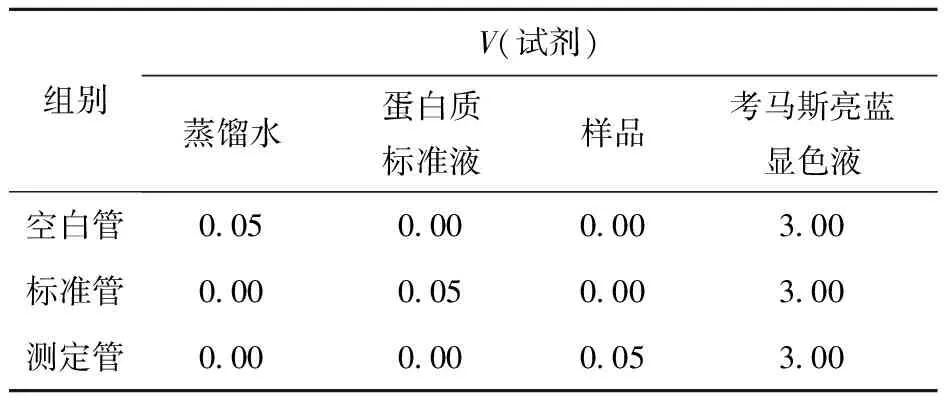
表1 蛋白质加样量
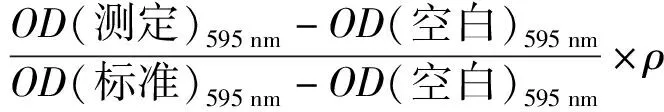
(3)
1.3.7.4 细菌eDNA含量测定
按照1.3.7.2节中方法制备EPS样本,使用细菌基因组DNA快速抽提试剂盒提取EPS中eDNA后,使用酶标仪检测260 nm处的吸光度,并根据吸光度计算eDNA含量。
1.3.8分子对接分析
对接使用的AgrA、LuxS、CshA、SarA蛋白质晶体结构从Uniprot数据库中下载获得,其中AgrA蛋白的PDB ID为6PRA,其余蛋白质为基于Alphafold预测的结构。MOp2、MOp3的3D结构采用PyMol 2.5.2构建,并保存为PDB格式。
采用AutoDock Vina 1.1.2软件进行分子对接,在对接开始之前,使用PyMol 2.5.2对受体蛋白进行处理,包括去除水分子、盐离子以及小分子。随后设置对接盒子,使之包裹整个蛋白质结构。此外,使用ADFRsuite 1.03将所有处理好的小分子以及受体蛋白转换为AutoDock Vina 1.1.2对接必需的PDBQT格式。对接时,全局搜索的详尽度设为32,其余参数保持默认设置。打分最高的对接构象被认为是结合构象,最后使用PyMol 2.5.2对接结果进行可视化分析。
1.4 数据处理
实验结果使用SPSS 26.0软件分析,采用单因素方差分析和Bonferroni统计学检验来确定P<0.05的显著性水平下的统计差异,数据表示为平均值±标准偏差。
2 结果与分析
2.1 S. aureus生物膜的形成能力
S.aureus可以在食品原料或者食品加工机器表面形成生物膜。金黄色葡萄球菌的生物膜形成能力见图1。由图1可知,随着培养时间的延长,吸光度不断上升,并且在48 h达到最高(1.78),表明此菌株有很强的生物膜形成能力,其结果判读依据是OD595 nm>4ODc(ODc=0.08)为强生物膜形成株[21]。48 h时被认为是生物膜的成熟阶段,生物膜复杂的三维结构完全形成,生物膜内细菌群也处于活跃状态[22-23]。因此,在后续的实验中,生物膜培养时间选择为48 h。
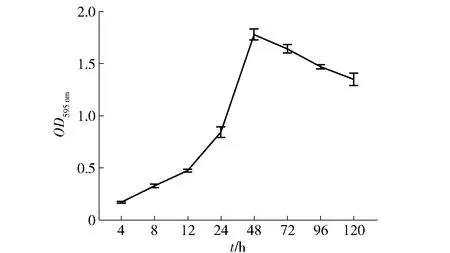
图1 金黄色葡萄球菌的生物膜形成能力Fig.1 Biofilm forming ability of S. aureus
2.2 辣木籽抗菌肽对S. aureus生物膜的MBIC和MBEC测定结果
辣木籽抗菌肽对金黄色葡萄球菌的MBIC和MBEC见图2。由图2可知,MOp2、MOp3对S.aureus的MBIC均为4 mg/mL,MBEC均为8 mg/mL。MOp2与MOp3的MBIC处于成熟生物膜抑制剂桉叶素(8 mg/mL)[24]与丁香精油(1 mg/mL)[17]之间,因此,MOp2、MOp3有望成为一种新型生物膜抑制剂。
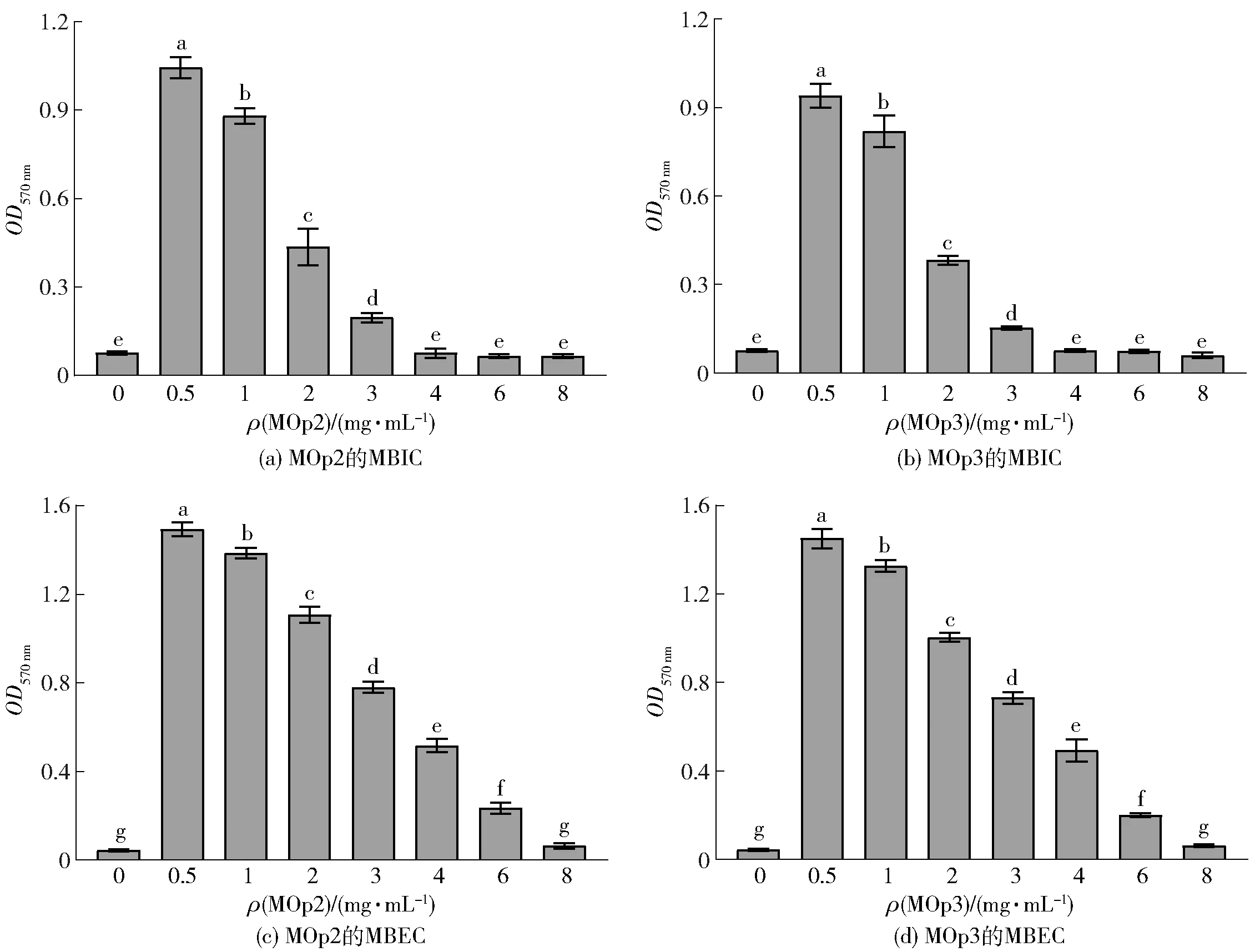
不同小写字母表示组间数据差异显著(P<0.05)。图2 辣木籽抗菌肽对金黄色葡萄球菌的MBIC和MBECFig.2 MBIC and MBEC of Moringa oleifera seeds antimicrobial peptides on S.aureus
2.3 辣木籽抗菌肽对S. aureus生物膜的清除作用
MOp2、MOp3对S.aureus生物膜的清除效果采用结晶紫半定量法测定,结果见图3。空白组的吸光度在12 h内基本保持不变,实验组的吸光度随着MOp2、MOp3质量浓度的增加而减少,说明MOp2与MOp3的质量浓度越高对S.aureus生物膜的清除效果越好。1×MBIC的MOp2处理12 h后,生物膜清除率达到63.28%,2×MBIC时生物膜清除率达到80.56%。1×MBIC的MOp3处理12 h后,生物膜清除率达到67.90%,2×MBIC时生物膜清除率达到81.64%,进一步说明MOp2、MOp3可以有效清除生物膜且呈现一定的剂量依赖性。
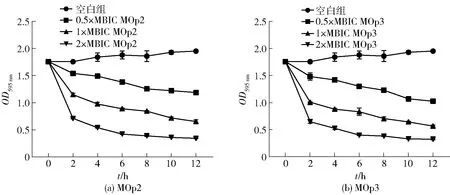
图3 辣木籽抗菌肽对金黄色葡萄球菌生物膜的清除效果Fig.3 Clearance effect of Moringa oleifera seeds antimicrobial peptides on S. aureus biofilm
2.4 辣木籽抗菌肽对S. aureus生物膜微观形态的影响
为了研究MOp2、MOp3对S.aureus生物膜形态结构的影响,采用荧光显微镜对菌体结构进行了微观观察,见图4。由图4可知,空白组[图4(a)]生物膜结构完整、立体,处理组[图4(b)至图4(e)]荧光强度明显下降,生物膜三维结构解体,大多呈游离状态分散在玻片表面。结果表明:MOp2、MOp3能破坏S.aureus的生物膜立体结构,导致细菌死亡,这与Reis-Teixeira等[25]的研究结果一致。

图4 金黄色葡萄球菌生物膜经辣木籽抗菌肽处理前后的荧光显微照片Fig.4 Fluorescence micrographs of S. aureus biofilm before and after treatment with Moringa oleifera seeds antimicrobial peptides
2.5 辣木籽抗菌肽对S. aureus生物膜内细菌新陈代谢的影响
细菌的新陈代谢能力一定程度上能反映出菌体细胞的活力。刃天青具有荧光强度,能够穿透细胞膜,通过不同细菌氧化还原酶的作用降解为高荧光强度的中间产物试卤灵。刃天青向试卤灵转化是不可逆的,并且这种转化与参与代谢的细菌数量成正比,因此这种方法可以检测细菌的生存能力[26]。
MOp2、MOp3对金黄色葡萄球菌生物膜新陈代谢的影响见图5。由图5可知,经过0.5×MBIC的MOp2与MOp3处理后,S.aureus生物膜的代谢活性明显下降(P<0.05),分别下降了15.60%和20.62%;而经过1×MBIC的MOp2与MOp3处理后,S.aureus生物膜的代谢活性显著下降了54.11%和62.34%。造成S.aureus生物膜代谢活性下降的原因可能是细菌代谢过程中能量传递的电子传递链主要位于细胞膜的内表面,细胞膜在受到抗菌肽的刺激和破坏后,能量代谢功能紊乱,因此代谢活性大大下降,同时先前的研究通过冷冻扫描电镜也发现MOp2、MOp3可以破坏S.aureus的细胞壁膜结构[14-15]。
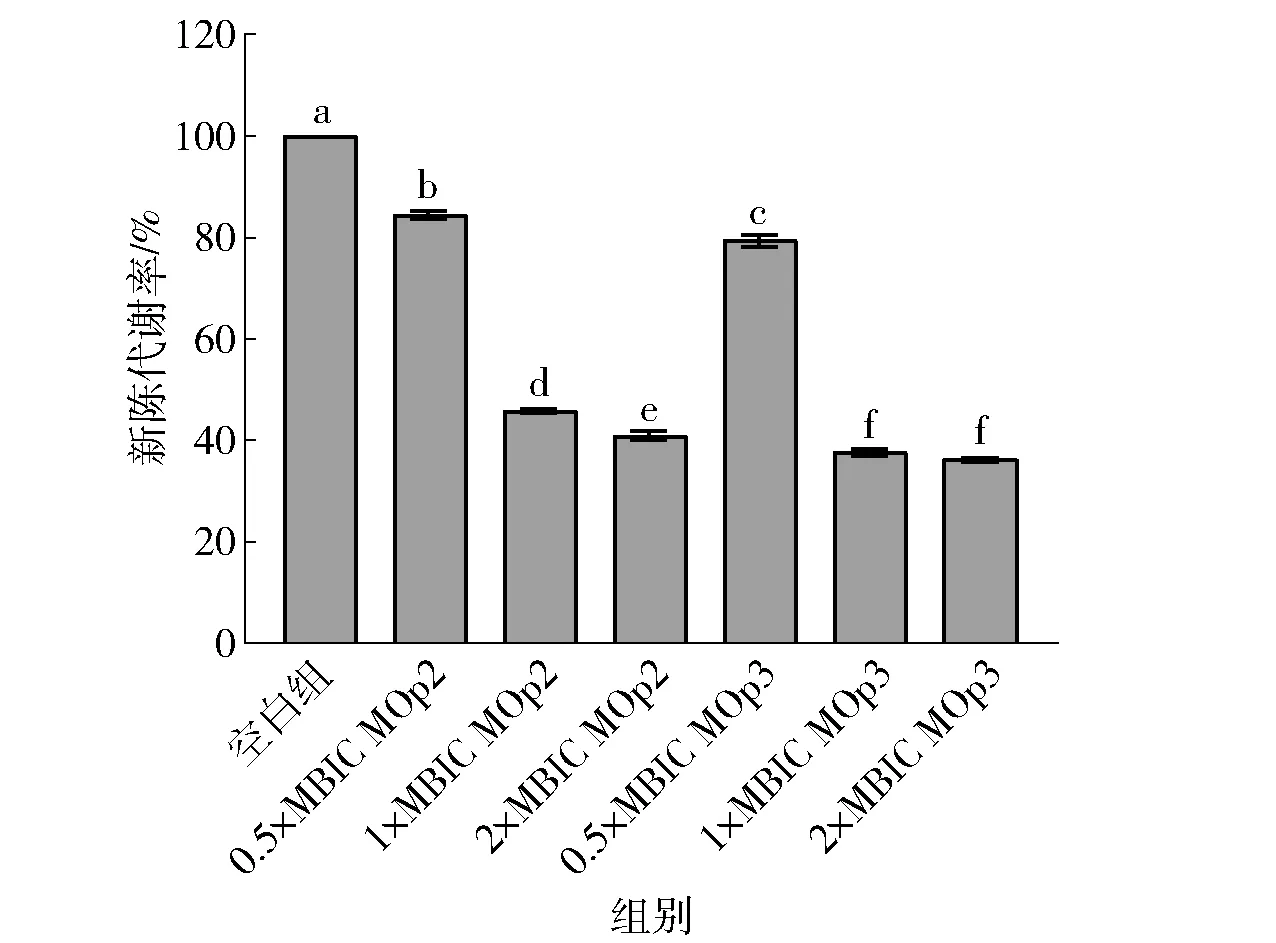
不同小写字母表示组间数据差异显著(P<0.05)。图5 辣木籽抗菌肽对金黄色葡萄球菌生物膜新陈代谢的影响Fig.5 Effect of Moringa oleifera seeds antimicrobial peptides on biofilm metabolism of S. aureus
2.6 辣木籽抗菌肽对S. aureus生物膜黏附率的影响
生物膜初期形成阶段主要依靠细菌细胞之间的黏附作用聚集到一起,此时细菌利用细胞壁锚定蛋白(CWA)附着于不同载体的表面[27]。本研究测定了MOp2、MOp3对S.aureus初期黏附的影响,见图6。 由图6可知,0.5×MBIC的MOp2与MOp3可以显著抑制S.aureus的初始定值(P<0.05),黏附率分别下降了19.84%和24.04%;1×MBIC的MOp2与MOp3对S.aureus的黏附呈现了更好的抑制作用,黏附率分别下降了44.19%和50.77%;特别是在2×MBIC时,黏附率分别下降了74.45%和75.96%。结果表明:MOp2、MOp3对生物膜菌体的初期黏附能力具有抑制作用且呈现剂量依赖性,细菌初期黏附能力下降,生物膜的形成能力也随之下降。
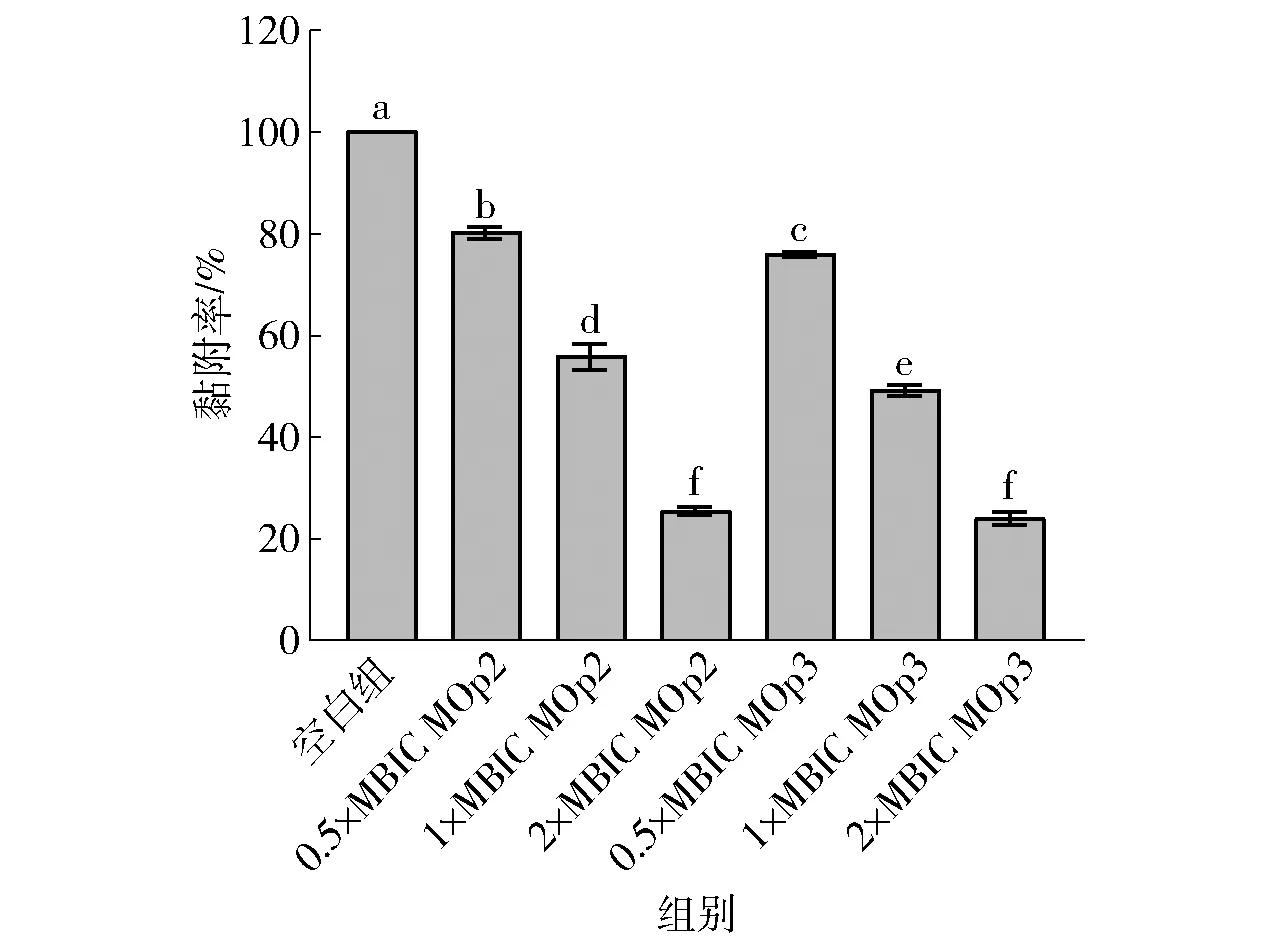
不同小写字母表示组间数据差异显著(P<0.05)。图6 辣木籽抗菌肽对金黄色葡萄球菌生物膜黏附率的影响Fig.6 Effect of Moringa oleifera seeds antimicrobial peptides on biofilm adsorption of S. aureus
2.7 辣木籽抗菌肽对S. aureus表面疏水性的影响
细胞表面疏水性与细菌黏附、生物膜的形成密切相关,细菌表面疏水性的降低可能会弱化生物膜的形成能力[28]。MOp2与MOp3对S.aureus表面疏水性的影响见图7。由图7可知,与空白组相比,在经过MOp2与MOp3处理后,细菌表面疏水性均有显著下降(P<0.05),且与抗菌肽质量浓度呈正相关;在2×MBIC时,S.aureus的表面疏水性分别下降了71.94%和73.77%,这与杨露等[28]的研究结果一致。
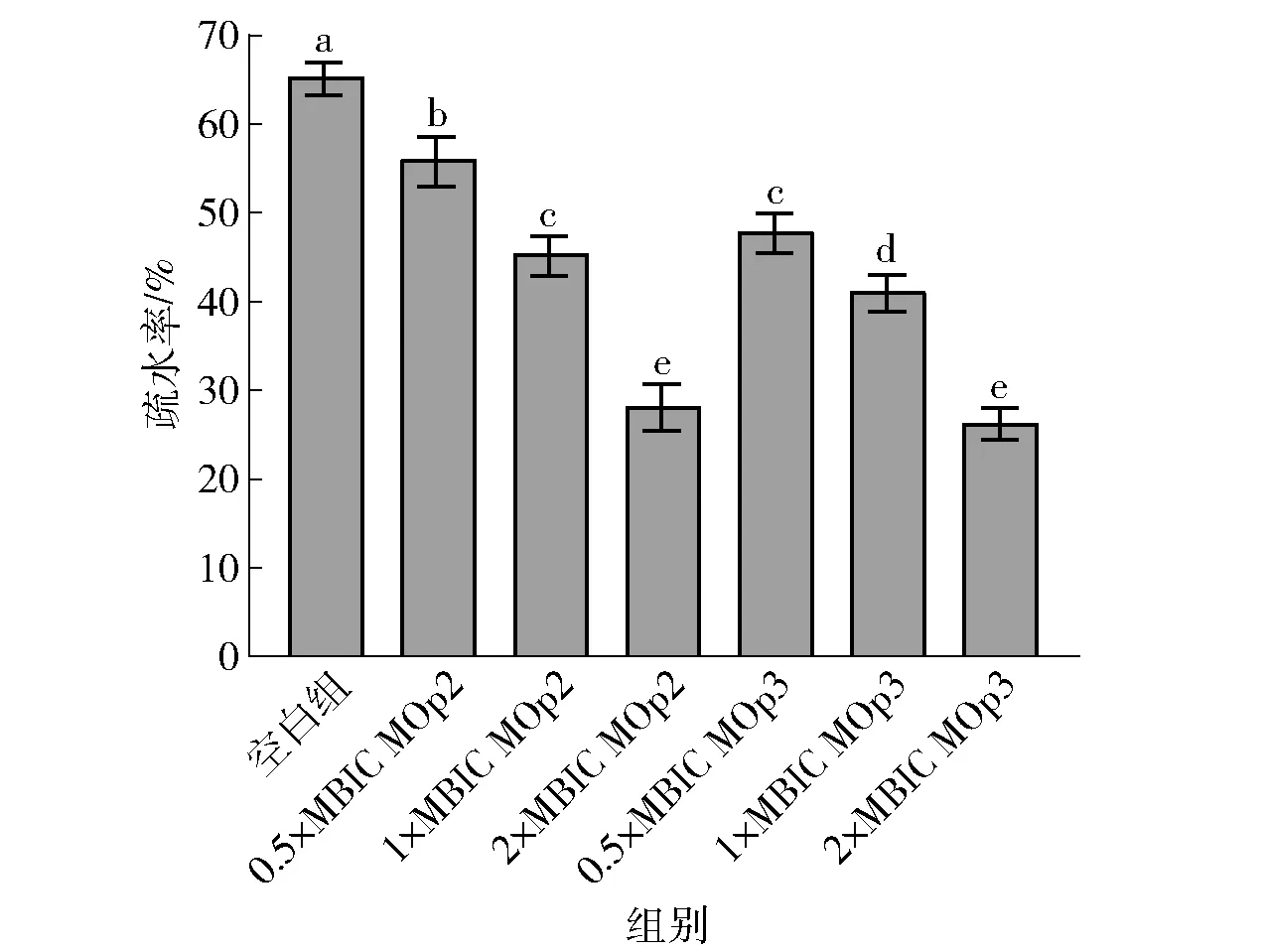
不同小写字母表示组间数据差异显著(P<0.05)。图7 辣木籽抗菌肽对金黄色葡萄球菌生物膜疏水性的影响Fig.7 Effect of Moringa oleifera seeds antimicrobial peptides on biofilm hydrophobicity of S. aureus
2.8 辣木籽抗菌肽对S. aureus胞外聚合物的影响
2.8.1S.aureus生物膜组成分析
成熟的生物膜是附着的微生物群落,能够抵抗外来分子(包括许多小分子抗菌剂)并导致持续感染[29]。生物膜的形成首先是细菌黏附到表面,然后是群体感应(QS)的聚集、菌落发育和EPS的分泌。其中,EPS具有一系列的功能,如作为支架和将生物膜细胞连接在一起[30]。同时,EPS还为生物膜提供了结构稳定性,并维持了其代谢活性。使用高碘酸钠、DNaseⅠ和蛋白酶分别水解多糖、DNA和蛋白质,测定胞外多糖、eDNA和胞外蛋白的含量,发现S.aureus生物膜中含量最高的是蛋白质(质量分数49.01%),其次是胞外多糖(质量分数39.73%)和eDNA(质量分数11.26%)。
2.8.2辣木籽抗菌肽对S.aureus生物膜胞外多糖的影响
多糖是EPS中研究最多的成分,基于糖单体,多糖分为同多糖和杂多糖。EPS的含量在增长平稳期开始时处于峰值,在指数阶段和稳定阶段观察到QS活性,QS系统的转录调控因子影响胞外多糖操纵子的转录调控因子,并控制胞外多糖的产生[31]。MOp2与MOp3对细菌胞外多糖含量的影响见图8。在经过1×MBIC的MOp2与MOp3处理后,胞外多糖的含量出现显著下降(P<0.05),分别下降了22.66%和27.39%;2×MBIC时,胞外多糖含量下降更为明显。可能的原因是MOp2与MOp3对S.aureus的QS系统造成影响,使胞外多糖合成受阻。
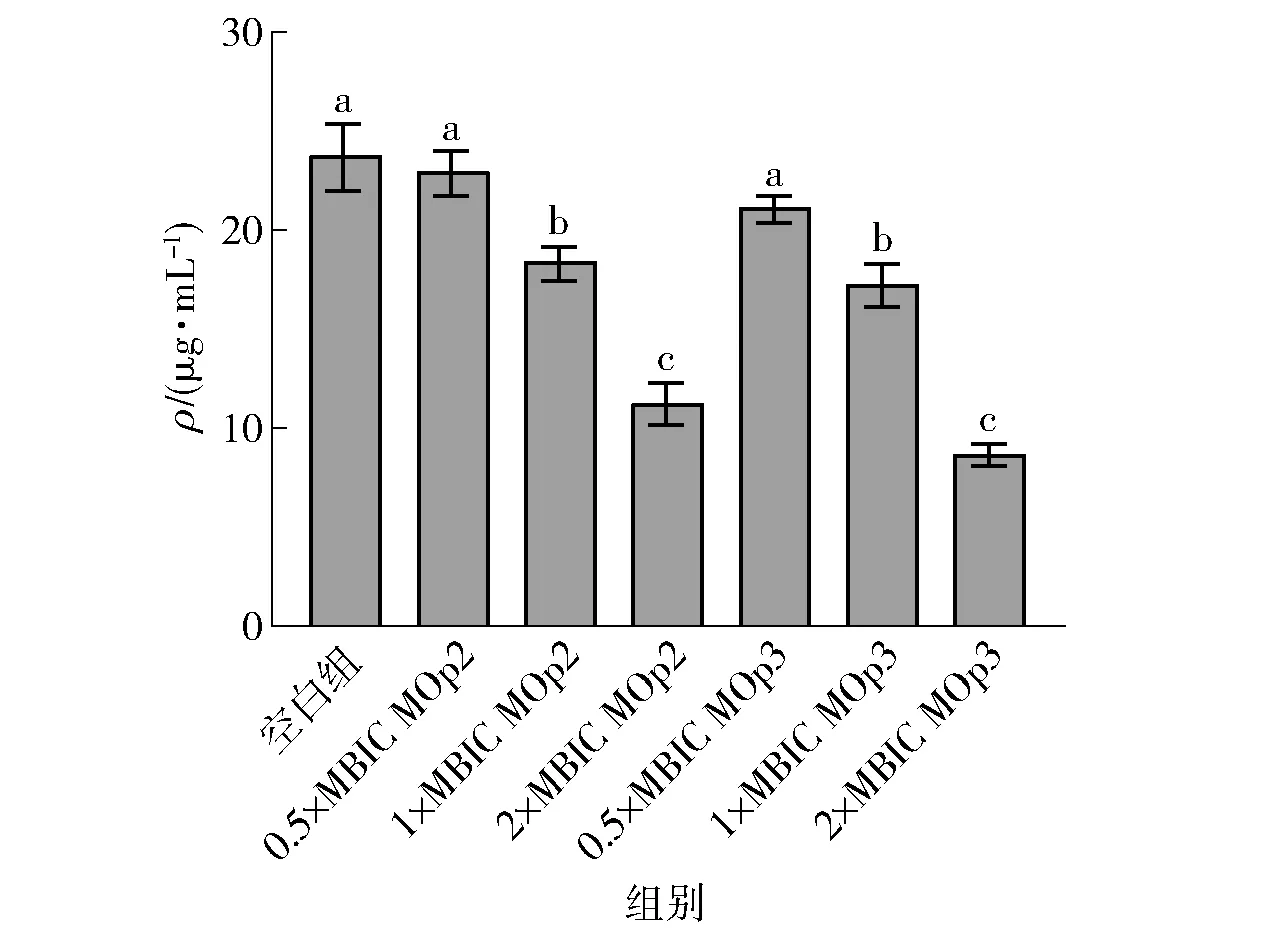
不同小写字母表示组间数据差异显著(P<0.05)。图8 辣木籽抗菌肽对金黄色葡萄球菌生物膜胞外多糖的影响Fig.8 Effect of Moringa oleifera seeds antimicrobial peptides on extracellular polysaccharides of S. aureus biofilm
2.8.3辣木籽抗菌肽对S.aureus生物膜胞外蛋白的影响
S.aureus的胞外聚合物中含量最高的为蛋白质,并且有研究对生物膜的EPS基质进行蛋白组学分析,发现存在一些毒力因子,它们是感染宿主的主要蛋白质[32],因此,探究MOp2与MOp3对细菌胞外蛋白分泌的影响尤为重要。辣木籽抗菌肽对金黄色葡萄球菌生物膜胞外蛋白的影响见图9。经过1×MIBC的MOp2、MOp3作用后,胞外蛋白的含量分别下降了48.05%和39.55%;经过2×MIBC的MOp2、MOp3作用后,胞外蛋白的含量分别下降了61.57%和54.54%。这说明MOp2与MOp3在很大程度上阻止了胞外蛋白的形成,并且明显抑制了胞外蛋白的合成与分泌,这与Vazquez-Armenta等[33]的研究结果一致。
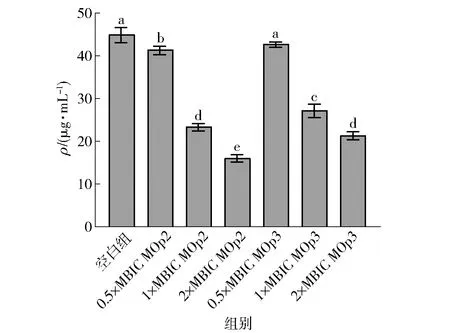
不同小写字母表示组间数据差异显著(P<0.05)。图9 辣木籽抗菌肽对金黄色葡萄球菌生物膜胞外蛋白的影响Fig.9 Effect of Moringa oleifera seeds antimicrobial peptides on extracellular protein of S. aureus biofilm
2.8.4辣木籽抗菌肽对S.aureus生物膜胞外DNA的影响
eDNA是S.aureus生物膜的功能成分,起初eDNA被认为是一种次要成分,主要与基因转移的基因库有关,但是最近有研究重新评估了其对生物膜形成的贡献。eDNA通过细胞死亡和裂解释放,主要发生在生物膜的内部,保护细菌免受抗菌剂和抗生素的影响[34],此外,eDNA还能促进细胞间的细胞黏附[35]。MOp2与MOp3对eDNA的影响见图10。 在0.5×MBIC与1×MBIC时,生物膜eDNA的含量变化不显著,在2×MBIC时,eDNA含量明显下降(P<0.05),分别下降了为14.24%和17.55%,与Secchi等[36]的研究结果一致,说明MOp2与MOp3通过抑制eDNA的合成,破坏细菌的自我防御系统并导致生物膜无法黏附。
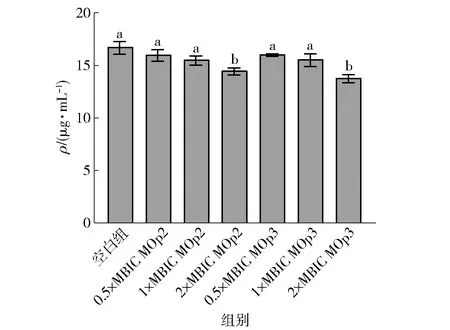
不同小写字母表示组间数据差异显著(P<0.05)。图10 辣木籽抗菌肽对金黄色葡萄球菌生物膜eDNA的影响Fig.10 Effect of Moringa oleifera seeds antimicrobial peptides on eDNA of S. aureus biofilm
2.9 辣木籽抗菌肽与S. aureus生物膜形成关键蛋白的分子对接分析
QS系统在生物膜形成过程中起关键作用。QS系统中的AgrA蛋白对菌体生物膜的形成、毒力因子分泌等多种生物活性起调控作用[37]。CshA是一种细菌黏附蛋白,覆盖在细菌细胞表面,细菌可以利用其附着在基质或者其他细菌上形成生物膜[38]。QS系统中AI-2信号分子的合成依赖LuxS蛋白酶。LuxS蛋白酶可以影响细菌形成生物膜以及其耐药性[39]。葡萄球菌辅助调节因子(SarA)是重要的毒力基因调控因子,可调控约120个基因的表达,涉及QS系统、生物膜合成、耐药性等众多与S.aureus致病相关的生理过程[40]。这4种蛋白质在生物膜形成过程中发挥重要作用,使用分子对接技术可推测MOp2、MOp3是否与这4种蛋白质发生相互作用。
结合能表示对接的可能性,低于-20.92 kJ/mol通常被认为更有可能结合[41]。辣木籽抗菌肽与S.aureus生物膜形成关键蛋白的分子对接位点见表2。由表2可知,MOp2、MOp3与这4种蛋白的结合能均小于-20.92 kJ/mol。辣木籽抗菌肽与S.aureus生物膜形成关键蛋白的分子对接结果见图11。 由图11可知,MOp2通过3个氢键与AgrA结合,MOp3通过6个氢键与AgrA结合;MOp2通过3个氢键与CshA结合,MOp3通过6个氢键与CshA结合;MOp2通过6个氢键与LuxS结合,MOp3通过6个氢键与LuxS结合;MOp2通过2个氢键与SarA结合,MOp3通过4个氢键与SarA结合。结果表明:MOp2与MOp3均可能通过氢键与这4种蛋白质结合,从而抑制这些蛋白质的表达,最终导致细菌无法黏附和形成生物膜。
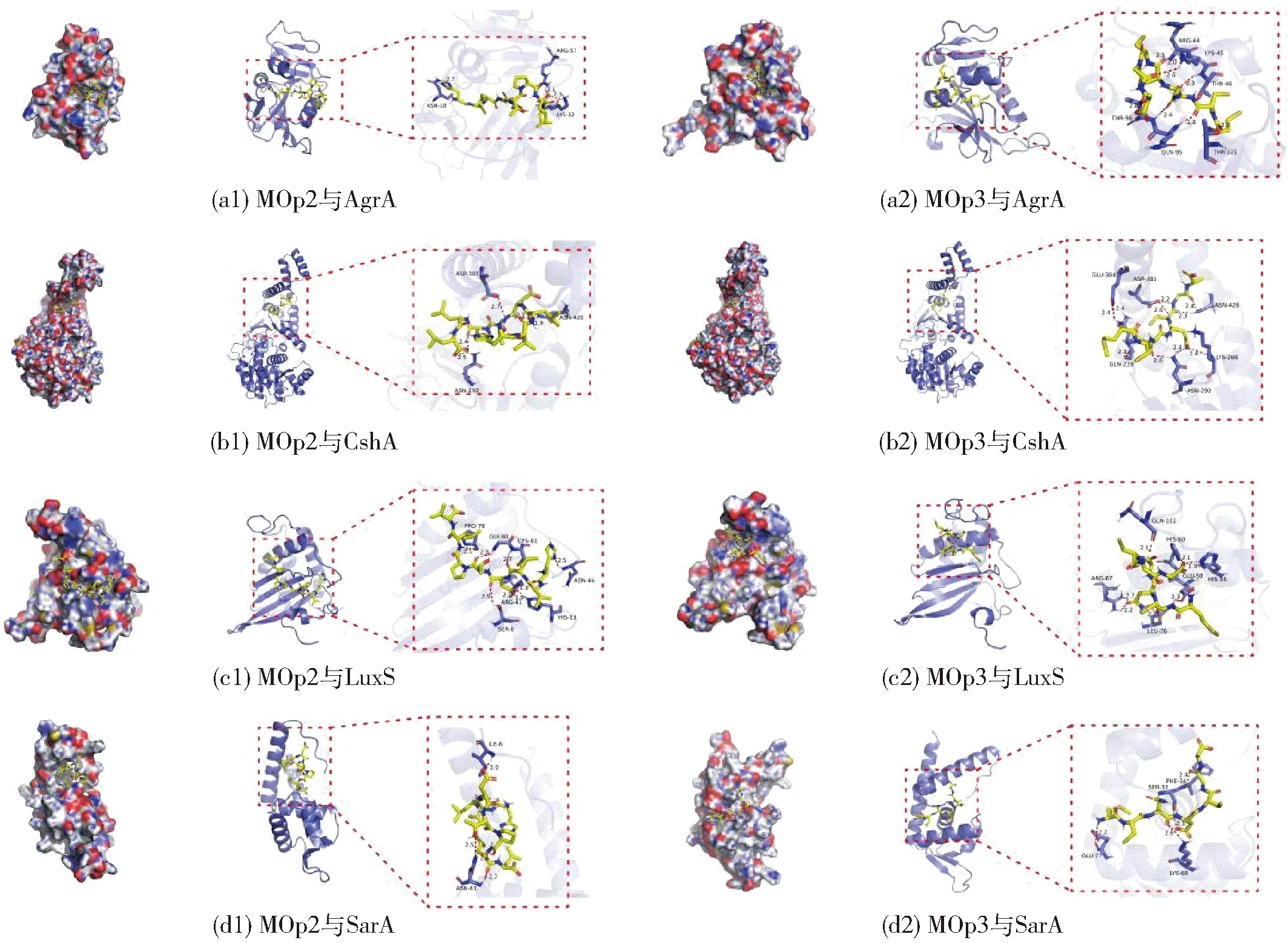
图11 辣木籽抗菌肽与金黄色葡萄球菌生物膜形成关键蛋白的分子对接结果Fig.11 Molecular docking results of Moringa oleifera seeds antimicrobial peptides with key biofilm formation proteins of S. aureus
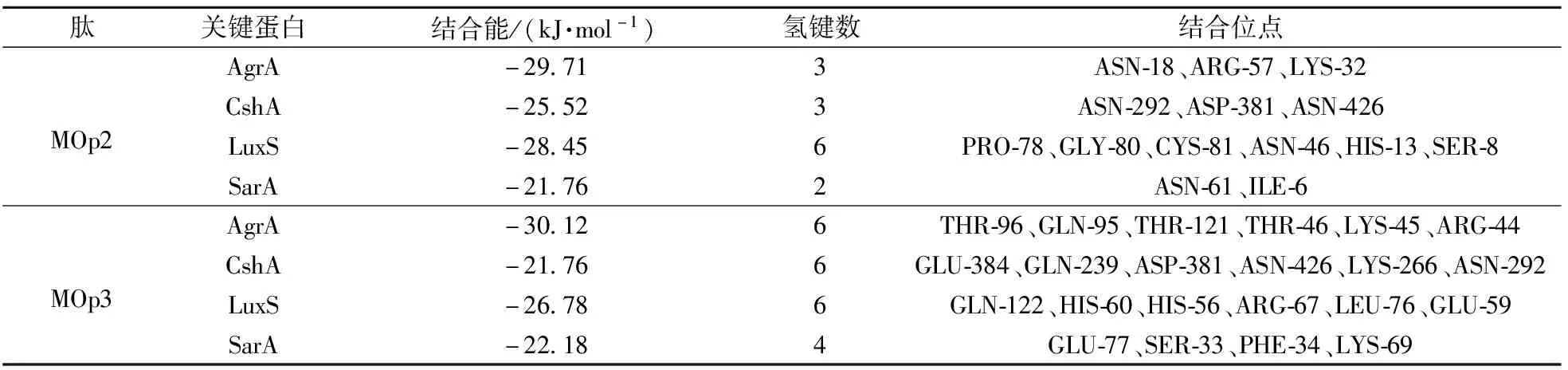
表2 辣木籽抗菌肽与金黄色葡萄球菌生物膜形成关键蛋白的分子对接分析
3 结 论
本研究采用结晶紫半定量法证明了S.aureusCICC 10384有很强的生物膜形成能力,而辣木籽抗菌肽MOp2、MOp3对S.aureus生物膜的MBIC和MBEC均为4 mg/mL和8 mg/mL,能有效清除S.aureus生物膜。经MOp2、MOp3处理后,S.aureus生物膜黏附减少、细菌数量减少,生物膜菌体新陈代谢能力和生物膜早期形成能力显著下降,细菌初期黏附能力及表面疏水性降低。酶解实验结果表明,S.aureus生物膜EPS中含量最多的为胞外蛋白,其次为胞外多糖和eDNA,而MOp2、MOp3会抑制EPS中3种成分的分泌合成。分子对接结果发现,MOp2、MOp3均可能通过氢键与生物膜形成关键蛋白AgrA、CshA、LuxS和SarA结合,这可能导致群体感应系统紊乱,进而导致细菌无法黏附和形成生物膜。研究结果可为辣木籽抗菌肽对S.aureus生物膜的影响提供一定的参考,希望为其在食品工业中的进一步应用提供一定的科学依据。接下来的研究将通过蛋白质组学、Western blot、平行反应监测、RT-qPCR等技术针对性地分析2种肽抑制生物膜的具体靶点。
