不同脱脂方法对高脂肪型复杂食物基质中牛乳过敏原检测的影响
2023-11-06熊子奕高金燕陈红兵
胡 巍, 杨 帆, 熊子奕, 高金燕, 陈红兵, 李 欣,*
(1.南昌大学 食品科学与技术国家重点实验室, 江西 南昌 330047;2.南昌大学 食品学院, 江西 南昌 330047;3.江西省食物过敏重点实验室, 江西 南昌 330047;4.南昌大学 中德联合研究院, 江西 南昌 330047)
牛乳是八大类过敏食物之一,其营养丰富[1]。牛乳中含有30多种潜在的过敏原蛋白,其中酪蛋白、α-乳白蛋白和β-乳球蛋白是牛乳中的主要过敏原[2]。尽管过敏原标签的使用有效地提高了消费者获取过敏原信息的便利性,但是现行的标签法规仍不能消除食品中隐藏的过敏原所引起的潜在危险。因此,实现食物过敏原的准确检测是保障食用安全的重要前提。
食物样品的前处理方法是过敏原检测的重要环节,采用不同方法直接影响到检测的准确性,并与过敏原的丰度、含量和免疫反应性有关[3]。食物基质成分易于与过敏原形成共价键、离子键、氢键或疏水相互作用从而影响其检测结果[4]。巧克力是相对复杂的食品基质之一,原料乳粉中包含的乳蛋白是其主要的过敏物质,其中含有的大量脂肪可能会在调温期间影响产品的结晶从而掩蔽部分过敏原表位[5]。此外,样品制备过程中脂肪的存在会阻碍过敏原蛋白的分离提取或影响抗原抗体反应从而降低检测的准确度[6]。因此,开发适用于高脂肪型食物脱脂的前处理方法迫在眉睫。然而直至目前,这类研究仍鲜有报道。
化学溶剂法和脂肪酶法作为食物中常见的脱脂方法,被广泛应用于样品的前处理中[7-8]。溶剂法常使用烷烃、醇和酯类等有机试剂溶解并分离脂肪[9],脂肪酶法通过使酯键水解断裂,将脂肪转化成较易从蛋白质中分离出来的脂肪酸和甘油[10]。然而,溶剂和酶均可能改变蛋白质的结构和性质,导致过敏原的致敏性发生变化。崔岩岩等[11]使用溶剂法对椰子粕进行脱脂处理,发现脱脂溶剂破坏了椰子分离蛋白亚基的二硫键,同时通过破坏蛋白分子间的疏水键使其三级结构展开。耿勤[12]发现脂肪酶脱脂会改变米渣蛋白的三级结构并使其溶解性降低。蛋白质结构影响着过敏原的致敏性,结构变化的过程中其表位的含量和暴露情况也可能随之变化。因此,脱脂效果好、过敏原提取率高且对过敏原结构影响较小的脱脂方法是目前高脂肪型复杂食物基质前处理的研发重点。
本研究选用含有牛乳过敏原的巧克力作为高脂肪型食物基质模型,分别利用正己烷、异丙醇和乙酸乙酯等脱脂剂和脂肪酶对样品进行脱脂处理,比较了不同脱脂方法对样品脱脂率、蛋白损失率、粒度、蛋白结构、脂肪分布情况和微观结构的影响。此外,利用间接ELISA定量脱脂前后样品中主要牛乳过敏原的浓度,依据实验结果为3种牛乳过敏原分别确定一种较优的脱脂方法,以期有效提升高脂肪型复杂食物基质中牛乳过敏原的提取效果,最终达到提升检测准确度的目的。
1 材料与方法
1.1 材料与试剂
乳粉,恒天然商贸上海有限公司(由纯牛乳喷雾干燥获得,蛋白质质量分数24%);可可粉,太古糖业(中国)有限公司;可可脂,法国可可百利公司;正己烷、异丙醇、乙酸乙酯均为色谱纯,德国Meker公司;食品脂肪酶(活力值50 000 U),安徽绿微康生物科技有限公司;牛血清白蛋白(bovine serum albumin, BSA)、预染大分子蛋白质Marker、考马斯亮蓝R250、乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)、8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid ammonium salt, ANS)、羊抗兔lgG抗体,美国Sigma公司;尼罗红染色剂,北京索莱宝科技有限公司;3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine, TMB),欣博盛生物科技有限公司;兔抗α-乳白蛋白、兔抗β-乳球蛋白和兔抗酪蛋白血清为实验室自制。其他常用生化试剂均为分析纯。
1.2 仪器与设备
SZC-101S1型脂肪测定仪,上海纤检仪器有限公司;XCell4 SureLock 中型胶电泳槽,美国Bio-RAD公司;TU-1901型紫外分光光度计,北京普析通用仪器公司;F-4600型荧光分光光度计、Regulus 8100型冷场发射扫描电镜,日本Hitachi公司;Varioskan LUX型多功能酶标仪,美国Thermo公司;BI-200SM型动静态光散射仪,美国Brookhaven公司;Leica TCS SP8型激光共聚焦显微镜,德国Laica公司。
1.3 实验方法
1.3.1模拟高脂肪型复杂食物基质的制备
巧克力食品模型较多,为了保障配方的稳定性,参考文献报道的基础模型并进行调整得出最终模型[13],乳粉60 g,可可脂70 g,白砂糖20 g。原材料混合均匀后在60 ℃下融化并搅拌,于45 ℃精炼 1 h, 随后在27~29 ℃进行调温,放入冰箱4 ℃冷却凝固2 h。
1.3.2脱脂处理方法
1)溶剂法。将样品和脱脂剂加入离心管中,恒温37 ℃磁力搅拌2 h,获得的处理液在8 000g下离心10 min,弃去上清,于通风橱内干燥并挥发溶剂,收集粉末状样品备用。
2)酶法。向磷酸盐缓冲液(phosphate buffered saline, PBS)中加入脂肪酶以获得质量浓度为0.3 g/L的脱脂酶液,样品预热后加入酶液进行水解,于 50 ℃下搅拌90 min。之后采用95 ℃水浴加热处理10 min使酶灭活,于冷水浴中迅速冷却,冻干成粉末状。
1.3.3脱脂率的测定
参考罗舜菁等[14]的方法并稍加修改。称取2 g左右样品,转入在底部已塞脱脂棉的滤纸筒内,再用脱脂棉塞入上部压住试样,放入专用铝杯中,于脂肪测定仪中进行脂肪量的测定。
设置浸泡、抽提、回收、烘干4个阶段的温度和时间,55 ℃浸泡1.5 h,75 ℃抽提1.5 h,85 ℃溶剂回收15 min,烘干阶段设为110 ℃45 min。称量测定前后铝杯的质量差以获得脂肪质量,脱脂率的计算见式(1)。
(1)
式(1)中,w0为脱脂前样品脂肪体积分数,g/100g;w1为脱脂后样品脂肪体积分数,g/100g。
1.3.4蛋白损失率的测定
采用Bradford(考马斯亮蓝)法测定脱脂处理后模拟基质中蛋白质的损失率。本研究将BSA设置为标准蛋白,配制不同浓度的标准蛋白溶液。向96孔酶标板中每孔加入20 μL待测样品和200 μL考马斯亮蓝G-250溶液混匀,避光放置10 min,于595 nm处测定其吸光度值,绘制蛋白质浓度标准曲线,从而计算出样液的蛋白质浓度,蛋白损失率的计算见式(2)。
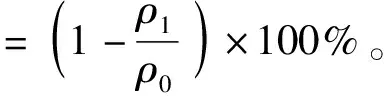
(2)
式(2)中,ρ0为脱脂处理前蛋白质量浓度,mg/mL;ρ1为脱脂处理后蛋白质量浓度,mg/mL。
1.3.5蛋白质分子质量的测定
采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)对脱脂处理后模拟基质中的蛋白质分子质量进行鉴定分析。每孔上样8 μL。电泳条件设置为:电流12 mA(浓缩胶)和24 mA(分离胶)。考马斯亮蓝R-250染色15 min,染色结束用冰醋酸-甲醇溶液进行脱色。
1.3.6蛋白质结构的测定
1.3.6.1 圆二色谱分析
参考操强等[15]的研究方法采用圆二色谱仪测定蛋白质的二级结构变化。比色皿厚度为1 mm,波长范围为190~240 nm,速度为100 nm/min,在室温及连续吹入氮气条件下检测,样品扫描3次取其平均值,通过差减除去空白基线信号值,再使用Dichroweb网站计算蛋白二级结构含量。
1.3.6.2 内源性荧光光谱分析
参考Gao等[16]的研究方法采用荧光分光光度计测定蛋白质的三级结构变化。设定荧光分光光度计的条件为:激发波长(λex)为280 nm,发射波长(λem)为300~450 nm,光步5 nm,测试时间为200 ms,狭缝宽度为5.0 nm,对样品的荧光强度进行扫描。
1.3.6.3 三维荧光分析
采用荧光分光光度计测定蛋白质的高级结构变化。当激发波长(λex)范围为200~400 nm,发射波长(λem)范围为200~600 nm时,两者都以5 nm为间距增加,采集荧光信号得到激发发射矩阵荧光光谱,即三维荧光光谱。
1.3.7蛋白质表面疏水性的测定
本研究以ANS荧光探针法测定蛋白质的表面疏水性差异[17]。室温下以1∶50的比例向样品中加入5 mmol/L ANS溶液,避光反应1 h后使用荧光分光光度计检测荧光强度,激发波长(λex)为390 nm,发射波长(λem)为400~600 nm,扫描速度为1 200 nm/min,狭缝宽度为5.0 nm。
1.3.8脂肪分布的测定
使用激光共聚焦显微镜观察测定模拟基质的脂肪分布,参考谢安琪等[18]的方法并稍加修改。取1 mL样品加入20 μL质量浓度为0.01 g/L的尼罗红染料并混合均匀,避光放置30 min。将样品均匀涂布于载玻片上并固定在激光共聚焦显微镜载物台上,20倍物镜,设置激发波长为488 nm,并采集荧光图像。
1.3.9模拟基质粒度的测定
参考Xie等[19]的研究方法,采用动静态光散射表征模拟基质的平均粒径大小并比较粒径分布的情况。
1.3.10模拟基质微观结构的测定
参考步营等[20]的方法测定模拟基质的微观结构。蘸取少量脱脂前后的样品粉末均匀涂布于导电胶上,并将导电胶贴合在置物台上,将附有样品的置物台放在冷场发射扫描电镜下进行观察,电压设置为5 kV。
1.3.11牛乳过敏原质量浓度的测定
参考本团队先前建立的间接ELISA方法[21]并稍加修改,测定模拟基质中牛乳过敏原的浓度。分别以α-乳白蛋白、β-乳球蛋白、酪蛋白和稀释一定倍数的待测样品作为包被抗原,兔多克隆抗体作为一抗,辣根过氧化物酶(horseradish peroxidase, HRP)标记的羊抗兔IgG作为二抗。α-乳白蛋白:将α-乳白蛋白用PBS梯度稀释至0.031 25、0.062 5、0.125、0.25、0.5 μg/mL进行抗原包被,兔抗α-乳白蛋白血清稀释倍数为1∶160 000,绘制α-乳白蛋白的定量标准曲线。β-乳球蛋白:将β-乳球蛋白用PBS梯度稀释至0.156 25、0.312 5、0.625、1.25、2.5 μg/mL进行抗原包被,兔抗β-乳球蛋白血清稀释倍数为 1∶160 000。酪蛋白:将酪蛋白用PBS梯度稀释至0.125、0.25、0.5、1.0、2.0 μg/mL进行抗原包被,兔抗酪蛋白血清稀释倍数为1∶10 000。
1.4 数据处理
每组实验重复3次并取平均值,采用SPSS 24.0进行差异显著性分析,认为P<0.05时为具有显著性差异,采用Origin 9.0进行图形绘制。
2 结果与分析
2.1 脱脂方法对模拟基质脱脂率和蛋白损失率的影响
不同脱脂方法处理后样品的脱脂率和蛋白损失率见图1。由图1可知,4种脱脂方法的脱脂率由优到差依次为正己烷、乙酸乙酯、脂肪酶、异丙醇。正己烷和乙酸乙酯的脱脂率均超过80%,其中正己烷脱脂率高达87.87%。此外,脱脂处理后模拟基质中的蛋白质均出现不同程度的损失,其中正己烷对蛋白质含量的影响最小,损失率为6.86%,异丙醇影响最大,损失率超过30%。
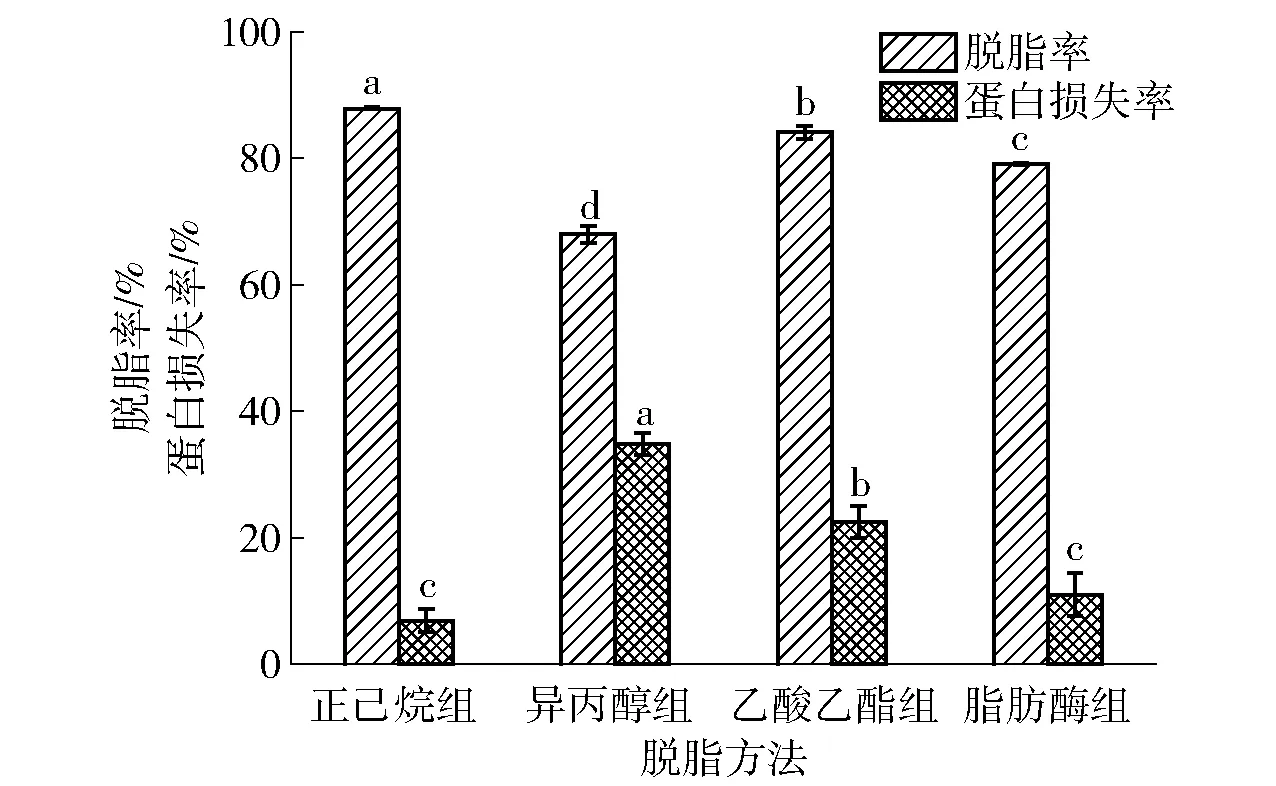
对照组为未经脱脂处理的巧克力样品,不同小写字母表示组间数据差异显著(P<0.05)。图1 脱脂方法处理后模拟基质的脱脂率和蛋白损失率Fig.1 Degreasing rate and protein loss rate of simulated matrix treated with different degreasing methods
2.2 脱脂方法对模拟基质中蛋白质分子质量的影响
不同脱脂方法处理后模拟基质中乳蛋白的SDS-PAGE电泳结果见图2。由图2可知,样品主要存在4条蛋白条带,分子质量依次位于35、25、15、10 kDa左右。这与预测的结果一致,巧克力中只含有乳蛋白,在25~35 kDa的是牛乳中含量最高的酪蛋白,分别位于15 kDa和10 kDa上方的是分子质量为18.3 kDa的β-乳球蛋白和14.2 kDa的α-乳白蛋白。脱脂前后样品中蛋白的组分和分子质量大小无显著变化,表明4种脱脂处理方法对样品中主要的牛乳过敏原蛋白的一级结构未产生影响。
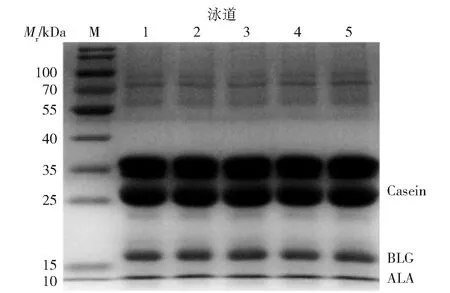
对照组为未经脱脂处理的巧克力样品。泳道M:蛋白 Marker;泳道1:对照组;泳道2~5 :正己烷组、异丙醇组、乙酸乙酯组和脂肪酶组。Casein:酪蛋白;ALA:α-乳白蛋白;BLG:β-乳球蛋白。图2 脱脂处理后模拟基质中蛋白质的SDS-PAGEFig.2 SDS-PAGE of proteins in simulated matrix after degreasing treatment
2.3 脱脂方法对模拟基质中蛋白质结构的影响
2.3.1圆二色谱分析结果
圆二色性光谱广泛应用于蛋白质构象研究领域。对不同脱脂方法处理前后蛋白质的圆二色性光谱进行分析,结果见图3和表1。由图3和表1可知,在190~240 nm的波长范围内,190 nm处的正峰和208、220 nm处的负峰是α-螺旋的特征峰,而195 nm左右的正峰和217 nm左右的负峰是β-折叠的特征峰。整体来看,脱脂处理改变了蛋白质的二级结构。和对照组相比,溶剂法脱脂处理后样品蛋白的α-螺旋含量均降低,正己烷、异丙醇和乙酸乙酯组分别降低了56.8%、88.1%和34.7%。异丙醇组β-转角含量降低41.8%,β-折叠和无规则卷曲含量分别升高了2.4和1.5倍。研究发现,氢键与二级结构含量的变化密切相关[22],脱脂溶剂中大多含有羟基、酯键、大量的氧原子和氢原子,可能与蛋白质发生相互作用从而改变了二级结构中氢键的顺序和排列模式,出现了大量反平行β-折叠聚集体[23]。此外,正己烷组β-转角含量升高了1.6倍,β-折叠含量降低了31.6%,无规则卷曲含量降低了92.5%。可能是因为α-螺旋结构被破坏,脯氨酸更加暴露于蛋白表面,促进了β-转角的形成[24]。乙酸乙酯组除α-螺旋和β-转角降低外,其他结构含量均略微升高,但整体而言变化最小。脂肪酶处理后α-螺旋含量升高36%,β-转角含量降低82.1%。这可能是由于脂肪酶处理后基质中与蛋白质结合的脂肪被去除,部分疏水区域暴露于蛋白质表面,由于疏水相互作用而出现蛋白质聚集。
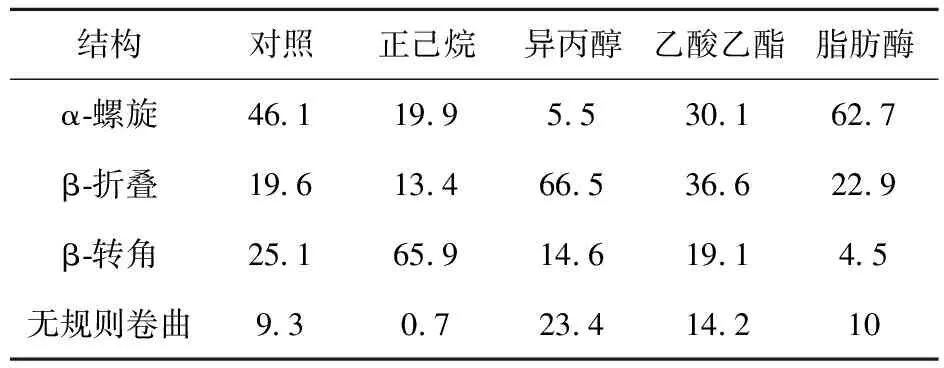
表1 脱脂处理后模拟基质中蛋白质的二级结构含量
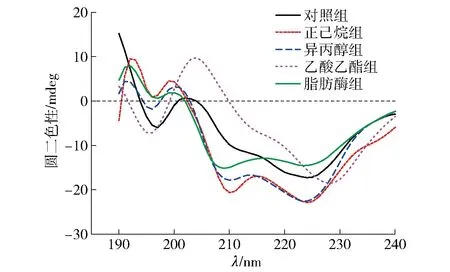
对照组为未经脱脂处理的巧克力样品。图3 脱脂处理后模拟基质中蛋白质的圆二色谱Fig.3 Circular dichroism spectrum of proteins in simulated matrix after degreasing treatment
2.3.2内源性荧光光谱分析结果
蛋白质的3种荧光氨基酸成分为色氨酸、酪氨酸和苯丙氨酸,色氨酸含量最多,酪氨酸的荧光通常会被淬灭,苯丙氨酸对蛋白质固有荧光的贡献由于其吸收率过低而通常忽略不计。因此,色氨酸通常被认为是蛋白质内源荧光光谱中340 nm处吸收峰的主要来源[25]。不同脱脂方法处理后蛋白质的内源性荧光光谱结果见图4。由图4可知,3种溶剂脱脂后模拟基质中蛋白质的内源性荧光强度均有不同程度的增强,而脂肪酶组的荧光强度略微降低。荧光增强可能是因为脂肪被脱除后蛋白质出现空穴结构,三级结构更为松散,色氨酸微环境的极性降低。脂肪酶因为特异性较强,相对来说对蛋白质的结构影响最小,但荧光强度有略微降低,可能是因为在脂肪酶脱脂之后,蛋白质结构先部分展开,但紧接着蛋白质之间产生新的疏水键,导致色氨酸和酪氨酸残基被进一步掩蔽。
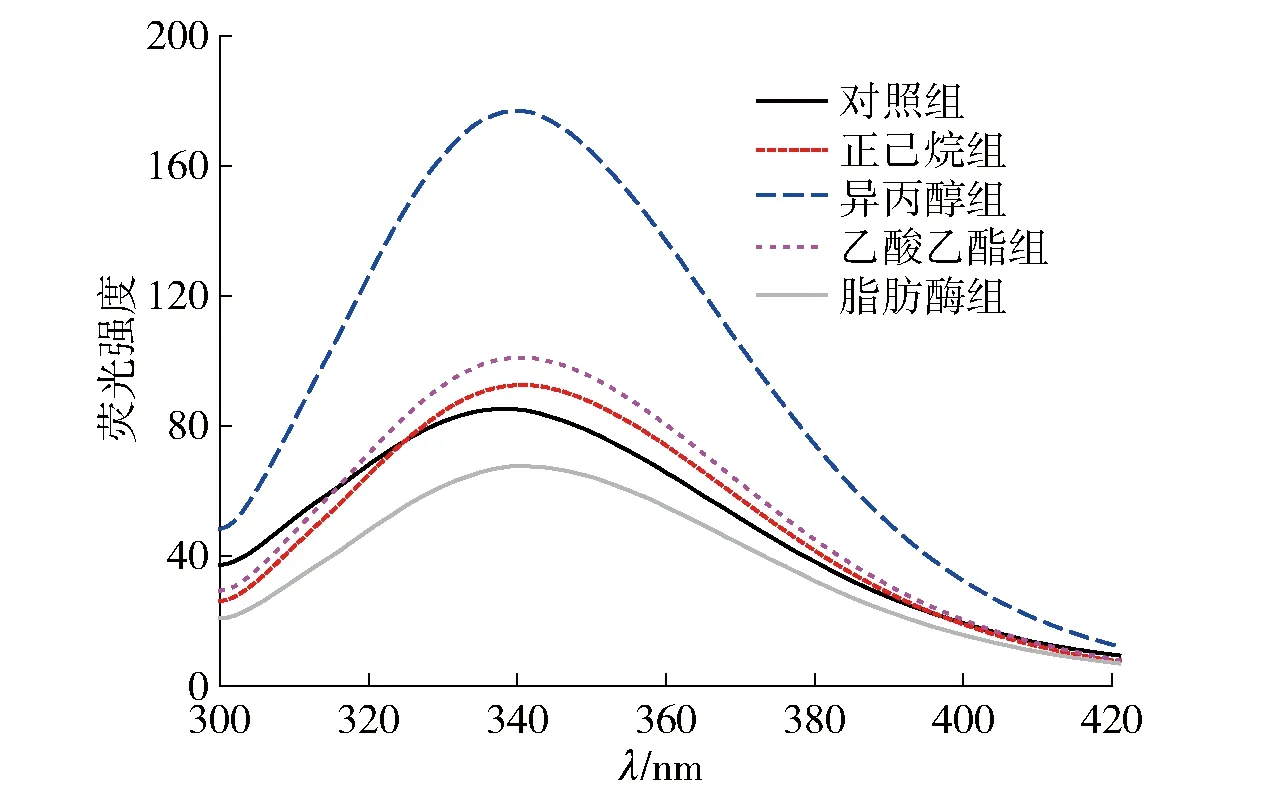
对照组为未经脱脂处理的巧克力样品。图4 脱脂处理后模拟基质中蛋白质的内源性荧光光谱Fig.4 Intrinsic fluorescence spectrum of proteins in simulated matrix after degreasing treatment
2.3.3三维荧光分析结果
不同脱脂方法处理后蛋白质的三维荧光光谱及结果见图5和表2。由图5和表2可知,三维荧光光谱的结果与内源性荧光光谱基本一致。样品出现了2个明显的蛋白荧光特征峰,峰a(λex=280 nm)和峰b(λex=235 nm)分别是由酪氨酸、色氨酸残基的π→π*跃迁和多肽链骨架的n→π*跃迁引起的特征峰,此外,色氨酸的吲哚基团被认为是蛋白质中约280 nm处紫外吸收最主要的来源,它们可以表征蛋白质的二级和三级结构[26]。结果表明:脱脂处理前后峰a位置无变化,峰b从原来的(λex=230 nm、λem=335 nm)红移至(λex=235 nm、λem=335 nm或λex=235 nm、λem=340 nm)。溶剂法脱脂处理后模拟基质中乳蛋白的三维荧光强度均升高,其中正己烷组对蛋白荧光强度影响最小,其次是乙酸乙酯。荧光增强可归因于脱脂溶剂中的羟基自由基或氧自由基具有优异的质子亲和能力,可能与芳香环中的氢质子结合,促使更多吲哚基团暴露[27]。相比于对照组,异丙醇组的峰a荧光强度升高了91.16%,同时峰b也升高了102.47%。异丙醇带有羟基,易与蛋白质二级结构中的氨基酸残基作用[28],破坏原有的α-螺旋、β-折叠含量和分布情况,使得蛋白质空间结构整体呈现解折叠和展开的趋势,这与圆二色性光谱的结果一致。脂肪酶因为特异性较强,相对来说对蛋白质的结构影响较小,但荧光强度有略微降低,可能是因为在脂肪酶脱脂之后,原脂肪与蛋白质结合的位置形成了部分空穴结构,促使蛋白质分子之间产生一定的疏水相互作用而部分聚集。
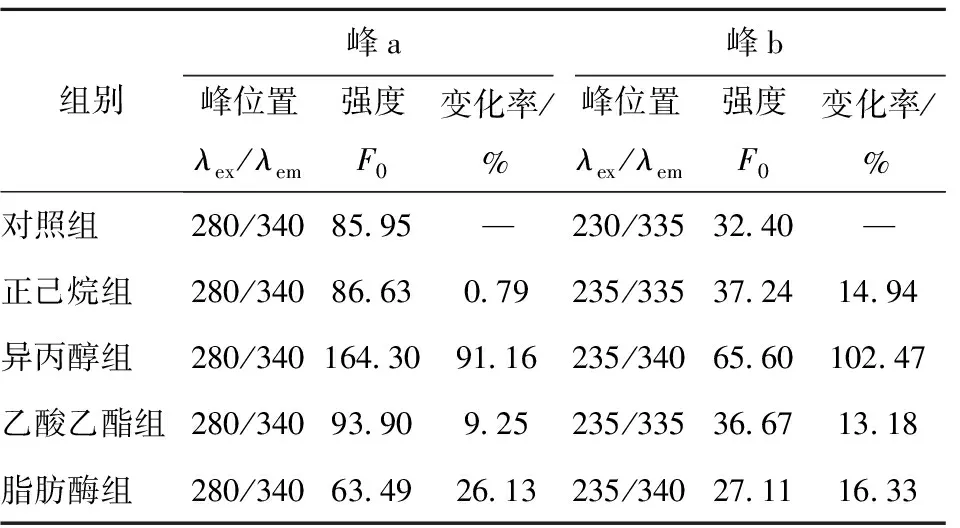
表2 脱脂处理后模拟基质中蛋白质的三维荧光光谱峰位置和峰强度
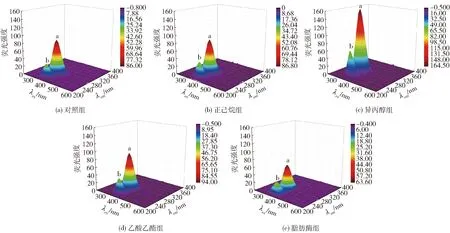
对照组为未经脱脂处理的巧克力样品。图5 脱脂处理后模拟基质中蛋白质的三维荧光光谱Fig.5 Three-dimensional fluorescence spectra of proteins in simulated matrix after degreasing treatment
2.4 脱脂方法对模拟基质中蛋白质表面疏水性的影响
ANS可与蛋白质结构中的疏水位点结合,因而测量蛋白质的表面疏水性可采用此法[29]。不同脱脂方法处理后蛋白质的ANS荧光光谱结果见图6。由图6可知,除脂肪酶组外,溶剂脱脂均使得蛋白的表面疏水性增强。其中,异丙醇组疏水性最强,脂肪酶组最弱且低于对照组。通常来说,蛋白质的带电基团和极性氨基酸残基通常位于外部,而非极性部分主要位于蛋白质折叠结构的内部[30]。根据圆二色谱和内源性荧光光谱的结果可知,溶剂脱脂处理使得模拟基质中蛋白质结构发生了不同程度的解折叠和展开,这可能使得原本包裹在内部的疏水性空腔暴露于外部,从而为ANS提供了更多的结合位点。研究表明,在高脂肪食品中脂肪与蛋白质接触紧密,脂肪在水解过程中产生的超氧化物自由基会促使蛋白质也发生氧化,而蛋白质氧化会引发氨基酸侧链的碳化[31]。因此,脂肪酶的水解作用可能使得乳蛋白表面疏水性侧链基团改变,导致ANS结合位点减少。
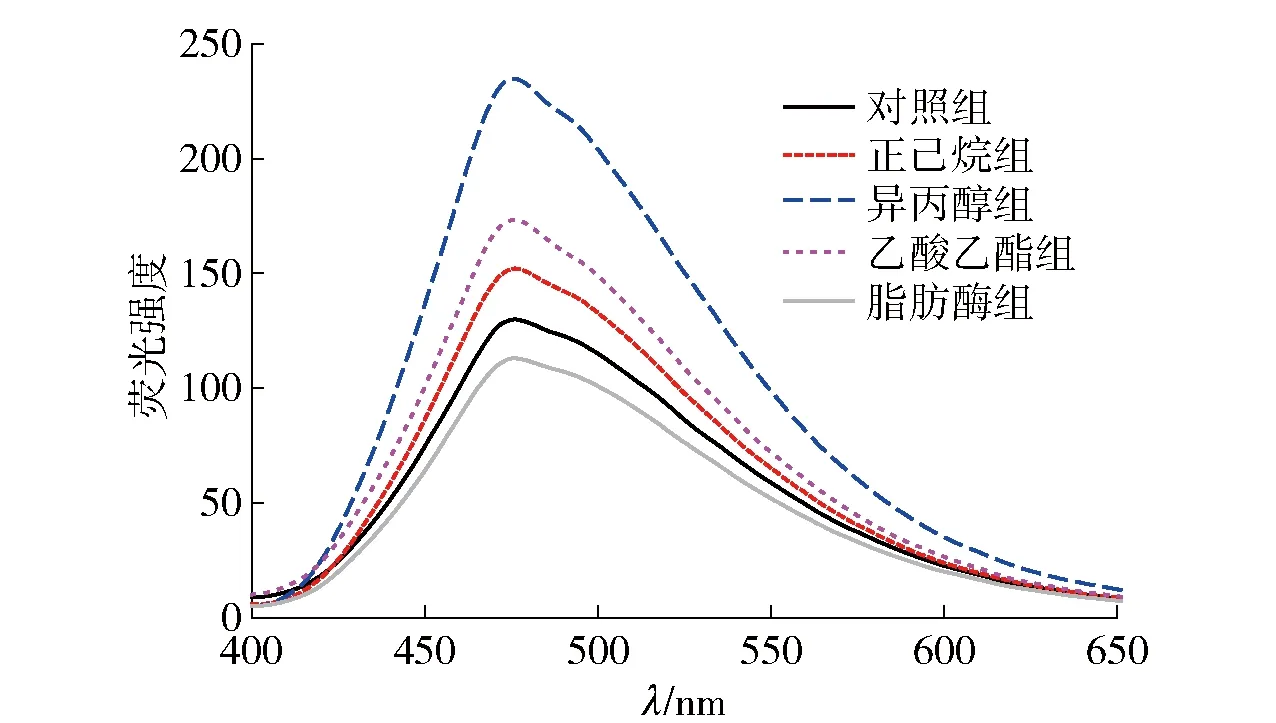
对照组为未经脱脂处理的巧克力样品。图6 脱脂处理后模拟基质中蛋白质的ANS荧光光谱Fig.6 ANS fluorescence spectrum of proteins in simulated matrix after degreasing treatment
2.5 脱脂方法对模拟基质脂肪分布的影响
脂肪用质量分数为0.1%的尼罗红染色,并将信号设置为绿色,可以清晰直观地看到模拟基质中绿色脂肪液滴的大小和分布情况。不同脱脂方法处理前后模拟基质的共聚焦显微镜观察结果见图7。由图7可知,未经处理的对照组中存在大量脂肪,脂肪液滴直径较大并呈现出大面积的聚集现象。经过不同脱脂方法处理后,脂肪液滴表现出不同程度的减小,整体分布由大量聚集变得更为分散和均匀。其中正己烷组的液滴最小且数量最少,其次是乙酸乙酯和脂肪酶。与脱脂率的结果一致,异丙醇组虽然未见明显的大脂肪块,但液滴分布仍然较为密集,去除的脂肪在4种脱脂方法中最少。根据相似相溶原理,结构相似的化合物更容易互相混溶,可能是因为异丙醇的极性比正己烷和乙酸乙酯的更强,脂肪在强极性环境中溶解性较差。相反,正己烷的极性最弱,更有利于脂肪的溶解和去除。

对照组为未经脱脂处理的巧克力样品。图7 激光共聚焦显微镜下脱脂处理后的模拟基质Fig.7 Laser confocal micrographs of simulated matrix after degreasing treatment
2.6 脱脂方法对模拟基质粒度的影响
脱脂处理后模拟基质的粒度测定结果见图8。由图8可知,从粒度分布情况来看,对照组颗粒大小均一且呈现单峰分布,正己烷组和乙酸乙酯组的变化较小,同样呈现单峰分布。异丙醇组和脂肪酶组由单峰分布变为双峰分布,说明模拟基质中产生了大颗粒聚集体。从平均粒径来看,正己烷组和乙酸乙酯组的粒径略微降低,这可能是因为脱脂处理后脂肪分子从蛋白质-脂肪复合物上脱去,溶液体系粒径随之降低。相反的是,异丙醇组粒径显著升高,由297.9 nm升高至445.1 nm,可能是因为异丙醇显著改变了蛋白质的空间结构,使其过度变性,形成了更大的聚集体。同时,异丙醇组的脱脂率最低,体系内残留的脂肪易与蛋白质的疏水侧链重新结合形成新的复合物。
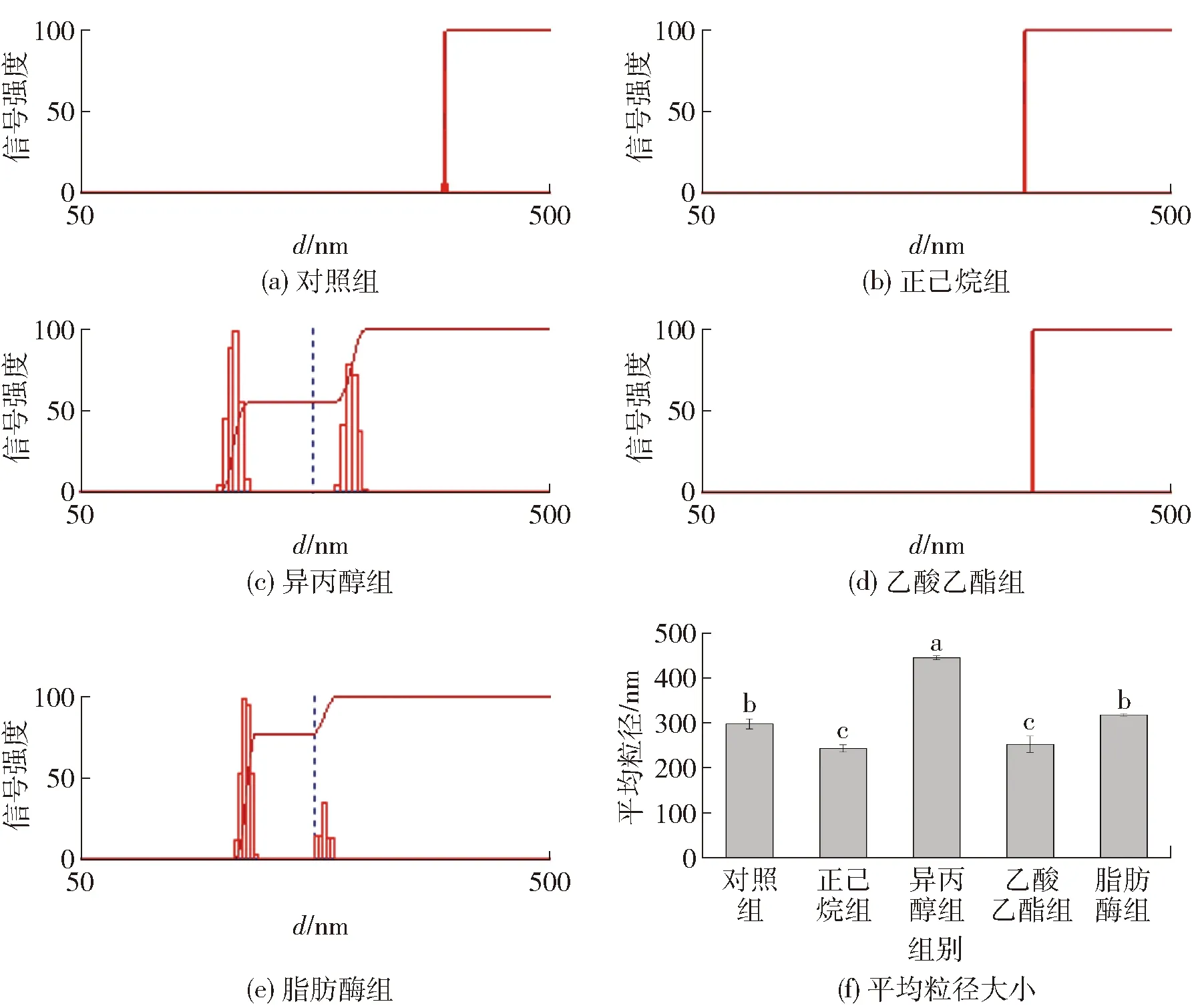
对照组为未经脱脂处理的巧克力样品;图8(a)至图8(e)为不同脱脂方法处理后模拟基质的粒径大小分布情况,图8(f)为平均粒径大小;不同小写字母表示组间数据差异显著(P<0.05)。图8 脱脂处理后模拟基质的粒度Fig.8 Particle size of simulated matrix after degreasing treatment
2.7 脱脂方法对模拟基质微观结构的影响
在放大倍数为5 000倍下使用扫描电镜观察不同方法脱脂前后模拟基质的微观结构变化,结果见图9。由图9可知,脱脂处理后表面形貌发生了明显的改变。由图9(a)可知,未处理的模拟基质表面光滑,内部结构紧凑,视野内可见大范围的致密平滑结构,可能是因为基质中的脂肪与蛋白质发生相互作用,致使颗粒之间大量聚集黏附。由图9(b)可知,正己烷脱脂处理后基质呈现出了多孔疏松的立体网状结构,这是由于脂肪分子被脱去后基质颗粒黏连情况明显减少,蛋白质由大量聚集转变为均一分散的状态,因而显示出更为清晰的骨架。乙酸乙酯脱脂后基质表面出现明显的裂解,产生明显的空腔,但其蛋白质微观结构不均一且仍存在少量结块,这可能是因为乙酸乙酯破坏了部分蛋白质结构,导致其整体骨架结构不明显[32]。脂肪酶脱脂后基质表面虽然出现了少许直径较大的孔洞,但仍可看出其余部分存在明显的光滑平面和块状堆积。异丙醇组呈现出不规则大小的结块,一方面是因为脂肪残留较多,另一方面是因为异丙醇对蛋白质结构破坏最为显著,蛋白质之间发生了聚集现象,基质重新形成平滑致密的结构[14]。
2.8 脱脂方法对牛乳过敏原提取质量浓度的影响
利用间接ELISA获得模拟基质中3种主要牛乳过敏原的质量浓度,结果见图10。由图10可知,溶剂脱脂处理整体提高了模拟基质中过敏原的提取质量浓度。然而,在脂肪酶组中表现为降低的趋势,不利于过敏原的提取和定量检测。牛乳中蛋白质的含量为3.0%~3.5%,其中酪蛋白占80%,是牛乳中含量最高的过敏原。除脂肪酶之外,其他3种溶剂脱脂均提高了酪蛋白的提取率。其中,乙酸乙酯组的过敏原质量浓度最高,由对照组的31.3 mg/mL升高至50.4 mg/mL,提升了61.02%。尽管该方法整体的蛋白损失率高于正己烷,但结果显示其更适合于酪蛋白的提取。对于α-乳白蛋白和β-乳球蛋白,正己烷脱脂后两者的质量浓度最高,分别为0.73 mg/mL和1.89 mg/mL。可能是因为正己烷的脱脂效果最佳,消除了脂肪基质对过敏原提取的阻碍作用。同时,该方法下的蛋白质损失量也最少,说明过敏原在该溶剂中的溶解度低,可以较好地保留下来。然而,异丙醇和乙酸乙酯处理后α-乳白蛋白和β-乳球蛋白的浓度均有所降低,可能是因为它们对这两种过敏原蛋白结构影响较为显著,从而使得表位更为隐蔽,甚至破坏了过敏原内部表位[33]。
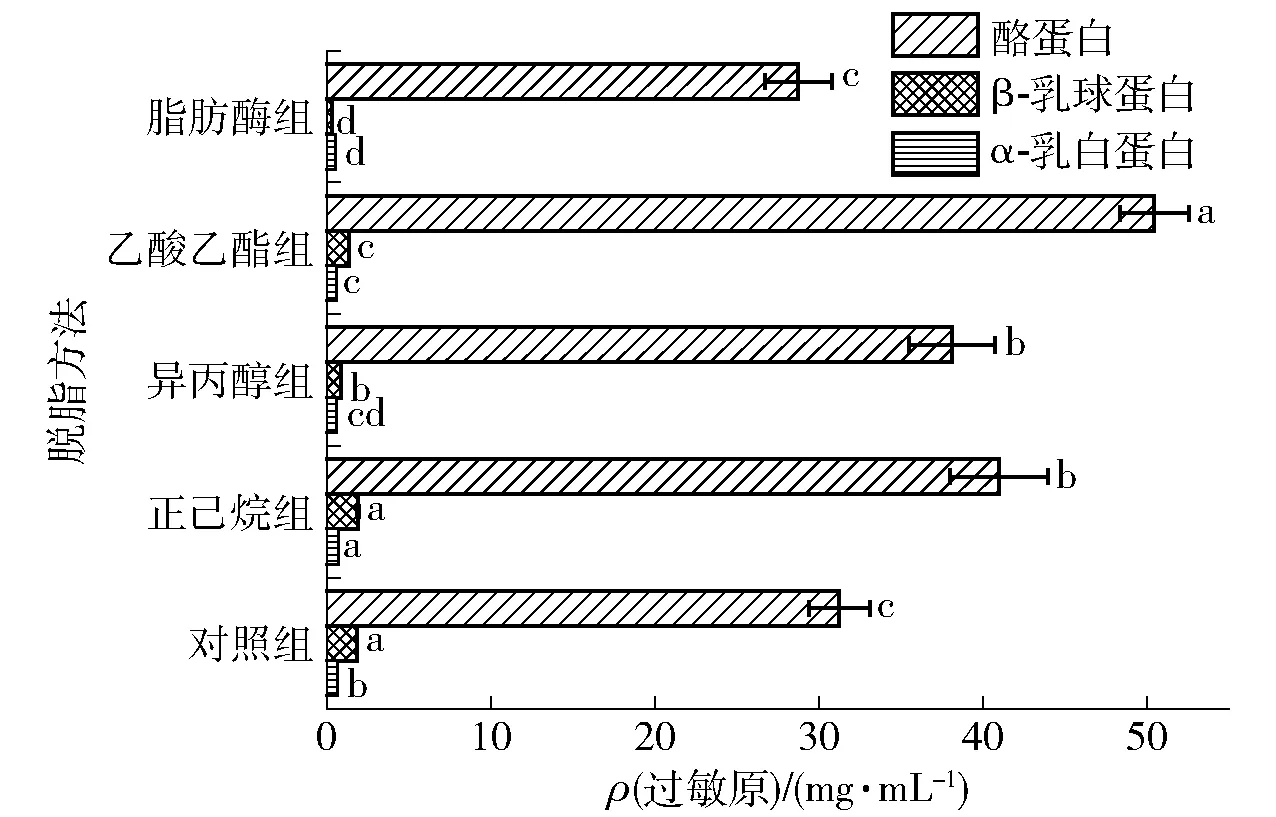
对照组为未经脱脂处理的巧克力样品;不同小写字母表示组间数据差异显著(P<0.05)。图10 脱脂前后模拟基质中主要牛乳过敏原的质量浓度Fig.10 Main milk allergens concentration in simulated matrix after degreasing methods treatment
3 结 论
通过与过敏原发生相互作用,复杂食物基质中的脂肪会影响过敏原的提取和抗原抗体反应从而影响过敏原检测结果。本研究首次提出通过脱脂处理提升高脂肪复杂食物基质中牛乳过敏原检测前处理效果的方法,利用正己烷、异丙醇、乙酸乙酯和脂肪酶对含有牛乳过敏原的高脂肪巧克力进行脱脂处理,发现脂肪酶组效果不理想,而脱脂剂可以提高牛乳过敏原的溶出率。正己烷的脱脂率最高且蛋白损失率最低,分别为87.87%和6.86%。相比于未脱脂样品,酪蛋白在乙酸乙酯组中的提取率最高并提升了61.02%,α-乳白蛋白和β-乳球蛋白在正己烷组中的提取质量浓度最高,分别为0.73 mg/mL和1.89 mg/mL,并且正己烷和乙酸乙酯对过敏原蛋白的结构破坏较小,可以较好地维持过敏原的致敏性。为了进一步优化高脂肪型食物基质中牛乳过敏原检测的前处理方法,后续将对脱脂处理后过敏原的提取体系进行研究。此外,还存在高淀粉和高蛋白等多个类型的复杂食物基质,未来应针对不同类型的复杂食物基质建立相应的研究方案,为获得更为完善的牛乳过敏原检测前处理方法提供理论依据。
