负载2种益生菌的多核微胶囊制备方法及特性研究
2023-11-06常诗晗乌日娜方海田刘晓燕滕政蓉任广钰刘慧燕武俊瑞
常诗晗, 乌日娜, 方海田, 刘晓燕, 滕政蓉, 任广钰,张 英, 刘慧燕,*, 武俊瑞,*
(1.沈阳农业大学 食品学院, 辽宁 沈阳 110866;2.辽宁省食品发酵技术工程研究中心, 辽宁 沈阳 110866;3.宁夏食品微生物应用技术与安全控制重点实验室/宁夏大学 食品与葡萄酒学院,宁夏 银川 750021;4.沈阳市微生物发酵技术创新重点实验室, 辽宁 沈阳 110866;5.宁夏伊品生物科技股份有限公司, 宁夏 银川 750001)
双歧杆菌是一种严格厌氧的益生菌,具有预防肠道感染,降低胆固醇水平,维持肠黏膜屏障完整性和抵抗病原体在肠道定植等一系列促进健康的特性[1-2]。在食品加工过程中以及在到达结肠之前的胃肠道运输过程中,双歧杆菌的生存能力经常受到阻碍。许多益生菌对胃中低pH值和近端肠内高浓度的胆盐环境都很敏感,在暴露于胃液时会失活[3]。益生菌在宿主体内达到预期效果,其活菌数必须在106CFU/g以上[4]。因此,为双歧杆菌创造严格的生长环境以及开发有效保护益生菌活性的技术具有重要意义。
微胶囊化包埋技术可以保护益生菌免受外部环境和胃肠道的不利条件的影响,提供足够的细菌数量,实现其益生作用,并延长其生命周期[5]。合理运用微胶囊技术和壁材,可提高包埋率与稳定性,将微胶囊的粒径控制在一个合适的范围内[6-7],也可以使其在特定条件下释放[8-9]。 内源乳化法和挤压法在微胶囊实验领域应用较广泛[10],是可行的益生菌保护、应用和控释技术。Holkem等[11]通过内源乳化法制备双歧杆菌BB-12微颗粒,并对其钙离子缓释效果进行了评价。结果表明,微球对双歧杆菌BB-12具有保护作用,在pH值7.5的条件下呈现出释放性。挤压法操作温和、简单、成本低,且不涉及任何有害溶剂,能够减少细胞的损伤,提高包埋效率[12]。此方法使用的材料中以海藻酸钠作为壁材的固定化应用最多。海藻酸盐是一种常用于固定活细胞的聚合物,具有很强的交联能力和不同分子质量的温和胶凝特性[13],有生物相容性好、无毒、可生物降解和低成本的特点,被广泛应用于益生菌微胶囊的制备中[14]。然而,仅由海藻酸盐制成的益生菌胶囊表面较粗糙,有孔隙和裂缝,所形成的凝胶孔隙可达5~200 nm[15]。在较低的pH值溶液时(例如在胃肠道条件下),单独的海藻酸钠不能有效地阻隔胃酸的渗入,无法更好地保护益生菌[16-17]。将海藻酸盐与其他聚合物混合能够增强微胶囊对酸性介质的耐受性,从而提高益生菌的存活率[18]。Han等[19]利用海藻酸钙-乳清蛋白分离物为壁材制备保加利亚乳杆菌和副干酪乳杆菌微胶囊,结果表明微胶囊中益生菌的存活率从3%提高到了41.26%。
国内外有关益生菌微胶囊的研究大多停留在方法和壁材上,且混合益生菌微生态制剂普遍存在活性保持与协同作用技术难题,关于益生菌微胶囊在实现分隔包埋以及在胃肠道的缓释情况方面的研究甚少。本研究拟对B.adolescensFS2-3和B.subtilisSN15-2进行微胶囊双菌分隔包埋,希望为防止益生菌菌株的直接接触抑制,创造一个良好的环境。采用海藻酸钠为壁材,同时添加巯基化羧甲基纤维素钠(CMC-SH)加强益生菌在肠道内的黏附性。研究益生菌在模拟胃肠道中活力变化及释放特性,并观察微胶囊在储存期间活菌数的变化。研究旨在为解决双歧杆菌不耐人体胃肠道恶劣环境的问题,以及具有肠道缓释功能的益生菌微胶囊分隔包埋问题提供新思路。
1 材料与方法
1.1 材料与试剂
海藻酸钠、氯化钙、碳酸钙、磷酸盐缓冲液、醋酸、氢氧化钠、盐酸,Biowest 公司;CMC-SH、CMC、N-(3-二甲氨基丙基)-N′-乙基碳二亚胺盐酸盐(EDC·HCl)、半胱氨酸盐酸盐、氯化钠、吐温-80、冰乙酸、胃蛋白酶、磷酸二氢钾、胆盐、胰蛋白酶,北京化工厂;金龙鱼大豆油,家乐福超市;N-羟基丁二酰亚胺(NHS)、二硫苏糖醇(DTT),北京索莱宝生物科技有限公司。
1.2 仪器与设备
TG-16G型低温高速离心机,上海安亭科学仪器厂;LGJ-10N/A型真空冷冻干燥机,上海浦东冷冻干燥设备有限公司;S-4800型扫描电子显微镜,日本日立高科技公司;BX43型显微镜,日本奥林巴斯公司;Secura 225D-1CN型天平,北京Sartorius公司;MLS-3780型高压蒸汽灭菌器,日本三洋公司。
1.3 实验方法
1.3.1菌种活化
青春双歧杆菌(B.adolescensFS2-3)活化:取-80 ℃超低温冰箱中甘油保藏的菌株解冻,在双歧杆菌固体培养基上划线,放置在含体积分数5%的CO2、5%的H2、90%的N2的厌氧培养箱中培养48 h。复苏后,挑取单菌落染色鉴定后,接种于双歧杆菌液体培养基中培养48 h。按体积分数为1%的接种比例接入双歧杆菌液体培养基中传代。
枯草芽孢杆菌(B.subtilisSN15-2)活化:将-80 ℃超低温冰箱中甘油保藏的菌株解冻,取一定菌液于LB固体培养基平板上划线,37 ℃过夜培养。接种环挑取菌落,接入LB液体培养基中,于37 ℃、150 r/min摇瓶培养24 h,备用。
1.3.2CMC-SH与海藻酸钠复合薄膜的制备
1.3.2.1 CMC-SH的制备
参照Deng等[20]方法,并稍加修改。将0.10 g CMC溶解在20 mL的超纯水中,加入0.22 g EDC·HCl和 0.13 g NHS, 调节pH值至4.8,于25 ℃下搅拌 2 h, 然后加入0.475 g半胱氨酸盐酸盐,用超纯水透析24 h。透析后,加入0.295 g DTT,pH值调为8.5,置于室温反应24 h。盐酸调节0.1 mol/L NaCl溶液至pH值为3.5,用于混合物透析。透析24 h后,再用pH 值3.5的HCl溶液透析48 h,冻干。
1.3.2.2 复合薄膜的制备
分别称量1 g的CMC和CMC-SH溶解于20 mL蒸馏水中。再称取0.6 g海藻酸钠加入上述溶液中,放置于25 ℃摇床中,溶胀4 h。取300 mg甘油加入溶液中,并超声处理2~3 min。将溶液分装倒入直径为7 cm的平底模具中,置于60 ℃烘箱中干燥6 h。再放于50%湿度、25 ℃条件下干燥48 h,备用。单一的海藻酸钠薄膜制备方法同上。
1.3.3微胶囊的制备方法
1.3.3.1 内芯微球的制备
采用内源乳化法制备内芯微球,参照李龙等[21]的方法,略有修改。取1 mLB.adolescensFS2-3(1×108CFU/mL)于1.5 mL离心管中,并按菌液体积的1%加入CMC-SH混合。将20 mL质量分数为2%海藻酸钠和0.1 g CaCO3与上述菌液充分混合,用灭菌水补足至60 mL。向混合液中加入含有质量浓度2 g/L吐温-80的大豆油180 mL。放置于400 r/min磁力搅拌器上乳化5 min。加200 μL乙酸继续乳化10 min。乳化后加灭菌蒸馏水使混合液分层,待凝胶成型的微胶囊都沉降到溶液底部后,吸去油相,离心收集微胶囊并洗涤3次,去除表面油相和菌体,保存好备用。
1.3.3.2 外壳微球的制备
采用挤压法制备外壳微球,配制50 mL质量分数为3%的海藻酸钠,200 mL质量分数为2%的氯化钙于121 ℃高压灭菌锅中灭菌20 min。取1 mLB.subtilisSN15-2(1×108CFU/mL)与1.3.3.1节制得的1 mL湿微球混合。将菌球混合液按体积比1∶1和海藻酸钠充分混合,菌胶混合液在注射泵的压力下,通过注射器和毛细管制得的微通道,进入质量分数为2%的氯化钙溶液中,搅拌钙化15 min。离心后洗涤,收集得到益生菌双菌微胶囊。
1.3.4微胶囊制备条件的单因素优化实验
以包埋率为考察指标考察不同因素对益生菌双菌微胶囊的影响,综合分析后选择了6种因素进行实验,见表1。
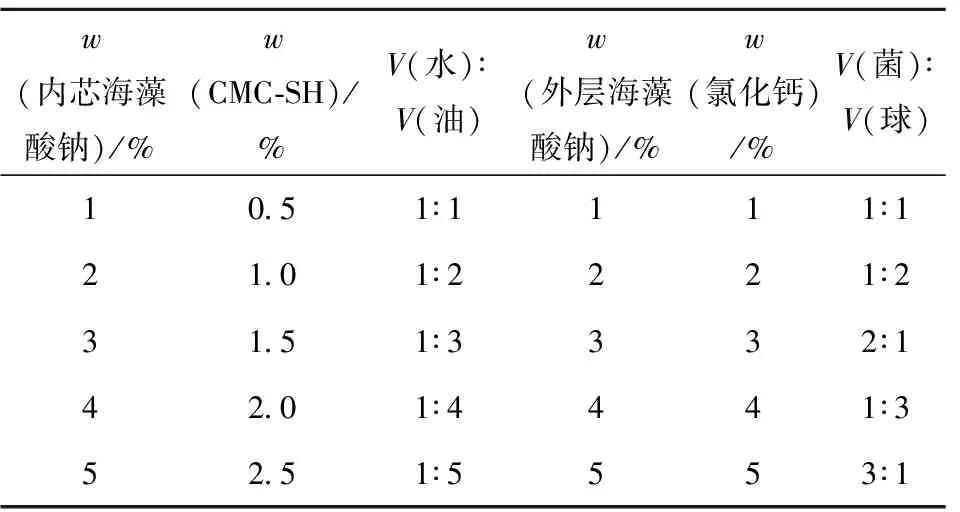
表1 单因素变量
1.3.4.1 内芯海藻酸钠质量分数的优化
实验过程保持CMC-SH在菌液中质量分数为1%,水油体积比为1∶3,外层海藻酸钠质量分数为3%,氯化钙质量分数为2%,菌液与内芯微球比例为1∶1。按照不同内芯海藻酸钠质量分数1%、2%、3%、4%、5%制备微胶囊。
1.3.4.2 CMC-SH质量分数的优化
实验过程保持内芯海藻酸钠质量分数为2%,水油体积比为1∶3,外层海藻酸钠质量分数为3%,氯化钙质量分数为2%,菌液与内芯微球比例为 1∶1。按照CMC-SH在菌液中不同质量分数(0.5%、1.0%、1.5%、2.0%、2.5%)制备微胶囊。
1.3.4.3 水相和油相体积比的优化
实验过程保持内芯海藻酸钠质量分数为2%,CMC-SH在菌液中质量分数为1%,外层海藻酸钠质量分数为3%,氯化钙质量分数为2%,菌液与内芯微球体积比为1∶1。按照不同水相与油相体积比(1∶1、1∶2、1∶3、1∶4、1∶5)制备微胶囊。
1.3.4.4 外层海藻酸钠质量分数的优化
实验过程保持内芯海藻酸钠质量分数为2%,CMC-SH在菌液中质量分数为1%,水油体积比为1∶3,氯化钙质量分数为2%,菌液与内芯微球体积比为1∶1。按照不同外层海藻酸钠质量分数(1%、2%、3%、4%、5%)制备微胶囊。
1.3.4.5 氯化钙质量分数的优化
实验过程保持内芯海藻酸钠质量分数为2%,CMC-SH在菌液中质量分数为1%,水油体积比为1∶3,外层海藻酸钠质量分数为3%,菌液与内芯微球体积比例为1∶1。按照不同氯化钙质量分数(1%、2%、3%、4%、5%)制备微胶囊。
1.3.4.6 菌液和内芯微球比例的优化
实验过程保持内芯海藻酸钠质量分数为2%,CMC-SH在菌液中质量分数为1%,水油体积比为1∶3,外层海藻酸钠质量分数为3%,氯化钙质量分数为2%。按照不同菌液与内芯微球体积比(1∶1、1∶2、2∶1、1∶3、3∶1)制备微胶囊。
1.3.5微胶囊包埋工艺的响应面优化
根据Box-Behnken中心组合试验的设计原理,在单因素实验的基础上,采取四因素三水平设计响应面优化试验。以包埋率为响应值,利用Design Expert进行分析。各因素及水平设置如表2。
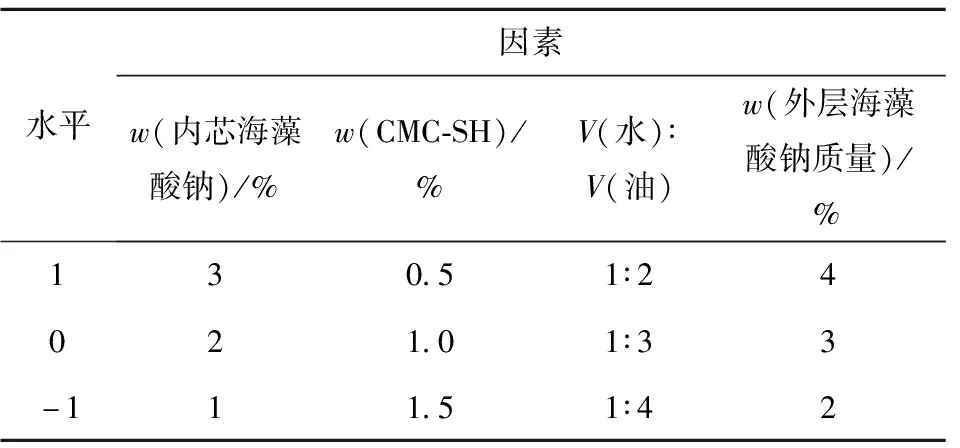
表2 响应面试验因素水平
1.3.6微胶囊包埋率的测定
参照Fritzen等[22]的方法,并稍加修改。称取制成的益生菌双菌微胶囊1 g,加入9 mL解囊液(质量分数为3%的柠檬酸三钠)中,置于37 ℃摇床中振荡。促使微胶囊中的益生菌完全释放进行平板计数。经过梯度稀释后,将菌悬液分成2份,1份涂布于双歧杆菌固体培养基上,于厌氧箱中培养24 h。另1份涂布于LB固体培养基上,置于 37 ℃ 培养箱中培养24 h,统计总菌数。根据 式(1) 计算微胶囊包埋率。
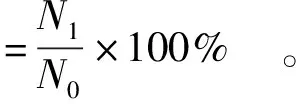
(1)
式(1)中,N0为制备微胶囊时起始添加的活菌数,CFU/g;N1为微胶囊中包埋的活菌数,CFU/g。
1.3.7微胶囊的结构形貌观察
采用扫描电镜(SEM)观察微胶囊冷冻干燥后的形态。用双面胶带固定在微胶囊表面,吹去多余粉末。样品通过溅射镀铜管镀金2.5 min,将微胶囊置于载玻片上,采用光学显微镜在10~100倍观察微胶囊形貌。
1.3.8微胶囊在模拟人工胃肠液中释放率的测定
1)模拟人工胃液制备。参照刘月静[23]的方法,并稍加修改。取质量浓度为2 g/L NaCl溶液,调pH值至2。取3 g胃蛋白酶,加入NaCl溶液中充分混匀,用0.22 μm滤膜过滤除菌,现用现配。
2)模拟人工肠液配制。基于Afzaal等[24]的方法,并稍加修改。取 6.8 g K2HPO4,用500 mL蒸馏水溶解,NaOH溶液调节pH值至6.8。另取10 g胰酶,加适量的水使其溶解,将2种溶液混合,并加水定容至1 000 mL,滤膜过滤,现用现配。
3)解囊液的配制。将质量分数为3%的柠檬酸三钠,溶解于50 mL蒸馏水中,121 ℃灭菌20 min备用。
称量1 g微胶囊,用无菌水充分洗涤。再将微胶囊加入9 mL预热的人工胃液中处理2 h后,转移至9 mL预热的人工肠液中,于37 ℃,100 r/min水浴摇床中振荡1 h,每隔一段时间取1管样品。根据式(2)计算微胶囊释放率。
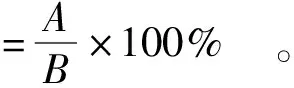
(2)
式(2)中,A为人工胃肠液处理后的活菌数,CFU/g;B为人工胃肠液处理前的活菌数,CFU/g。
1.3.9微胶囊的储存稳定性评价
基于姚泽晨[25]的方法,并稍加修改。将益生菌双菌微胶囊分装于2 mL离心管中,在4、25 ℃温度条件下保存6周。每周取1管,评价储存稳定性。
1.4 数据处理
实验均重复3次,结果用平均值±标准偏差表示。使用SPSS 22.0统计软件对数据进行显著性分析,P<0.05表示差异具有显著性,同时利用Origin 2020软件绘图。
2 结果与讨论
2.1 不同单因素对益生菌包埋率的影响
2.1.1内芯海藻酸钠质量分数对益生菌包埋率的影响
海藻酸钠对益生菌包埋率影响见图1。由图1可知,随着海藻酸钠质量分数的增加,包埋率呈先上升后下降的趋势。当海藻酸钠质量分数达到2% 时,包埋率达到最大,与其他组有明显差异性。海藻酸钠质量分数过低时,胶囊的外壁过薄,机械强度较弱,不能有效包埋菌体。而当海藻酸钠质量分数高于2%时,溶液黏度和密度也会随之变大,这使得凝胶网络结构的空隙无法容纳更多芯材,影响成球效果[26]。因此,内芯海藻酸钠较优质量分数为2%。
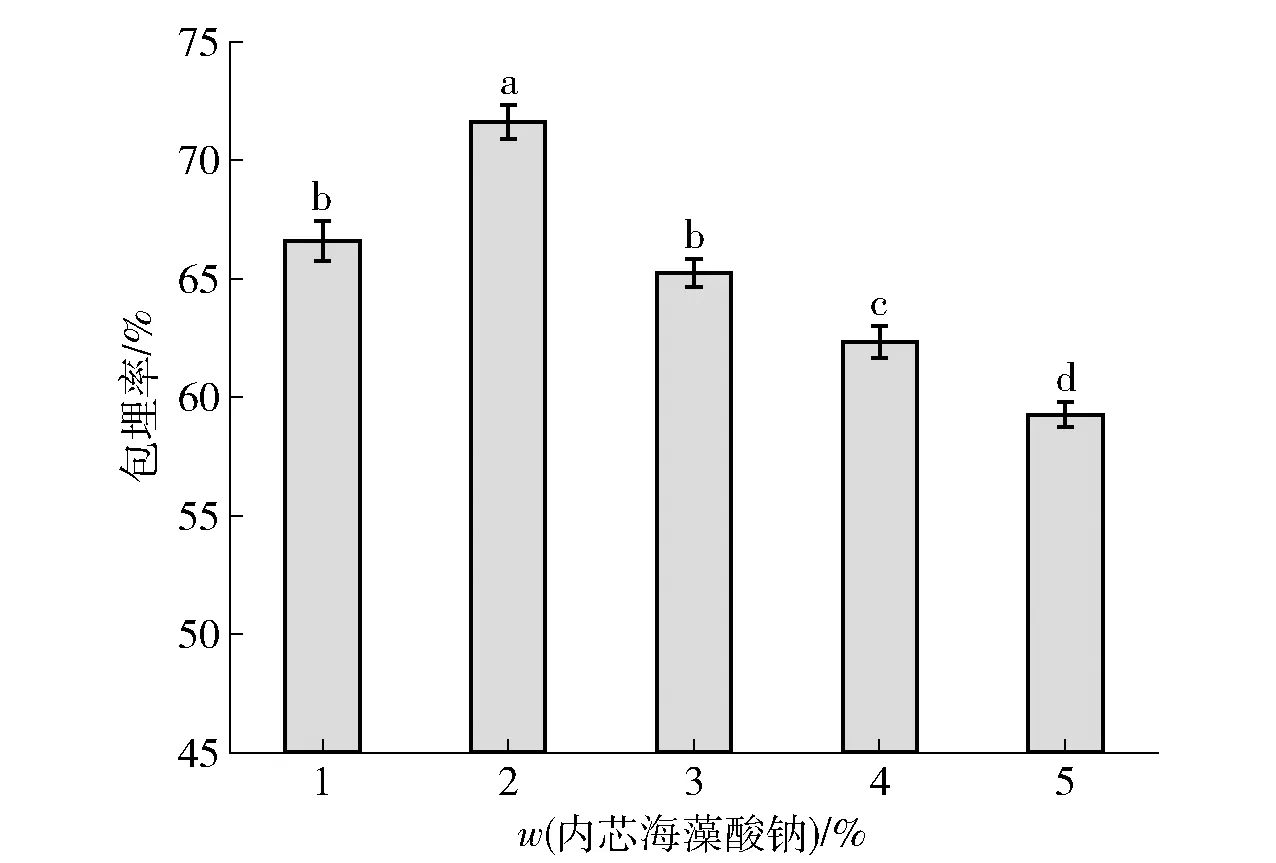
不同小写字母表示组间数据差异显著(P<0.05)。图1 内芯海藻酸钠质量分数对益生菌包埋率的影响Fig.1 Effect of sodium alginate concentration on inner core on probiotic embedding rate
2.1.2CMC-SH质量分数对益生菌包埋率的影响
CMC-SH对益生菌包埋率影响见图2。由图2可知,随着CMC-SH质量分数的增加,微胶囊的包埋率增加,当CMC-SH质量分数为1%时,微胶囊包埋率最大,CMC-SH的质量分数继续增大会不利于益生菌的包埋。CMC-SH的添加使海藻酸钠凝胶孔隙变小,有效提高微胶囊对益生菌的保护作用。而CMC-SH本身就具有一定黏弹性,质量分数过大会使要包埋的菌体分散较为困难,不利于溶解,进而引起包埋率降低。在质量分数为1%时包埋达到较佳效果,而质量分数在2%以上时已经不利于包埋,影响益生菌包埋率。因此,选用质量分数为1%的CMC-SH进行包埋。
2.1.3水相与油相体积比对益生菌包埋率的影响
水相油相体积比对益生菌包埋率的影响见 图3。 由图3可知,随着水相油相体积比的改变,微胶囊的包埋率也随之变化。当油相体积过小时,形成微球之间摩擦力过大,影响包埋率。而油相体积增加过大时,单位体积豆油中海藻酸钠含量过高,过多的菌体进入囊结构中导致囊壁变薄,在后续的搅拌过程中容易致使结构破裂,造成包埋率下降[27-28]。因此,结合数据选用水相与油相体积比为 1∶3,该比值较适于包埋。
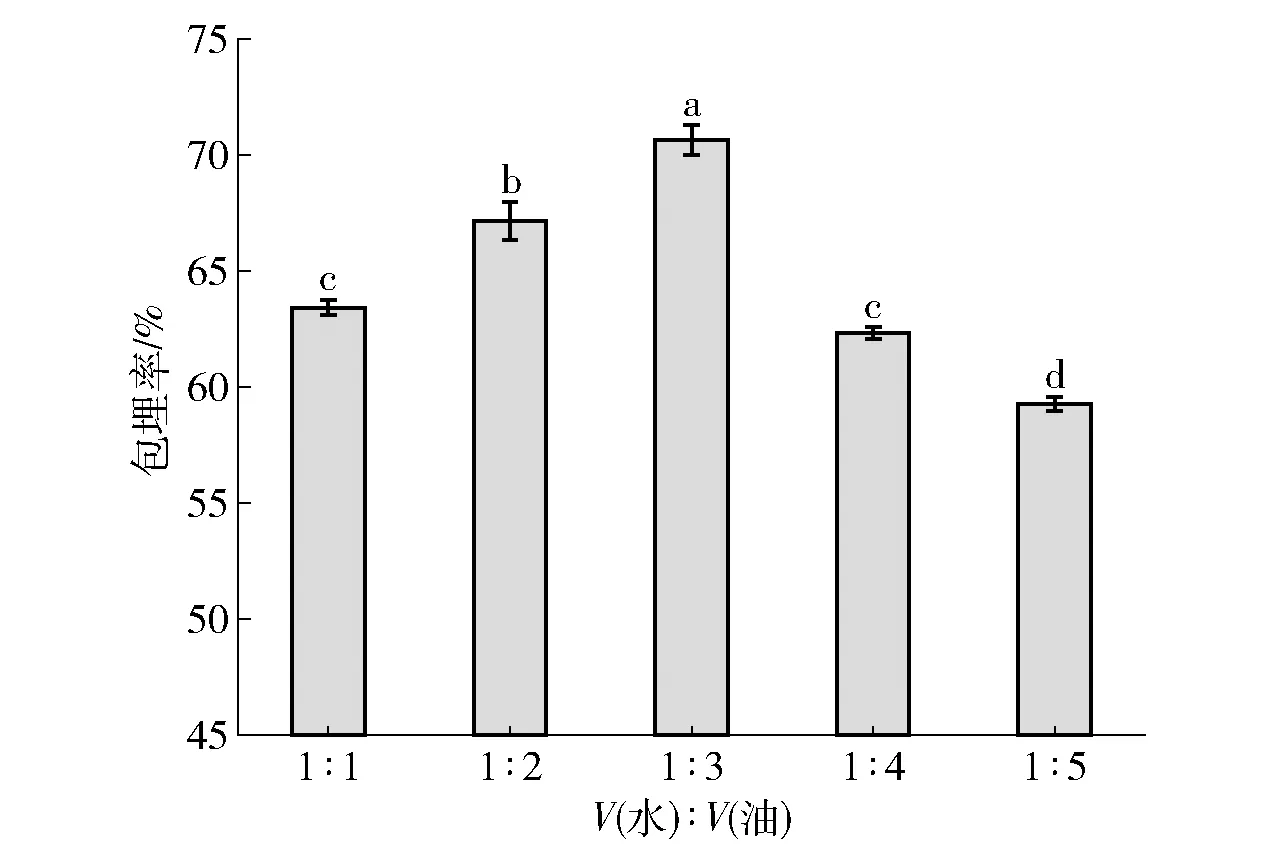
不同小写字母表示组间数据差异显著(P<0.05)。 图3 水相油相体积比对益生菌包埋率影响Fig.3 Effect of water-oil volume ratio on probiotic embedding rate
2.1.4外层海藻酸钠质量分数对益生菌包埋率的影响
外层海藻酸钠质量分数对菌生菌包埋率的影响见图4。由图4可知微胶囊的包埋率随外层海藻酸钠质量分数增加而增加,当外层海藻酸钠质量分数为 3%时,微胶囊包埋率最大,当外层海藻酸钠质量分数继续增加时,微胶囊包埋率降低。外层海藻酸钠的质量分数过低机械强度弱,不利于保护益生菌,或质量分数过高黏性较大造成菌体不易分散且不易被挤出,进而造成部分益生菌损失[29],同样会影响菌体的包埋率。而与用海藻酸钠制备内芯微球的方法不同,所选最佳质量分数也会有所不同。因此,外层海藻酸钠质量分数以3%为较优条件。
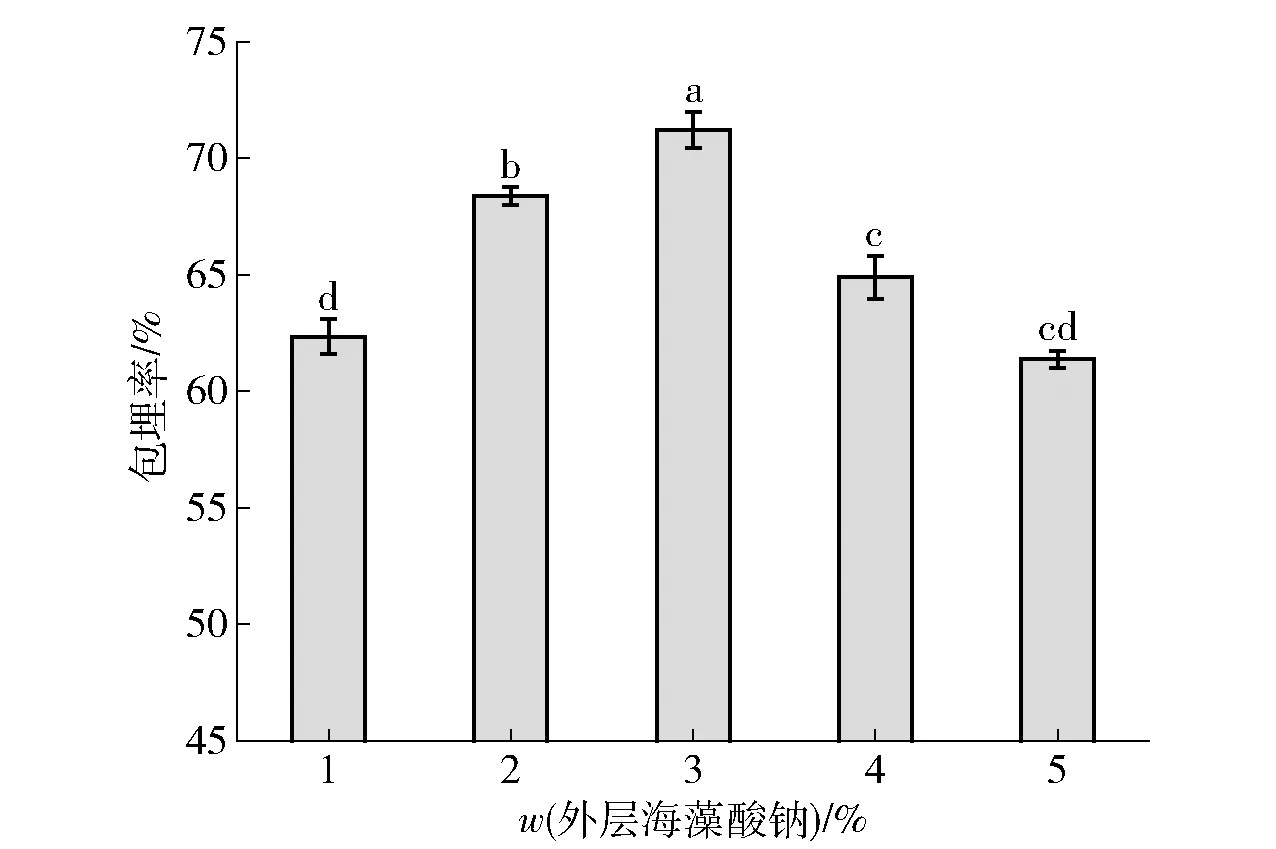
不同小写字母表示组间数据差异显著(P<0.05)。图4 外层海藻酸钠质量分数对益生菌包埋率影响Fig.4 Effect of sodium alginate concentration in outer layer on probiotic embedding rate
2.1.5氯化钙质量分数对益生菌包埋率的影响
氯化钙对益生菌包埋率影响见图5。由图5可知,随着氯化钙质量分数的改变,对益生菌的包埋情况也会不同。当 CaCl2质量分数小于2%时,随着CaCl2质量分数的升高,包埋率也增大,在氯化钙质量分数为2%时,益生菌包埋率最高。随着氯化钙质量分数的继续升高,包埋率反而下降,原因可能是过高的Ca2+含量会导致体系内交联有限造成包埋率下降。周莉等[30]对保加利亚乳杆菌微胶囊化的研究也发现相应结果。因此,选用2%质量分数的氯化钙效果最优。
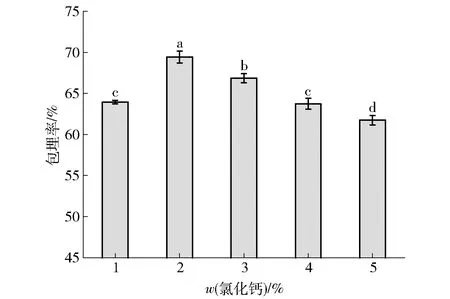
不同小写字母表示组间数据差异显著(P<0.05)。图5 氯化钙质量分数对益生菌包埋率影响Fig.5 Effect of calcium chloride concentration on probiotic embedding rate
2.1.6菌液和内芯微球比例对益生菌包埋率的影响
菌液与内芯比例对益生菌包埋率的影响见 图6。 由图6可知,菌液和内芯微球的混合同样会影响益生菌的包埋率,但程度相对较小。内芯微球加入过少,液体里含有球的密度过低,会降低双歧杆菌的菌数。而内芯微球较多时,密度过大同样会影响包埋率。同样,当菌液的数量较多,大量的菌游离于溶液体系中,不能被壁材包裹,也会造成包埋率不高,达不到预期效果。当菌液和内芯微球的比例适中(体积比1∶1)时,壁材很好地把游离菌用致密的网状海藻酸钙结构包被。结合数据,选用菌液与微球体积比为1∶1时,制备益生菌双菌微胶囊最好。
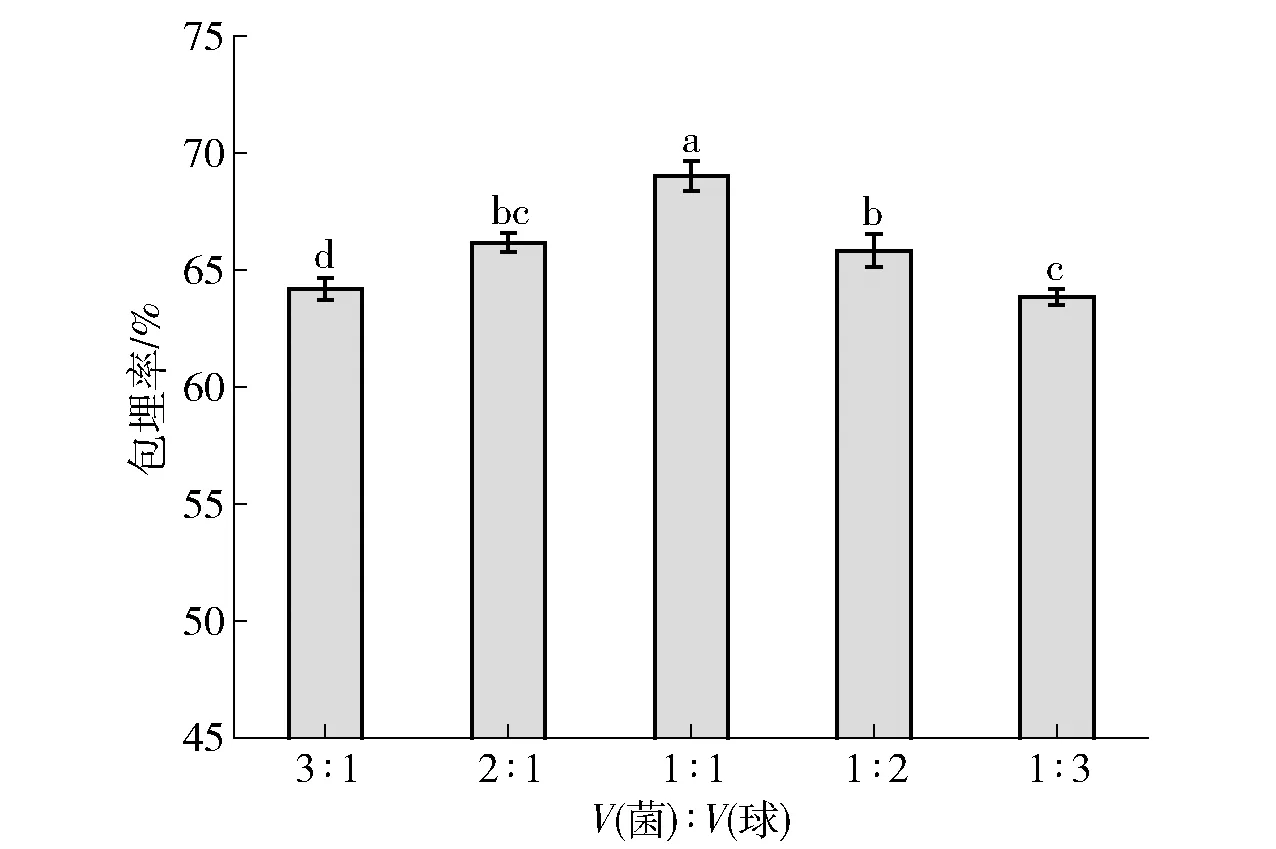
不同小写字母表示组间数据差异显著(P<0.05)。图6 菌液和内芯微球体积比对益生菌包埋率影响Fig.6 Effect of volume ratio of bacterial solution to inner core microsphere on probiotic embedding rate
2.2 响应面优化试验结果
2.2.1回归模型及显著性分析结果
采用Box-Behnken design ( BBD ),以包埋率为响应值,试验结果见表3。
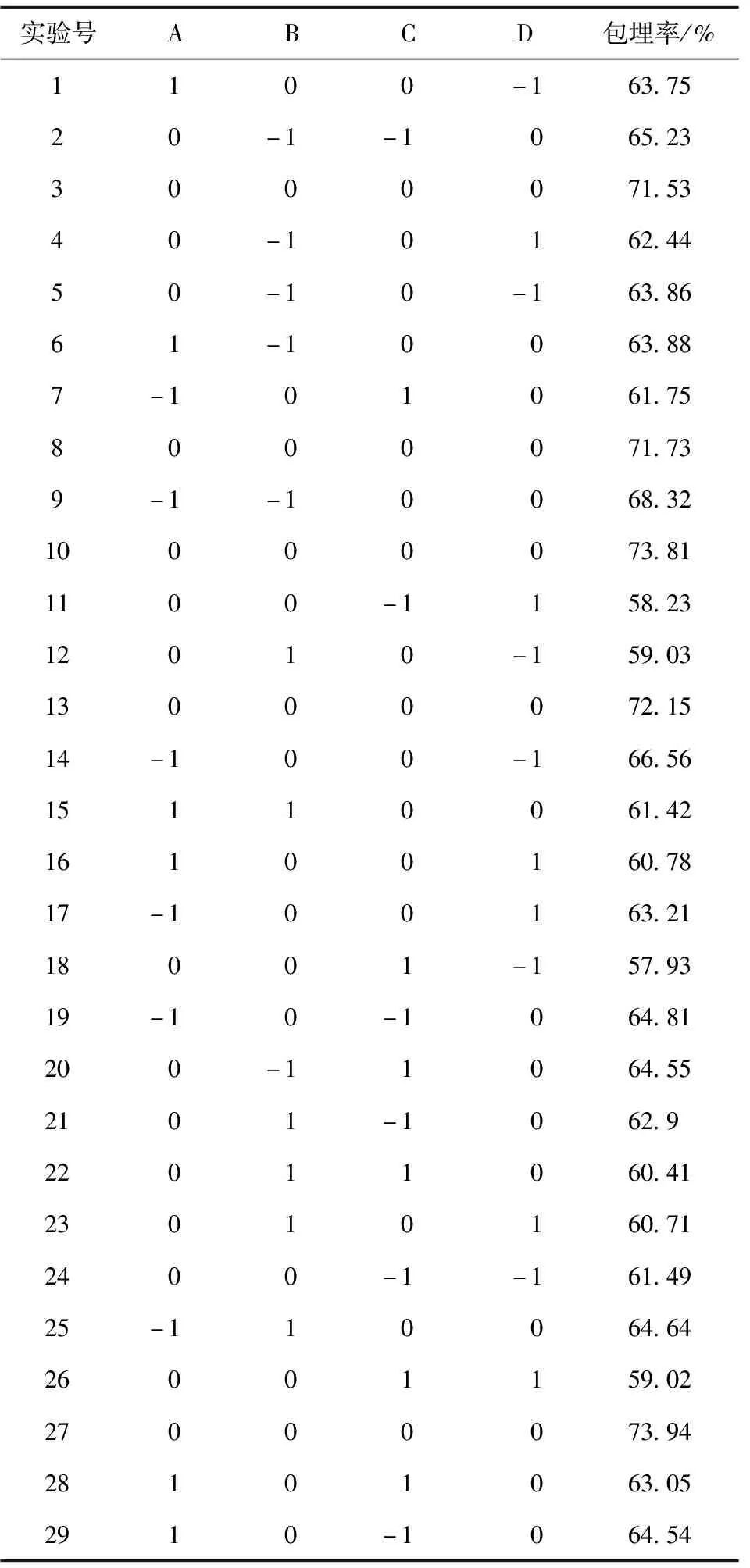
表3 响应面试验设计及结果
利用Design-expert 10.0.7 软件对实验数据进行处理,得到二次多元回归方程,见式(3)。
Y=72.63-0.99×A-1.60×B-0.87×
C-0.69×D+0.30×AB+0.39×AC+
0.095×AD+0.45×BC+0.78×BD+1.09×
CD-3.08×A2-4.25×B2-5.93×
C2-6.79×D2。
(3)
式(3)中,Y为响应值,即包埋率;A为内芯海藻酸钠质量分数;B为CMC-SH在菌液中质量分数;C为水油体积比;D为外层海藻酸钠质量分数。
表4为回归模型方差分析结果。由表3可知,模型P值显著(P<0.000 1),而失拟项不显著,说明模型具有统计意义,且实验的拟合度较好,可用此模型进行工艺分析;B2、C2、D2为极显著;由F值可知,因素对包埋率的影响由大到小为CMC-SH在菌液中质量分数、内芯海藻酸钠质量分数、水油体积比、外层海藻酸钠质量分数。
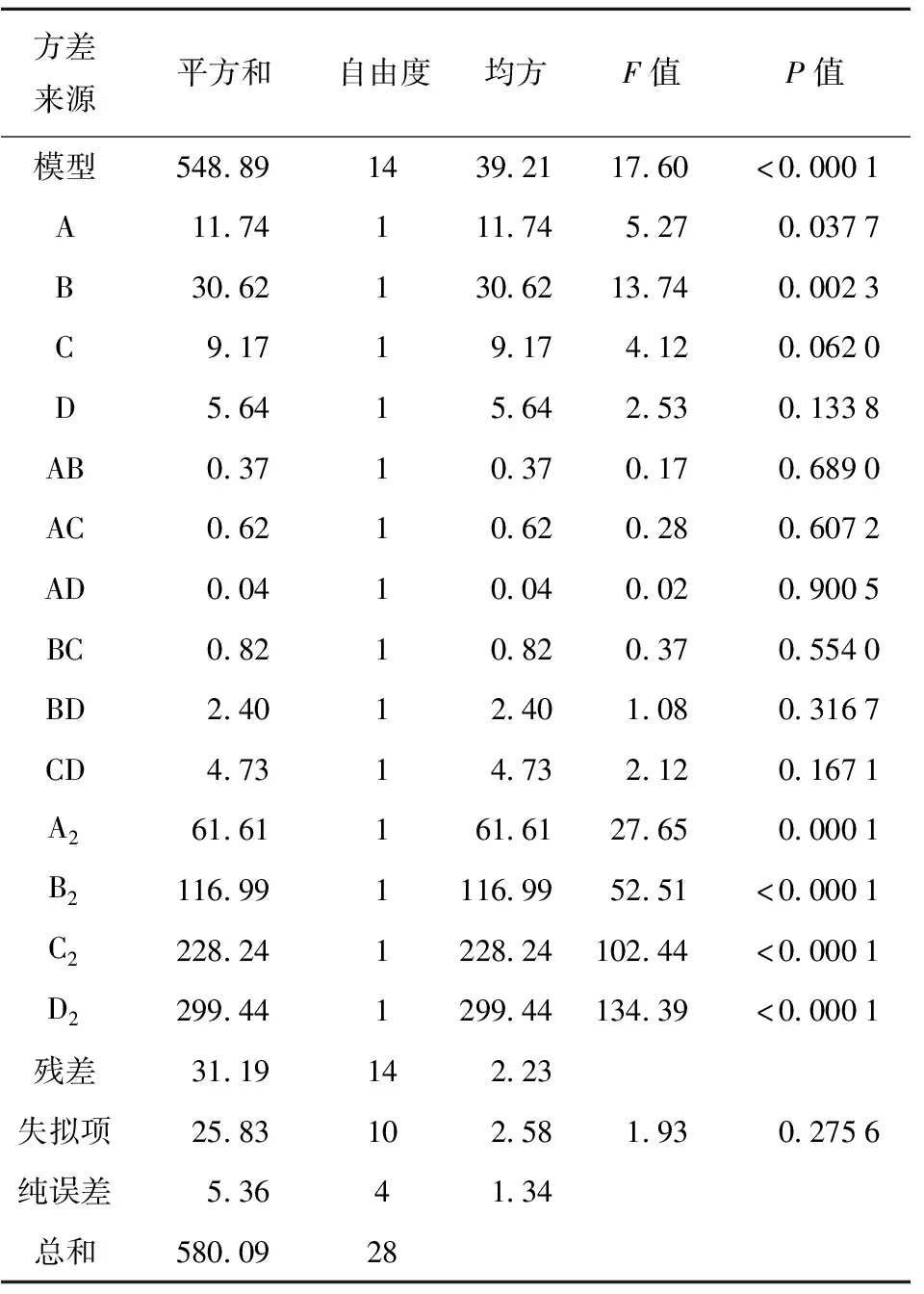
表4 回归模型方差分析结果
2.2.2响应面模型验证
响应面立体图和等高线图见图7。等高线是椭圆形可说明2个因素交互作用显著,而圆形则相反。根据立体图曲面的倾斜度可确定2个因素对响应值的影响程度。通过软件分析,得到益生菌双菌微胶囊的较佳制备工艺参数:内芯海藻酸钠质量分数为1.82%,CMC-SH在菌液中的质量分数为0.9%,水油体积比为1.0∶2.9,外层海藻酸钠质量分数为2.9%。在优化条件下计算出包埋率的理论预测值为72.93%。以此为条件,进行3次平行实验的包埋率平均值为72.14%,与模型的理论预测值基本接近。
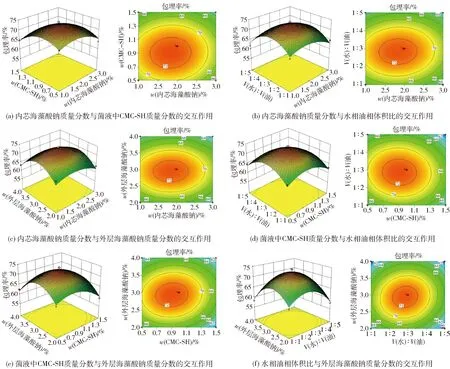
图7 不同因素交互作用对包埋率的影响Fig.7 Effect of interaction of different factors on embedding rate
2.3 微胶囊结构的形貌观察结果
扫描电子显微镜观察制备的微胶囊结果见图8(a)。 由图8可知,益生菌双菌微胶囊因受到真空冷冻干燥的影响,失水皱缩呈现凹陷和褶皱结构。微胶囊冻干后粒径会减小,且壁材海藻酸钠形成的微胶囊具有多孔性[31]。表面是致密网状结构,没有显示裂缝或可见断裂,限制了酸和酶对益生菌的影响,包埋益生菌效果较好。根据光学显微镜观察[图8(b)],采用挤压法制备的湿微胶囊呈内外2个规则的球形,外壳微球能顺利包埋内芯微球,成功制成益生菌双菌微胶囊。
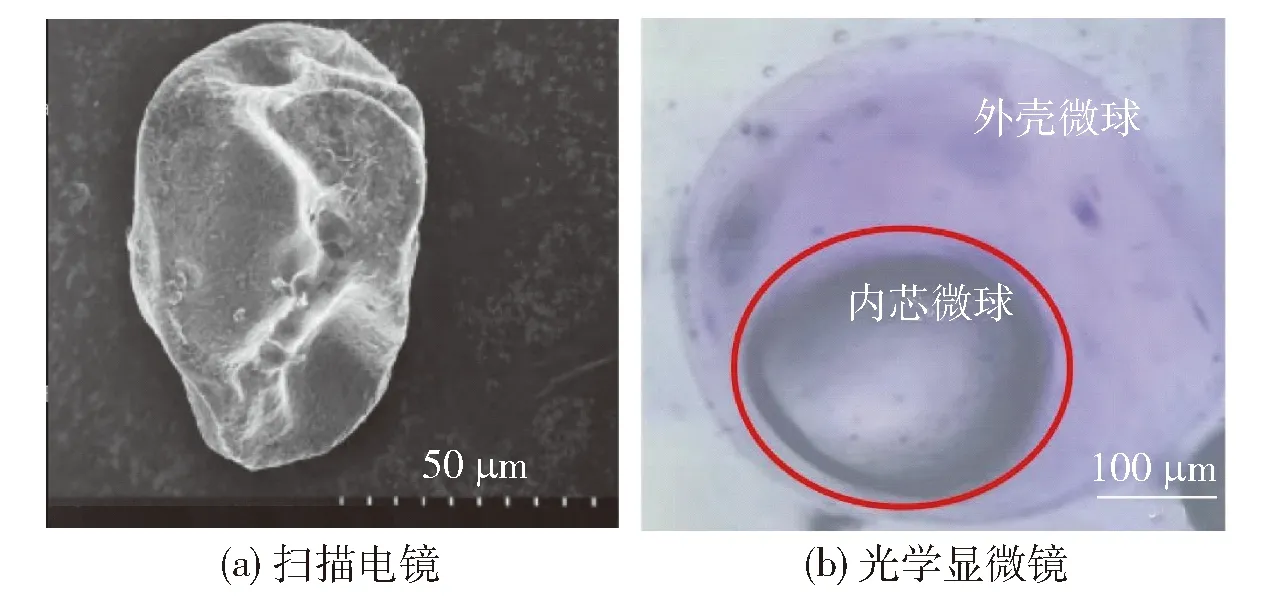
图8 微胶囊形貌Fig.8 Morphology of microcapsules
2.4 连续模拟人工胃肠道对微胶囊释放率的影响
益生菌在肠内释放是发挥益生性能的关键,通过测定释放率,确定益生菌释放时间,实验结果见图9。由图9可知,双菌微胶囊在胃液处理2 h的释放率微乎其微,而单菌微胶囊释放率已达到最大值。与单菌微胶囊相比,双菌微胶囊更能保持菌株在胃液中的活力。在肠液处理150 min后,通过观察菌落形态并计数,双菌微胶囊中青春双歧杆菌的活菌数明显增多,枯草芽孢杆菌已经释放出来。随着时间的变化,溶液中的微胶囊也逐渐崩解,在180 min时,释放率达到86.3%,微胶囊基本完全崩解。Luo等[32]利用复合材料制备的植物乳杆菌微胶囊也可以保护模拟胃液中益生菌的活力,并在模拟肠液中更好释放益生菌,能顺利将其定殖到肠道。海藻酸钠在模拟人工胃液中会发生质子化,当微胶囊进入肠液后更易溶胀,进而加快释放速度。
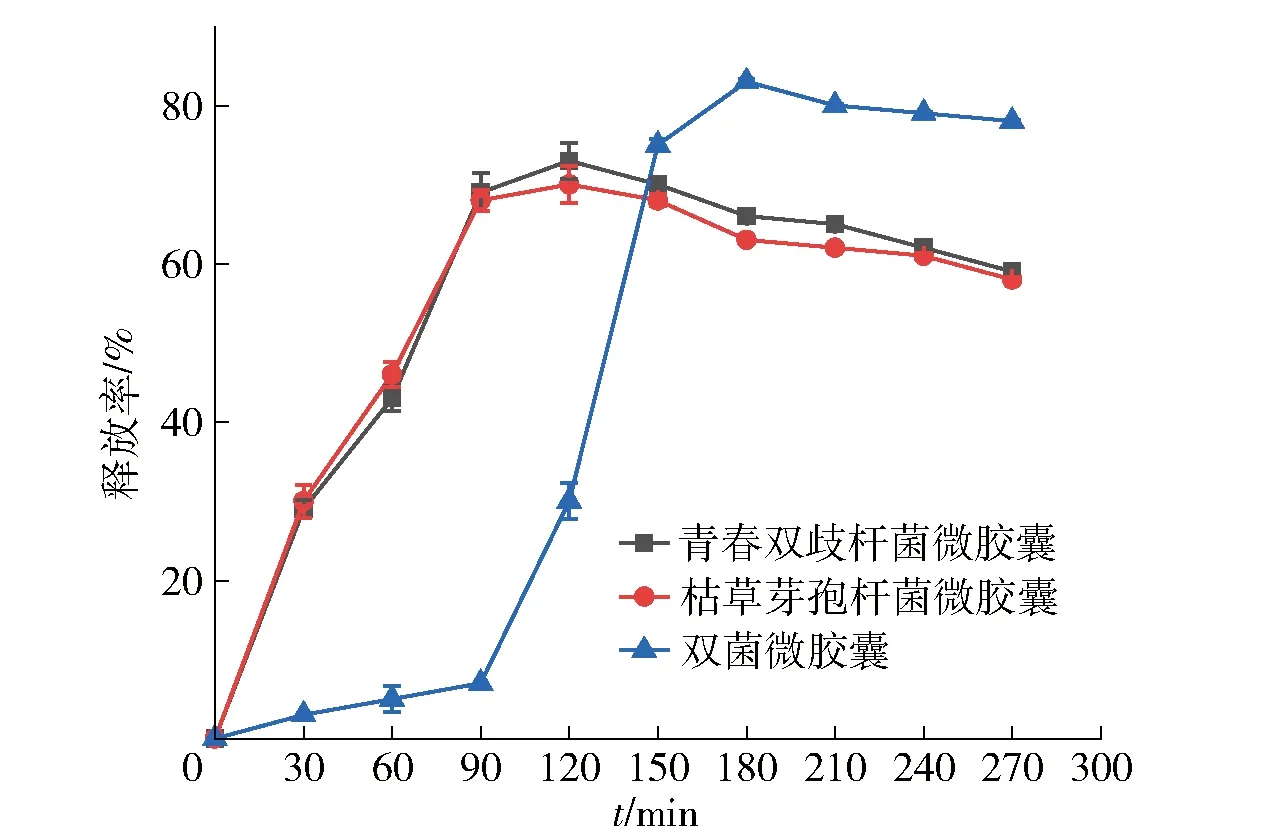
图9 微胶囊在连续模拟人工胃肠液中的释放率Fig.9 Release rate of microcapsules in continuous simulated artificial gastroenteric fluid
2.5 不同贮藏条件对微胶囊益生菌活性的影响
益生菌通过微胶囊化,可以在加工过程中提高菌株活菌数,免受外界环境影响。选择一个合适的温度贮藏益生菌微胶囊,保证益生菌存活率至关重要[33]。微胶囊贮藏稳定性见图10。由图10可知, 4 ℃和 25 ℃ 贮藏温度下,益生菌双菌微胶囊的贮藏存活率都高于2种游离菌株。对比2种温度下益生菌的存活率,随着时间的延长,在42 d后, 4 ℃ 条件下的微胶囊中菌株存活率能达到66.13%,较 25 ℃条件下菌株的存活率60.71%更高。实验结果证实,4 ℃条件下微胶囊具有良好的稳定性,适合贮藏益生菌双菌微胶囊。
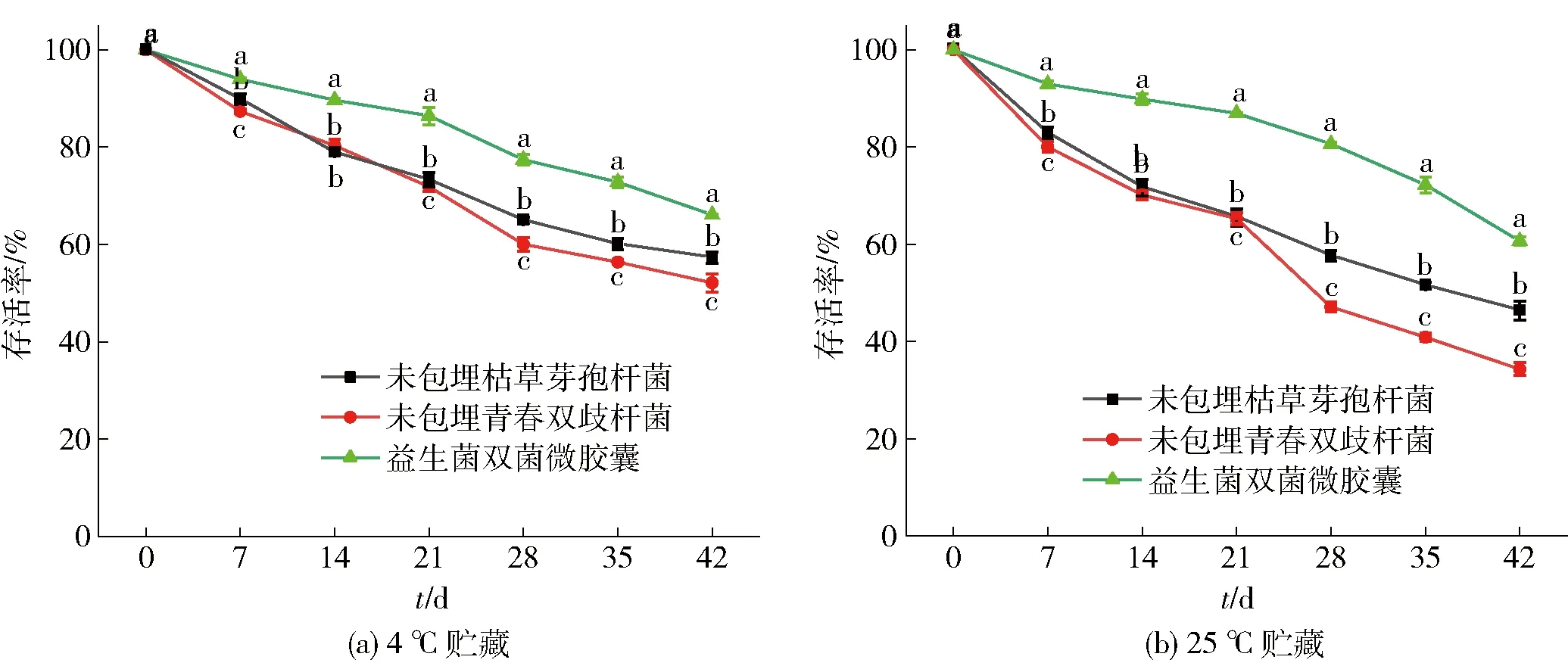
不同字母表示同一贮藏时间益生菌存活率差异显著(P<0.05)。 图10 微胶囊在不同温度下贮藏的存活率Fig.10 Survival rate of microcapsules stored at different temperatures
3 结 论
本研究制备的益生菌双菌微胶囊,将2种益生菌封装到不同隔间,包裹在同一微胶囊内。通过响应面优化试验,得到益生菌双菌微胶囊的最优制备工艺参数:内芯海藻酸钠质量分数为1.82%;CMC-SH在菌液中的质量分数为0.9%;水油体积比1.0∶2.9;外层海藻酸钠质量分数为2.9%。益生菌双菌微胶囊可提高益生菌在胃肠道的活性并能在肠道内充分释放益生菌。不同温度贮藏实验结果显示,益生菌双菌微胶囊在4 ℃条件贮藏比在25 ℃条件下贮藏具有更高的存活率。制备的微胶囊能够解决益生菌不耐人体胃肠道恶劣环境的问题,希望研究结果可为具有肠道缓释功能的益生菌微胶囊分隔包埋研究开辟新的思路。
