调控配位不饱和位点增强锆基金属有机框架纳米酶的蛋白水解酶活性及应用
2023-10-24许珂宇夏利伟邢克宇程云辉
许珂宇 夏利伟 邢克宇 程云辉,2 许 宙
(1. 长沙理工大学食品与生物工程学院,湖南 长沙 410114;2. 齐鲁工业大学食品科学与工程学院,山东 济南 250353)
微生物蛋白酶是食品工业中的主要酶类之一,占整个酶类市场的65%[1-3]。然而,微生物生产蛋白酶仍存在许多问题,如菌种培育操作复杂、环境要求严格、纯化过程繁琐、生产成本高昂等。此外,在贮藏和应用过程中,pH值和温度条件更是严重限制了微生物蛋白酶在工业中的发展[4]。由于纳米酶不具有蛋白质结构,所以各种环境因素(如pH值和温度)对纳米酶的催化活性中心造成的破坏性较小。因此,纳米酶具有高选择性[5]、稳定性和潜在可回收性[6-7],可以降低食品工业中酶催化的经济成本[8]。
蛋白水解酶纳米酶是一种具有蛋白水解酶活性的纳米酶,已在寡肽和蛋白质水解过程中显示出高选择性[9-10]。然而,这些蛋白水解酶纳米酶的活性相对较低,严重阻碍了蛋白水解酶纳米酶的实际应用。
金属有机框架(MOFs)是一种新兴的多孔纳米材料[11-12],是由金属离子或金属团簇和多种有机配体通过配位构建的[13-14]。因此,通过改变金属团簇和有机配体类型,MOFs的结构和性能(如纳米级孔隙率、高表面积、良好的热稳定性和均匀的空腔结构)可以被调整。目前,Zr-MOFs作为催化剂已被用于肽键的水解[15-17]。然而,大多数Zr-MOFs中金属离子与有机配体完全配位,这种微观结构阻碍了Zr-MOFs对肽的吸附,严重影响了Zr-MOFs的催化性能。有研究[18-19]表明,MOFs的催化性能可以通过改变缺陷而被提高,而不同的缺陷可以通过调整配位不饱和金属位点(CUSs)来实现。最常见的CUSs调控方法是在MOFs合成过程中使用不同的有机配体[20]。
研究拟通过简便的水热法制备3种具有不同配位不饱和位点的Zr-MOFs纳米酶(12-配位Zr-MOF、6-配位Zr-MOF和4-配位Zr-MOF),利用扫描电子显微镜(SEM)、动态光散射(DLS)、傅里叶变换红外光谱(FTIR)和X射线衍射(XRD)来表征Zr-MOF纳米酶的特征。以双甘肽(Gly-Gly)水解率为指标,评估3种Zr-MOFs纳米酶的蛋白水解酶活性,并于食品工业中3种常见的蛋白质(大豆蛋白、鱼糜蛋白和酪蛋白)中验证Zr-MOFs纳米酶的实际应用能力,以期为食品工业中蛋白水解提供技术支撑。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
四氯化锆(ZrCl4)、八水合二氯氧化锆(ZrOCl28H2O)、对苯二甲酸(BDC)、均苯三甲酸(H3BTC)、[1,1′:4′,1″]三联苯-3,3″,5,5″-四甲酸(TPTC):北京百灵威科技有限公司;
大豆分离蛋白、酪蛋白、鱼糜蛋白、N,N-二乙基甲酰胺(DEF)、苯异硫氰酸酯(PITC):上海麦克林科技有限公司;
N,N-二甲基甲酰胺(DMF)、无水乙醇、溴化钾、甲醇、甲酸、乙腈、三乙胺、正己烷、醋酸:分析纯,国药集团化学试剂有限公司。
1.1.2 主要仪器设备
管式炉:GSL-1600X型,郑州博科仪器公司;
电子分析天平:FA2004N型,上海精密科学仪器有限公司;
数显恒温磁力搅拌器:85-2型,天津市泰斯特仪器有限公司;
台式高速离心机:TG16-WS型,湖南湘仪离心机仪器有限公司;
电热恒温鼓风干燥箱:DHG-9246A型,上海精宏实验设备有限公司;
高效液相色谱:E2695型,美国沃特世公司;
激光粒度仪:Zetasizer nano型,英国Malvern公司;
扫描电子显微镜:JEOLJEM-2100型,日本电子株式会社;
傅立叶红外光谱仪:Nicolet6700型,美国Thermo Nicolet公司;
X-射线衍射仪:smartlab9型,日本理学公司。
1.2 方法
1.2.1 Zr-MOFs纳米酶的合成
(1) 12-配位Zr-MOF的制备:将60.6 mg ZrCl4和0.423 g BDC溶于15 mL DMF和0.447 mL冰醋酸混合溶液中,置于聚四氟乙烯内胆(20 mL)中,120 ℃加热24 h。冷却,8 017×g离心15 min。将得到的产物分别用DMF和甲醇洗涤3次,后续试验前,于室温下真空活化12-配位Zr-MOF[14]。
(2) 6-配位Zr-MOF的制备:将40.3 mg ZrOCl2·8H2O和26.2 mg H3BTC溶于5 mL DMF和5 mL甲酸混合溶液中,置于聚四氟乙烯内胆(20 mL)中,130 ℃加热48 h。冷却,12 333×g离心10 min。将得到的产物用DMF和乙醇分别洗涤3次,并于150 ℃活化20 h后进行后续试验[21]。
(3) 4-配位Zr-MOF的制备:将42.8 mg ZrOCl2·8H2O溶于4 mL DEF和2.5 mL甲酸混合溶液中,置于聚四氟乙烯内胆(20 mL)中,80 ℃加热1 h,冷却,加入13.6 mg TPTC和200 μL去离子水,超声处理20 min,于130 ℃加热48 h,14 800×g离心10 min,用DMF和丙酮洗涤3次,并于80 ℃真空干燥[22]。
1.2.2 Zr-MOFs纳米酶的表征 使用Malvern Zetasizer Nano-ZS测量Zr-MOFs的DLS,通过SEM观察Zr-MOFs的形貌,使用FTIR分析Zr-MOFs的化学结构,通过XRD获取Zr-MOFs的晶体结构信息,并通过高效液相色谱法(HPLC)测定Gly-Gly和Gly含量。
1.2.3 Zr-MOFs纳米酶的蛋白水解酶活性分析
(1) 双甘肽的水解:将2.0 μmol Zr-MOFs和50 μL Gly-Gly溶液(40 mmol/L)加入到950 μL 超纯水中,60 ℃搅拌。Gly-Gly被Zr-MOFs水解后,混合物于14 800×g离心20 min以去除Zr-MOFs[23],通过HPLC检测水解产物,并通过Gly产率计算Zr-MOF水解Gly-Gly的催化速率。
(2) 蛋白水解酶活性测定:以双甘肽(Gly-Gly)水解率为指标,评估Zr-MOFs纳米酶的蛋白水解酶活性。将200 μL样品溶液、100 μL三乙胺乙腈溶液和100 μL PITC乙腈溶液混合,室温放置1 h,向混合物中加入400 μL正己烷,室温静置10 min,过滤,滤液用800 μL超纯水稀释。流动相A为0.1 mol/L乙酸—乙酸钠缓冲溶液(pH 6.5);流动相B为乙腈;洗脱流速1.0 mL/min;检测波长254 nm;柱温40 ℃;上样量10 μL。梯度洗脱条件:0~7 min,100% A,7~15 min,85% A、15~18 min,100% A。
(3) Zr-MOFs纳米酶(6-配位Zr-MOF)的异质性:将2.0 μmol 6-配位Zr-MOFs和50 μL Gly-Gly溶液(40 mmol/L)加入到950 μL水中,于60 ℃孵育催化3 h,离心去除6-配位Zr-MOF,并使剩余溶液进一步反应。
(4) Zr-MOFs纳米酶(6-配位Zr-MOF)的可重复使用性:采用溶剂洗涤法进行再生[23]。150 ℃真空条件下,将6-配位Zr-MOF活化24 h,继续用于催化反应。
(5) Zr-MOFs纳米酶(6-配位Zr-MOF)对3种蛋白质的水解:将大豆蛋白、鱼糜蛋白和酪蛋白分别与6-配位Zr-MOF于60 ℃孵育。于不同的时间间隔内,采用SDS-PAGE分析3种蛋白质的分子量和水解产物。分离的条带用Kemas Brilliant Blue R-250染色。
1.2.4 数据分析 每组数据3次重复,利用Origin 2017软件处理数据与作图。
2 结果与分析
2.1 Zr-MOFs纳米酶的表征
在聚四氟乙烯内胆中,使用不同的有机羧酸作为连接剂,与Zr团簇配位连接,分别合成了3种Zr-MOFs纳米酶,即12/6/4-配位的Zr-MOFs纳米酶(图1)。

图1 不同配位数的Zr-MOFs结构示意图
由图2和图3可知,12-配位Zr-MOF纳米酶是一种具有光滑表面的规则球体,直径为100 nm;6-配位Zr-MOF纳米酶是一种规则的八面体纳米材料,直径为2 μm;4-配位Zr-MOF纳米酶呈圆形,直径为150 nm,与文献[24-25]的结果一致。因此,3种Zr-MOFs被成功合成。
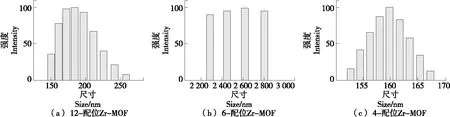
图2 不同配位数的Zr-MOFs的水合粒径

图3 不同配位数的Zr-MOFs的SEM图像

图4 不同配位数的Zr-MOFs的FTIR图像
图5 不同配位数的Zr-MOFs的XRD图像
2.2 Zr-MOFs纳米酶的蛋白水解酶活性
由图6(a)可知,6-配位Zr-MOF和4-配位Zr-MOF纳米酶的蛋白水解酶活性明显高于12-配位Zr-MOF的,6-配位Zr-MOF对双甘肽的水解率达52%,而4-配位Zr-MOF和12-配位Zr-MOF的水解率分别为6.15%,45.8%。天然蛋白酶通过Zn2+裂解肽链而水解双甘肽[31-32]。因此,Zr-MOF的活性中心被认为是CUSs。CUSs模拟了Zn2+在天然锌金属蛋白酶中的作用,更多的CUSs将有助于提高Zr-MOF纳米酶的水解性能。然而,4-配位Zr-MOF纳米酶的催化活性低于6-配位Zr-MOF纳米酶的,是因为4-配位Zr-MOF纳米酶的小孔尺寸阻碍了双甘肽与CUSs的结合[22,33]。综上,6-配位Zr-MOF纳米酶对双甘肽的催化活性最高。
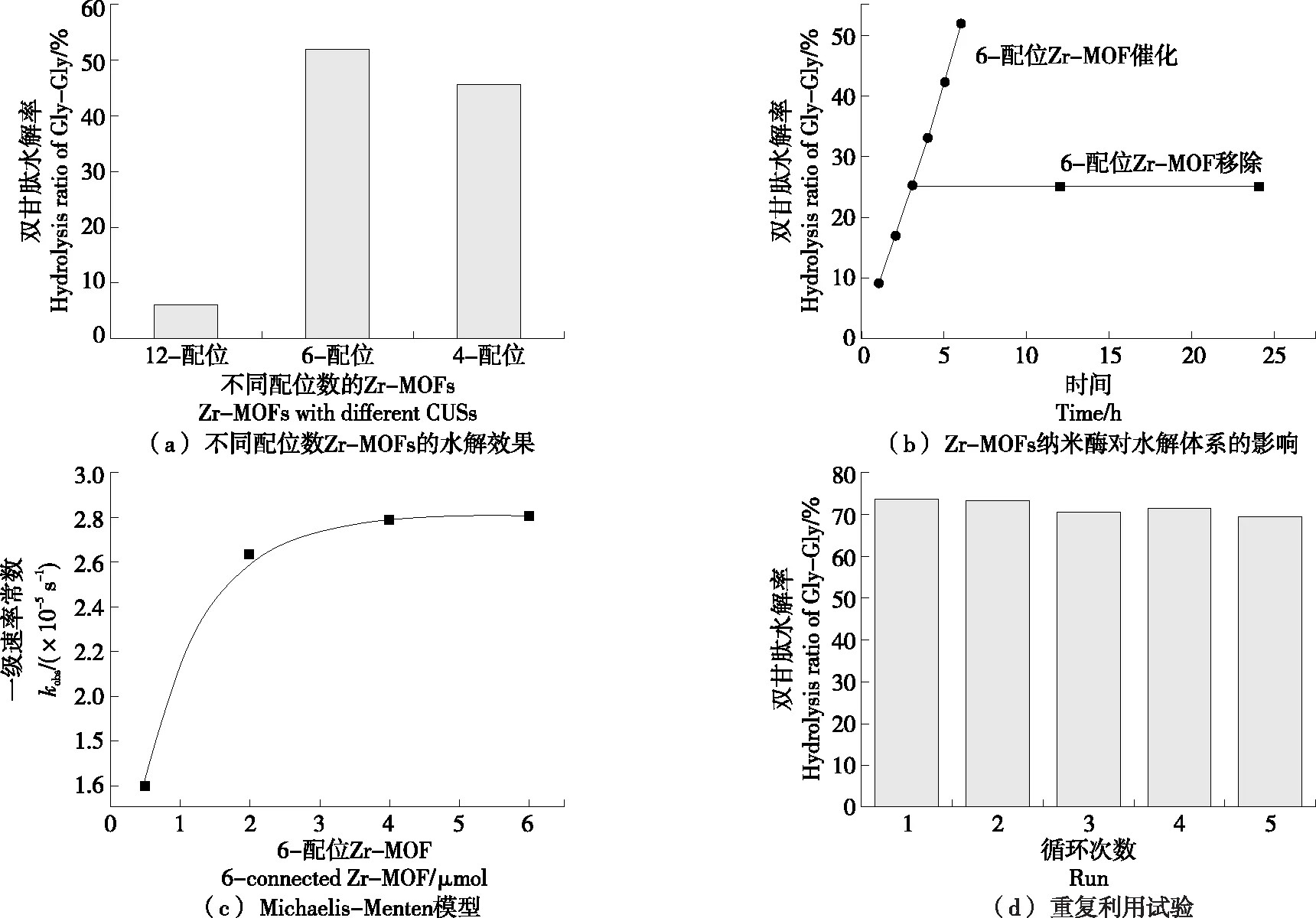
图6 Zr-MOFs纳米酶的蛋白水解酶活性
6-配位Zr-MOF纳米酶水解双甘肽的一阶反应速率常数为2.64×10-5s-1,在没有Zr-MOF纳米酶存在的情况下,双甘肽的水解恒定速率为7.4×10-9s-1[34],表明使用6-配位Zr-MOF纳米酶时,双甘肽的水解反应速率增加了2.63×103倍,说明6-配位Zr-MOF对双甘肽具有较好的水解性能。
由图6(b)可知,当从水解体系中去除6-配位Zr-MOF纳米酶后,双甘肽的水解率几乎不变,表明双甘肽不再被水解。该测试异质性的热过滤试验表明,在双甘肽水解体系中具有催化活性的是6-配位Zr-MOF纳米酶。
由图6(c)可知,以6-配位Zr-MOF纳米酶含量为横坐标,一阶反应速率常数为纵坐标绘制曲线,并由伪Michaelis-Menten模型[式(1)]进行拟合。6-配位Zr-MOF纳米酶对双甘肽的水解反应符合Michaelis方程。当6-配位Zr-MOF纳米酶含量为4.0 μmol时,水解双甘肽的速率常数达到最大为7.4×10-9s-1,说明使用4.0 μmol 6-配位Zr-MOF可以实现良好的水解效果。
(1)
式中:
kobs——一阶反应速率常数;
kmax——最大反应速率常数;
[MOF]——MOF催化剂的浓度,mol/L;
KM——米氏常数。
由图6(d)可知,在重复使用5次后,Gly-Gly的转化率未明显下降,说明6-配位Zr-MOF的水解活性未受到较大影响,表明6-配位Zr-MOF具有较高的稳定性,在实际应用中具有较大的重复利用潜力。
2.3 Zr-MOF纳米酶水解蛋白质
由图7可知,随着水解时间的延长,3种蛋白的条带逐渐变浅,表明Zr-MOF纳米酶可以同时水解3种蛋白质,展现出广泛的蛋白酶活性。Zr-MOF纳米酶对大豆蛋白和鱼糜蛋白显示出较高的催化活性,对酪蛋白的催化活性较低。如图7(a)所示,水解过程中没有低分子量(<14.4 kDa)的条带,可能是由于Zr-MOF纳米酶将大豆蛋白的长肽水解为短肽。由于短链多肽容易从SDS-PAGE凝胶中漏出,所以无法被观察到。由图7(b)可知,随着水解时间的延长,大豆蛋白的长肽条带逐渐变浅,短肽条带逐渐变深,说明Zr-MOF纳米酶对鱼糜蛋白具有较好的水解效果。由图7(c)可知,酪蛋白的长肽条带逐渐变浅,短肽条带逐渐变深,但变化不明显,表明Zr-MOF纳米酶可以催化大豆蛋白、鱼糜蛋白和酪蛋白水解,展现出广泛的蛋白酶活性,且对大豆蛋白和鱼糜蛋白显示出较高的催化活性。

图7 6-配位Zr-MOF水解3种蛋白质的SDS-PAGE图
3 结论
通过调节锆基金属有机框架的配位不饱和金属位点制备了3种具有不同蛋白水解酶活性的纳米酶,证明了一种可以调节锆基金属有机框架纳米酶的蛋白水解酶活性的方法。以双甘肽水解率为指标,评估了具有不同配位不饱和金属位点的锆基金属有机框架纳米酶的蛋白水解酶活性,其中6-配位的锆基金属有机框架纳米酶对双甘肽的蛋白水解酶活性最高,对双甘肽的水解率达52%,证实了锆基金属有机框架的蛋白酶活性可以通过调整配位不饱和金属位点而被提高,同时具有良好的异质性和可重复利用性。此外,锆基金属有机框架纳米酶可以分别水解3种常见的蛋白质(大豆蛋白、鱼糜蛋白和酪蛋白),展现出广泛的蛋白酶活性,表明锆基金属有机框架作为蛋白水解酶纳米酶具有较好的实际应用潜力。研究中蛋白催化水解温度较高,后续需进一步研究锆基金属有机框架纳米酶结构对催化温度的影响机理,以期降低锆基金属有机框架纳米酶高效水解蛋白时的温度。
