3种培养基对鸡肉产品中两类耐药菌培养的影响
2023-10-24黄柳娟樊彦莉
黄柳娟 樊彦莉 钟 海 蒋 静 邵 毅
(1. 上海市农业科学院农产品质量标准与检测技术研究所,上海 201403;2. 上海海关动植物与食品检验检疫技术中心,上海 200135;3. 上海海关,上海 200135)
养殖业抗生素的滥用导致农业生产成为抗生素耐药菌(Antimicrobial risistant bacteria, ART)的一大来源[1],农业源ART菌可能通过食物链传播至人类[2]。水平基因迁移(Horizontal gene transfer, HGT)是耐药基因在各类细菌中扩散的重要方式[3],但相较于致病菌,数量庞大、遗传背景丰富、可能更频繁地参与HGT的非致病菌的耐药性尚未受到系统监测和研究[4]。其中标准化、批量化培养、分离ART菌技术的缺乏,是制约非致病菌耐药性研究的瓶颈问题之一。
活细菌的分离检测对于细菌种类的进一步表征至关重要[5]。培养基类型和成分浓度[6]会影响可培养细菌群落构成[7]和单类细菌的生长速率[8],以及对抗生素的耐受性[9-10]。针对未知耐药细菌群落的初步筛查或耐药基因的迁移研究,科研人员使用脑心浸液肉汤(BHI)[11-12]、麦康凯琼脂[13]、胰蛋白胨大豆琼脂(TSA)[14]、LB[15]、平板计数琼脂(PCA)[16]等培养基,但这些培养基对不同基质中的不同ART菌的培养效果并未得到评估。
培养基营养物质的丰富度对可培养细菌的种类和数量的影响尚无定论[17],鉴于BHI、TSA和PCA培养基对细菌培养的普适性或在标准化操作中的广泛应用[18-19],研究拟以这3种培养基为例,基于高通量测序技术,分析在不同培养基上培养获得的冷鲜鸡和鸡肉熟食表面四环素耐药(Tetracycline resistant,Tr)菌和磺胺耐药(Sulfamethoxazole resistant,Sr)菌的菌群结构和菌属丰度,为评估培养基对不同基质上不同ART菌的培养效果提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
4份冷鲜鸡产品(整鸡、鸡胸肉、鸡腿肉和鸡翅,编号分别为F1、F2、F3和F4)和 3份散装鸡肉熟食制品(白斩鸡、盐水鸡和烤鸡,编号分别为R1、R2和R3):无菌袋包装后置于冰袋中,3 h内送回实验室,市售;
PCA培养基、BHI培养基及TSA培养基:英国OXOID公司;
真菌抑制剂放线菌酮(Cyc):分析纯,美国AMRESCO公司;
四环素(Tet)、磺胺甲恶唑(Sul)、甲氧苄啶(Tri):分析纯,美国 SIGMA公司;
生理盐水:广东环凯微生物科技有限公司;
医用酒精:国药集团化学试剂有限公司;
细菌基因组提取试剂盒:德国QIAGEN公司;
聚合酶链式反应(PCR)试剂盒、琼脂糖电泳试剂盒:北京全式金生物技术有限公司;
PCR产物电泳凝胶回收试剂盒:美国 Thermo Scientific公司;
PCR引物:生工生物工程(上海)股份有限公司。
1.1.2 主要仪器设备
均质机:BAGMIXER400型,法国Interscience公司;
水平核酸电泳系统:Mini-Sub cell GT型,美国Bio-Rad公司;
凝胶成像系统:Criterion Stain Free型,美国Bio-Rad公司;
超微量分光光度计:NanoDrop 2000c型,美国Thermo公司;
高压灭菌锅:SX-500型,日本TOMY公司。
1.2 方法
1.2.1 Tr菌和Sr菌的培养 根据GB 4789.2—2016和Huang等[11]的方法从鸡肉样品表面初步培养出对四环素或磺胺甲恶唑耐药的细菌。无菌条件下将样品表面(深度不超过5 mm)的组织剪碎,混匀,准确称量25 g于无菌袋中,加入225 mL 0.9%无菌生理盐水,用均质机拍打2 min制成均质液。吸取200 μL均质液分别均匀涂布于3种培养基(BHI、TSA、PCA)平皿上,每种培养基平皿中含有16 μg/mL Tet和100 μg/mL Cyc(分别记为BHItet组、TSAtet组和PCAtet组),或152 μg/mL Sul、8 μg/mL Tri和100 μg/mL Cyc(分别记为BHIsul组、TSAsul组和PCAsul组),或仅含有100 μg/mL Cyc(分别记为BHIcyc组、TSAcyc组和PCAcyc组),分别对样品中的可培养Tr菌、可培养Sr菌和可培养总菌进行培养。每个处理重复3次。所有平皿于(30±1) ℃下倒置培养48 h,将同组的3个平皿中的菌体全部刮取并混合,提取细菌总脱氧核糖核酸(DNA)后进行菌群多样性分析。
1.2.2 细菌总DNA的提取 用2 mL生理盐水重悬刮取培养皿上的菌体,充分混匀,取100 μL菌悬液,用细菌基因组提取试剂盒提取细菌总DNA。经1%琼脂糖凝胶电泳和超微量分光光度计测定后,对16S rRNA基因的V3~V4区域进行扩增,上游引物为341F:5′-CCTAYGGGRBGCASCAG-3′,下游引物为 806R:5′-GGACTACNNGGGTATCTAAT-3′。用琼脂糖凝胶电泳检测PCR扩增产物质量后,委托北京诺禾致源生物信息科技有限公司进行高通量测序。
1.2.3 高通量测序 基于IonS5TMXL测序平台进行测序,使用Cutadapt(V1.9.1)[20]对reads进行低质量部分剪切,得到最终的有效数据(Clean Reads)。利用Uparse软件(Uparse v7.0.1001)[21]对所有样品的全部Clean Reads 进行聚类,默认以97%的一致(Identity)将序列聚类成为OTUs,对OTUs序列进行物种注释。对各样品的数据进行均一化处理,以样品中数据量最少的为标准进行均一化处理,最终确定各物种的相对丰度。基于均一化处理后的数据,利用β多样性分析中的主坐标分析(PcoA)比较样本之间的差异,并用MetaStat方法对组间的物种丰度数据进行假设检验得到P值,根据P值筛选具有显著性差异的物种。
2 结果与分析
2.1 两类可培养ART菌的菌群结构及可培养总菌的差异
由图1、图2可知,不论使用哪种培养基,每个样品中的两类ART菌与总菌相比,排名前十的优势菌属在种类和丰度上均有差异,甚至在冷鲜鸡和鸡肉熟食样品中分别有5(样品F2,用PCA培养)~30(样品F1,用BHI培养)、8(样品R2,用PCA培养)~20(样品R2,用BHI培养)个属的耐药细菌在对应的可培养总菌(从不含抗生素的培养基上培养获得)中并未得到鉴定,说明冷鲜鸡和鸡肉熟食表面各类耐药细菌菌群的组成各不相同。因此,有必要研究不同培养基对某类ART菌菌群培养效果的影响。

图2 3种培养基上的可培养总菌(C)、Tr菌和Sr菌的种属数维恩图
2.2 3种培养基对两类可培养ART菌组分的影响
由表1、表2可知,冷鲜鸡表面共鉴定出78个属的Tr菌和77个属的Sr菌,多于前期研究[22]及单一BHI培养基中的。其中34个种属的Tr菌和33个种属的Sr菌在3种培养基上被鉴定出,而仅在BHI、TSA和PCA培养基上鉴定出的特有Tr菌属各有30,5,3个,Sr菌属为9,8,14个。

表1 3种培养基特异性培养的Tr菌
在鸡肉熟食样品表面共鉴定出28个属的Tr菌和43个属的Sr菌,其中3种培养基的共有菌属分别为19,28个,特有Tr菌属分别为3,2,1个,Sr菌属分别为1,6,0个。微生物菌群中某个菌株或某类菌属是否能获得培养,除受培养基质能提供的营养支持及抗生素抑制外,还受到周边菌群的协同促进或竞争抑制。鸡肉熟食表面只在PCA培养基上得到培养的Tr菌为环丝菌属(Brochothrixspp.),只在BHI培养基上得到培养的Sr菌为乳杆菌属(Lactobacillusspp.),只在TSA培养基上得到培养的Sr菌为拟杆菌属(Bacteroidesspp.)和肉杆菌属(Carnobacteriumspp.),但这些菌属在冷鲜鸡样品中的3种培养基上均能得到培养;而冷鲜鸡表面只在PCA培养基上得到培养的Sr菌Cetobacteriumspp.在鸡肉熟食样品中的3种培养基上均能得到培养,慢生根瘤菌属(Bradyrhizobiumspp.)在鸡肉熟食样品中用TSA培养基也能得到培养。因此,培养基对表1、表2中涉及的菌属的培养偏好性还需进一步验证。
2.3 3种培养基对两类可培养ART菌丰度的影响
主坐标分析结果表明,经3种培养基培养后,冷鲜鸡和鸡肉熟食样品表面两类可培养ART菌的主要群落结构差异不大。进而用Metastat法分析经3种培养基培养后丰度产生差异的ART菌菌属,即在BHItet组、TSAtet组和PCAtet组之间分别进行两两比较。组间聚类结果表明,BHI和TSA对所培养细菌的丰度具有较高的相似性。由图3、图4可知,冷鲜鸡表面有5个属的Tr菌和3个属的Sr菌在不同培养基上产生了显著差异。其中,4种Tr菌(气单胞菌属Aeromonasspp.、水栖菌属Enhydrobacterspp.、乳杆菌属Lactobacillusspp.和泛菌属Pantoeaspp.)和2种Sr菌(肠球菌属Enterococcusspp.和乳杆菌属Lactobacillusspp.)在PCA培养基上能获得培养的稳定性及丰度均较高,而1种Tr菌(漫游菌属Vagococcusspp.)和1种Sr菌(类香味菌属Myroidesspp.)在BHI培养基上获得培养的稳定性及丰度均显著较高。上述菌属中,肠球菌属、乳杆菌属、漫游菌属和类香味菌属曾被报道是冷鲜鸡肉产品表面的优势菌属[23],肠球菌属和乳杆菌属的细菌还被证实较多地参与了耐药基因的水平迁移[24]。因此,当研究对象包含上述菌属时,可针对性地选择更适合的培养基以获得更多的目标菌株。

图4 冷鲜鸡表面差异耐药菌菌属的丰度
由图5、图6可知,鸡肉熟食样品表面有1个属的Tr菌和5个属的Sr菌在3种培养基上产生了显著差异。其中,对四环素耐药的库特氏菌属Kurthiaspp.在BHI培养基上的丰度显著高于PCA培养基上的;而2种Sr菌(依格纳季氏菌属Ignatzschineriaspp.和未知的毛螺菌科Lachnospiraceae属)在BHI培养基上的丰度显著较高,3种Sr菌(经黏液真杆菌属Blautiaspp.、巨球菌属Macrocuccusspp.和未知的瘤胃球菌科Ruminococcaceae属)在TSA培养基上的丰度较高。
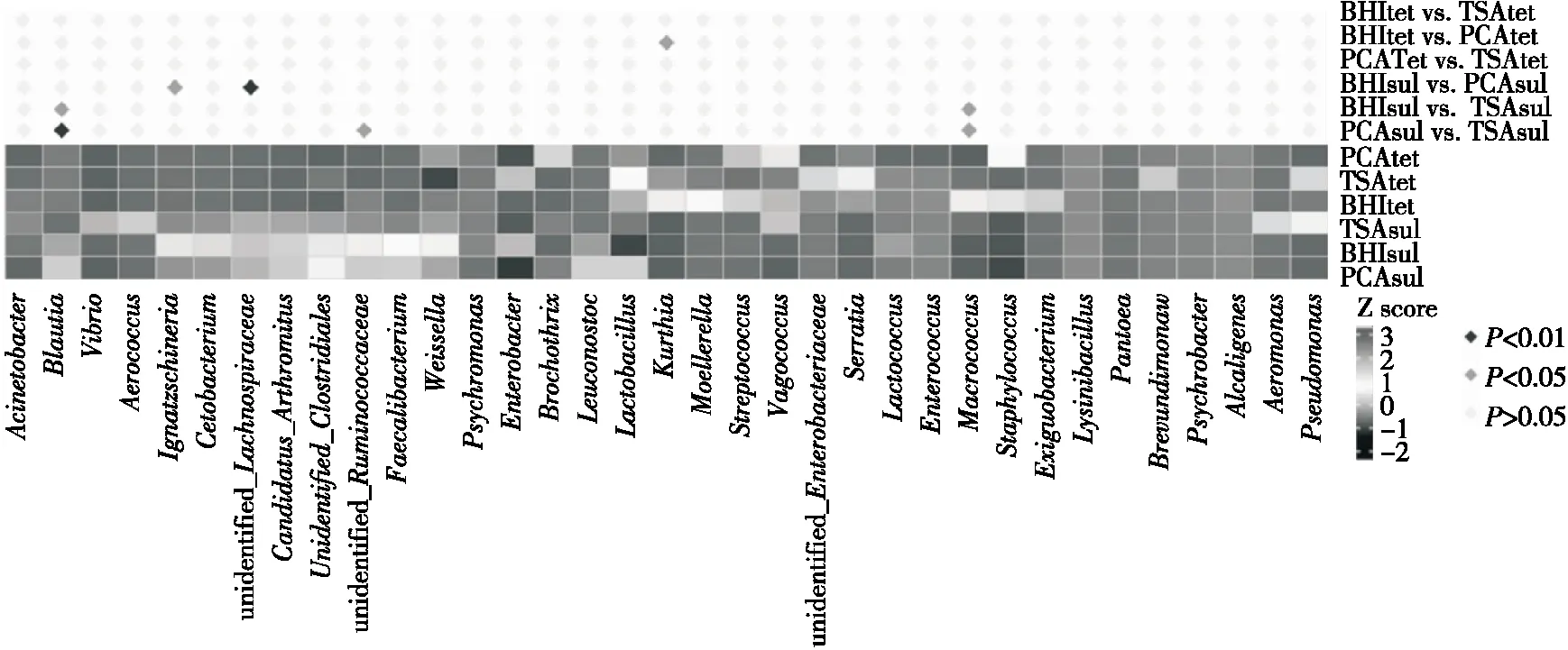
图5 鸡肉熟食表面耐药菌经不同培养基培养后的差异菌属
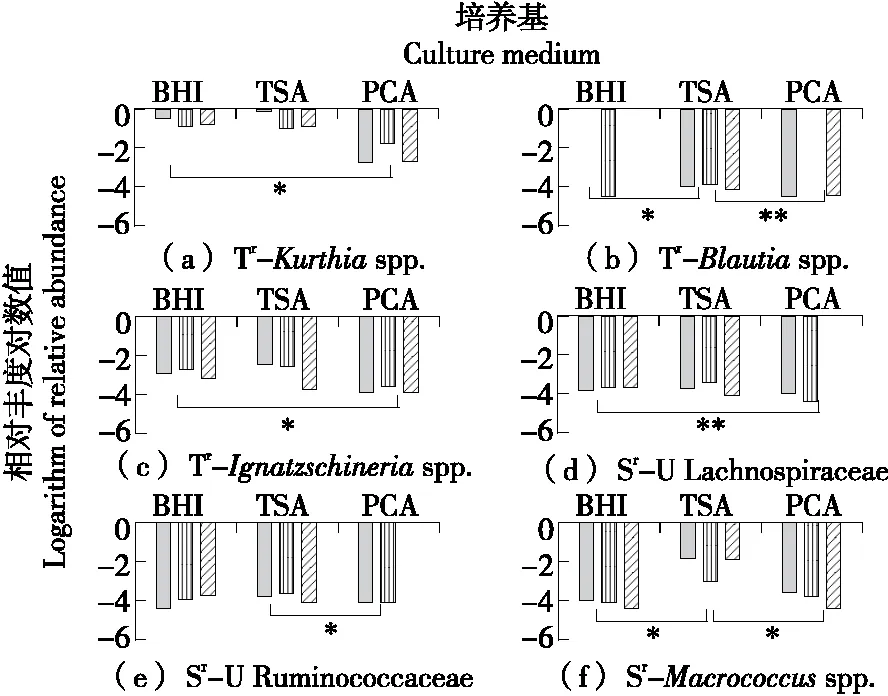
图6 鸡肉熟食表面差异耐药菌菌属的丰度
营养物质可用性的差异会影响菌落形成的程度[25],可能是造成3种培养基对鸡肉产品中两类耐药菌培养效果差异的原因。由于可能高达99.999%的微生物物种无法通过常规的培养方法获得[26],因此,突破现有常用培养基的局限、优化培养基成分是微生物菌种分离领域的重要研究方向。其中,稀释传统培养基[27]或添加细菌来源环境成分作为培养基补充物[28]是提高可培养细菌的物种数量乃至发现新物种的有效途径。这些方法在鸡肉可培养耐药菌多样性的提高方面的可用性,以及适宜的稀释倍数或添加物浓度还需更加深入的研究。
3 结论
研究基于高通量测序技术,以脑心浸液肉汤培养基、胰蛋白胨大豆琼脂培养基和平板计数琼脂培养基3种培养基为例,分析比较了不同培养基上培养获得的冷鲜鸡和鸡肉熟食表面四环素耐药(Tr)菌和磺胺耐药(Sr)菌的菌群结构。结果表明,3种培养基上均能获得培养的菌属数仅为总可培养的抗生素耐药菌属数的43.59%(34/78,冷鲜鸡Tr菌),42.86%(33/77,冷鲜鸡Sr菌),67.86%(19/28,鸡肉熟食Tr菌)和65.12%(19/28,鸡肉熟食Sr菌)。3种培养基对冷鲜鸡和鸡肉熟食样品表面两类可培养抗生素耐药菌的主要菌落结构的影响不大,但对部分菌属的丰度产生了显著影响,这些菌属可能在数量或特性上是耐药研究需要重点关注的菌群。因此,汇总多种培养基上获得的菌群信息可以更完善地描述鸡肉样品表面抗生素耐药菌的组成。
