基于高分辨质谱和网络药理学的可可茶多酚降血糖活性研究
2023-10-24黄秋颜林晓蓉陈忠正张媛媛
黄秋颜 李 斌 林晓蓉 鲁 森 陈忠正 张媛媛
(华南农业大学食品学院,广东 广州 510642)
可可茶(CamelliaptilophyllaChang),又称“南昆山毛叶茶”,是生长在广东省惠州市南昆山的珍稀茶树[1],该茶树不含或仅含不到0.1%的咖啡碱,可可碱含量高达3%~7%。研究证实,可可茶比传统茶树[Camelliasinensis(L). O. Kuntze]具有更突出的抗氧化[2-3]、抗炎[4]、抗癌[5]等功效。进一步理化分析发现,可可茶不仅具有高可可碱、低咖啡碱的生物碱组成,还具有高茶多酚、高反式/低顺式儿茶素、高花青素、含有多种特殊多酚等理化特性[6-7]。茶多酚是可可茶最重要的一类功能活性组分,但国内外原以高效液相色谱结合常规茶多酚单体标准品的分析方法,难以更全面、系统揭示可可茶的特殊多酚组成,制约了其功能特性的广泛研究。
超高效液相色谱—高分辨质谱联用技术(Ultra performance liquid chromatography-high resolution mass spectrometry,UPLC-HRMS)具有高分离效能、高灵敏度和高分辨率等优势,能够快速、全面展示天然多组分复杂体系的理化组成特性,已被用于分析普安茶[8]、黄金芽[9]等特色茶树的理化组成特性。网络药理学是近年发展起来的一种药物功能预测手段,主要基于质谱、核磁等技术解析的药物化学结构信息,借助计算机和数据库,通过对现有基因、靶点蛋白、疾病和药物等信息的分析处理和模拟预测,构建药物、靶点和疾病的关系网络,进而利用算法分析和预测药物功效及活性组分、作用机制[10],目前已成功用于预测绿茶[11]、藤茶[12]、苦丁茶[13]等植物的神经治疗和抗癌等功能特性。这些技术进展为系统揭示可可茶的特殊多酚组成,并在此基础上快速探究其健康功效,提供了新的平台和路径。
基于此,研究拟以可可茶的多酚粗提物为主要研究材料,采用UPLC-HRMS技术鉴定其组成,根据各组分的化学结构,采用网络药理学手段预测其功能活性;根据预测结果选择排名第三的降血糖活性,以云南大叶种绿茶多酚粗提物为对照,利用α-葡萄糖苷酶和α-淀粉酶初步验证其体外降血糖活性;通过GO功能富集和KEGG通路富集预测其降血糖作用机制,通过构建“组分—疾病—通路”网络筛选核心降血糖活性组分,并利用分子对接技术验证各组分与两种淀粉水解酶的结合能力,探讨可可茶多酚组分的降血糖活性及作用机制,为进一步分析可可茶的独特理化组成、深入揭示这一珍稀茶树资源的功能特性提供理论研究依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
可可茶:1芽2~3叶,采自广东省惠州市龙门县南昆山,鲜叶经微波杀青、干燥加工成干茶;
云南大叶种绿茶:一级,广东省华海糖业发展有限公司。
1.1.2 试剂
α-葡萄糖苷酶(酵母,比活力100 U/mg)、α-淀粉酶(猪胰腺,比活力14 U/mg)、4-硝基苯-α-D-吡喃葡萄糖苷(4-nitrophenyl-α-D-glucopyranoside,PNPG):上海源叶生物科技有限公司;
氯化钠、可溶性淀粉、硫酸、苯酚、氢氧化钠、酒石酸钾钠、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)均为国产分析纯。
1.2 仪器
纯水机:Milli-Q Integral 3型,德国Merck-Millipore公司;
电子分析天平:AL204型,梅特勒托利多仪器有限公司;
冷冻干燥机:Alpha 1-2 LD plus型,德国Martin Christ公司;
酶标仪:VersaMax型,美国Molecular Devices公司;
电热恒温水浴锅:HWS-24型,上海一恒科学仪器有限公司;
冷冻高速离心机:Centrifuge 5804R型,德国Eppendorf公司。
1.3 试验方法
1.3.1 两品种绿茶多酚的提取制备 参考旷小珊等[14]的方法,以可可茶和云南大叶种绿茶为原料,采用乙醇提取、乙酸乙酯萃取制备茶多酚粗提物。
1.3.2 可可茶多酚的组成分析 以可可茶多酚粗提物为研究材料,称取2 mg可可茶冻干粉,采用1 mL甲醇溶解,利用Agilent 654UHD Q-TOF超高压液相色谱/四极杆串联飞行时间质谱联用仪结合Agilent SB-Aq C18色谱柱(150 mm×2.1 mm,1.8 μm),以0.1%甲酸—水(A)和0.1%甲酸—乙腈(B)为流动相,流速0.4 mL/min,柱温50 ℃,进样量3 μL。线性梯度洗脱程序为:0 min,5% B;0.5 min,5% B;18 min,40% B;20 min,90% B;20.9 min,90% B;21 min,5% B;25 min,5% B。分别采用正、负离子模式扫描,扫描范围为70~1 000(m/z)。利用Amdis软件处理原始数据,将得到的一级、二级质谱数据分别与茶叶自建数据库、NIST、mzCloud和HMDB数据库中的化合物进行匹配确认。
1.3.3 可可茶多酚的功能预测 参考肖梦君等[15]的方法,先鉴定可可茶多酚组分的化学结构,再通过PubChem、SIWSS数据库和Metascape平台预测其功能活性。
1.3.4 可可茶多酚的降血糖活性预测 根据1.3.3的预测结果,以2型糖尿病(Type 2 diabetes mellitus,T2DM)为关键词,参考梁林盼等[16]的方法,通过GeneCards人类基因数据库、OMIM孟德尔遗传代谢数据库、DisGeNET数据库和TTD数据库收集T2DM的相关靶点,通过绘制韦恩图筛选可可茶多酚组分的潜在降血糖靶点,并通过STRING数据库结合Cytoscape 3.8.0、Prism等软件对潜在的降血糖靶点进行蛋白质相互作用(Protein-protein interaction,PPI)分析、GO功能富集和KEGG通路富集。同时,参考王腾飞等[17]的方法,建立可可茶多酚降血糖的“组分—靶点—通路”网络,根据拓扑参数、度值、介数中位数、紧密度等指标,筛选可可茶的核心降血糖多酚组分。
1.3.5 两品种绿茶多酚的体外降血糖活性评价
(1)α-葡萄糖苷酶活性抑制率:参考Deng等[18]的方法,稍作修改。采用pH 6.8、0.1 mol/L的磷酸缓冲液(PBS)分别配制底物PNPG溶液(2.5 mmol/L)和α-葡萄糖苷酶溶液(0.2 U/mL),将可可茶和云南大叶种绿茶的茶多酚粗提物用一级水溶解并稀释配成0.25,0.50,1.00,2.00,4.00 μg/mL系列浓度的样液,分别吸取50 μL不同浓度待测液于96孔板中,再加入50 μLα-葡萄糖苷酶溶液,于37 ℃孵育10 min,加入50 μL的PNPG溶液,37 ℃反应30 min,再加入50 μL 0.2 mmol/L的Na2CO3终止反应,于酶标仪405 nm处测定其吸光度(A1)。以阿卡波糖代替绿茶多酚作为阳性对照,以等体积PBS代替绿茶提取物作为空白对照(其吸光度记为A0),加入绿茶多酚并以等体积PBS取代α-葡萄糖苷酶溶液作为样品空白(其吸光度记为A2)。根据式(1)计算两品种绿茶多酚和阿卡波糖对α-葡萄糖苷酶的抑制率。
(1)
式中:
R——抑制率,%;
A0——以PBS代替代测样品的吸光值;
A1——经过待测样品处理的吸光值;
A2——以PBS代替α-淀粉酶溶液的吸光值。
(2)α-淀粉酶活性抑制率:参照Deng等[18]的方法并略作修改。采用pH 6.8、0.1 mol/L的PBS分别配制1%淀粉溶液与α-淀粉酶溶液(2 U/mL),绿茶多酚粗提物用一级水溶解并稀释配成不同浓度(0.125,0.250,0.500,1.000,2.000 mg/mL)的样液,DNS试剂参考赵凯等[19]的方法配制。取5 mL试管,分别加入待测样液300 μL和α-淀粉酶溶液400 μL,混匀后,于37 ℃孵育10 min后,加入1%可溶性淀粉溶液300 μL,37 ℃反应15 min。最后,加入2 mL DNS试剂显色,立即煮沸10 min终止反应,冷却后于酶标仪540 nm处测定其吸光度(A1)。以阿卡波糖为阳性对照,以PBS为空白对照(其吸光度记为A0),以等体积PBS代替α-淀粉酶溶液分析样液作为样品空白(其吸光度记为A2)。根据式(1)计算两品种绿茶多酚和阿卡波糖对α-淀粉酶的体外抑制率。
1.3.6 可可茶多酚的核心降血糖组分验证 参考沈荷玉等[20]的方法,采用分子对接技术结合Pymol软件分析1.3.4预测的可可茶核心降血糖多酚组分与α-葡萄糖苷酶、α-淀粉酶的相互作用。
1.4 数据处理
使用SPSS 20.0进行差异显著性分析和相关性分析,小写字母不同表示组间差异显著(P<0.05),图表数据以平均值±标准偏差表示。采用Origin 9.0计算各组分对两种淀粉水解酶的半抑制浓度(half maximal inhibitory concentration,IC50)及绘图。
2 结果与分析
2.1 可可茶多酚组分鉴定
采用UPLC-HRMS技术分别在正、负离子模式下分析可可茶的多酚粗提物的组成,其总离子流图见图1。通过对比各数据库中的一级、二级质谱数据,共鉴定出130个组分,包括GCG、EGCG、CG、ECG、GC、EGC、C、EC等8种儿茶素单体,槲皮素、芦丁、香豆素、杨梅素等黄酮及黄酮苷类,原花青素A1、A2、B2等花青素和花白素类,没食子酸、咖啡酸、绿原酸等酚酸和缩酚酸类,以及传统茶树不含或含量极少的儿茶素-3,5-二没食子酸酯和1,2,4,6-四没食子酰葡萄糖等多酚组分。与传统高效液相色谱法受限于标准品等仅能检测8种儿茶素单体、没食子酸等组分相比,高分辨质谱技术从可可茶的多酚粗提物中鉴定出了更丰富的多酚组成,为进一步挖掘可可茶及其多酚组分的功能特性提供了物质基础。
2.2 可可茶多酚组分功能活性预测
在利用高分辨质谱系统鉴定可可茶多酚组分化学结构的基础上,研究采用基因注释工具Metascape对130种组分的潜在作用靶点做DisGeNET分析,计算靶点聚集在每个疾病条目中的数目和显著性,以-logP值作热图分析,排名前20的疾病类型如图2所示。其中排名前3的疾病类型为神经性疾病、记忆障碍和糖尿病。目前,糖尿病已成为继癌症、心血管疾病之后的第三大类非传染性疾病,传统茶树的提取物及其茶多酚、茶多糖等已被证实能够有效抑制淀粉水解酶、改善机体胰岛素抵抗[21],具有较强的降血糖活性,但目前尚未系统、深入探究可可茶多酚的降血糖活性。

图2 可可茶多酚组分的疾病富集分析
2.3 可可茶多酚体外降血糖活性评价
在利用网络药理学预测可可茶多酚的降血糖活性基础上,以可可茶和云南大叶种绿茶的多酚粗提物为研究材料,比较分析两品种绿茶多酚对α-淀粉酶和α-葡萄糖苷酶活性的抑制率及IC50,结果如图3所示。由图3可知,两种绿茶多酚对两种淀粉水解酶的活性均有显著抑制作用,随其质量浓度增大,抑制率升高,且对α-葡萄糖苷酶的抑制作用强于α-淀粉酶;其中,可可茶多酚对两种淀粉水解酶活性的抑制作用显著强于云南大叶种,当质量浓度达4 μg/mL时,其对α-葡萄糖苷酶的抑制作用与阳性药物阿卡波糖相当,当质量浓度为0.5~2.0 mg/mL时,其对α-淀粉酶的抑制活性均强于阿卡波糖。这一结果表明,可可茶多酚比云南大叶种绿茶多酚具有更强的体外降血糖作用,但其核心活性组分和作用机制尚不明确。
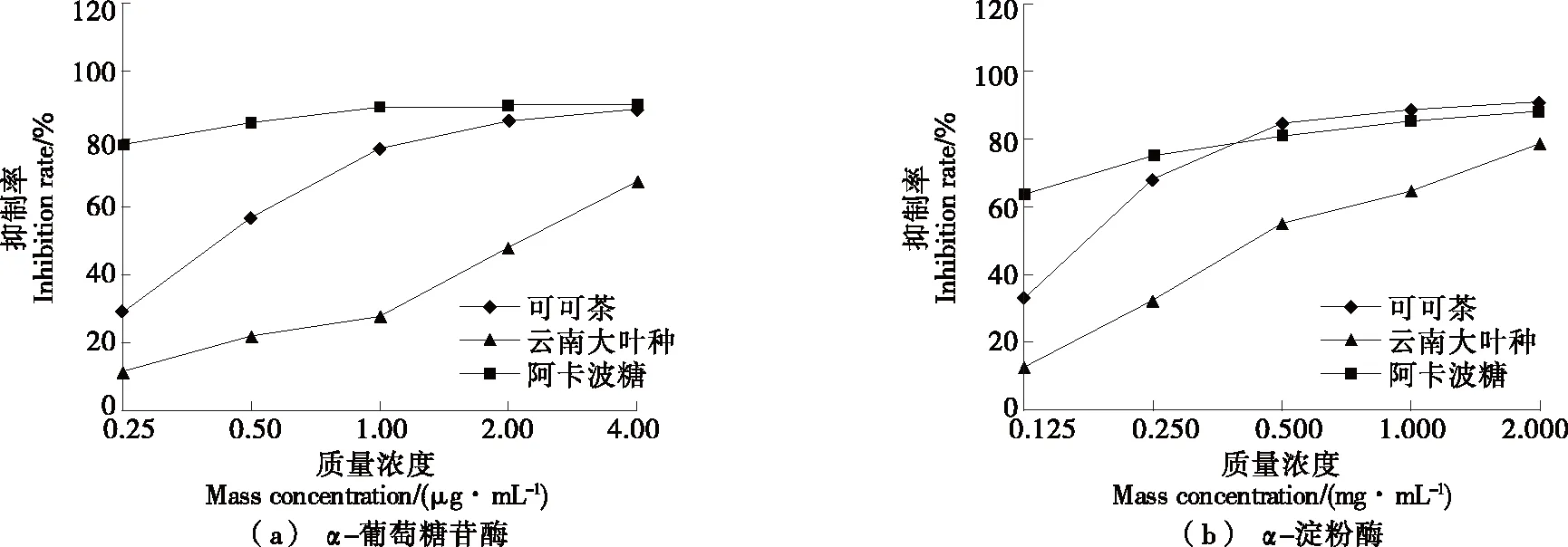
图3 两种绿茶多酚对α-葡萄糖苷酶和α-淀粉酶的抑制率及半抑制浓度IC50
2.4 可可茶多酚降血糖作用机制预测
为进一步探索可可茶多酚发挥降血糖活性的分子机制,利用GeneCards、OMIM、DisGeNET和TTD数据库筛选获得4 820个T2DM的候选靶点,采用Venny分析潜在作用靶点与糖尿病相关作用靶点的交集,获得了367个可可茶多酚的潜在降血糖靶点,见图4(a)。利用String平台生成这些靶点的PPI网络,该网络图含有367个节点、13 758条边,平均每个节点有37条边,靶点之间有较强的关联性,见图4(b)。通过比较紧密度、度值和平均最短路径,筛选出GAPDH、AKT1、TP53、ALB、IL6、TNF 6个可可茶多酚的降血糖关键作用靶点(表1)。
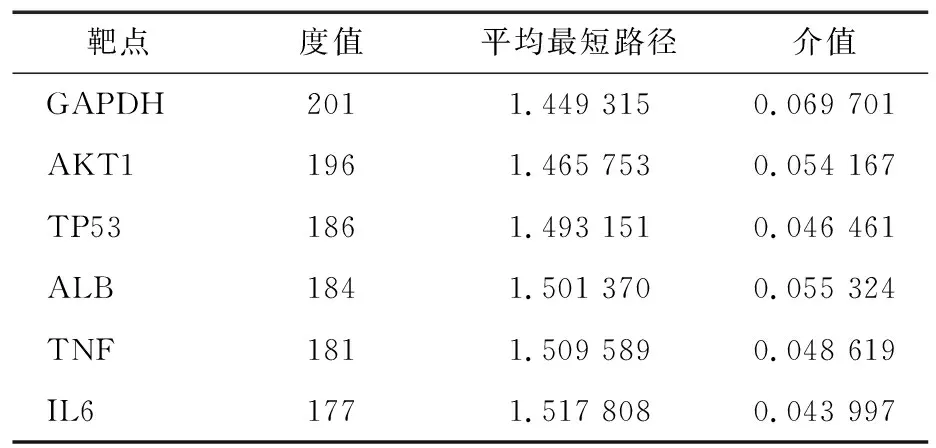
表1 可可茶多酚关键降血糖靶点的拓扑学参数

图4 可可茶多酚潜在降血糖靶点的韦恩图及PPI网络
进一步对可可茶多酚的367个潜在降血糖靶点进行GO功能富集和KEGG通路富集分析。GO分析共富集了3 836个条目,其中3 287个与生物过程相关,190个与细胞成分相关,359个与分子功能相关。根据P值<0.01,选取生物过程(BP)、细胞成分(CC)、分子功能(MF)富集结果排名前10的条目进行可视化处理,结果如图5所示。由图5可知,可可茶多酚的降血糖靶点主要参与丝裂原活化蛋白激酶和氧化应激反应等生物过程,存在于膜筏、膜微区、囊泡腔等细胞成分,行使蛋白丝氨酸/苏氨酸/酪氨酸激酶活性、磷酸酶结合活性、丝氨酸水解酶活性等分子功能。KEGG分析共富集了119个信号通路,主要涉及PI3K-AKT、刺激神经组织的交互通路、癌症的蛋白聚糖通路、脂质和动脉硬化等途径。其中,PI3K/AKT信号通路富集得分最高,作为经典的胰岛素信号通路,其在调节糖原合成和糖异生中起关键作用[22],同时也是多酚类化合物或富含多酚的植物提取物发挥降血糖功效的关键通路[23-25]。
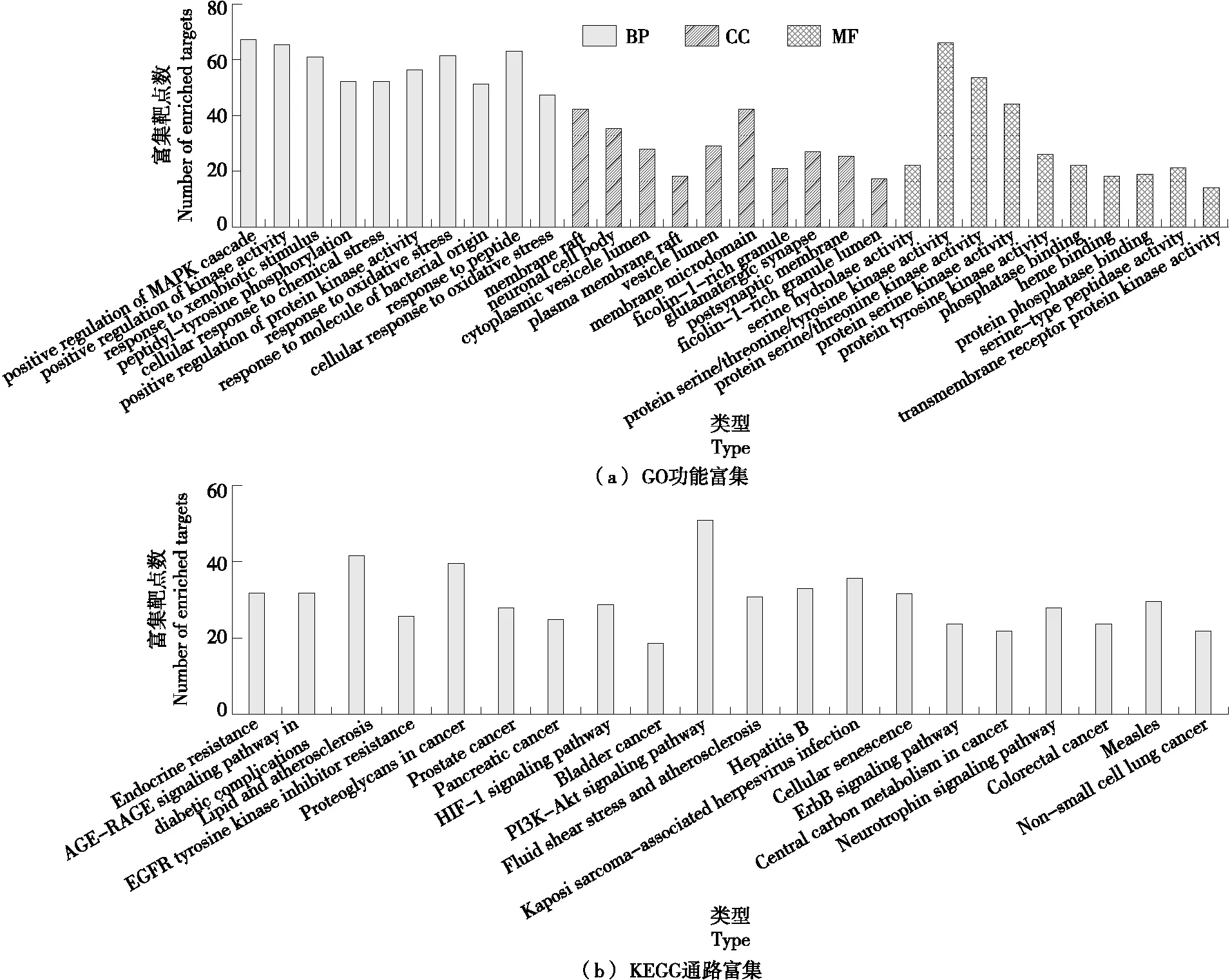
图5 可可茶多酚潜在降血糖靶点的GO功能富集和KEGG通路富集
上述研究结果表明:可可茶多酚可能通过作用于GAPDH、AKT1、TP53、ALB、IL6、TNF等多个靶点发挥降血糖活性,涉及丝氨酸/苏氨酸/酪氨酸激酶等多种生物功能及胰岛素抵抗、炎症、癌症等多条信号通路,具有多靶点、多通路的作用特点。
2.5 可可茶多酚核心降血糖组分预测与验证
为进一步筛选可可茶多酚粗提物的核心降血糖活性组分,研究将上述可可茶多酚组分、潜在降血糖靶点及KEGG富集分析中前20条通路导入Cytoscape软件,构建可可茶多酚的“组分—T2DM—通路”网络图(图6),并以度值、平均最短路径、介值等拓扑学参数综合评价节点的关键程度,结果如表2所示。由表2可知:排名前10的金合欢素、草质素、山核桃素、花青素、木犀草素、杨梅素、山萘酚、柚皮素、山药素Ⅲ和山奈素可能是可可茶多酚的核心降血糖组分。其中,花青素、柚皮素、木犀草素、杨梅素和山柰酚等已被证实能够减轻糖尿病小鼠中胰岛B细胞的损伤,促进肝糖原和胰岛素的合成、抑制体外淀粉消化酶活性,调控机体内的血糖水平[26-27]。
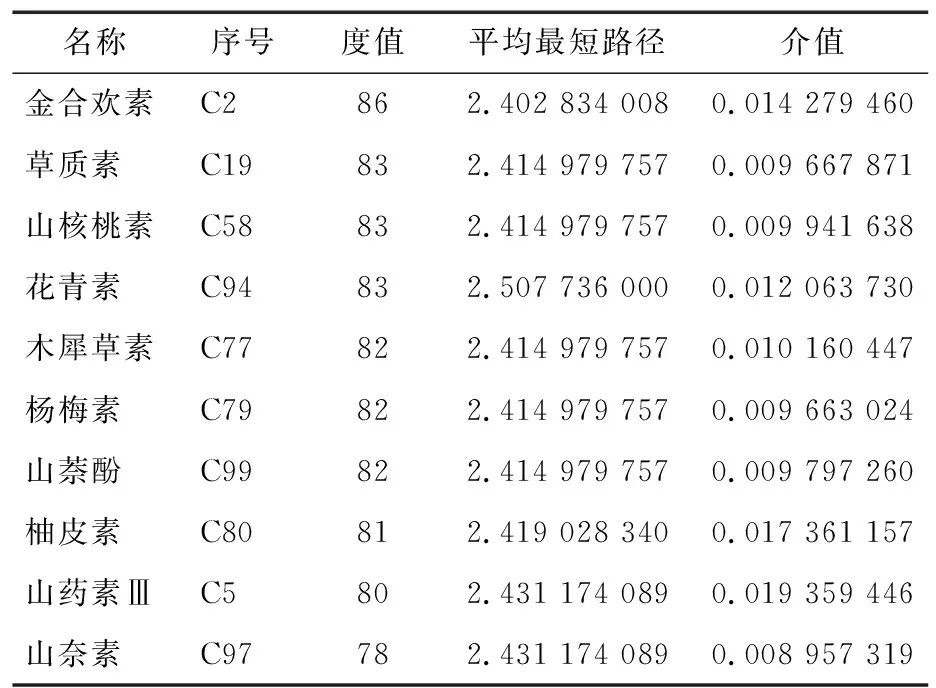
表2 可可茶多酚排名前10的降血糖活性组分的拓扑学参数

图6 可可茶多酚的“组分—T2DM—通路”网络
研究以阿卡波糖为阳性对照,将上述筛选的10种多酚组分与α-葡萄糖苷酶和α-淀粉酶进行分子对接,以验证10种多酚组分的降血糖活性,结果如图7所示。10种可可茶核心降血糖多酚组分与α-葡萄糖苷酶、α-淀粉酶的对接结合能均小于-21 kJ/mol,说明各组分与两种淀粉水解酶具有较强的结合能力。进而,利用PyMol软件对山核桃素、花青素、杨梅素等8组对接结合能较低的分子对接结果进行可视化(图8),发现8种多酚组分均能通过氢键与两种淀粉水解酶分子中不同位置的氨基酸残基结合。这些结果提示,山核桃素、花青素、杨梅素等10种多酚组分,可能是可可茶多酚中发挥降血糖活性的核心组分。
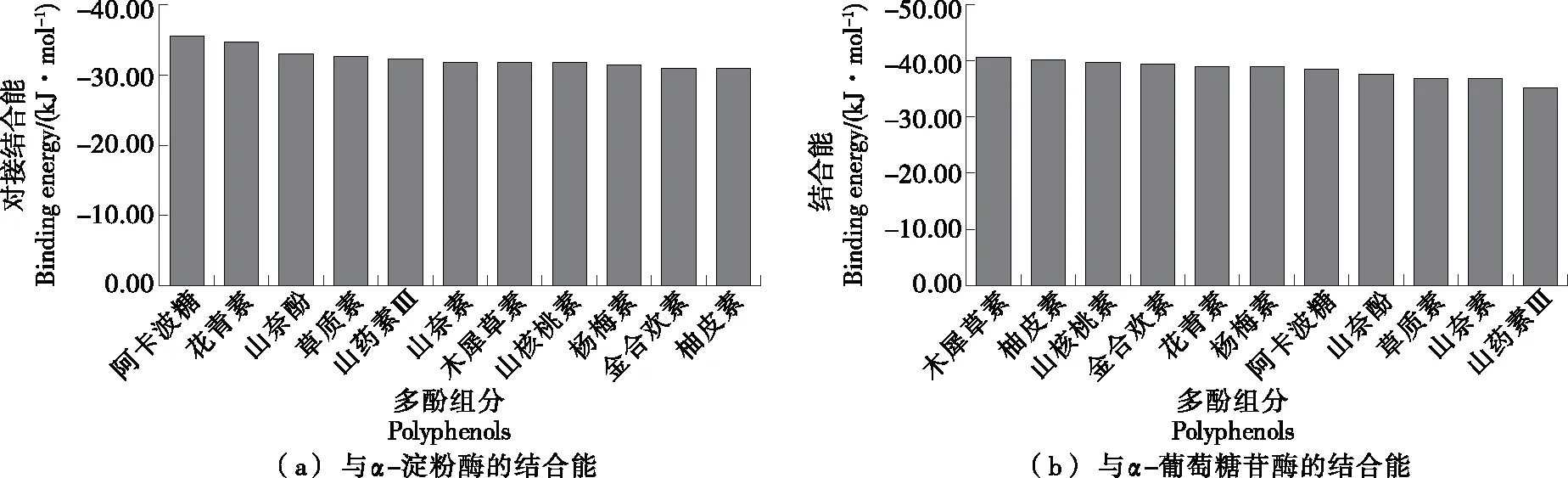
图7 可可茶核心降血糖多酚组分与α-淀粉酶和α-葡萄糖苷酶的结合能

图8 可可茶核心降血糖多酚组分与α-淀粉酶和α-葡萄糖苷酶分子对接可视化图
3 结论
研究利用UPLC-HRMS技术,从可可茶多酚粗提物中鉴定出130种组分;采用网络药理学预测结合体外α-葡萄糖苷酶、α-淀粉酶抑制实验验证,发现可可茶比云南大叶种绿茶多酚具有更强的降血糖活性;经GO功能富集和KEGG通路富集,预测其通过GAPDH、AKT1、TP53、ALB、IL6、TNF 6个关键作用靶点和PI3K-AKT1等主要信号通路发挥降血糖活性;通过构建“组分—靶点—通路”网络、结合各组分与α-葡萄糖苷酶和α-淀粉酶的分子对接模拟,筛选出山核桃素、花青素等10种核心降血糖组分。研究结果表明,可可茶多酚粗提物通过多组分、多靶点、多通路共同发挥降血糖功效,这为未来进一步利用细胞、动物等模型靶向深入研究可可茶的降血糖活性及作用机制提供了相关的研究路线。
