过表达FAM3A通过激活PI3K/Akt信号通路减轻低氧/复氧诱导的心肌细胞损伤
2023-10-23钟妮尔安慧仙
钟妮尔,杨 光,安慧仙
(1陕西省人民医院心血管内二科,西安 710068;2西安国际医学中心医院心内二科;*通讯作者,E-mail:anhuixian6789@163.com)
急性心肌梗死是一种常见的冠心病,具有非常高的致死和致残率[1]。近年来,随着生活水平的提高和老年人口的增加,急性心肌梗死的发病率普遍升高,给家庭和社会都带来了沉重的负担[2]。冠状动脉急性或慢性狭窄或堵塞,可导致供血区的心肌细胞缺血缺氧,进而发生细胞坏死,引起心脏功能异常[3]。采用再灌注手段立即恢复心肌供血,是治疗心肌梗死的主要方法。但是,缺血心肌恢复血液灌注后,会产生第二次损伤,临床上称之为心肌缺血再灌注损伤[4]。心肌缺血再灌注损伤是一个复杂的病理变化过程,涉及心肌细胞凋亡和氧化应激等不良细胞过程[5]。心肌缺血再灌注会导致多个基因异常表达,从而影响心肌细胞凋亡和氧化应激等过程[6]。因此,探寻对心肌缺血再灌注损伤具有调控作用的新基因,对开发有效的临床治疗方法可提供重要的理论基础和靶标分子。
PI3K/Akt信号通路是目前研究比较广泛的一个信号通路,可参与调控多种细胞过程,其异常调控与多种疾病的发生密切相关[7,8]。PI3K具有磷脂酰肌醇激酶的活性,可将二磷酸磷脂酰肌醇转化为三磷酸磷脂酰肌醇。三磷酸磷脂酰肌醇作为第二信使,可招募Akt至细胞膜内侧,使其磷酸化,从而激活Akt下游通路[9]。越来越多的研究表明,PI3K/Akt信号通路在心肌缺血再灌注损伤中具有重要的调控作用[10]。在缺血再灌注损伤的心肌组织中,PI3K/Akt信号通路活性下调;而上调PI3K/Akt信号通路活性可以抑制心肌细胞凋亡,缓解氧化应激反应,对心肌缺血再灌注损伤具有良好的保护效应[11]。因此,深入探讨PI3K/Akt信号通路的调控机制,鉴定可调控PI3K/Akt信号通路的新分子,对于心肌缺血再灌注损伤具有非常重要的意义。
序列相似性家族3A蛋白(family with sequence similarity 3 member A, FAM3A)是FAM家族的一员,具有广泛的组织细胞表达模式,与胚胎发育密切相关[12]。FAM3A是一种线粒体蛋白,可以增加ATP的产生和分泌[13]。FAM3A可以维护正常的线粒体跨膜电位,减少线粒体活性氧(reactive oxygen species,ROS)的产生,抑制线粒体的肿胀,在维持线粒体的正常功能中发挥重要作用[14]。FAM3A可调控糖原和脂肪的生成,在代谢异常相关的疾病中发挥重要作用[13,15,16]。另外,FAM3A具有细胞保护作用,可减轻细胞受到的高糖损伤、炎症损伤以及谷氨酸毒性损伤[17-19]。值得注意的是,FAM3A对大脑和肝脏器官的缺血再灌注损伤,具有良好的保护作用[20,21]。关于FAM3A在心肌缺血再灌注损伤中作用,目前研究甚少。本项目通过心肌细胞的低氧/复氧(hypoxia/reoxygenation,H/R)模型来模拟体内心肌缺血再灌注损伤,研究FAM3A过表达对H/R诱导的心肌细胞损伤的调控作用,并阐明可能的分子作用机制,对FAM3A在心肌缺血再灌注损伤的作用进行初步探讨。
1 材料和方法
1.1 材料与试剂
小鼠HL-1心肌细胞购自北京BeNa Culture Collection公司;DMEM培养基和胎牛血清购自武汉Procell生命科技有限公司;CCK-8试剂盒、LDH试剂盒、TUNEL试剂盒和和SOD试剂盒购自上海碧云天生物科技有限公司;ROS试剂盒和MDA试剂盒购自沈阳万类生物科技有限公司;TransIntro EL转染试剂、RNA提取试剂TransZol、First-Strand cDNA合成试剂盒、Green qPCR SuperMix、蛋白提取试剂盒和蛋白浓度测定试剂盒购自北京全式金生物科技有限公司;兔抗鼠FAM3A、Bcl-2、Bax、α-actin抗体和HRP标记的山羊抗兔二抗购自武汉三鹰生物技术有限公司;兔抗鼠cleaved Caspase-3抗体购自北京博奥森科技有限公司;兔抗鼠Akt和p-Akt抗体购自美国Cell Signaling Technology公司;兔抗鼠p-PI3K和PI3K抗体购自江苏亲科生物研究中心有限公司;PI3K抑制剂LY294002购自上海Selleck公司。
1.2 实验方法
1.2.1 心肌细胞H/R模型建立 小鼠HL-1心肌细胞培养在DMEM培养基中,并添加10%的胎牛血清,置于37 ℃、5% CO2的细胞培养箱中培养。将心肌细胞置于含1% O2、5% CO2和94% N2的厌氧培养箱中,37 ℃孵育6 h。然后,将心肌细胞转移至含5% CO2和95%空气的常氧培养箱中,37 ℃孵育12 h。常氧对照组细胞置于37 ℃、5% CO2的细胞培养箱中正常培养。
1.2.2 细胞转染和分组 构建表达小鼠FAM3A基因的重组载体pcDNA3.1-FAM3A。将HL-1心肌细胞接种于24孔板,置于常氧培养箱中孵育。待细胞融合度达到80%左右,采用TransIntro EL转染试剂将质粒转染至心肌细胞。将转染细胞继续培养48 h,进行后续实验。
分组一:为了研究FAM3A对H/R损伤的调控作用,将细胞分为常氧组、H/R组、H/R+空载体组和H/R+FAM3A载体组。常氧组心肌细胞在常氧条件下培养;H/R组心肌细胞低氧培养6 h,然后常氧培养12 h;H/R+空载体组心肌细胞转染pcDNA3.1空载体,然后进行H/R处理;H/R+FAM3A载体组心肌细胞转染pcDNA3.1-FAM3A,然后进行H/R处理。
分组二:为了验证FAM3A通过PI3K/Akt信号通路减轻H/R损伤,将细胞分为常氧组、H/R+空载体组、H/R+FAM3A载体组和H/R+FAM3A载体+LY294002(PI3K/Akt抑制剂)组,LY294002的处理浓度为20 μmol/L。
1.2.3 RT-qPCR检测FAM3A的mRNA表达 按1.2.2分组一处理心肌细胞,采用TransZol试剂盒抽提细胞总RNA,采用First-Strand cDNA合成试剂盒合成cDNA。以cDNA为模板,加入Green qPCR SuperMix和正反向引物,加去离子水补至20 μl反应体系。采用PCR反应条件:94 ℃,30 s;然后94 ℃ 5 s,60 ℃ 30 s,40个循环。以α-actin为内参基因,采用2-ΔΔCt公式计算靶基因的相对表达水平。FAM3A正向引物序列为5′-GGCCCTAATCATCATTATGGGTC-3′,反向引物序列为5′-TGCAGTCACTGAGTTCTCTGG-3′。α-actin正向引物序列为5′-CCCAAAGCTAACCGGGAGAAG-3′,反向引物序列为5′-CCAGAATCCAACACGATGCC-3′。
1.2.4 Western blotting检测FAM3A、Bax、Bcl-2、cleaved Caspase-3、PI3K和Akt的蛋白表达 按1.2.2分组一处理心肌细胞,提取细胞蛋白,测定蛋白浓度,采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离蛋白。采用湿转法将凝胶中分离的蛋白转移至PVDF膜上。将膜浸入5%脱脂奶粉中,室温封闭1 h。加入一抗稀释液(FAM3A抗体稀释度为1∶500,Bax抗体稀释度为1∶2 000,Bcl-2抗体稀释度为1∶2 000,p-Akt抗体稀释度为1∶2 000,Akt抗体稀释度为1∶1 000,p-PI3K抗体稀释度为1∶1 000,PI3K抗体稀释度为1∶1 000),4 ℃摇床孵育过夜。TBST洗膜,加入二抗稀释液(稀释度为1∶5 000),室温孵育1 h。采用ECL试剂进行显色,将膜放入凝胶成像仪,采集图像。
1.2.5 CCK-8法检测细胞生存率 将心肌细胞接种到96孔板,按1.2.2分组一处理。待处理完成,每孔中加入10 μl CCK-8溶液,继续培养2 h,采用酶标仪测定细胞溶液在450 nm波长处的吸光度。
1.2.6 LDH法检测细胞损伤 将心肌细胞接种到24孔板,按1.2.2分组一处理。待处理完成,吸取细胞上清液,转移到96孔培养板。每孔中加入60 μl LDH检测工作液,混匀、室温避光孵育30 min。采用酶标仪测定溶液在490 nm处测定吸光度。
1.2.7 TUNEL法检测细胞凋亡 将心肌细胞接种到盖玻片上,按1.2.2分组处理。待处理完成,采用4%多聚甲醛固定细胞。PBS洗涤细胞,加入含0.3% Triton X-100的PBS,进行透化处理。PBS洗涤细胞,每孔加入50 μl TUNEL检测液,于37 ℃避光孵育60 min。PBS洗涤细胞,加入DAPI溶液复染细胞核,室温避光孵育10 min。采用抗荧光淬灭封片液封片,在荧光显微镜下观察和拍照。
1.2.8 DCFH-DA探针检测ROS水平 将心肌细胞接种到24孔板,按1.2.2分组处理。待处理完成,吸弃培养液,加入含有DCFH-DA探针的无血清培养基,置于细胞培养箱中孵育30 min。采用无血清培养基洗涤细胞,然后采用荧光酶标仪检测荧光强度。
1.2.9 MDA试剂盒检测MDA含量 将心肌细胞接种到24孔板,按1.2.2分组一处理。待处理完成,吸弃培养液,加入PBS作为匀浆介质破碎细胞。离心取上清,加入MDA检测试剂,漩涡混匀,95 ℃沸水浴40 min。取出后流水冷却,离心取上清,采用酶标仪测定溶液在532 nm处的吸光度。
1.2.10 SOD试剂盒检测SOD活性 将心肌细胞接种到24孔板,按1.2.2分组一处理。待处理完成,吸弃培养液,加入SOD制备液,裂解细胞。吸取上清液,转移到96孔培养板,加入酶工作液和反应启动液混匀,置于37 ℃孵育30 min,采用酶标仪测定溶液在450 nm处的吸光度。
1.3 统计学分析

2 结果
2.1 H/R处理降低FAM3A在心肌细胞中的表达
RT-qPCR结果显示,与常氧组相比,H/R组FAM3A的mRNA表达水平降低,差异有统计学意义(P<0.01,见图1A)。Western blotting结果显示,与常氧组比较,H/R组FAM3A蛋白表达量减少,差异有统计学意义(P<0.01,见图1B)。

与常氧组比较,**P<0.01

A.RT-qPCR检测FAM3A的mRNA表达水平B.Western blotting检测FAM3A的蛋白表达水平
2.2 过表达FAM3A可提高H/R处理的心肌细胞的存活率
与H/R+空载组比较,H/R+FAM3A载体组FAM3A的mRNA和蛋白表达水平升高,差异有统计学意义(P<0.01,见图2)。CCK-8实验结果显示,与常氧组比较,H/R组心肌细胞的存活率显著降低;与H/R组和H/R+空载组比较,H/R+FAM3A载体组心肌细胞存活率显著提高(P<0.01,见图3A)。LDH细胞毒性实验结果显示,与常氧组比较,H/R组LDH活性显著升高;与H/R组和H/R+空载组比较,H/R+FAM3A载体组LDH活性显著降低(P<0.01,见图3B)。
2.3 过表达FAM3A减轻H/R诱导的心肌细胞凋亡
TUNEL实验结果显示,与常氧组比较,H/R组心肌细胞凋亡率显著增加;与H/R组和H/R+空载组比较,H/R+FAM3A载体组心肌细胞凋亡凋亡率显著下降(P<0.01,见图4A)。Western blotting实验结果显示,与常氧组比较,H/R组cleaved Caspase-3和Bax蛋白表达水平显著升高,而Bcl-2蛋白表表达水平显著降低;与H/R组和H/R+空载组比较,H/R+FAM3A载体组cleaved Caspase-3和Bax蛋白水平显著减少,而Bcl2蛋白表表达水平显著显著增加(P<0.01,见图4B)。
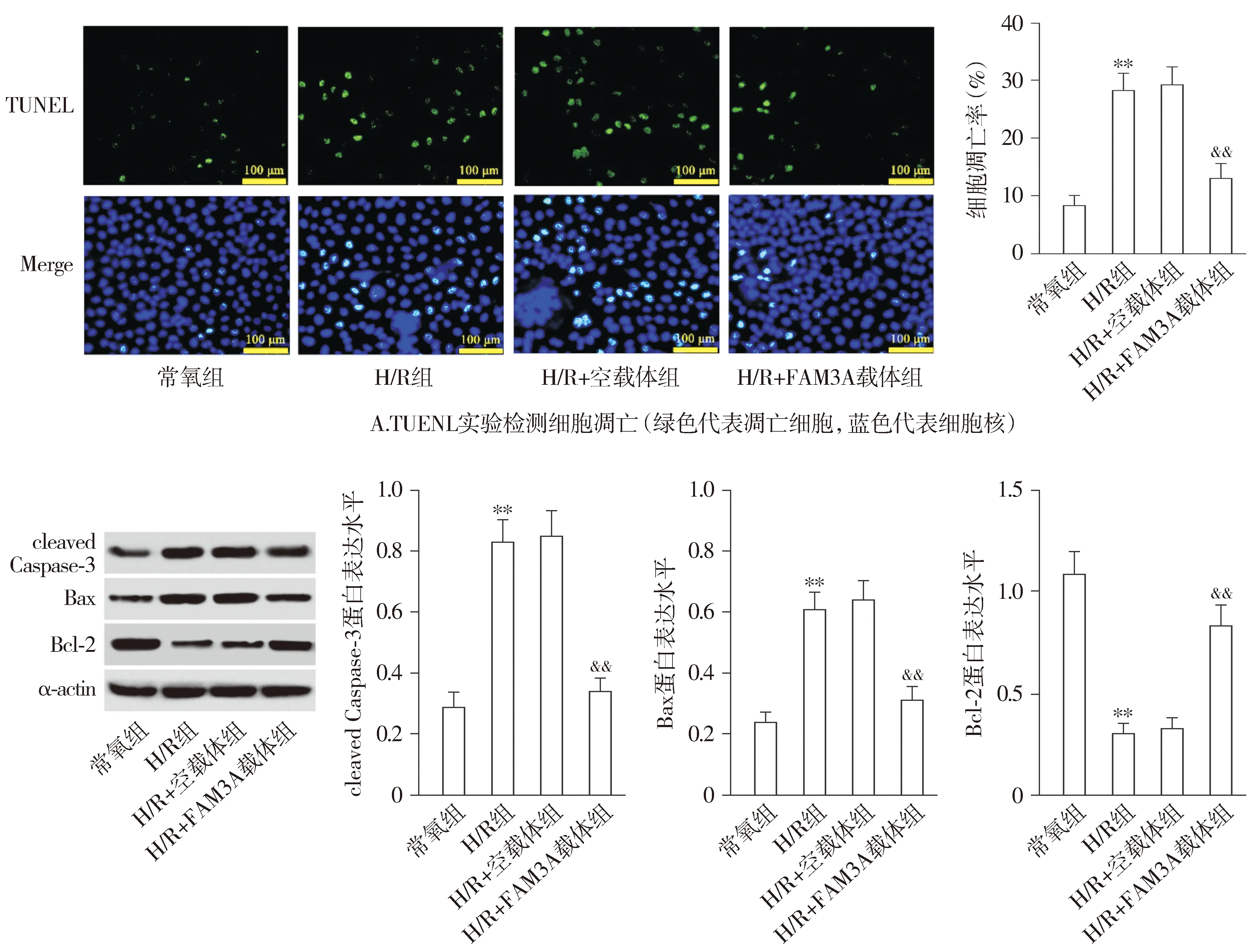
B.Western blotting检测cleaved Caspase-3、Bax和Bcl-2蛋白水平
2.4 过表达FAM3A减轻H/R诱导的心肌细胞的氧化应激
与常氧组比较,H/R组ROS水平显著升高,MDA含量显著增加,SOD活性显著降低;与H/R组和H/R+空载组比较,H/R+FAM3A载体组ROS水平显著降低,MDA含量显著减少,SOD活性显著升高(均P<0.01,见图5)。
2.5 过表达FAM3A激活PI3K/Akt信号通路
Western blotting实验结果显示,与常氧组比较,H/R组PI3K和Akt的磷酸化水平显著降低;与H/R组和H/R+空载组比较,H/R+FAM3A载体组PI3K和Akt的磷酸化水平显著升高(均P<0.01,见图6)。

与常氧组比较,**P<0.01;与H/R组和H/R+空载体组比较,&&P<0.01
2.6 抑制PI3K/Akt信号通路逆转FAM3A介导的心肌细胞保护作用
与常氧组比较,H/R+空载组心肌细胞凋亡率显著增加,ROS水平显著升高(均P<0.01,见图7)。与H/R+空载组比较,H/R+FAM3A载体组心肌细胞凋亡率显著降低,ROS水平显著下降(均P<0.01,见图7)。与H/R+FAM3A载体组比较,H/R+FAM3A+LY294002组心肌细胞凋亡率显著增加,ROS水平显著升高(P<0.01,见图7)。

与常氧组比较,**P<0.01;与H/R+空载体组比较,&&P<0.01;与H/R+FAM3A载体组比较,@@P<0.01
3 讨论
缺血再灌注会导致心肌组织中大量基因异常表达,引起多种信号通路的异常调控,促进心肌损伤病理的进展过程。鉴定心肌缺血再灌注损伤中异常表达的新基因,研究其对心肌损伤的调控作用,是目前研究的热点方向。这些研究可为研发心肌缺血再灌注损伤的新型治疗方法提供重要的理论基础和靶标分子。本项目通过心肌缺血再灌注损伤的体外模型,即H/R心肌细胞损伤模型,发现FAM3A在H/R处理的心肌细胞中表达下调。进一步的细胞功能学实验结果发现,过表达FAM3A通过激活PI3K/Akt信号通路减轻H/R诱导的心肌细胞损伤,表明FAM3A可能是心肌缺血再灌注损伤的一个重要调控分子。
既往研究发现,FAM3A参与调控一些器官的缺血再灌注损伤。在小鼠中敲除FAM3A可加剧缺血再灌注诱导的肝损伤[20]。在小鼠后肢缺血模型中,过表达FAM3A可促进内皮血管的新生,减轻缺血损伤[22]。另外,过表达FAM3A还可以减轻缺血再灌注对脑组织损伤,显著改善神经认知功能[23]。本项目通过心肌细胞H/R模型,探讨了FAM3A对心肌缺血再灌注损伤可能的调控作用。研究结果发现,过表达FAM3A可有效抑制H/R诱导的心肌细胞损伤,表明FAM3A极可能参与调控心肌缺血再灌注损伤过程。值得注意的是,最新发表的文献表明FAM3A直接参与心肌缺血再灌注损伤[24]。该文献中报道,与野生型小鼠比较,FAM3A敲除的小鼠在受到心肌缺血再灌注损伤时,其死亡率增加,心肌梗死面积更大,心脏收缩功能下降更为明显[24]。因此,结合本研究实验结果可以更明确地证明FAM3A参与调控心肌缺血再灌注损伤。
FAM3A具有抗凋亡和抗氧化作用,可减轻细胞受到的有害损伤。在HT22神经元细胞中,过表达FAM3A可减轻过氧化氢诱导的细胞损伤、凋亡和ROS产生[25]。过表达FAM3A还可减少内质网应激诱导的神经元细胞凋亡[14]。在PC-12神经元细胞中,过表达FAM3A可减轻谷氨酸诱导的细胞凋亡和氧化应激[19]。敲除血管内皮细胞中FAM3A可加剧高糖诱导的细胞凋亡和氧化应激[17]。另外,过表达FAM3A可减少H/R诱导的肝细胞凋亡[20]。本项目通过质粒转染技术来实现FAM3A在心肌细胞中过表达,以此来研究FAM3A对H/R诱导的心肌损伤的调控作用。与以往的研究报道一致,本研究表明FAM3A过表达可减轻H/R诱导的心肌细胞凋亡和氧化应激,进一步证实FAM3A是一个具有细胞保护作用的基因。因此,本研究证实FAM3A在H/R损伤的心肌细胞中发挥保护作用。
FAM3A是PI3K/Akt信号通路的重要调控分子。据报道,FAM3A可提高PI3K的催化活性,从而促进Akt的激活[13]。FAM3A通过激活Akt促进脂肪细胞中的脂肪合成[16]。过表达FAM3A可通过激活PI3K/Akt信号通路,提高细胞在不利环境下的存活率[18,20]。考虑到PI3K/Akt信号通路在H/R诱导的心肌细胞损伤中也发挥关键作用[26],本项目进一步研究了FAM3A是否调控H/R处理的心肌细胞中的PI3K/Akt信号通路。研究结果发现,FAM3A过表达可显著上调PI3K和Akt的蛋白磷酸化水平,说明FAM3A可促进PI3K/Akt信号通路的激活。进一步研究发现,抑制PI3K/Akt信号通路则显著逆转FAM3A过表达对H/R心肌细胞的保护作用。因此,本项目证实了FAM3A通过激活PI3K/Akt信号通路来减轻H/R诱导的心肌细胞损伤。
综上所述,本研究发现FAM3A参与调控H/R诱导的心肌细损伤,其作用机制主要通过激活PI3K/Akt信号通路来发挥抗凋亡和抗氧化应激作用。通过靶向FAM3A抑制心肌细胞损伤,可作为心肌缺血再灌注损伤的一个潜在治疗策略。但是,本研究关于FAM3A的作用是通过体外H/R细胞模式得到的,存在一定的局限性。因此,关于FAM3A在心肌缺血再灌注损伤的明确作用和机制,需要通过动物模型的体内实验进一步地研究和验证。
