转录因子Nrf2过表达对人牙髓干细胞增殖、迁移及成骨分化的影响
2023-10-23翟莎菲张丽慧刘雅楠马笑笑刘昌奎
翟莎菲,张丽慧,李 雪,刘雅楠,马笑笑,张 典,刘昌奎
(1西安医学院口腔医学院口腔组织病理学教研室,西安 710021;2西安医学院口腔医学院口腔正畸学教研室;3西安医学院临床医学院;4西安医学院基础医学部;5西安医学院口腔医学院口腔颌面外科学教研室;*通讯作者,E-mail:dentistlck@126.com)
牙周炎造成的牙槽骨吸收是导致牙齿丧失的首要原因。很多研究提示氧化应激参与骨代谢的调节过程。核转录因子-E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)作为转录因子,其本身及其对氧化应激的调控均参与骨代谢[1]。牙髓干细胞具有易获得性和高成骨潜力,是一种有前途的骨再生的细胞来源。以往的研究显示,Nrf2是调节成骨细胞和骨形成的重要因素,Nrf2活化参与了牙周膜干细胞循环机械拉伸下的成骨分化[2]。在缺氧环境下,敲低人脐带间充质干细胞中的Nrf2表达会损害干细胞标志物的表达和成骨过程,而Nrf2的过表达能使间充质干细胞增殖增加,细胞凋亡率显著降低[3],提示Nrf2对干细胞的增殖和分化有调节作用。但Nrf2是否能够调节牙髓干细胞的自我更新和成骨分化能力,目前未见有研究。本研究旨在探索Nrf2过表达对人牙髓干细胞增殖、迁移能力和成骨分化的影响,为组织工程学的进一步研究奠定基础。
1 材料与方法
1.1 主要试剂与仪器
α-MEM细胞培养基、Ⅰ型胶原酶、胎牛血清购自美国Gibco公司,慢病毒载体构建和病毒包装由上海吉凯基因公司设计及提供;转染试剂lipo2000购自美国Invitrogen公司;茜素红购自国药;细胞增殖MTT检测试剂盒和碱性磷酸酶(ALP)试剂盒购自碧云天公司;青链霉素、含EDTA的胰蛋白酶、β-甘油磷酸钠、牛血清白蛋白购自美国Sigma公司;地塞米松、抗坏血酸购自阿拉丁公司;嘌呤霉素购自MCE公司;Q-PCR试剂套装(Trizol、反转录及扩增试剂盒)购自日本TaKaRa公司。CO2细胞培养箱(Heraeus,日本);倒置显微镜及照相系统(Olympus公司,日本);酶标仪(BioTek,美国);荧光定量PCR仪(ABI,美国);Transwell小室(Corning,美国)。
1.2 细胞培养
实验经过西安医学院医学伦理委员会批准,收集15~24岁在门诊因正畸或者阻生要求拔出的健康第三磨牙。参考文献[4]方法,含青链霉素的PBS溶液反复冲洗清洁牙齿,高速球钻开髓后无菌取出牙髓组织,剪弃根尖,组织剪碎后加入4 000 mg/L的Ⅰ型胶原酶37 ℃孵箱中消化40 min,PBS漂洗,加入2 ml含20%胎牛血清,100 U/ml青霉素,100 mg/L链霉素的α-MEM培养基重悬,单细胞悬液接种在6孔板,5% CO2、37 ℃培养,细胞汇合80%时,按1∶3传代,有限稀释法纯化细胞。
1.3 细胞转染和转染效率的验证
细胞分为Nrf2过表达组和空病毒组。带有荧光标记的过表达Nrf2的载体和病毒的包装由吉凯公司完成。载体名称:GV358。元件顺序为:Ubi-MCS-3FLAG-SV40-EGFP-IRES-puromycin。载体序列见图1。按照Lipo2000说明书,将吉凯公司已包装后的过表达Nrf2的慢病毒转染人牙髓干细胞,分别用不同浓度的嘌呤霉素(浓度分别为0.5,1,2,4 mg/L)处理细胞。分别用不同感染复数(multiplicity of infection,MOI,分别为1∶10,1∶100,1∶200和1∶500)的病毒感染细胞,荧光显微镜下观察,筛选合适的转染条件。通过实时定量PCR(quantitative real time polymerase chain reaction,Q-PCR)对转染后的细胞进行筛选和鉴定。Nrf2引物序列Forward:5′-TTCCCGGTCACATCGAGAG-3′,Reverse:5′-TCCTGTTGCATACCGTCTAAATC-3′。

图1 过表达Nrf2载体序列
1.4 MTT法检测细胞增殖能力
实验分为3组:过表达组、空病毒组和空白组。过表达组为方法1.3已经筛选的稳定过表达Nrf2的牙髓干细胞;空病毒组为方法1.3已经筛选的转染慢病毒对照载体的牙髓干细胞;空白组是未加刺激的牙髓干细胞。MTT实验步骤如下:各组分别稀释细胞,每孔1 000个细胞悬液在96孔板中铺板,每组设置5个复孔,分别在培养时间到达24,48,72,96 h时结束培养,培养时间结束后避光,每孔加入10 μl的5 mg/ml MTT,放回培养箱继续培养4 h,终止培养,轻柔吸尽孔内液体,避光加入DMSO,酶标仪490 nm波长检测吸光度(OD值)。
1.5 Transwell检测细胞迁移能力
实验分2组:过表达组和空病毒组。过表达组为方法1.3已经筛选的稳定过表达Nrf2的牙髓干细胞,空病毒组为方法1.3已经筛选的转染慢病毒对照载体的牙髓干细胞。Transwell实验方法如下:将各组细胞按照1×105个/ml重悬于100 μl无血清(含0.1%牛血清白蛋白)培养基,接种细胞入Transwell小室的上室,下室加600 μl α-MEM培养基,将细胞在37 ℃下孵育4 h。取出含有过滤器的上部腔室,用甲醇固定细胞15 min。用棉签小心地去除膜上部未迁移的细胞,用1 mg/L DAPI染色膜下部细胞5 min,荧光显微镜下观察。在8个随机的视野中统计迁移细胞数量。
1.6 茜素红染色检测钙化结节
实验分2组:空病毒组和过表达组。两组细胞分别加入矿化诱导液进行矿化诱导培养。矿化诱导液为含10%胎牛血清的α-MEM培养基,其中加入包括0.01 mg/L地塞米松、10 mg/L β-甘油磷酸钠和50 mg/L维生素C。细胞培养14 d,弃去培养基,PBS洗2次,加入4%多聚甲醛常温固定10 min,PBS洗2次,加入0.1%茜素红溶液(pH值4.2),避光染色30 min,蒸馏水冲洗3次,倒置显微镜下拍照。拍照后将经过矿化诱导的空病毒组和过表达组这两组细胞每孔加入0.5 ml的10%(W/V)氯化烷基十六吡啶,室温静置30 min,吸取溶液100 μl于96孔板,酶标仪562 nm波长记录OD值。
1.7 ALP活性检测
实验分为空病毒组和过表达组。按1.6诱导配方加入矿化诱导液。两组细胞矿化诱导至7 d,弃去培养基,PBS洗2次,加入50 μl 0.2%的Triton X-100,4 ℃过夜,在镜下确认细胞完全裂解后,按照试剂盒要求,分别加入缓冲液、基质液,混匀,37 ℃水浴孵育15 min,加入显色剂,酶标仪520 nm波长记录OD值。
1.8 统计学分析
采用GraphPad prism 7.0软件进行独立样本t检验及单因素方差分析,单因素方差分析后进一步两两比较采用Tukey检验。P<0.05为差异具有统计学意义。
2 结果
2.1 过表达Nrf2慢病毒转染人牙髓干细胞的荧光显微镜观察结果
不同浓度嘌呤霉素和不同MOI感染人牙髓干细胞的实验结果发现,2 mg/L嘌呤霉素以感染复数MOI=100转染人牙髓干细胞作用时间24 h,感染效率接近90%(见图2)。Q-PCR结果显示:相对于空病毒组,过表达组人牙髓干细胞中Nrf2表达水平增加,差异具有统计学意义(P<0.05,见图3)。

空病毒组 过表达组

与空病毒组比较,*P<0.05
2.2 过表达Nrf2对人牙髓干细胞增殖和迁移能力的影响
MTT实验结果显示:细胞分别培养至48,72,96 h时,与空病毒组和空白组相比,过表达组人牙髓干细胞的OD值减小(P<0.05,见图4)。与空病毒组相比,过表达组人牙髓干细胞的细胞迁移数量减少(P<0.05,见图5)。
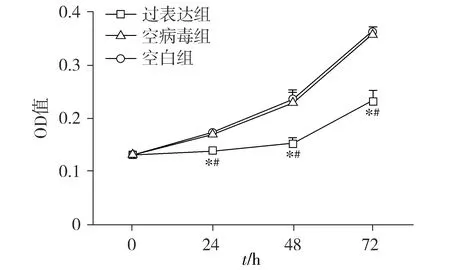
与空病毒组比较,*P<0.05;与空白组比较,#P<0.05
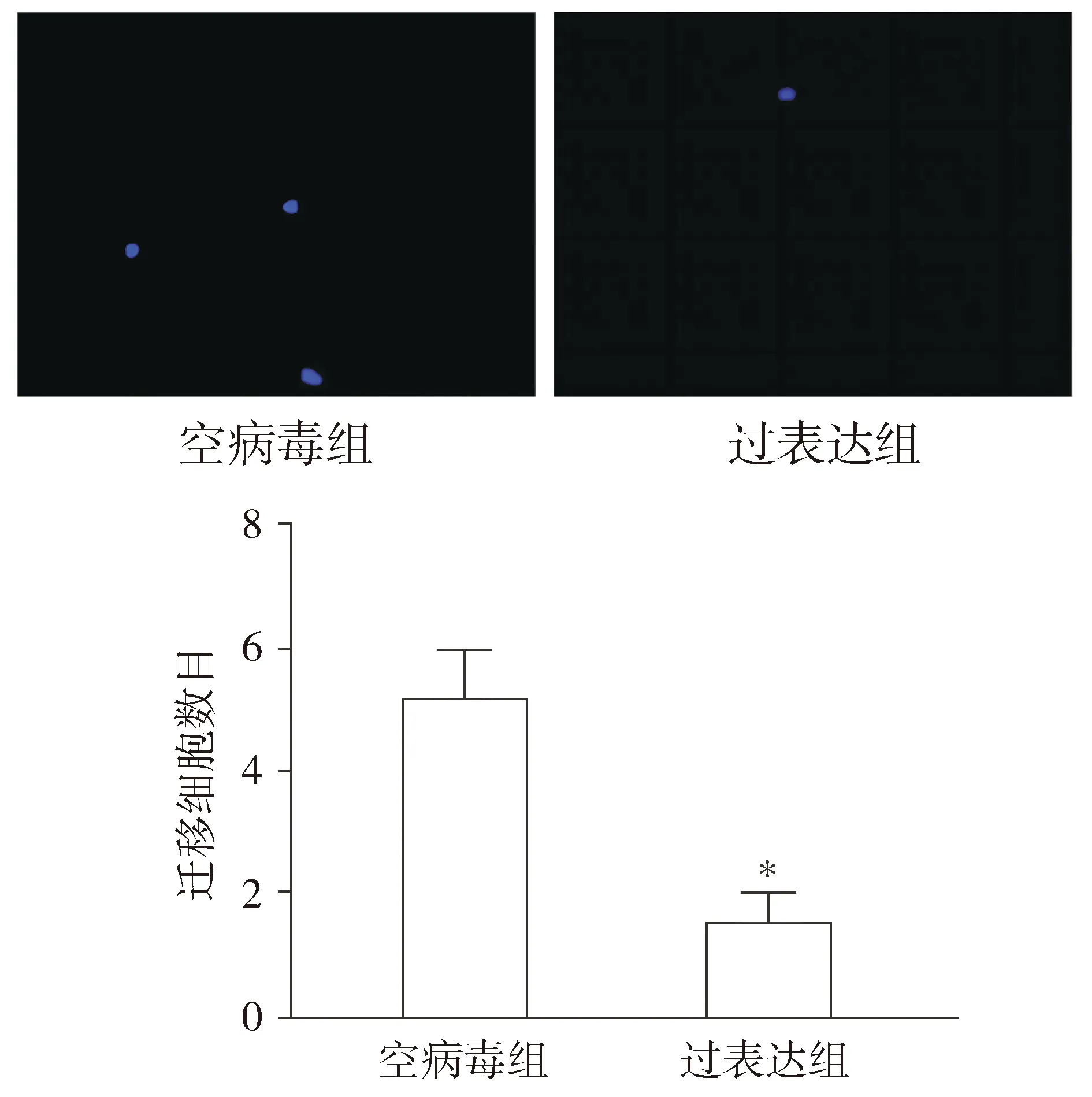
与空病毒组比较,*P<0.05
2.3 过表达Nrf2对人牙髓干细胞成骨矿化诱导的影响
茜素红染色结果显示:经过14 d的成骨诱导,过表达组人牙髓干细胞形成的矿化结节数低于空病毒组(见图6)。半定量分析表明:过表达组茜素红染色OD值低于空病毒组OD值,差异具有统计学意义(P<0.05,见图7)。

图6 Nrf2过表达对人牙髓干细胞成骨诱导形成的矿化结节的影响 (茜素红染色,×40)

与空病毒组比较,*P<0.05
2.4 过表达Nrf2对人牙髓干细胞ALP活性的影响
ALP活性检测结果显示,与空病毒组相比,过表达组人牙髓干细胞ALP活性降低,差异具有统计学意义(P<0.05,见图8)。

与空病毒组比较,*P<0.05
3 讨论
Keap1-Nrf2系统通过调节细胞氧化还原稳态在机体的防御机制中起关键作用。Nrf2是一种可诱导的转录因子,可激活编码抗氧化蛋白和Ⅱ期酶的基因,以响应氧化应激。Nrf2的活性受Kelch样环氧氯丙烷相关蛋白1(Kelch-1ike ECH-associated protein l,Keap1)调控,Keap1在正常条件下促进Nrf2的泛素化和随后的降解,并在应激或者损伤时释放抑制的Nrf2活性[5]。尽管Keap1-Nrf2系统在保护细胞免受外源性和内源性损伤方面具有重要的作用,但一系列证据表明Keap1-Nrf2系统具有各种新功能,特别是在细胞增殖和分化方面[6]。由于不同细胞类型的增殖和分化通常受到细胞氧化还原平衡的影响和调节,因此Nrf2被认为通过调节活性氧的细胞水平来控制这些细胞过程。
干细胞的产生和命运通常受到细胞氧化还原和代谢稳态的调节。在应激或损伤激活后,增殖的成体组织干细胞通过生长因子激酶信号的影响增加其氧利用,改变细胞代谢物水平和氧化还原状态,降低其抗氧化酶的表达,并激活活性氧信号[7-9]。Nrf2是许多抗氧化酶的共同上游调控因子[10]。Nrf2的过表达提高了不良环境中间充质干细胞的存活率和对氧化应激的抗性[11,12]。Nrf2的缺失导致缺氧对间充质干细胞增殖和成骨促进能力的下降,而Nrf2过表达能够抑制间充质干细胞凋亡[11]。这些结果说明Nrf2在体内不良微环境中调节间充质干细胞治疗效率方面发挥作用[13]。
牙髓干细胞容易从接受正畸治疗的健康供体的牙齿中分离获取,其具有分化为神经细胞、成牙细胞和成骨细胞的能力,后两种细胞类型能够在体外形成矿化结节。与非牙源性间充质干细胞相比,牙髓干细胞具有更高的增殖率、更低的细胞衰老和更强的成骨能力。牙髓干细胞在抵抗脂多糖诱导的细胞凋亡和衰老方面优于骨髓间充质干细胞,并且在体内小型猪牙周炎模型中注射牙髓干细胞后牙周再生得到改善[16,17]。牙髓干细胞对传代培养和炎症诱导的衰老具有优越的抗性,为牙周炎性微环境下再生提供了优良的种子细胞来源。因此,本研究选用了牙髓干细胞,探讨过表达Nrf2对牙髓干细胞的细胞功能的影响,不同于以往的研究,牙髓干细胞没有给与药物处理或者环境刺激,因此细胞处于非应激状态。实验结果发现2 mg/L嘌呤霉素以感染复数MOI=100转染人牙髓干细胞作用24 h,感染效率接近90%,并且转染过表达Nrf2载体可以促进人牙髓干细胞中Nrf2表达水平,说明过表达Nrf2人牙髓干细胞构建成功。对Nrf2全基因组分布的分析已经确定了新的Nrf2靶基因集,其产物参与细胞增殖和分化,但不一定参与氧化应激的调节[14]。因此,Nrf2对未受到应激或损伤的成体干细胞亦可能具有调节作用。但是这方面的研究报道不多。本研究实验结果首次观察到过表达Nrf2能影响非应激状态下的牙髓干细胞的细胞功能,丰富了Nrf2对于非应激条件成体干细胞功能影响的实验数据。推测Nrf2对于非应激条件牙髓干细胞功能的调节作用,可能与不参与氧化应激调节的新的Nrf2靶基因有关。
Nrf2在成骨细胞分化中的作用仍存在争议,在小鼠骨髓间充质干细胞成脂分化过中,核Nrf2蛋白水平持续下降,而延长细胞传代过程中Nrf2活化程度降低,从而影响人骨髓间充质干细胞成骨分化[15]。也有研究指出Nrf2负调控大鼠脂肪间充质干细胞成骨细胞分化[16]。这说明由于实验的异质性(不同的物种、组织和/或方案),Nrf2在间充质干细胞中的机制功能存在差异,因此,为明确Nrf2在生理或应激条件下对人类间充质干细胞的影响,需要使用人类间充质干细胞进行研究和验证。因此,本研究探讨了Nrf2在牙髓干细胞增殖、迁移和成骨分化的作用,通过建立慢病毒过表达Nrf2的人牙髓干细胞后进行细胞增殖、细胞迁移和成骨能力检测。研究结果提示,稳定过表达Nrf2人牙髓干细胞增殖和迁移能力降低,成骨诱导的矿化结节数量减少,ALP活性降低,提示过表达Nrf2能降低人牙髓干细胞的细胞增殖和迁移能力,同时抑制牙髓干细胞成骨分化。
在生理条件下,Nrf2维持细胞的氧化还原稳态,并发挥抗炎功能和进一步的抗癌活性,从而支持细胞存活。因此,Nrf2的激活在肿瘤化学预防中很重要。但是,Nrf2的过度活化也会赋予肿瘤细胞多种优势,一些研究表明在各种肿瘤中Nrf2信号通路组成性激活会促进肿瘤细胞的生长和增殖,阻止细胞凋亡,增强肿瘤干细胞的自我更新能力,甚至可增强肿瘤细胞的化学耐药性[17]。本研究结果提示过表达Nrf2能抑制人牙髓干细胞增殖、迁移能力和成骨分化能力,说明Nrf2的组成性激活对正常牙髓干细胞的作用是不同于肿瘤干细胞的。通常来说,细胞倾向于保持氧化还原动态平衡,因此也会高表达还原型谷胱甘肽。但是肿瘤细胞总体呈现氧化应激态,也就是ROS的产生与抗氧化防御之间的失衡,倾向于氧化,故在肿瘤细胞内,ROS的浓度通常是正常细胞的100倍。此外,Nrf2活化参与了牙周膜干细胞循环机械拉伸下的成骨分化,Nrf2激活剂T-BHQ可促进牙周膜干细胞体外和体内成骨分化,这可能与循环机械拉伸提高了成骨细胞分化过程中ROS水平和Nrf2的活化有关[2]。总结以上研究,Nrf2激活促进干细胞增殖和成骨分化能力与高水平的ROS直接相关。在稳态条件的生理水平,ROS浓度基本稳定,本研究观察正常牙髓干细胞Nrf2的组成性激活对细胞功能(包括细胞增殖、迁移和成骨分化能力)的影响,因此,与肿瘤干细胞或者受到刺激的正常干细胞研究结果相反,过表达Nrf2可降低人牙髓干细胞的细胞增殖和迁移能力,同时抑制牙髓干细胞成骨分化。靶向Nrf2的预处理可能是提高人牙髓干细胞生存和功能的可行策略。但该思路仍需进行深入探究,这也将是下一步研究的方向。
