齐墩果酸-壳聚糖纳米颗粒的制备及其对BRL-3A细胞氧化应激水平的影响
2023-10-23于卫华刘江正孔德钦姬秋和李文丽
金 磊,王 帅,于卫华,刘江正,刘 瑞,孔德钦,姬秋和,李文丽*
(1空军军医大学军事预防医学系军事毒理学与防化医学教研室,特殊作业环境危害评估与防治教育部重点实验室,陕西省自由基生物学与医学重点实验室,西安 710032;2中国人民解放军联勤保障部队第901医院内分泌科;3无锡市第九人民医院病理科;4空军军医大学第一附属医院内分泌科;*通讯作者,E-mail:liwenli@fmmu.edu.cn;#共同通讯作者,E-mail:jqiuhe@fmmu.edu.cn)
齐墩果酸(oleanolic acid,OA)是广泛存在于各种植物中的天然化合物,生物毒性较低。因其具有抗病毒、消炎、保肝、调节免疫等多种生物学作用,临床被用于治疗急性黄疸型肝炎和慢性肝炎[1]。由于OA可抑制脂质合成、促进脂质代谢、保护和促进胰腺β细胞释放胰岛素[2,3]、增加肝糖原储备[4-6],进而减轻胰岛素抵抗(insulin resistance, IR)[2,4,5],近年将其作为治疗2型糖尿病(type 2 diabetes mellitus, T2DM)候选药物进行深入研究。然而此物质水溶解度极低,对酸碱均不稳定,导致其生物利用度极低,限制了药用价值的研究与开发应用。本课题组先期成功建立棕榈酸诱导BRL-3A细胞胰岛素抵抗模型[7],该模型稳定性好,可作为OA研发的良好模型。本团队目前已熟练掌握将高生物相容性、可体内降解的壳聚糖降解为小分子纳米颗粒技术,故探索将壳聚糖纳米化后对OA进行包裹形成自组装齐墩果酸-壳聚糖纳米颗粒(nanoOA),以提高溶解度,并研究nanoOA生物安全性及对BRL-3A细胞氧化应激水平的影响,以期发现提高OA生物利用度的新剂型,从而能够进一步研究其对胰岛素抵抗和糖尿病的治疗作用。
1 材料与方法
1.1 细胞株与试剂
BRL-3A肝细胞系购自中国科学院上海细胞生物所。RPMI-1640培养基购自美国Gibco公司,四甲基噻唑蓝(MTT)购自美国Amresco公司,二甲基亚砜(DMSO)购自美国Sigma公司,OA购自西安小草制药有限公司,2’,7’-二氯荧光黄双乙酸盐(DCFH-DA)购自美国Sigma公司,新生牛血清购自杭州四季青生物工程材料有限公司,胰蛋白酶、BSA购自西安国安生物科技有限公司,无水乙醇购自天津市红岩化学试剂厂,青霉素G、硫酸链霉素购自鼎国生物公司,BCA蛋白定量分析试剂盒购自美国Thermo公司,丙二醛(MDA)测试盒购自南京建成生物工程研究所。
1.2 主要仪器
医用型洁净工作台(SW-CJ,苏州安泰空气技术有限公司),CO2培养箱(Incubator 311,美国赛默飞世尔公司),倒置荧光显微镜(CKX53,日本Olympus公司),全波段酶标仪(Infinite 200 PRO,瑞士Tecan公司),全自动高速冷冻离心机(KH20R-Ⅱ,德国Sigma公司),流式细胞仪(Accuri C6,美国BD公司),透射电子显微镜(JEM-2010,日本电子光学公司)。
1.3 细胞培养与处理
具体操作参照本课题组前期方法[7],简单概括如下:当处于对数生长期细胞汇合度超过90%时,胰酶消化离心后弃去上清液将细胞收集,加入完全培养基重悬成单细胞悬液。调整细胞浓度约为1×105/ml,将细胞接种于微孔板,接种量为100 μl/孔(96孔板)和500 μl/孔(6孔板)。在37 ℃恒温、饱和湿度、体积分数5% CO2的培养箱中培养12 h,观察细胞汇合度超过80%时,用PBS溶液洗涤3次后,按实验分组施加处理因素,置于37 ℃培养箱不同时间进行后续实验。
1.4 实验分组
观察细胞汇合度超过80%时,用PBS溶液洗涤3次后,依据施加处理因素分为两组:OA组和nanoOA组,分别加入0,6.25,12.5,25,50,100 μg/ml OA和nanoOA。置于37 ℃培养箱3,6,12,24 h后进行相应细胞活力和氧化应激指标检测。以上每组均设5个复孔,每组实验独立重复3次。
1.5 OA储备液配制
称取500 mg OA于50 ml DMSO中,振荡混匀,配成10 mg/ml储备液,过滤分装-20 ℃保存,实验前按比例用无血清RPMI-1640培养液稀释。
1.6 nanoOA储备液配制
参照韩璐既往使用方法[8,9]将降解后小分子量壳聚糖经反应体系得到壳聚糖纳米微粒,将壳聚糖纳米微粒溶于pH=7.4的PBS溶液中,与OA搅拌反应得到相应粒径的水溶性齐墩果酸-壳聚糖纳米颗粒,于288 nm检测包封OA浓度(1.7 mg/ml),灭菌后分装为1 ml/管,-20 ℃保存,实验前按比例用无血清RPMI-1640培养液稀释。
1.7 MTT比色法检测细胞活力
接种于96孔板中细胞按1.4中实验分组处理完毕后,每孔加入MTT工作液200 μl,置于37 ℃培养箱继续孵育4 h,吸弃孔内上清液,每孔加入150 μl DMSO,振荡溶解紫色结晶3 min。酶标仪上测定各孔490 nm波长处吸光度OD490 nm值。各处理组细胞相对活力=各处理组OD490 nm值/对照组OD490 nm值×100%。
1.8 荧光探针法检测细胞内活性氧(reactive oxygen species, ROS)水平
接种于6孔板中细胞按1.4的实验分组处理后,吸弃孔内上清液,避光加入DCFH-DA(10 μmol/L,1 ml/孔),于37 ℃培养箱中孵育30 min。PBS溶液洗涤细胞3次,充分去除未进入细胞内的DCFH-DA。胰酶消化离心收集细胞,PBS溶液洗涤,离心收集细胞沉淀。加入PBS溶液1 ml重悬成单细胞悬液,置于流式细胞仪以DCFH-DA的最大激发和吸收波长(EX 488 nm,EM 530 nm)检测细胞内ROS荧光强度。每样分别计数1×104个细胞。数据获取和分析使用仪器自带CFlowPlus软件。
1.9 吸光光度法检测细胞内丙二醛(malondialdehyde, MDA)水平
接种于6孔板中细胞按1.4中实验分组处理后,弃去孔内上清液,细胞刮将细胞刮下,用移液器将细胞转移至塑料离心管,BCA法进行蛋白定量分析,并按照MDA测试盒说明书进行处理后吸取反应液0.25 ml加入到96孔板中,酶标仪测定各孔及空白孔吸光度OD520 nm值。MDA含量(nmol/mg蛋白)=(样品OD值-空白OD值)/(标准OD值-空白OD值)×标准品浓度(10 nmol/ml)÷样品蛋白浓度(mg蛋白/ml)。
1.10 统计学分析
2 结果
2.1 nanoOA制备效果评价
MTT法检测结果显示,不同浓度壳聚糖纳米颗粒作用BRL-3A细胞后,其活力仅轻度降低,差异无统计学意义(见图1)。
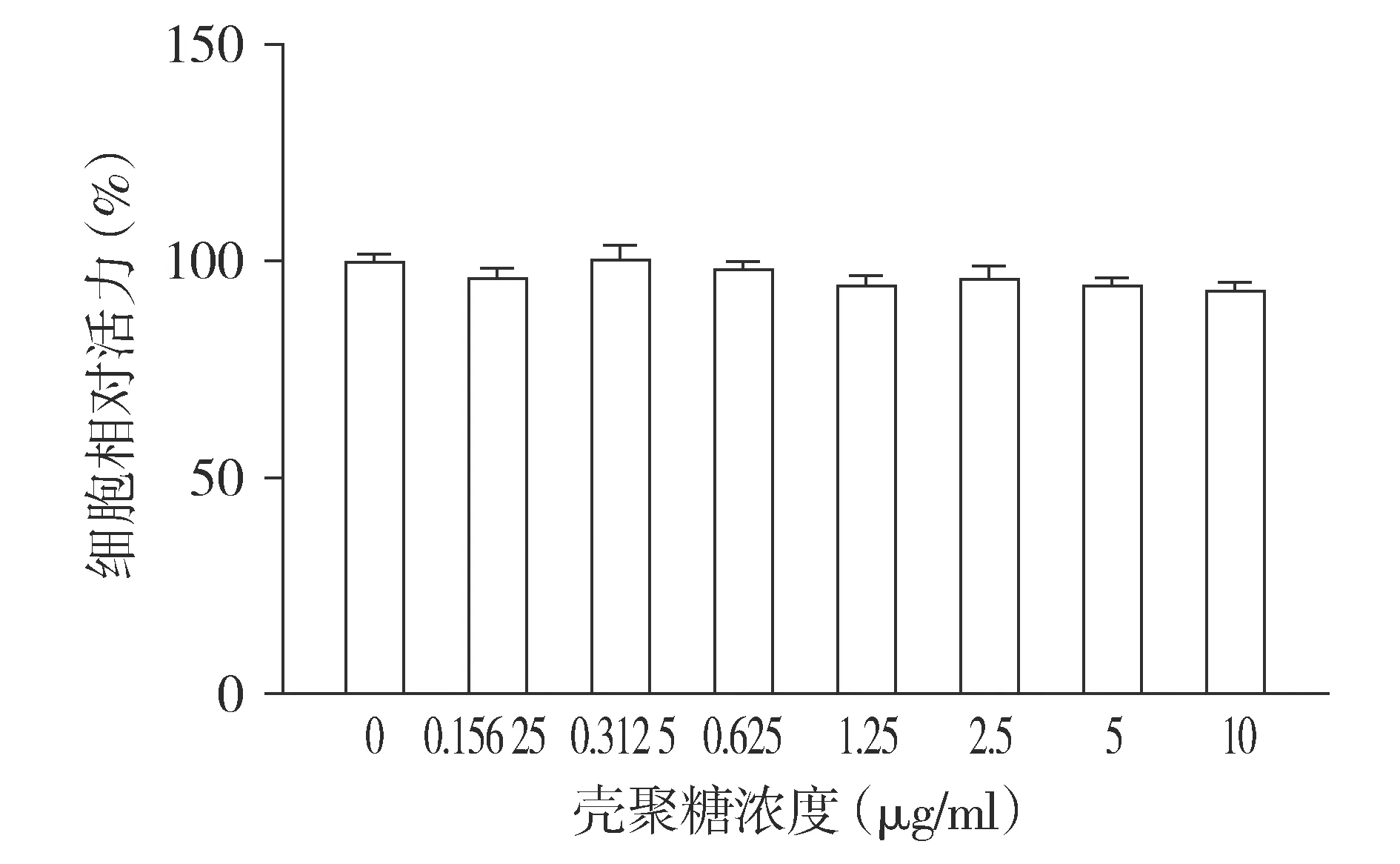
图1 不同浓度壳聚糖纳米颗粒对BRL-3A细胞活力的影响
结果显示,齐墩果酸-壳聚糖纳米颗粒溶解度可达10 mg/ml,且有较好稳定性。同时通过光镜及电镜观察,制备的nanoOA较为均匀,粒径在20~40 nm(见图2),达到安全有效进入细胞内部标准。此外在复温方面:20 ℃环境中将冰箱冻存的nanoOA储备液取出后解冻速度较OA快(3 minvs10 min)。
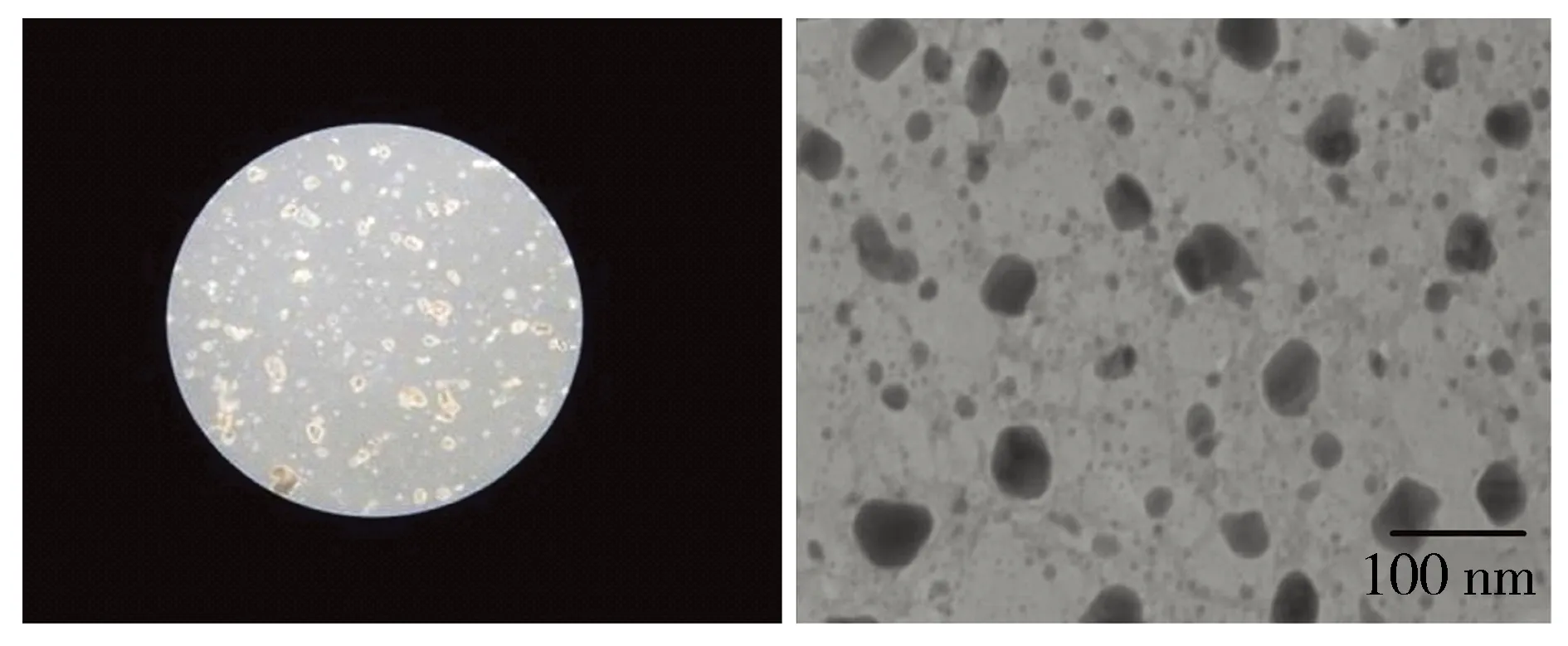
A.光镜下形态 (×100) B.电镜下形态
2.2 OA和nanoOA对BRL-3A细胞活力影响
MTT结果显示,与同时间0 μg/ml OA相比,低浓度(6.25,12.5,25 μg/ml)OA作用3,6,12,24 h,BRL-3A细胞活力并未明显下降,且在3 h时轻度提高细胞活力;而高浓度OA(50,100 μg/ml)作用后各时间点细胞相对活力则明显下降(P<0.05,见表1)。
表1 不同浓度OA、nanoOA作用不同时间对BRL-3A细胞相对活力的影响
而不同浓度nanoOA作用后BRL-3A细胞相对活力没有明显改变,且这一趋势不因浓度增大而改变,尤其在高浓度状态下细胞活力受影响程度较小,与同浓度OA组相比,细胞活力明显较高,差异有统计学意义(P<0.05)。因此,纳米化可以降低OA对BRL-3A细胞毒性作用。
2.3 OA和nanoOA对BRL-3A细胞ROS水平影响
ROS检测结果可见,与0 μg/ml OA相比,各浓度处理后细胞内ROS峰值发生右移,ROS升高的细胞比例依次升高,浓度为100 μg/ml时ROS升高的细胞比例虽然有所下降,但峰型已呈双峰(见图3),提示有大量细胞碎片生成。进一步分析发现,OA处理后细胞相对荧光强度明显增加(P<0.05,见图4),存在剂量-效应关系。
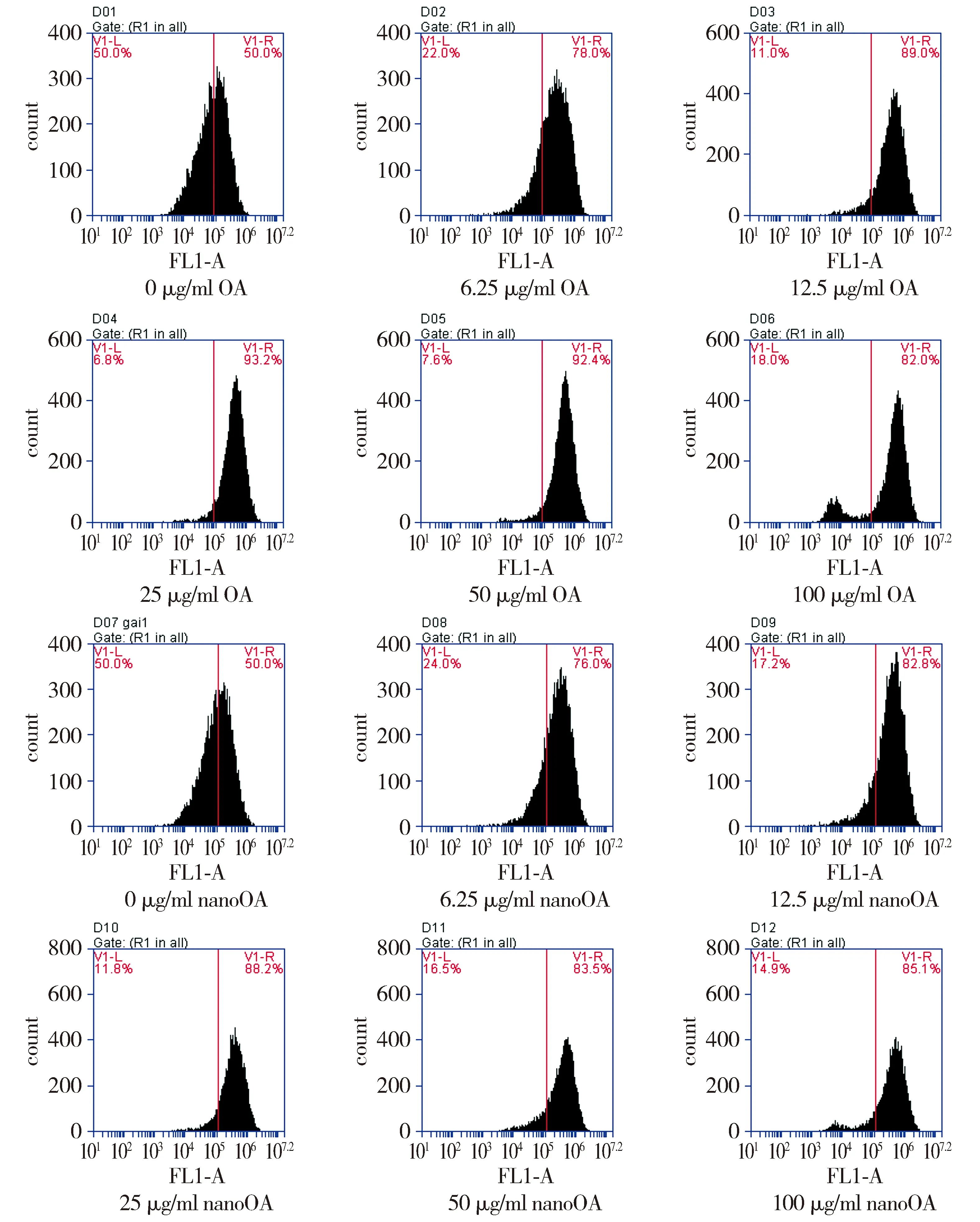
图3 OA和nanoOA对BRL-3A细胞ROS水平的影响
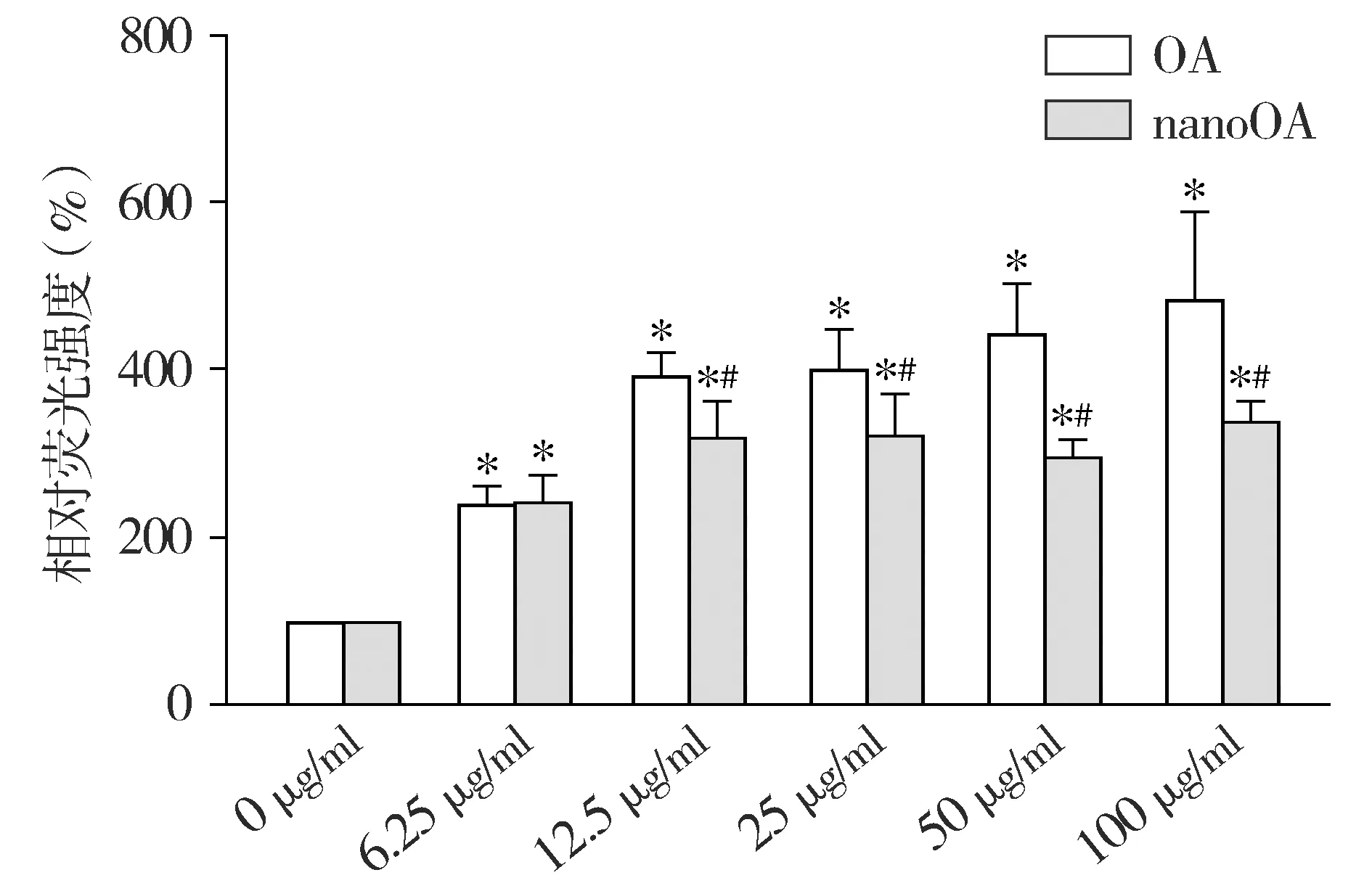
与0 μg/ml相比,*P<0.05;同浓度与OA组相比,#P<0.05
而与0 μg/ml相比,各浓度nanoOA处理后细胞内ROS峰值亦发生右移,但ROS升高的细胞比例相较OA组则较低,增加nanoOA浓度后,细胞内ROS水平未见明显增加。
将两组结果综合对比分析后发现,浓度为12.5,25,50,100 μg/ml时,nanoOA组ROS水平均比OA组低(P<0.05,见图4)。
2.4 OA和nanoOA对BRL-3A细胞MDA水平的影响
细胞MDA检测结果显示,与0 μg/ml相比,不同浓度OA(12.5,25 μg/ml)处理后BRL-3A细胞内MDA水平增高(P<0.05),而用nanoOA预处理后细胞MDA水平基本持平,且与同浓度OA相比下降明显(P<0.05,见图5)。
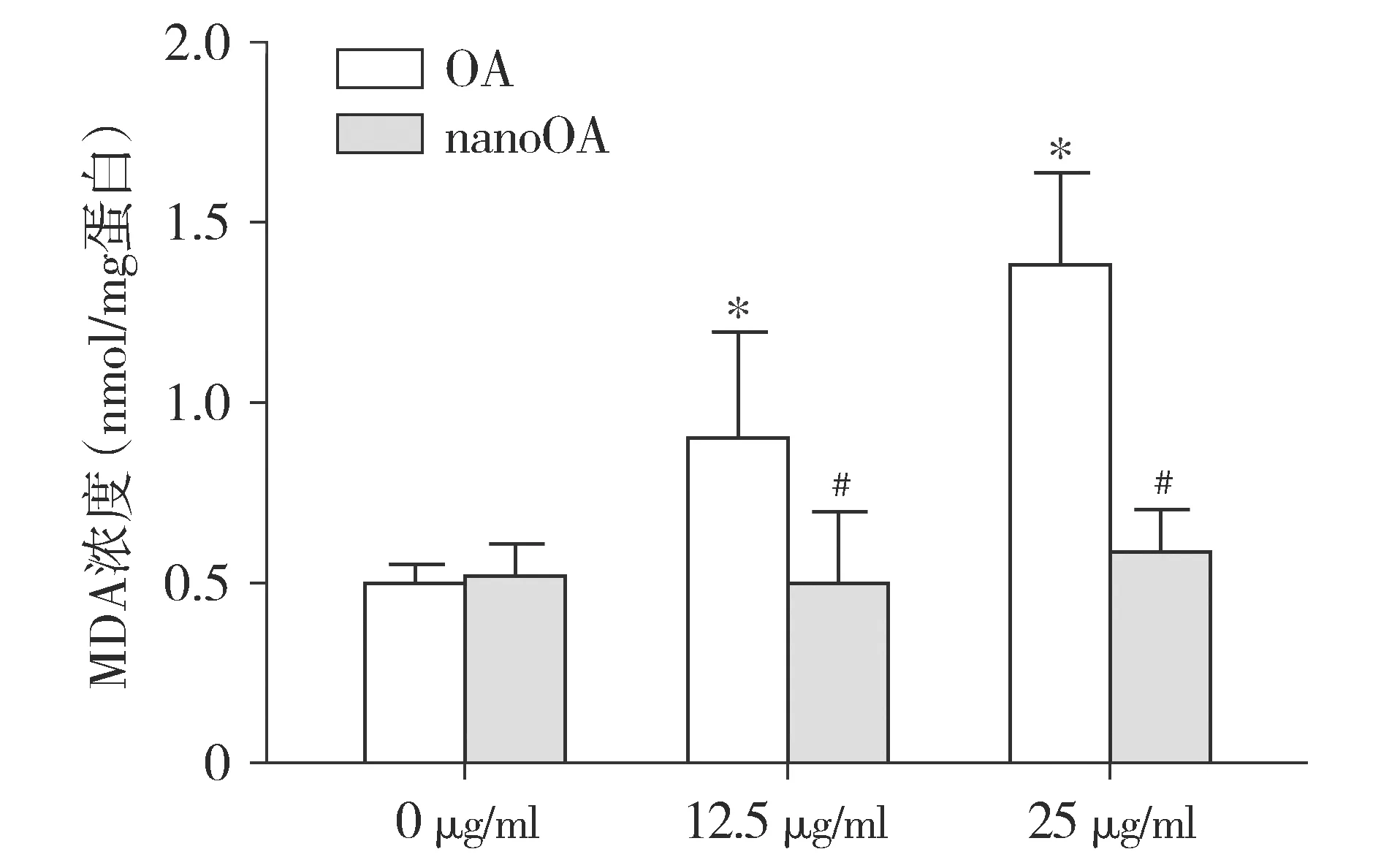
与0 μg/ml相比,*P<0.05;同浓度与OA组相比,#P<0.05
3 讨论
齐墩果酸是一种五环三萜化合物,于1908年由英国化学家Powers首次从木犀科植物橄榄中发现并分离获得,后由Ruzicka确定了其结构[10]。该化合物广泛存在于木犀科、龙胆科、五加科等自然界的植物中,在三七、女贞子、人参中含量丰富。
齐墩果酸是典型的具有生物活性的天然药物,具有很大的开拓潜力。早期研究发现OA具有良好减轻肝损伤、降低血清氨基转移酶、抑制肝纤维化、促进肝细胞再生的作用[1],在治疗急慢性肝炎及肝硬化,尤其是急性黄疸型肝炎方面有较好疗效,后续研究发现其具有抗肿瘤[11,12]、抗凋亡[13]、保护神经[14-16]等作用,被广泛用于临床研究。随着对T2DM相关研究的深入,人们发现OA在刺激胰岛素表达和分泌、减轻IR[2,4,5]、保护胰腺β细胞[2,3]、促进葡萄糖利用、抑制葡萄糖吸收、增加肝糖原储备[4-6]、调节脂代谢、抗氧化[17]、防治T2DM并发症等多方面均有作用,而成为一个有多重开发价值的传统药物。然而由于其溶解度低难于被胃肠道吸收,使得临床应用的片剂、胶囊剂、颗粒剂的生物利用度均较低,同时存在副作用大等不利因素,因此其在应用上受到了限制,与此相关的制剂学研究一直受到重视。
纳米技术在提高药物溶解性、靶向性等方面体现出的卓越特性,使得纳米药物已成为目前制剂学的研究热点。壳聚糖源自于自然界中的甲壳素,因其具有无毒、抑菌、增强免疫作用以及生物相容性好等优势,已被广泛用作药物和疫苗的递送载体。将壳聚糖经反应体系[8]降解成的小分子纳米颗粒,与抗氧化剂自组装后,抗氧化剂的水溶解度及抗氧化效果都得到了明显改善[9,18]。因此,本实验基于此方法将OA与壳聚糖纳米颗粒自组装包裹后进行体外实验。
纳米载体标准为1~100 μm,过大过小均不适于用作药物递送系统。光镜和电镜观察发现本实验所采用壳聚糖颗粒大小均匀且适中,达到了纳米颗粒的标准,有效减少了毒副作用产生,溶解度的测定也证实了其具有较好的水溶性,说明该法制备的纳米颗粒无毒、生物相容性好,可作为高安全性药物载体进行后续研究。接下来用MTT法排除了药物载体对细胞的毒性作用,发现其对细胞生存率无影响,证明了药物载体的生物安全性。为证实纳米化是否能减低OA对BRL-3A细胞的影响,本团队对细胞生存率和细胞内ROS和MDA进行了检测,发现nanoOA对细胞的影响均小于OA,在高浓度时差异尤为明显,提示纳米化可以降低OA导致的BRL-3A细胞内ROS和MDA水平增高,降低了脂质过氧化程度,验证了nanoOA可减轻细胞的氧化应激损伤。
综上所述,壳聚糖纳米颗粒具有良好的生物安全性,将OA包裹后可以明显提高其水溶性,同时可以减轻其细胞毒性作用,nanoOA较OA更具生物安全性与生物利用度,是较安全有效的OA制剂类型。因而OA-壳聚糖纳米颗粒可以作为OA的一种新剂型进行后续分子机制及药效学研究。
以上结果仅反映纳米化可以改善齐墩果酸的水溶性及对细胞的氧化应激损伤,本团队针对其是否可改善齐墩果酸对胰岛素抵抗作用进行体内和体外研究,相关数据及结果有待公布。
