基于宏基因组技术分析自然发酵羊肉香肠中微生物多样性及生物胺的代谢
2023-10-21吴双慧何济坤刀筱芳唐俊妮
吴双慧,牛 茵,何济坤,刀筱芳,唐俊妮,陈 娟*
(西南民族大学食品科学与技术学院,四川 成都 610041)
羊肉是蛋白质含量高、脂肪和胆固醇含量都比较低的一种食物,是比猪肉更优良的畜肉[1]。简州大耳羊的肉品质优良,含粗蛋白21.08%、粗脂肪1.22%、胆固醇47.62 mg/100 g,富含人体所必需的各种脂肪酸和氨基酸[2]。羊肉发酵香肠是用羊肉制成的香肠,是香肠中的新品种,因其加工技术成熟、方便食用和耐贮存等特点备受关注。国内外关于羊肉香肠的研究并不多,主要集中于加工工艺及其参数优化[3-4]、发酵剂或工艺对其理化性质及风味物质的影响[5-6]、发酵剂或香料对产品生物胺的影响[7-8]等方面,而对产品生物胺与发酵微生物相关性这方面研究较少。
生物胺是一种分子质量低、难挥发的碱性物质,摄入的食物中如果生物胺含量较高可能会中毒,导致头痛、呕吐或者腹泻等不良症状出现[9-10]。此外,在亚硝酸盐存在的环境下生物胺容易形成致癌性的亚硝基胺[11]。生物胺通常存在于具有高含量蛋白的食品中,如奶酪、腊肠和干香肠[12]。Kamil等[13]测定了市售的10 个不同品牌的120 个香肠样品中的生物胺,发现样本中尸胺含量高达1 148.75 mg/kg,组胺最高为469.375 mg/kg,酪胺为438.125 mg/kg。Li Lu等[14]在16 个市售香肠中检测到8 种生物胺,有的样品生物胺总含量高达1 417.57 mg/kg。欧盟规定食品中组胺含量不得超过100 mg/kg,酪胺含量范围为100~800 mg/kg[15-16]。食用总生物胺含量超过1 000 mg/kg的食品将会对人体健康产生危害[17]。
自然发酵香肠的发酵过程属于开放式多菌种混合发酵体系,其中具有氨基酸脱羧酶活性的微生物产生氨基酸脱羧酶将游离氨基酸脱羧生成相应的生物胺。因此,研究生物胺与微生物的相关性,有助于了解生物胺的形成机理。李晓宏[18]研究了发酵香肠中生物胺与微生物的相关性,结果表明组胺与菌落总数呈显著负相关,苯乙胺和大肠杆菌呈显著性负相关,酪胺与菌落总数、葡萄球菌、乳酸菌都呈负相关。张雅琳[19]对川味香肠中细菌和真菌菌群和组胺的生成进行相关性分析,发现魏斯氏菌属、肠球菌属、沙雷氏菌、库特氏菌属、赖氨酸杆菌属等对组胺的生成有关系。Dabadé等[20]测定了比利时市售食品中的多种生物胺,发现尸胺含量与乳酸菌、腐胺与总需氧菌数、苯乙胺与肠球菌呈显著正相关。这些研究都是关于以猪肉为原料的发酵香肠,对于羊肉发酵香肠中生物胺的研究目前主要集中在温度、发酵剂[21-22]和香辛料[8,23]等因素对其含量的影响,关于自然发酵羊肉香肠中微生物与生物胺的关联性分析、生物胺的代谢研究至今鲜见报道。
因此,本研究以不同发酵阶段的羊肉香肠为实验对象,采用高效液相色谱方法测定样品中的生物胺含量,采用宏基因组技术分析样品中的微生物组成及变化,对生物胺和微生物多样性进行相关性分析,并结合非冗余(Non-Redundant,NR)蛋白质序列、直系同源蛋白分组比对(evolutionary genealogy of genes: Non-supervised Orthologous Groups,eggNOG)数据库和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库对微生物和酶的丰度与功能进行注释,探究生物胺与微生物菌群的相关性,以及生物胺代谢与微生物和酶的关系,旨在为探究自然发酵羊肉香肠中生物胺的代谢机制提供科学依据。
1 材料与方法
1.1 材料与试剂
原料肉(简州大耳羊) 四川天地羊生物工程有限责任公司;猪肠衣 成都市当地市场;食盐、白糖为超市购买。
甲醇、乙腈(均为色谱纯) 赛默飞世尔科技公司;乙酸铵(色谱纯) 天津市科密欧化学试剂有限公司;氯化钠、三氯乙酸、正丁醇、正己烷、三氯甲烷、乙醚、碳酸氢钠、氢氧化钠(均为分析纯),乙酸(色谱纯) 成都市科隆化学品有限公司;谷氨酸钠(分析纯) 索莱宝生物科技有限公司;丹磺酰氯(分析纯)、腐胺、色胺、组胺、酪胺、亚精胺、精胺、1,7-二氨基庚烷等标准品 上海源叶生物科技有限公司;尸胺、2-苯乙胺等标准品 德国Dr.Ehenstorfer有限公司;TruSeq Nano DNA LT Sample Prepararion Kit(F C-1 2 1-4 0 0 1) 美国I l l u m i n a 公司;AgencourtAMPure XP(A63881) 美国Beckman Coulter公司;KAPA Library Quantification Kits(KK4824) 美国Kapa Biosystems公司。
1.2 仪器与设备
XHF-D高速分散器 宁波新芝生物有限公司;1260高效液相色谱仪 美国安捷伦科技有限公司;Kromasil C18液相色谱柱 瑞典Akzo Nobel公司;5409HJ507060冷冻离心机、Centrifuge 5418R台式离心机 德国Eppendorf公司;N-20多功能氮吹仪 山东云网数据科技有限公司;有机尼龙过滤膜(0.22 μm) 日本津腾公司;MyCycler聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;Covaris S220超声打断仪 基因技术(Gene)有限公司;LC 480定量PCR仪 瑞士Roche公司。
1.3 方法
1.3.1 羊肉发酵香肠的制备与取样
根据胡冠华等[24]的方法,将去皮后的羊瘦肉绞碎与丁状脂肪按照4∶1的比例混匀,加入2.5%食盐、1%白糖、各70 mg/kg的亚硝酸钠和硝酸钠、500 mg/kg抗坏血酸,充分混匀后在0~4 ℃腌制24 h。将腌制完成的肉丁灌入清洗干净的猪肠衣中,垂直晾晒于通风处,自然发酵26 d,在0、5、14 d和26 d取样测定生物胺含量,同时送样进行宏基因组技术分析。
在相同条件下分别发酵3 批羊肉香肠,每批每个时间点各取2 份样品,每个时间点共6 份样品,贮藏于-80 ℃,用于测定生物胺;每批每个时间点各取1 份样品,每个时间点共3 份样品,由于操作失误,14 d丢失1 份样品,贮藏于-80 ℃,用于宏基因组技术分析。
1.3.2 生物胺的含量测定
西门庆毫无疑问是金瓶梅里当之无愧的男一号,对他的研究也是颇为深入。西门庆的形象内涵十分丰富,他既耽于女色,又善于经营;既天真多情,又精于谋算。其人生哲学就是赚钱与纵欲。以西门庆为核心,小说也设置了一系列影身人物。
采用高效液相色谱法测定羊肉香肠样品中的生物胺含量,参考GB/T 5009.208—2016《食品中生物胺的测定》[25]的方法进行样品前处理、标准品溶液配制、样品和标准品的衍生以及测定。
1.3.3 宏基因组技术分析
样品送至上海欧易生物医学科技有限公司进行宏基因组技术分析。在Illumina平台得到原始数据后,首先用Trimmomatic[26]软件对其进行拆分、质量剪切、去除宿主污染等操作。得到的序列使用拼接软件对优质序列进行拼接组装,并进行基因预测。对预测出的基因进行物种以及功能上的注释分类,包括NR、eggNOG和KEGG等。同时得到各样本中物种的相对丰度,接着进行样本相似性聚类、排序检验以及差异统计比较等分析,使用R软件完成统计分析和作图。
1.4 数据处理
采用Excel 2019、Origin 2022 64bit和IBM SPSS Statistics 22软件对生物胺测定结果进行分析,数据结果采用±s表示。使用上海欧易生物医学科技有限公司提供的在线微生物分析平台(https://cloud.oebiotech.cn/task/)进行微生物与生物胺的相关性分析。
2 结果与分析
2.1 羊肉香肠的生物胺测定结果
利用高效液相色谱分别确定了色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺和精胺的保留时间。以这8 种生物胺标准品制作不同质量浓度的混合标准品溶液,以峰面积比作为因变量,不同质量浓度(mg/L)作为自变量,绘制并得到标准曲线和方程,分别为y=0.034 9x+0.004 3(R2=0.999 7)、y=0.693 2x-0.001 2(R2=0.999 9)、y=1.352 1x+0.017 3(R2=0.999 8)、y=1.786 3x+0.009 8(R2=0.999 9)、y=1.830 6x-0.002 0(R2=0.999 6)、y=1.520 2x+0.009 0(R2=0.999 9)、y=1.755 7x-0.115 2(R2=0.999 2)和y=1.278 5x-0.088 4(R2=0.999 1)。通过标准曲线方程,计算出不同发酵阶段羊肉香肠样品中各种生物胺含量,结果如表1所示。

表1 不同发酵阶段羊肉香肠的生物胺含量变化Table 1 Changes in contents of biogenic amines in fermented mutton sausage during different fermentation stages mg/kg
表1显示,色胺、苯乙胺和腐胺在羊肉香肠发酵过程中差异不显著(P>0.05)。尸胺和组胺含量变化没有明显的规律,而酪胺、亚精胺和精胺均呈现先上升后降低的趋势,只是酪胺的最大值出现在第5天,而亚精胺和精胺最大值则是在第14天。其中,组胺最终含量为1.26 mg/kg,酪胺最终为5.07 mg/kg,总生物胺为80.42 mg/kg,自制羊肉香肠的生物胺符合报道要求组胺、酪胺和总生物胺含量的规定,香肠的安全性符合要求[15-17]。在8 种生物胺中,精胺含量最高,为羊肉香肠发酵过程中的主要生物胺,14 d达到最高值97.70 mg/kg,呈现先增加后减少的趋势;0 d与26 d的精胺含量与14 d呈显著差异;亚精胺和精胺一般与原料肉的品质、部位以及生理状况有关,是生物体内的生理多胺,虽然研究表明这两种胺对人体健康没有直接的不良影响,但可能与亚硝酸盐反应形成致癌的亚硝胺,因此,也需要控制其含量。
2.2 羊肉香肠中微生物的群落结构
提取羊肉香肠样品基因组,经宏基因组测序和去除低质量数据后,得到62 106 208 bp,包含67 377 条序列。对羊肉香肠样品进行物种注释,共鉴定出43 个门、60 个纲、112 个目、201 个科、465 个属和2 156 个种的微生物。
在细菌的属水平,丰度排名前30的细菌群落结构如图1 所示,较直观地展示了不同发酵阶段羊肉香肠中细菌群落构成的异同。第0 天,嗜血杆菌属(Haemophilus)、葡萄球菌属(Staphylococcus)、酒球菌属(Oenococcus)、李斯特菌属(Listeria)和弓形菌属(Arcobacter)相对丰度较高,分别为20.39%、18.82%、10.02%、5.24%和5.20%;第5天时,样品中相对丰度较高的细菌属为弧菌属(Vibrio)、葡萄球菌属、嗜血杆菌属、酒球菌属和明串珠菌属(Leuconostoc),其相对丰度分别为21.16%、17.79%、13.86%、6.50%和3.83%;到第14天时,葡萄球菌属相对丰度达到4 组样品的最高值,为43.95%,其次分别是嗜血杆菌属,相对丰度为11.73%,为4 个时间点的最低值,弧菌属的相对丰度为7.64%,酒球菌属和李斯特菌属的相对丰度也变为了4 个时期的最低值,分别为6.03%和3.15%;直到第26天,与第14天相比,相对丰度较大的细菌属类别不变,但相对丰度发生了改变,葡萄球菌属为25.39%、嗜血杆菌属为18.63%、酒球菌属为8.89%、弧菌属为4.79%、李斯特菌属为4.70%。说明发酵羊肉香肠中的细菌构成较为复杂,不同发酵阶段的样品中的优势菌属不同,这可能是由于自然发酵这一生产方式导致。总体来讲,在自然发酵羊肉香肠样品中葡萄球菌属的占比较大,这是一类常见于发酵肉制品中的优势菌,葡萄球菌可以快速还原硝酸盐,使降解产物与肌红蛋白结合形成亚硝基红蛋白,赋予肉制品红润的色泽,同时还能够防止脂肪氧化[27]。样品中具有相对丰度较高的嗜血杆菌属,这可能与原材料有关,羊肉或者猪肠衣自身携带有嗜血杆菌属,导致样品中这种微生物相对丰度较高,可能会引发食源性疾病,因此在选择原材料时应注意原料的品质,保证食品安全。
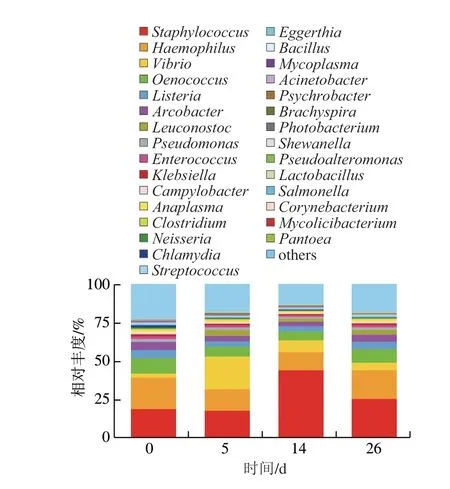
图1 不同发酵阶段羊肉香肠中细菌属水平的相对丰度Fig.1 Relative abundance of bacteria in mutton sausage during different fermentation stages
真菌在羊肉香肠样品中占比较小,相对丰度排名前3 0 的真菌属中,最大的是德巴利酵母菌属(Debaryomyces),其相对丰度仅为0.206%,在第14天时出现,其余的真菌属相比较细菌属而言,对生物胺的作用可以忽略不计。
2.3 羊肉香肠中细菌属水平结构与生物胺的相关性分析

图2 细菌属水平结构与生物胺的相关性分析Fig.2 Analysis of the correlation between bacterial community and biogenic amines
2.4 数据库注释分析
2.4.1 eggNOG数据库注释分析
将11 份样品测序得到的数据与eggNOG数据库进行比对,获得了每个基因对应的直系同源集(Clusters of Orthologous Groups,COG)注释情况(图3),共鉴定出36 935 个COG功能单元,这些功能单元分属于23 个主要的功能大类。其中,基因数排名前3的主要是未知功能类9 190 个基因,氨基酸的转运和代谢3 242 个基因,复制、重组和修复2 936 个基因。

图3 羊肉香肠基因的eggNOG数据库注释统计图Fig.3 Statistics of gene annotation in eggNOG database
2.4.2 KEGG数据库注释分析
将NR基因在KEGG数据库中进行注释,结果如图4所示。11 份样品中共有39 319 个NR基因注释到KEGG的34 条代谢通路中,在第1水平的通路中,注释到新陈代谢通路的数量最多,共有26 273 条;其次是环境信息处理,共6 041 条;遗传信息处理,共3 795 条;细胞过程,共2 335 条;生命系统最少,仅有875 条。在新陈代谢通路的第2水平中,除4 203 条NR基因被注释到全局和总览图外,碳水化合物代谢、氨基酸代谢、辅酶因子和维生素的代谢是被注释最多的途径。KEGG数据库注释结果揭示了羊肉香肠中微生物主要通过调控碳水化合物代谢和氨基酸代谢过程影响香肠的品质,其中,与生物胺产生相关的代谢为氨基酸代谢。

图4 羊肉香肠基因的KEGG代谢通路统计Fig.4 Statistics of gene annotation in KEGG metabolic pathways
2.4.2.1 不同发酵阶段羊肉香肠的KEGG代谢分析
将不同发酵阶段香肠样品的KEGG数据库中第1水平的丰富度进行绘图后发现(图5),在羊肉香肠中,共有5 大类代谢通路,不同时间的微生物基因在同一类中注释结果存在差异,但无论在哪大类代谢通路中,第14天所比对的基因在同一类别中比例都最高,而第0天所注释的结果比例都最低,说明第14天的5大功能最旺盛。其中,新陈代谢功能尤其突出,表明14 d是自然发酵羊肉香肠中微生物代谢活动最为旺盛的时间。
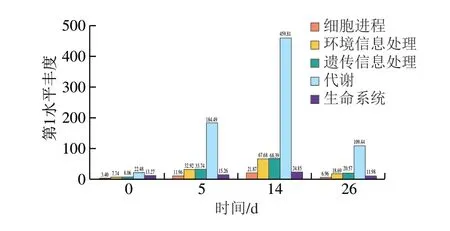
图5 不同发酵阶段羊肉香肠的KEGG第1水平丰富度Fig.5 First level abundance of KEGG for fermented mutton sausage during different fermentation stages
2.4.2.2 不同发酵阶段羊肉香肠的新陈代谢类型分析
由图6可知,在新陈代谢通路的第2水平中,每个阶段注释到的第2水平所含有丰度各不相同。第0天各种代谢的丰度均低于第14天,在第0天各种代谢中能量代谢最为旺盛;在第5、14、26天时,除去NR基因被注释到的全局和总览图外,碳水化合物代谢最旺盛,其次是氨基酸代谢和能量代谢。11 份样品中共有13 条代谢通路中出现生物胺,从KEGG数据库的第2水平来讲属于其中的5 类,分别为氨基酸代谢6 条,其他氨基酸代谢的代谢有2 条,能量代谢1 条,辅酶因子和维生素的代谢1 条,其他次生代谢物的生物合成有3 条。
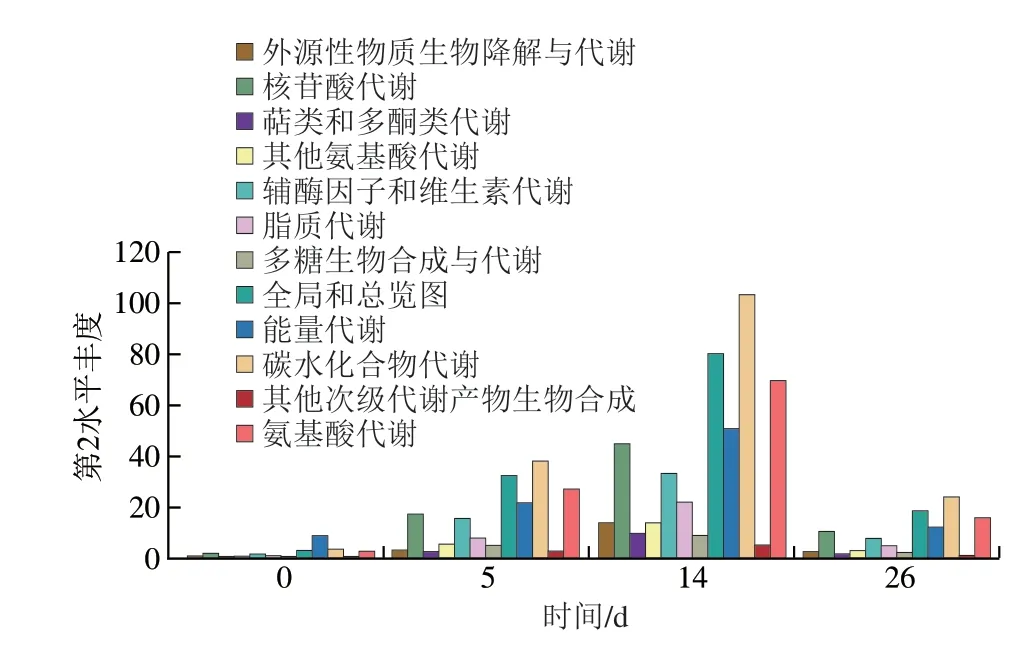
图6 不同发酵阶段羊肉香肠的新陈代谢类型丰富度Fig.6 Abundance of metabolism types in mutton sausage during different fermentation stages
2.5 与生物胺代谢相关的通路分析
图7为羊肉香肠样品分别结合KEGG Pathway中ko00380、ko00360、ko00350和ko00950注释的色胺、苯乙胺和酪胺代谢通路图。色胺、苯乙胺和酪胺都在单胺氧化酶(EC: 1.4.3.4)的作用下被降解,通过在KEGG数据库中对酶的来源进行追踪发现,单胺氧化酶主要由3 种菌产生,分别为嗜冷杆菌属(Psychrobactersp.)YP14、假单胞菌属OV144和嗜冷杆菌属YGAH215。样品去宿主基因后,与KEGG数据库进行比对,没有注释到合成这3 种胺的微生物,推测样品中色胺、苯乙胺和酪胺的形成可能是由于原料肉中内源酶的催化作用。

图7 羊肉香肠的色胺、苯乙胺和酪胺代谢路径Fig.7 Metabolic pathways of tryptamine, phenylethylamine and tyramine in fermented mutton sausage
图8 为羊肉香肠样品结合K E G G P a t h w a y 中ko00310、ko00480注释的尸胺代谢通路图。尸胺只由微生物通过赖氨酸脱羧酶(EC: 4.1.1.18)作用于赖氨酸脱羧形成,样品中具有这种能力的微生物只有1 种菌,为Photobacterium piscicola。尸胺降解的途径只有1 条,涉及到的微生物有2 种(假交替单胞菌属(Pseudoalteromonassp.)JB197、半透明假交替单胞菌(Pseudoalteromonas translucida)),都是通过亚精胺合酶(EC: 2.5.1.16)降解尸胺。

图8 羊肉香肠的尸胺代谢路径Fig.8 Metabolic pathway of cadaverine in fermented mutton sausage
图9为结合KEGG Pathway中ko00330、ko00480注释的腐胺代谢通路图。合成腐胺的路径有2 条,一条为胍基丁胺在胍基丁酶(EC: 3.5.3.11)的作用下合成腐胺,产生这种酶的微生物有3 种,分别为木糖葡萄球菌(Staphylococcus xylosus)、Vibrio rumoiensis、马葡萄球菌(Staphylococcus equorum);另一条合成途径是鸟氨酸在鸟氨酸脱羧酶(EC: 4.1.1.17)作用下脱羧形成腐胺,涉及的微生物有荧光假单胞菌(Pseudomonas fluorescens)、莓实假单胞菌(Pseudomonas fragi)、嗜冷杆菌属YGAH215和嗜冷杆菌属1501(2011)。腐胺的降解途径有氧化、转移等方式,其中产生carboxynorspermidine synthase(EC: 1.5.1.43)的微生物有Vibriosp.、V.rumoiensis、噬海藻弧菌(V.algivorus),产生亚精胺合酶(EC: 2.5.1.16)的微生物有假交替单胞菌属JB197和半透明假交替单胞菌,产生二胺N-乙酰基转移酶(EC: 2.3.1.57)的微生物有Vibriosp.、Leuconostoc suionicum、V.aphrogenes、腐生葡萄球菌(Staphylococcus saprophyticus)、葡萄球菌属OJ82和木糖葡萄球菌。

图9 羊肉香肠的腐胺代谢路径Fig.9 Metabolic pathway of putrescine in fermented mutton sausage
图10为结合KEGG Pathway中ko00330、ko00410和ko00480注释的亚精胺和精胺代谢通路图。可以看出,亚精胺的合成有3 条途径,第1条是腐胺在亚精胺合酶(EC: 2.5.1.16)的作用下生成亚精胺,涉及到的微生物有假交替单胞菌属JB197和半透明假交替单胞菌;另外一条途径是羧基亚精胺在羧基精胺脱羧酶(EC: 4.1.1.96)作用下生成亚精胺,产生这种酶的微生物是Vibriosp.和V.aphrogenes;第3条途径则是谷胱甘肽亚精胺在谷胱甘肽亚精胺酰胺酶(EC: 3.5.1.78)的作用下合成亚精胺,样品中产生这种酶的微生物只有发光杆菌属(Photobacteriumsp.)NCIMB 13483。对于亚精胺的降解有2 条途径,一条途径是亚精胺在谷胱甘肽亚精胺合酶(EC: 6.3.1.8)作用下转化为谷胱甘肽亚精胺,产生这种酶的微生物只有发光杆菌属NCIMB 13483;另一条途径则是在精胺合酶(EC: 2.5.1.22)作用下降解为精胺,样品中产生这种酶的微生物只有硝化螺旋细菌(Nitrospirae bacterium)。
组胺可以通过组氨酸脱羧形成,同时可以通过基团转移、酶氧化、化学合成等途径被降解[28],样品去宿主基因后,与KEGG数据库进行比对,没有注释到代谢组胺的微生物,推测样品中组胺的代谢可能是由于原料肉中内源酶的作用,导致样品中检测出低含量的组胺。
3 讨 论
李苗云等[29]的研究表明,与发酵香肠中生物胺形成相关的细菌主要有肠杆菌、微球菌、芽孢杆菌、假单胞菌以及发光杆菌等的一些种类,与本研究结果相符。许多微生物属的物种都能同时代谢一种或多种生物胺[30]。本研究发现Vibriosp.和V.aphrogenes两种弧菌既能合成腐胺又能降解腐胺,同时还可以降解亚精胺;嗜冷杆菌属YGAH215不仅降解色胺、苯乙胺和酪胺,还能合成腐胺;假交替单胞菌属JB197不仅能降解尸胺和腐胺,同时能合成亚精胺;木糖葡萄球菌不仅能产生合成腐胺的酶,还可以产生降解腐胺的酶。唐小曼等[31]的研究发现,有6 种微生物,如阿氏肠杆菌(Enterobacter asburiae)、unclassified_g_Enterobacter、阴沟肠杆菌(Enterobacter cloacae)、催产克雷伯氏菌(Klebsiella oxytocin)、汉斯德巴氏酵母菌(Debaryomyces hansenii)与油桃千酵母菌(Millerozyma arinosa)同时与腐胺、尸胺的代谢相关。张鹏飞[32]的研究发现肠杆菌属(Enterobactersp.)638同时与尸胺、腐胺、亚精胺与精胺的代谢相关,荧光假单胞菌与酪胺和组胺的合成相关。
大部分研究人员认为,生物胺产生能力不能归属到分类种,只能归属到菌株[33]。张鹏飞[32]、Anderegg[34]、Hu Min[35]等的研究发现荧光假单胞菌与酪胺和组胺的合成有关,木糖葡萄球菌是酪胺的主要产生菌,肠球菌属、乳杆菌属(Lactobacillus)和乳球菌属(Lactococcus)是组胺的主要产生菌。但本研究却发现,荧光假单胞菌不参与酪胺和组胺的代谢,只与腐胺的合成有关;木糖葡萄球菌不参与组胺和酪胺的代谢,只与腐胺的代谢有关;肠球菌属、乳杆菌属和乳球菌属不代谢组胺。已有报道和本研究结果不一致,可能是由于生物胺的形成应该归属于细菌菌株而不是微生物的分类种或者属。
4 结 论
研究发现羊肉香肠中微生物多样性丰富,葡萄球菌属、弧菌属、酒球菌属和嗜血杆菌属是主要优势细菌属;检测出8 种生物胺,其中精胺含量最高。相关性分析表明尸胺与明串珠菌属和假交替单胞菌属等5 种细菌属呈极显著正相关;精胺与酒球菌属和芽孢杆菌属等15 种细菌属呈显著负相关;亚精胺与酒球菌属和弓形菌属等4 种菌属呈显著负相关;酪胺与酒球菌属和泛菌属等5 种菌属呈显著负相关,而与假交替单胞菌属和发光杆菌属呈显著正相关;色胺与葡萄球菌属和链球菌属呈显著正相关;不存在与组胺、腐胺和苯乙胺显著相关的细菌属。经过eggNOG、KEGG数据库比对,分别注释到36 935、39 319 个基因,主要为碳水化合物代谢和氨基酸代谢。经KEGG数据库注释后,发现有代谢尸胺、腐胺、精胺和亚精胺的细菌和酶,有降解色胺、苯乙胺和酪胺的细菌和酶,没有代谢组胺的细菌和酶,色胺、苯乙胺、酪胺和组胺的合成可能由于内源酶的作用。本研究揭示了羊肉香肠中微生物多样性、生物胺代谢及其与关联微生物、酶的关系,确定了自然发酵羊肉香肠中生物胺代谢的路径,对解析羊肉香肠中微生物的动态变化以及生物胺的监测具有重要意义和应用价值。
