本土季也蒙毕赤酵母在干红葡萄酒中试生产中的应用潜力
2023-10-21陈学莲
藏 伟,刘 叶,刘 宇,彭 帅,陈学莲,王 婧,*
(1.甘肃农业大学食品科学与工程学院,甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州 730070;2.甘肃紫轩酒业有限公司,甘肃 嘉峪关 735100)
酵母菌对葡萄酒品质和风格起着重要作用。由于酿酒酵母(Saccharomyces cerevisiae)酒精转化率高、发酵完全等优点,在葡萄酒行业中被开发成活性干粉制剂广泛使用[1]。然而,在葡萄酒酿造中,用单一商业S.cerevisiae菌剂进行发酵,虽可确保酒精发酵(alcoholic fermentation,AF)的顺利进行和完成,但会导致发酵过程中酵母菌群多样性下降,酵母代谢产生的化学反应复杂度降低,使葡萄酒质量风味趋近,产品风格特色不突出[2]。近几年,大量的研究已经证实,在葡萄酒AF前期,一些非S.cerevisiae的菌种参与发酵会增加葡萄酒感官特征的复杂性[3-4]。毕赤酵母(Pichia)是葡萄酒自然发酵过程中普遍存在的酵母菌种,也是重要的产酯酵母之一,对葡萄酒香气成分的多样性做出了重要贡献[5-6]。
季也蒙毕赤酵母(Meyerozyma guilliermondii)由于其独特的代谢活动,在各种代谢产物的合成、功能蛋白的生产和生物防治方面表现出了巨大潜力[7-9];M.guilliermondii与一些化学物质结合可以提高对霉菌的抑制作用[10];此外,Benito等[11]的研究发现,M.guilliermondii发酵能够增加吡喃花色苷类物质的形成,这些物质具有增强干红葡萄酒颜色稳定性的作用。也有研究表明,M.guilliermondii能分泌多种胞外水解酶,如菊粉酶、α-淀粉酶、α-鼠李糖苷酶和脂肪酶[7];Aplin等[12]通过顺序接种M.guilliermondii(P40D002)可降低葡萄酒的乙醇含量,并产生高浓度的乙酸乙酯等香气物质。Yan Wei等[13]也报道了M.guilliermondii能够产生高浓度2-苯乙醇,对增强玫瑰香气具有积极影响。本实验室前期工作中优选出1 株高产β-葡萄糖苷酶的M.guilliermondii菌株NM218,该酶的产生与菌株细胞生长同步进行,通过酿酒学特性研究也证实该菌株具有较高的葡萄酒环境耐受性和低酸条件下的高酶活力性质[14],与S.cerevisiae顺序接种发酵,可以增加酯类和萜烯类等挥发性物质,增强葡萄酒香气的复杂性[15],在霞多丽干白葡萄酒陈酿过程中添加M.guilliermondii的β-葡萄糖苷酶制剂可增加萜烯类、C13-降异戊二烯类、高级醇类、酯类、脂肪酸类物质,丰富了葡萄酒的香气复杂性[16]。
目前关于非S.cerevisiae与S.cerevisiae混菌发酵的研究大部分是在实验室微酿条件下的结果,中试规模下的应用研究鲜有报道,而中试实验是将实验室成果与产业化应用连接的重要桥梁。因此,本研究目的是将NM218与商业S.cerevisiae以顺序接种的模式进行中试发酵,并对发酵过程中酵母生长状况、葡萄酒酿酒学特性和感官特征进行分析,以期明晰M.guilliermondii的应用潜力,为M.guilliermondii的工业化应用提供一定数据参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌剂与原料
菌株NM218由甘肃省葡萄与葡萄酒工程学重点实验室筛选于自然发酵的葡萄醪中,并经过26S rDNA D1/D2测序,确定其为M.guilliermondii(序列相似度99.51%),现保藏于中国普通微生物菌种保藏管理中心(CGMCC NO:23155);菌株NM218活性干粉菌剂由本实验室参考张馨文等[17]的方法经过高密度培养,添加复合冻干保护剂等方法制备于冰箱冷藏备用。商业S.cerevisiae活性干粉制剂FX10、商业乳酸菌活性干粉制剂(Oenococcus oeni)Lactoenos 450 Preac购自法国Laffort公司。
2021年10月采摘于宁夏博纳伯馥酒庄的赤霞珠(Cabrnet Sauvignon),糖质量浓度250 g/L(以还原糖计),可滴定酸6.45 g/L(以酒石酸计),pH 3.89。
1.1.2 培养基与试剂
WL(Wallerstein Laboratory)营养琼脂培养基北京奥博星生物技术有限公司。
氯化钠(分析纯,99%)、无水乙醇(分析纯) 天津市光复科技有限公司;果胶酶(食品级) 法国Laffort公司;2-辛醇(色谱纯,99%)等标准品 Sigma-Aldrich(上海)贸易有限公司。
1.2 仪器与设备
TU-1080紫外-可见分光光度计 北京普析通用仪器有限责任公司;WINESCAN S20 FLEX多功能葡萄酒分析仪 福斯华(北京)科贸有限公司;H2050R高速冷冻离心机 长沙湘仪离心机仪器有限公司。
1.3 方法
1.3.1 发酵中试实验
赤霞珠葡萄果实在分拣台人工摘除烂果及二次果等,送入除梗破碎机除梗破碎后按70%的量输入2 t不锈钢控温罐,加入40 mg/L果胶酶,分次加入SO2至质量浓度达到50 mg/L,打循环至均匀后在低温(10 ℃)下浸渍24 h,随后恢复室温后进行酵母接种发酵,实验如下:
供试酵母活性干粉均采用200 mg/L的接种量进行,先温水活化后接种于50 L葡萄醪中扩培24 h后进行接种实验。以先接种NM218,48 h后再接种FX10为处理组;只接种FX10为对照组,25~27 ℃控温发酵。参考冯丹萍等[18]的方法,当相对密度在1.058左右时视为发酵中期,相对密度在1.015左右视为发酵末期,相对密度降至0.993~0.996时视为AF结束。发酵期间,分别在接种NM218后12 、48 h、发酵中期、发酵末期取样监测酵母生长状况。AF结束后酒样转罐分离,加入1 g/t的乳酸菌干粉活化液启动苹果酸-乳酸发酵,18~20 ℃控温发酵,苹果酸-乳酸发酵结束后酒样转罐分离,在15 ℃条件下陈酿贮藏。其中,AF结束与陈酿5 个月(5M)分别进行取样,对照组酒样分别记为AF-CK和5M-CK;处理组酒样分别记为AF-NM和5M-NM;每组实验重复3 次。
1.3.2 酵母生长动态监测
参考本实验室Gao Pingping等[15]的方法,采用平板计数法。酒样梯度稀释后涂布在WL培养基上,28 ℃培养72 h后进行菌落计数。根据M.guilliermondii在WL培养基上菌落特征为圆形乳白色而S.cerevisiae为白色带浅绿色,中间凸起的形态差异分别进行统计。
1.3.3 常规理化指标测定
利用多功能葡萄酒分析仪,测定乙醇、总酸、挥发酸、残糖、甘油等。
多功能葡萄酒分析仪条件:用25% H3PO4溶液调零液;酒样进液量为30 mL;样品温度25 ℃;XY自动进样系统分析时间持续30 s。
1.3.4 颜色指标测定
1.3.4.1 CIELab颜色参数测定
参照SN/T 4675.25—2016《出口葡萄酒颜色的测定CIE 1976(L*a*b*)色空间法》[19]进行测定。检测条件:酒样经0.45 μm滤膜过滤,2 mm光程石英比色皿,用紫外-分光光度计连续扫描380~780 nm谱段,间隔5 nm,每酒样重复3 次,蒸馏水为空白。将380~780 nm波长处吸光度矫正到1 cm光程后,CIELab颜色参数计算如下:
式中:X、Y和Z为样品三刺激值;X0、Y0和Z0为D65标准白光三刺激值,取值为94.825、100.00、107.381。
1.3.4.2 总花色苷含量测定
参考兰圆圆等[20]的方法,计算如式(6)所示:
总花色苷质量浓度/(mg/L)=(A1-A2)×875 (6)
式中:A1、A2分别为用HCl溶液、NaHSO3溶液处理的酒样在520 nm波长处的吸光度。
1.3.4.3 单体花色苷比例、离子化指数测定
参考赵宇等[21]的方法,计算如式(7)、(8)所示:
式中:A1、A2、A3分别为未经过处理、SO2溶液处理、乙醛溶液处理的酒样在520 nm波长处的吸光度。
式中:A1、A2、A3、A4分别为未加NaHSO3溶液酒样、加入NaHSO3溶液酒样、未加HCl溶液酒样、加入HCl溶液酒样在520 nm波长处的吸光度。
1.3.5 挥发性香气化合物测定
参考Gao Pingping等[15]的方法,采用顶空固相微萃取-气相色谱-质谱(headspace-solid phase microextractiongas chromatography-mass spectrometry,HS-SPME-GCMS)联用仪进行测定。
SPME条件:取8 mL酒样于装有2.5 g NaCl、10 μL内标物2-辛醇(820.7 mg/L)的顶空瓶中,加磁力搅拌转子密封,置于磁力搅拌器上,40 ℃水浴平衡30 min后顶空萃取30 min。
GC-MS条件:TG-WAX色谱柱(60 m×0.25 mm,0.5 μm);升温程序为40 ℃保持5 min,以3.5 ℃/min升至180 ℃,保持15 min;载气(He)流速1 mL/min;不分流进样;电子电离源;电子能量70 eV;进样口温度240 ℃、传输线温度180 ℃、离子源温度250 ℃;质量扫描范围m/z50~350。
定性定量分析:GC-MS分析所得的样品质谱图经计算机在NIST、Wiley数据库检索比对,结合谱图分析进行定性。各成分的含量以2-辛醇为内标物进行半定量分析。香气物质含量和气味活性值(odor activity value,OAV)按式(9)、(10)计算:
式中:X为香气物质质量浓度/(µg/L);A1为测得香气物质的峰面积;f为内标物校正因子,f=1;C为内标物质量浓度/(µg/L);A为内标物峰面积。
1.3.6 感官评价
参考赵美等[22]的方法,略作修改,品评小组由10 位葡萄酒专业人员组成,使用10 分结构化数值尺度量化,分别从外观(色泽、澄清度)、香气(花香、果香、异味)、口感(酸度、酸甜平衡感、余味)和整体评分这4 个方面对各酒样进行品评。感官评分标准见表1。
1.4 数据处理
通过Microsoft Office Excel 2019进行数据整理和统计;利用IBM SPSS Statistics 26软件对数据进行方差分析;应用Origin 2021软件绘图。
2 结果与分析
2.1 AF过程中的相对密度变化
采取比重法对发酵进程进行监测,发酵温度控制在25~27 ℃左右,发酵进程见图1,对照组在发酵第1~6天时相对密度下降最快,说明这一阶段发酵速率较高;第7天相对密度下降趋势减缓,发酵速率开始减缓,直至第18天发酵结束。处理组在1~7 d发酵速度较快,随后发酵减缓,与对照组相比,发酵时间延长了2~3 d。

图1 AF过程中相对密度变化Fig.1 Changes in specific gravity during alcoholic fermentation
2.2 发酵过程酵母生物量分析
由表2可知,对照组中S.cerevisiae在整个AF过程中生物量呈现先上升后下降的趋势,在发酵中期以前始终保持107CFU/mL数量级。处理组中,S.cerevisiae、M.guilliermondii生物量同样呈现出先上升后下降的趋势,其中,M.guilliermondii生物量在接种48 h后达到最大(8×107CFU/mL),至发酵中期时,S.cerevisiae的生物量(107CFU/mL)已远大于M.guilliermondii(105CFU/mL),发酵末期未检测到M.g u i l l i e r m o n d i i的存在,而S.cerevisiae的生物量保持在105CFU/mL水平。
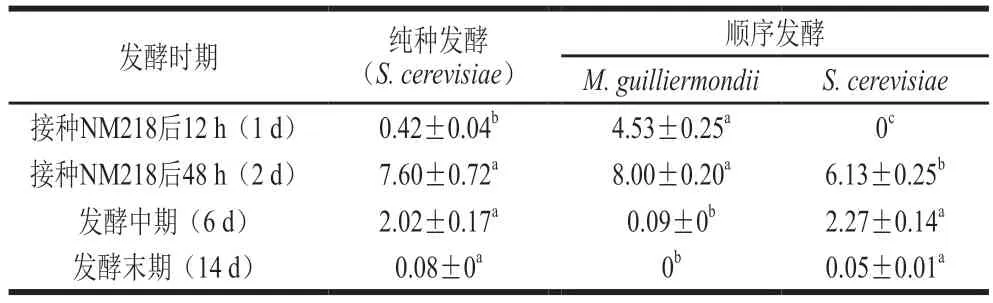
表2 两种接种方式下不同发酵时期酵母生物量Table 2 Yeast biomass during different fermentation periods under two inoculation modes 107 CFU/mL
2.3 常规理化指标分析
由表3可知,供试酒样基本理化指标均符合GB/T 15037—2006《葡萄酒》的要求。两款酒样残糖质量浓度均低于4 g/L,表明酒样均能彻底发酵;乙醇体积分数范围为13.95%~14.44%,处理组乙醇含量显著低于对照组,说明M.guilliermondii的参与能够降低乙醇体积分数;酒样中挥发酸质量浓度均不高于0.78 g/L,说明酒样发酵过程无异常情况;AF-NM与5M-NM处理组酒样总酸含量均低于对照组酒样,但差异不显著,随着陈酿的进行,5M-CK与5M-NM酒样总酸含量均显著降低;AF-NM与5M-NM处理组酒样甘油含量均显著低于对照酒样,说明M.guilliermondii并不是高产甘油的非S.cerevisiae。

表3 AF结束与陈酿5 个月后基本理化指标Table 3 Basic physicochemical indexes of wines at the end of alcoholic fermentation and after aging for five months
2.4 颜色指标分析
由表4可以看出,基于CIELab颜色空间的5 个参数数据结果均表现为处理组酒样显著高于同一时期对照组酒样。L*代表酒样的明暗程度,L*越大,酒样颜色越亮。AF结束时,AF-NM酒样的L*值显著高于AF-CK酒样211.47%,陈酿5 个月后依然高于对照酒样180.80%;虽然陈酿5 个月后各酒样L*值均呈上升趋势,但5M-CK酒样比AF-CK的L*值仅增高了24.33%,而5M-NM酒样比AF-NM的L*值增高了37.91%,说明菌株NM218的参与发酵对颜色明亮度影响显著。a*值代表酒样红绿色程度,a*值越高说明酒体颜色中红色分量越大,可以看出,AF结束时和陈酿5 个月后,处理组酒样比同一时期对照酒样的a*值分别增加了42.35%、47.01%,说明菌株NM218参与发酵可能能够增强某种红色成分的物质。b*值代表酒样黄蓝色程度,b*值越高说明酒体颜色中黄色分量越大,通常干红葡萄酒陈酿时间越长,b*值也逐渐增高,而本实验中,AF结束时和陈酿5 个月后,处理组酒样比同一时期对照酒样的b*值分别增加了174.53%、205.68%,说明菌株NM218在AF过程即显著增加了酒体黄色成分的分量。由此也相应地使处理组酒样的C*ab值(色彩饱和度)和h*ab(色调)增高。色差(ΔE*ab)与L*、a*和b*值贡献程度有关,表征酒样间总体差异程度。以AF-CK为参比酒样,5M-CK表现为ΔE*ab大于4,AF-NM与5M-NM均表现为ΔE*ab大于22,说明菌株NM218参与发酵对色差影响显著。AF结束时,处理组AF-NM总花色苷含量和单体花色苷比例显著低于对照(AFCK)酒样,尤其总花色苷含量降低了49.08%。陈酿5 个月后,各酒样总花色苷含量也都略有下降,在5 个月的陈酿过程中,5M-NM较AF-NM降低了1.80%,这个降低幅度与对照酒样即5M-CK较AF-CK的降低幅度差异不大,说明菌株NM218在AF过程中能够显著降低花色苷含量。离子化指数反映葡萄酒中对颜色起贡献的花色苷比例[21],从表4可以看出,处理组酒样的离子化指数均显著高于同一时期对照酒样,数据结果与L*值、b*值相对应,说明菌株NM218显著增加了酒中对颜色起贡献的花色苷比例。

表4 酒样相关颜色指标Table 4 Color parameters of wine samples
2.5 香气化合物分析
葡萄酒的风味是由不同挥发性香气化合物共同作用的结果。实验通过HS-SPME-GC-MS法分析酒样香气物质,共检测出64 种挥发性香气化合物,包括醇类18 种、酯类31 种、萜烯类7 种、酸类2 种、醛酮及其他类6 种,各个酒样的挥发性化合物种类及含量均有差异(图2、表5)。

图2 不同香气物质种类含量Fig.2 Contents of different classes of aroma substances in wine samples
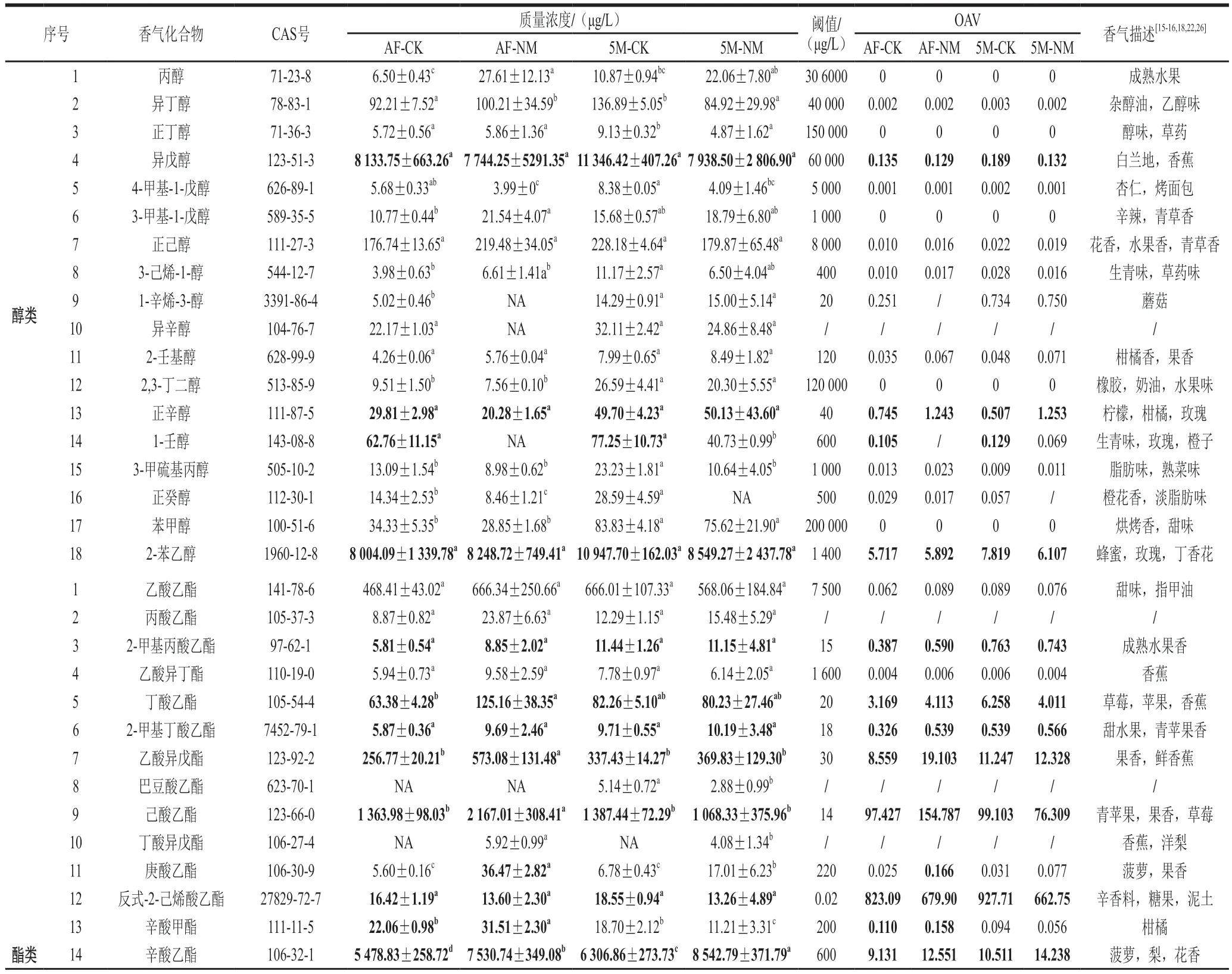
表5 香气化合物成分分析Table 5 Composition of aroma compounds in wine samples
高级醇类物质是酵母氨基酸代谢的次级产物之一,是葡萄酒中的主要香气物质,高级醇低于300 mg/L时可以增加葡萄酒香气的复杂性,赋予葡萄酒怡人的花香和水果香,但当高于400 mg/L时会给葡萄酒带来刺鼻的气味[23]。适量的醇类物质可使葡萄酒的香气更为复杂、浓郁,如2,3-丁二醇具有橡胶、奶油、水果味;正辛醇赋予葡萄酒茉莉、柠檬、柑橘等多种风味。这些醇类物质对葡萄酒整体感官质量有一定的优化作用[24]。两款酒样共检测出18 种醇类物质,总质量浓度为16 444.37(AF-NM)~23 056.98 μg/L(5M-CK),均低于3 0 0 m g/L。异戊醇(>4 7.4 7%)和2-苯乙醇(>47.39%)在醇类物质中占比最大,OAV均大于1,赋予葡萄酒香蕉、蜂蜜、玫瑰、丁香花等气味。
酯类物质是葡萄酒香气中的重要组成部分,主要在葡萄酒发酵和陈酿过程中产生,可以赋予葡萄酒愉悦的花香和果香,对葡萄酒香气的形成起着至关重要的作用[23]。两款酒样共检测出31 种酯类物质,酯类物质的总质量浓度为11 244.49(AF-CK)~15 224.347 μg/L(5M-NM)。辛酸乙酯在酯类物质中占比最大,其次为丁二酸二乙酯、己酸乙酯和癸酸乙酯等。AF-NM酒样中,丁酸乙酯(97%)、乙酸异戊酯(123%)、己酸乙酯(59%)、庚酸乙酯(621%)、辛酸甲酯(43%)、辛酸乙酯(37%)、己酸异戊酯(77%)、反-4-癸烯酸乙酯(238%)、乙酸苯乙酯(61%)和3-苯丙酸乙酯(140%)含量均显著高于AF-CK。5M-NM中辛酸乙酯(35.45%)、乙酸异戊酯(10%)、庚酸乙酯(151%)、丁二酸二乙酯(63%)、反-4-癸烯酸乙酯(351%)和肉豆蔻酸乙酯(83%)含量均高于5M-CK。值得注意的是,丁酸异戊酯和辛酸异戊酯仅在处理组中检出。
脂肪酸是酵母在脂肪酸代谢过程中形成的,当接近其阈值时,葡萄酒会产生果味、奶酪味、黄油味。但浓度过高会使葡萄酒具有“汗味”、“脂肪味”、“腐臭味”等不良风味[25]。实验共检测出正己酸、辛酸两种脂肪酸,其中,对照组与处理组酒样经陈酿后总酸均显著高于AF结束的酒样。值得注意的是,辛酸只在对照组中检出。
萜烯类物质阈值较低,赋予葡萄酒浓郁的香气。实验共检测出芳樟醇、香茅醇、橙花醇、反式-橙花叔醇、大马士酮、香叶基丙酮、α-萜品醇7 种萜烯类物质。其中,5M-CK较AF-CK、5M-NM较AF-NM大马士酮含量显著增加,分别增加了120%、171.43%。处理组与对照组在同一时期萜烯类物质总含量没有显著性差异,但经陈酿后分别增加了170.14%、115.01%。还检测到6 种酮醛及其他类化合物,总质量浓度为290.83~577.48 μg/L,包括醇酮类5 种、其他类化合物1 种,尽管这些物质含量较低,但对酒体香气复杂性有一定的积极贡献。
2.6 主要香气化合物的热图分析
OAV为香气物质的含量与气味阈值的比值,是评价单一香气化合物对葡萄酒整体香气贡献程度的指标[26]。为确定供试酒样的香气差异,对OAV>0.1的香气物质进行热图聚类分析。由图3可知,AF-CK酒样中芳樟醇、月桂酸乙酯、辛酸甲酯、1-壬醇等含量较高,赋予葡萄酒浓郁的菠萝、梨、柑橘等香气;AF-NM酒样中月桂酸乙酯、乙酸苯乙酯、辛酸甲酯、己酸乙酯等香气物质含量较高,赋予葡萄酒复杂浓郁的香蕉、草莓、苹果、柑橘等水果香;5M-CK酒样中大马士酮、壬醛、3-甲基丁酸乙酯、2-苯乙醇、癸酸乙酯等香气物质含量较高,能够为葡萄酒带来复杂浓郁的玫瑰、橙子、黑莓、香蕉、丁香花等气味;5M-NM酒样中大马士酮、乙酸苯乙酯、香茅醇、2-甲基丁酸乙酯、2-甲基丙酸乙酯、正辛醇等香气物质含量较高,能够为葡萄酒带来浓郁的玫瑰、青柠檬、苹果等香气。热图分析表明,NM-218与S.cerevisiae顺序接种发酵能够增加部分酯类、萜烯类物质的含量,提升赤霞珠干红葡萄酒中的花香、果香,提高香气复杂性。

图3 酒样主要香气成分热图Fig.3 Heatmap of the major aroma compounds of wine samples
2.7 感官分析
为更好地评估供试菌株对葡萄酒感官质量的影响,进行感官评价(图4)。外观方面,处理组酒样与对照组酒样在AF结束、陈酿5 个月均呈紫红色,但处理组酒样较同一时期对照组酒样紫红色较浅;香气方面,AF结束与陈酿5 个月酒样均无明显异味,处理组酒样花香、果香显著优于对照组;口感方面,处理组酒样AF结束时酸度较低、余味较强,经陈酿后处理组余味、酸甜平衡感较强;处理组酒样在陈酿5 个月后整体评分方面也获得了较高的分数,酒样酒体协调、香气浓郁。

图4 感官分析雷达图Fig.4 Radar plot of sensory analysis
3 讨 论
近年来,消费市场对不同类型和风格葡萄酒的需求不断增长,而S.cerevisiae与本土非S.cerevisiae混合发酵作为一种调控葡萄酒香气特性的新工艺,成为了研究和应用的热点之一。NM218菌株是本实验室优选出的1 株本土菌株,前期研究表明[14],菌株NM218能够在350 g/L葡萄糖、250 mg/L SO2、pH 2.5和9%乙醇条件下表现出较好的耐受性,在反应温度40 ℃、pH 4.0条件下,β-葡萄糖苷酶活力可达49.5 mU/mL,具有应用于混菌发酵的潜力。Gao Pingping等[15]结果表明,NM218菌株与S.cerevisiae顺序接种于葡萄醪液中,48 h后M.guilliermondii生物量达到106~107CFU/mL,能够改善葡萄酒的风味特征。因此,为保证实验中NM218在葡萄酒发酵过程具有较高的生物量与β-葡萄糖苷酶活力,NM218以48 h后接种S.cerevisiae的接种策略进行混菌发酵。
色泽是评价葡萄酒风味质量的重要指标,而花色苷是其颜色的物质基础,对红葡萄酒颜色起决定作用[27]。Han Fuliang等[28]采用主成分回归分析法研究了赤霞珠葡萄酒中花色苷与颜色的关系,发现参与分析的花色苷可以解释葡萄酒红色的64.56%~81.57%。本研究中,处理组AF-NM酒样总花色苷质量浓度(291.08 mg/L)显著低于对照组AF-CK酒样(571.67 mg/L),这可能归因于M.guilliermondiiNM218高β-葡萄糖苷酶活力[29]。然而,AF-NM酒样的a*值(45.61)却高于AF-CK(32.04),AF-NM酒样离子化指数与AF-CK酒样相比显著增高,说明处理组酒样对颜色起贡献的花色苷比例较高,所以处理组a*值高于对照组的原因可能是M.guilliermondii能够使酒样中产生对红色分量贡献较大的花色苷类物质,从而导致a*值较高,具体原因尚不清楚,这一点后期还需继续研究以明确酒样中不同成分对颜色的影响。本研究AF-NM酒样b*值(24.90)显著高于AF-CK(9.07),陈酿5 个月后趋势不变。这一结果可能与吡喃类花色苷的含量有关,Benito等[11]研究表明,M.guilliermondii发酵能够增加吡喃花色苷类物质的形成,而吡喃类花色苷对橘黄色贡献较大[25]。从颜色参数可以看出,处理组酒样陈酿5 个月的花色苷总量低于对照组,红色指标和黄色都明显增加,这一结果还需继续在陈酿期进行跟踪检测以探明原因。同时也说明,针对高β-葡萄糖苷酶活力的M.guilliermondii菌种在干红葡萄酒的应用中,可以考虑适当延长浸渍时间,让花色苷等呈色物质更好的浸入葡萄酒[30];其次,也可以考虑针对桃红葡萄酒或干白葡萄酒的酿造进行应用研究。
香气是葡萄酒感官评价的重要指标,也是影响葡萄酒感官质量的重要因素。陈誉文等[5]研究表明,毕赤酵母属与S.cerevisiae混合发酵可以有效提高冰酒的香气复杂性和丰富度,可酿造出具有本土特色的优质葡萄酒。本研究中,NM218与S.cerevisiae顺序接种发酵能够增加乙酸异戊酯、辛酸异戊酯、丁酸乙酯、己酸乙酯、香茅醇等部分酯类、萜烯类物质的含量,提升赤霞珠干红葡萄酒中的花香、果香,提高香气复杂性,这与Gao Pingping等[15]研究结果一致。值得注意的是,丁酸异戊酯与辛酸异戊酯仅在处理组中检出,这可能与NM218菌株的某种酿酒特性有关,具体机制还有待进一步研究。
4 结 论
本土M.guilliermondii菌株NM218与商业S.cerevisiaeFX10以间隔48 h顺序接种进行赤霞珠干红葡萄酒中试酿造,在AF过程中,M.guilliermondii细胞活菌数在AF中期逐渐降低为105CFU/mL,到发酵末期完全消亡,而S.cerevisiae自接种后到发酵末期一直存在于发酵体系;所得酒样基本理化指标均符合GB/T 15037—2006的要求;顺序接种能提高酒体CIELab颜色参数、离子化指数,降低总花色苷含量与单体花色苷比例,使酒样颜色亮度、红色色调、黄色色调与色彩饱和性与对照酒样存在显著差异;此外,顺序接种发酵能够增加酒样中丁酸乙酯、乙酸异戊酯、己酸乙酯、辛酸甲酯、辛酸乙酯、乙酸苯乙酯、香茅醇等酯类、萜烯类物质的含量,且有2 种独有香气,赋予赤霞珠干红葡萄酒浓郁的花香、果香,提高香气复杂性,在一定程度可以提升葡萄酒的感官品质。综上结果表明,NM218与FX10顺序接种发酵可以增强干红葡萄酒香气品质和感官愉悦感。
