升降润肠方对功能性便秘模型大鼠胃肠动力及结肠黏膜水通道蛋白3、水通道蛋白9的影响
2023-10-11申慧贞赵骞闫慧敏杨燕王昕泰刘畅
申慧贞 赵骞 闫慧敏 杨燕 王昕泰 刘畅
功能性便秘(functional constipation,FC)是儿科门诊常见的消化系统疾病,长期便秘可引起食欲减退、口苦口臭、腹胀腹痛等胃肠功能紊乱,病程越长,干预越晚,治疗效果越差[1]。升降润肠方由北京儿童医院已故名医王鹏飞治疗便秘经验方加减而成[2],本课题组前期临床研究发现该方治疗儿童FC疗效显著[3],但其作用机制尚不清楚。FC与胃肠蠕动减慢、结肠内水液过度吸收和(或)分泌减少而表现为粪便干结而致大便排出困难密切相关。水通道蛋白(aquaporin,AQP)在人和动物胃肠道水液代谢中发挥着重要作用[4],其中水通道蛋白3(AQP3)、水通道蛋白9(AQP9)存在于结肠粘膜,并可调控结肠水液代谢[5-6]。本实验拟通过观察升降润肠方对FC模型大鼠胃肠动力及结肠黏膜AQP3、AQP9表达的影响,探讨其治疗FC的可能作用机制,为升降润肠方治疗儿童FC提供科学依据,从而更好的应用于儿科临床。
1 材料与方法
1.1 实验动物及环境
48只SPF级6~8周龄SD大鼠,雌、雄各24只,体质量180~200 g,购于北京华阜康生物科技股份有限公司,动物合格证号:110322210100863418。大鼠饲养于恒温22℃,湿度40%~50%,12小时光照/黑夜交替的SPF级实验室,均自由摄食,并定时清洁、更换饲料,所有实验操作遵循实验动物伦理委员会规定。该实验通过实验动物伦理委员会批准(伦理号MDKN-2021-051)。
1.2 药物
盐酸小檗碱片(源叶生物,国药准字:S30593,5 g/片);升降润肠方,组成:茯苓10 g、 橘红10 g、钩藤10 g、伏龙肝10 g、炙甘草6 g、桃仁10 g、当归10 g,由首都医科大学附属北京儿童医院药房提供,并由院内制剂室水煎煮制备成含生药1.15 g/mL的药液,4℃冰箱保存备用;乳果糖口服溶液(湖南科伦制药有限公司,国药准字:H20093523,0.667 g/mL)。
1.3 主要试剂及仪器
兔抗鼠AQP3多克隆抗体(Abcam,货号:ab125219)、鸡抗鼠AQP9多克隆抗体(Abcam,货号:ab15129);BCA蛋白定量试剂盒(Thermo,货号:Cat No.23225);TRNzol总RNA提取试剂[天根生化科技(北京)有限公司];AQP3、AQP9、GAPDH引物均在北京Invitrogen公司合成。
低温台式离心机(湖南湘仪实验室仪器开发有限公司,型号:TGL-16),荧光定量PCR仪(Applied Biosystems,型号:ABI7500),曝光仪(上海易孛特,型号:eBlot)。
1.4 动物分组及模型制备
48只大鼠正常喂养和观察1周后称重,采用随机数字表法随机分为空白组、模型组、乳果糖组、升降润肠方组,每组12只,雌、雄各半。参照吴迪等[7]的造模方法并略作改进:各组大鼠禁食不禁水12小时后,空白组每日1次予生理盐水0.2 mL/(10 g·d)灌胃,其余组每日1次予盐酸小檗碱5 mg/(10 g·d),加生理盐水2 mL配制成的混悬液灌胃,连续灌胃21天进行造模,期间不限食水。当大鼠出现6小时内排便粒数减少、大便粒形小且干硬时为造模成功。
1.5 干预方法
空白组、模型组均予生理盐水1 mL/次,2次/天,灌胃;根据动物药物剂量换算公式:大鼠剂量(mg/kg)=成人剂量(mg/kg)×折算系数(6.25),按成人体质量60 kg计算,乳果糖组,予乳果糖口服溶液1mL/(次·天)[乳果糖日服剂量30 mL换算成SD大鼠3.1 mL/(kg·d)],第2次灌胃予生理盐水1 mL/次;升降润肠方组予中药液1 mL/次,2次/天灌胃[升降润肠方日服剂量66 g生药换算成SD大鼠6.9 g/(kg·d)];四组均连续灌胃14天。
1.6 标本采集
末次给药后每组随机抓取大鼠雌、雄各3只,禁食不禁水12小时,将活性炭按0.1 mL/10 mg的比例进行灌胃30分钟后,脱颈处死大鼠,做胃排空率、碳墨推进率、结肠粪粒数测定;余大鼠禁食不禁水12小时后,用3%戊巴比妥钠麻醉后剖腹取近端结肠组织30 mm左右平分3段冲洗,1段放入4%甲醛中固定备用以待免疫组化,另2段置于-80℃超低温冰箱保存备用以待实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)及蛋白印迹(Western blot,WB)。
1.7 指标检测
1.7.1 胃肠动力测定 将计算好的活性炭灌胃30分钟后脱颈处死大鼠,取胃称重,用生理盐水冲洗胃内容物后再次称重,胃排空率=[1-(胃全重-胃净重)/胃全重]×100%;剪取肠管测量小肠总长度,从幽门至活性炭前沿的距离视为肠管内推进距离,碳墨推进率=(肠管内推进距离/小肠全长)×100%;并记录整个结肠内粪便存留的粒数。
1.7.2 免疫组化染色 取备用的结肠组织,采用S-P法进行免疫组化染色,通过Motic3000显微镜在400倍下观察切片,阳性结果为棕色或者棕黄色。采用Image-pro Plus图像分析系统,计算平均光密度值并观察AQP3、AQP9在结肠黏膜中的分布及表达情况。
1.7.3 qRT-PCR检测 取备用结肠组织,采用TRNzol总RNA提取试剂进行RNA提取,进行RNA浓度、纯度检测,以A260/A280比值范围1.8~2.1为较高纯度RNA。采用PrimeScriptTMRT reagent Kit with gDNA Eraser进行cDNA反转录,以此为模板进行PCR扩增,引物见表1,每个样本检测3个复孔。原始检测数据采用2-△△ct相对定量公式计算。
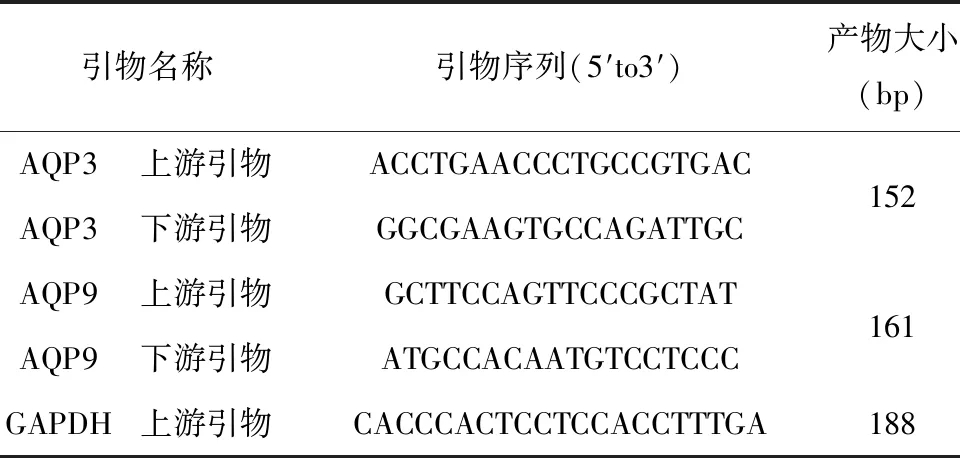
表1 引物序列
1.7.4 WB检测 取结肠组织,RIPA裂解液抽提蛋白,用BCA蛋白定量试剂盒测定蛋白浓度,计算调整蛋白浓度,上样、电泳、转膜、封闭、一抗和二抗孵育、漂洗后将其显色、曝光、显影;β-actin选作内参,Image J软件进行灰度值分析。
1.8 统计学方法

2 结果
2.1 各组大鼠胃肠动力比较
与空白组相比,模型组的胃排空率、碳墨推进率降低、存留粪粒数增多,差异均有统计学意义(P<0.05),提示便秘模型复制成功。与模型组相比,乳果糖组的胃排空率差异无统计学意义(P>0.05),升降润肠方组的胃排空率增加,差异有统计学意义(P<0.05);与模型组相比,两组的碳墨推进率均增加、存留粪粒数均减少,差异有统计学意义(P<0.05)。与乳果糖组相比,升降润肠方组的胃排空率增加(P<0.05),但两组的碳墨推进率、存留粪粒数差异无统计学意义(P>0.05)。见表2、3。

表2 各组大鼠胃排空率比较鼠只=6)

表3 各组大鼠肠道炭墨推进率及存留粪粒数比较
2.2 各组大鼠结肠组织中AQP3、AQP9的分布及表达情况比较
2.2.1 免疫组化检测 AQP3阳性细胞主要位于结肠黏膜表层柱状上皮,且均为吸收细胞胞浆着色,杯状细胞未见到阳性着色(图1)。AQP9阳性细胞主要位于结肠黏膜表层柱状上皮,且均为杯状细胞胞浆着色,吸收细胞未见到阳性着色(图2)。与空白组相比,模型组AQP3的平均光密度值升高,AQP9的平均光密度值降低(P<0.05)。与模型组相比,乳果糖组AQP3的平均光密度值均降低(P<0.05),AQP9的平均光密度值升高,但差异无统计学意义(P>0.05);与模型组相比,升降润肠方组AQP3的平均光密度值降低(P<0.05),AQP9的平均光密度值升高(P<0.05)。与乳果糖组相比,升降润肠方组AQP3的平均光密度值降低,但差异无统计学意义(P>0.05),AQP9的平均光密度值升高 (P<0.05)。见表4。
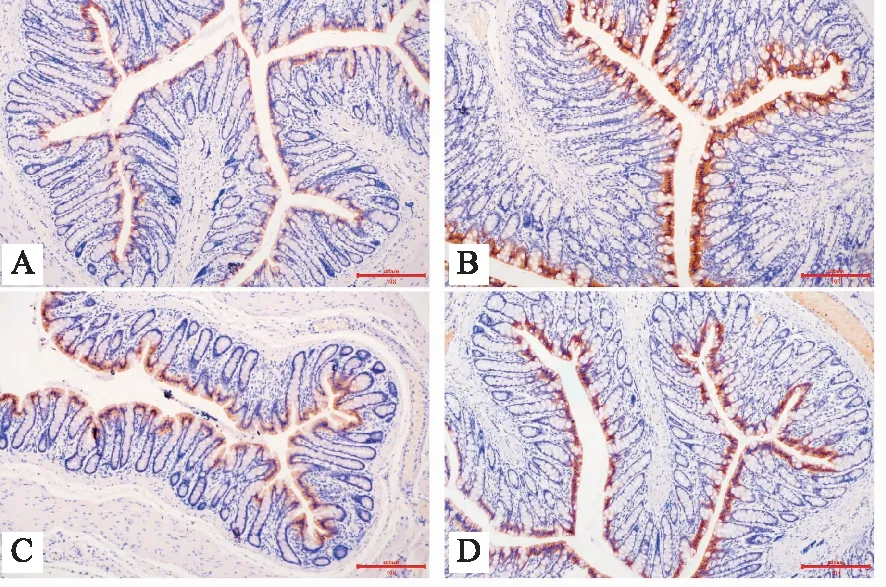
注:A:空白组;B:模型组;C:乳果糖组;D:升降润肠方组。
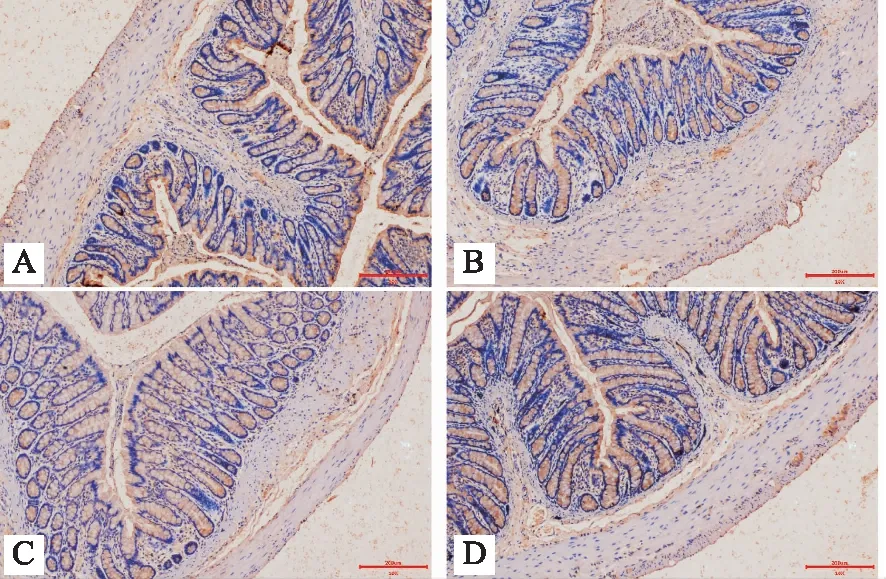
注:A:空白组;B:模型组;C:乳果糖组;D:升降润肠方组。

表4 各组大鼠近端结肠黏膜组织AQP3、AQP9平均光密度值比较
2.2.2 qRT-PCR、WB检测 与空白组相比,模型组AQP3 mRNA及蛋白表达上升,AQP9 mRNA及蛋白表达下降(P<0.05)。与模型组相比,乳果糖组AQP3 mRNA及蛋白表达下降(P<0.05),AQP9 mRNA及蛋白表达升高,但差异无统计学意义(P>0.05);与模型组相比,升降润肠方组AQP3 mRNA及蛋白表达下降(P<0.05),AQP9 mRNA及蛋白表达上升(P<0.05)。与乳果糖组相比,升降润肠方组AQP3 mRNA及蛋白表达降低,但差异无统计学意义(P>0.05),AQP9 mRNA及蛋白表达上升(P<0.05)。见表5、6及图3。
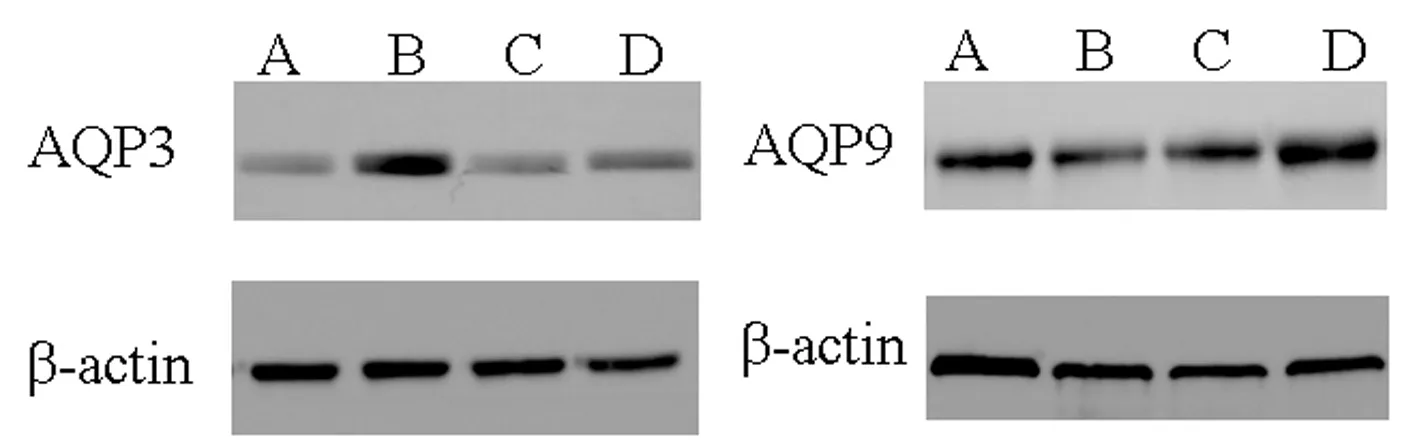
注:A:空白组;B:模型组;C:乳果糖组;D:升降润肠方组。

表5 各组大鼠近端结肠黏膜组织AQP3、AQP9 mRNA水平比较

表6 各组大鼠近端结肠黏膜组织AQP3、AQP9蛋白表达水平
4 讨论
既往认为小儿便秘以饮食积滞、燥热内结证最为常见[8-9],治疗多以消食导滞、清热润肠通便为主。闫慧敏教授根据小儿“脾常不足、肝常有余、肺常不足”的生理特点及“络病理论”[10],从脾虚肠燥论治,创立了升降润肠方,该方运脾生津、润肠通便、调畅气机,思路新颖。在实际应用中根据患儿脾虚、肠燥、气滞程度不同,往往酌情加用白术、火麻仁、炒苦杏仁、生地黄、白芍、枳实、厚朴等,经前期临床研究证实疗效显著。
慢传输型便秘是儿童功能性便秘的常见类型,是由各种原因引起的结肠运动功能迟缓、传输粪便能力下降而导致的便秘[11],其发病机制与肠神经系统病变、神经递质分泌异常、Cajal间质细胞异常、平滑肌功能障碍、精神心理问题、肠道菌群失调等相关[12]。本实验结果显示模型组大鼠的胃排空率及碳墨推进率低于空白组,结肠粪粒存留粒数高于空白组(P<0.05),提示该模型为慢传输型便秘模型。与模型组相比,升降润肠方可以促进FC模型大鼠胃肠动力(P<0.05),且在促进胃动力方面优于乳果糖(P<0.05)。说明升降润肠方可促进慢传输型FC模型大鼠的胃肠动力,从而缩短粪便在结肠的存留时间,减少水分吸收,以缓解便秘。
功能性便秘的发生与肠道水液代谢障碍有关[13],对人体而言,结肠上皮细胞每天需要逆渗透压浓度梯度吸收1.5~2 L的水来保证大便成型,然而,在某些生理和病理条件下,结肠上皮细胞也能分泌水分和电解质,AQPs在胃肠上皮细胞水液的转运中发挥重要作用,其功能的发挥与它所在的位置之间似乎有密切的关系[14]。AQP3是一种在食道、结肠近端和远端表达丰富的水通道蛋白,其精确定位在基底外侧膜的单层柱状上皮细胞[15]。在吗啡诱导的便秘模型大鼠中,结肠黏膜AQP3的表达水平升高,促进水分由肠腔侧到血管侧的吸收,并导致便秘[16];利用HgCl2和CuSO4抑制大鼠AQP3的功能,则可导致严重腹泻[17];以上说明AQP3在调节肠道水液平衡方面起着关键作用。早期研究证实AQP9主要存在于人类和大鼠的肝脏,并可允许各种各样的水和中性溶质通过[18];近年袁维堂等[6]发现AQP9存在于人类结肠,且便秘患者降结肠黏膜AQP9蛋白表达低于非便秘者;赵兵等[19]证实便秘大鼠结肠中AQP9表达水平明显降低,经治疗后AQP9表达水平显著提高,推测AQP9减少可能影响肠道黏液分泌,导致粪便含水量不足,形成干结粪便,从而引起便秘。本研究免疫组化示AQP3、AQP9分别主要存在结肠黏膜上皮层的吸收细胞、杯状细胞;吸收细胞参与水分的吸收而致粪便含水量降低;杯状细胞参与结肠黏液分泌、润滑肠道促进粪便排出,与既往研究一致[20]。本研究结果示模型组结肠黏膜AQP3 mRNA及蛋白表达水平高于空白组,AQP9低于空白组(P<0.05),说明二者参与了大鼠FC的发生。而与模型组相比,升降润肠方组结肠黏膜AQP3水平下降,AQP9上升(P<0.05),这从分子机制证实了升降润肠方具有生津、润肠通便的作用。研究同时表明,升降润肠方组结肠黏膜AQP9水平高于乳果糖组(P<0.05),但AQP3水平较乳果糖组无明显差异(P>0.05)。
本研究仍有一定的局限,仅检测了升降润肠方对胃肠动力及AQP3、AQP9的影响,仍需进一步探究神经递质、肠道菌群等对胃肠动力的影响及VIP-cAMP-PKA、NF-κB等信号通路对AQP3、AQP9具体调控机制,以更深层次明确升降润肠方治疗便秘的生物学机制。
综上所述,升降润肠方可促进FC模型大鼠胃排空率、碳墨推进率,减少粪粒存留,同时能调控结肠黏膜AQP3、AQP9的表达,其在促进胃排空率及上调AQP9的表达方面优于乳果糖。故升降润肠方治疗儿童FC的作用机制与其能促进胃肠动力,下调近端结肠黏膜AQP3及上调近端结肠黏膜AQP9的表达相关。
