半夏厚朴汤通过抑制内质网应激改善慢性间歇性低氧引起的小鼠心脏损伤
2023-10-11宋纪显陈琦杨新栎安继仁赵亚硕吉恩生
宋纪显 陈琦 杨新栎 安继仁 赵亚硕 吉恩生
阻塞性呼吸睡眠暂停(obstructive sleep apnea,OSA)可引起慢性间歇性低氧(chronic intermittent hypoxia,CIH),诱导小鼠心肌损伤和心脏功能障碍[1]。CIH主要的病理特征是反复低氧/复氧循环,引起活性氧(reactive oxygen species,ROS)升高和内质网应激(endoplasmic reticulum stress,ERS)进而导致心肌细胞凋亡[2-3]。内质网应激与多种心血管疾病密切相关,持续高水平存在会激活未折叠蛋白反应,造成细胞功能障碍和凋亡[4]。本课题组前期研究证实半夏厚朴汤可通过减少铁沉积,抑制氧化应激和线粒体损伤,进而减轻CIH引起的心脏损伤[5-6],同时有研究发现CIH可以激活ERS导致主动脉血管重构[7],但是半夏厚朴汤是否可以通过抑制ERS反应发挥心脏保护作用尚不明确。因此为了进一步探讨CIH引起心脏损伤的具体机制以及寻找半夏厚朴汤发挥心脏保护作用的其他潜在机制,课题组建立小鼠CIH模型,并观察ERS在其中的作用以及半夏厚朴汤对ERS的调控作用。
1 材料与方法
1.1 实验动物
C57BL/6N小鼠(SPF级,雄性),8周龄,体质量(20±2)g,购自北京维通利华实验动物技术有限公司,动物许可证号: SYXK[冀]2017-005,于河北中医药大学科研中心动物中心进行饲养。该实验已通过河北中医药大学伦理委员会审查(动物伦理编号:DWLL2020044)。
1.2 主要药品与试剂
半夏厚朴汤所用中药饮片均购自河北神威药业有限公司,处方:半夏12 g、厚朴9 g、茯苓12 g、生姜15 g、苏叶6 g。
RIPA裂解液(武汉赛维尔生物科技有限公司,货号:G2002)、蛋白酶抑制剂(Thermo Scientific,货号:A32955)、Tween-20(北京索莱宝科技有限公司,货号:9005-64-5)、BCA试剂盒(CoWin Biosciences,货号:CW0014),超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)、过氧化氢酶(catalase, CAT)试剂盒(南京建成,货号:A001-1、A007-1、A003-1)、TUNEL试剂盒(Vazyme Biotech,货号:A112)、葡萄糖调节蛋白78(glucose-regulated protein 78, GRP78)抗体(武汉赛维尔生物科技有限公司,货号:GB11098)、CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein, CHOP)抗体(华安生物,货号:ET17030)、内质网氧化还原1样蛋白(endoplasmic reticulum oxidoreductin-1-like protein, ERO1L)抗体(Bioss公司,货号:bs-10551R)、GAPDH抗体(武汉赛维尔生物科技有限公司,货号:GB15002)。
1.3 仪器设备
CIH氧舱(Oxyeycler Model 84,BioSpherix公司,美国)、小动物超声成像系统(Vevo 2100, VisualSonics,加拿大)、生化分析仪(Phenom Pro,荷兰)、多功能读数仪(Varioskan LUX,Thermo Scientific,美国)、多功能成像系统(Vilber Fusion FX5 Spectra,Vilber Lourmat,法国)。
1.4 造模与分组
将C57BL/6N小鼠30只适应性饲养1周后随机分为3组:正常组、模型组(CIH组)、半夏厚朴汤治疗组(简称治疗组)。模型制备共计3周,具体方法参考本课题组前期研究[5]。每日造模前,治疗组小鼠灌胃给予半夏厚朴汤0.3 mL[7.02 g/(kg·d),此处参照汉代张仲景的《金匮要略》中的配方,按照临床成人(70 kg)剂量的等效小鼠(20 g)剂量换算,即0.14 g/20 g],模型组与正常组小鼠灌服与治疗组同等体积的生理盐水。
1.5 指标检测
1.5.1 超声心动图分析 造模结束前一天,进行小动物B超检测。首先将小鼠放入麻醉盒中,冲入异氟烷对小鼠进行吸入麻醉,麻醉成功后将小鼠固定在操作板上,小鼠鼻腔持续给予异氟烷,并用脱毛膏将小鼠心区附近脱毛,暴露胸腔,将耦合剂挤在心区,用探头检测相关的指标。然后以QRS波和T波作为收缩期和舒张期的指标,结合图像上二尖瓣的开闭情况测量左心室内径。M型超声记录并测定射血分数(ejection fraction,EF)、左心室收缩末期内径(LV-End systolic diameter,LVESD)、左心室舒张末期内径(LV-End diastolic diameter,LVEDD)。所有测试小鼠至少取3个连续循环的平均值,并进行分析。
1.5.2 动物标本采集 造模结束后,采用0.4%戊巴比妥钠腹腔注射麻醉后,首先进行摘除眼球法取血,留存用于血清指标的检测。然后将小鼠仰卧位固定于手术操作板上,暴露胸腔。迅速摘取心脏用4°C生理盐水冲洗,放于无菌无酶冻存管内,置于液氮、-80°C保存,用于后续指标检测。
1.5.3 心肌酶检测 采用全自动生化分析仪分别测定各组小鼠血清中肌酸激酶(creatine kinase,CK)、肌酸激酶同工酶(creatine kinase-MB,CK-MB)、乳酸脱氢酶同工酶1(lactic dehydrogenase isoenzyme1, LDH1)的含量。每组小鼠随机抽取6只进行检测。
1.5.4 心脏组织中ROS检测 取小鼠心脏组织,加入RIPA裂解液,3000 转离心10分钟,取上清液加入待测试剂,置于酶标仪波长550 nm处,分别测定SOD、CAT活力和MDA含量。每组小鼠随机抽取3只进行检测。
1.5.5 Western blot检测 称取小鼠心肌组织,按照组织重量∶裂解液=10 mg∶100 μL的比例加入预冷的RIPA裂解液,将组织剪碎后用研磨仪研磨1分钟/次,共三次,然后用高速冷冻离心机4°C、12000 转离心20分钟,吸取上清液。用BCA法对蛋白浓度进行测定,选取30 μg蛋白进行SDS-PAGE电泳,将蛋白转移到PVDF膜上,用脱脂奶粉常温封闭2小时后孵育GAPDH、GRP78、CHOP、ERO1L一抗4°C过夜,然后用TBST洗涤3次,每次15分钟,常温孵育山羊抗小鼠/兔二抗2小时后用TBST洗涤3次,每次15分钟,用ECL进行化学发光成像。用Image J软件对目的条带灰度值进行分析,计算目标蛋白灰度值/GAPDH灰度值的相对表达。每组小鼠随机抽取3只进行检测。
1.5.6 TUNEL染色 每组小鼠取3只制备冰冻切片。将冰冻切片固定后,使用蛋白酶K修复。之后滴加破膜工作液覆盖组织,常温下孵育20分钟,然后滴加buffer常温孵育10分钟进行室温平衡。滴加反应液,37℃恒温箱孵育2小时后滴加DAPI染液,避光室温孵育10分钟,复染细胞核。将切片洗涤甩干后用抗荧光淬灭封片剂封片,于荧光显微镜下观察并采集图像以检测凋亡小体的数量,代表心肌细胞凋亡的情况。
1.6 统计学处理

2 结果
2.1 半夏厚朴汤对CIH暴露小鼠心脏功能的影响
超声心动图结果表明,与正常组相比,模型组小鼠左心室EF下降(P<0.05),LVESD、LVEDD均有不同程度的升高(P<0.05);与模型组相比,治疗组小鼠EF提高,LVESD、LVEDD均有下降(P<0.05)。结果见表1、图1。
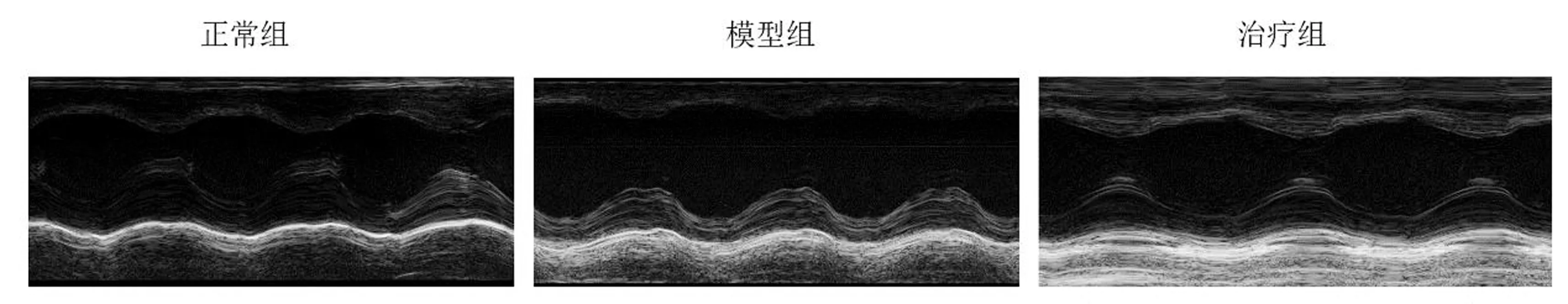
图1 各组小鼠超声心动图

表1 各组小鼠心脏功能指标EF、LVESD、LVEDD比较
2.2 半夏厚朴汤对CIH暴露小鼠血清CK、CK-MB、LDH1含量的影响
与正常组相比,模型组CK、CK-MB、LDH1的含量显著增加(P<0.05);与模型组相比,治疗组的CK、CK-MB、LDH1含量明显降低(P<0.05)。结果见表2。

表2 各组小鼠血清中CK、CK-MB、LDH1的含量比较
2.3 半夏厚朴汤能对CIH暴露小鼠心脏组织SOD、MDA、CAT含量的影响
与正常组相比,模型组SOD和CAT含量明显降低,MDA含量显著升高(P<0.05);与模型组相比,治疗组SOD、CAT含量上升,MDA含量下降(P<0.05)。结果见表3。

表3 各组小鼠心脏组织中SOD、MDA、CAT的含量比较
2.4 半夏厚朴汤对CIH暴露小鼠心脏组织GRP78、CHOP、ERO1L蛋白表达的影响
Western blot结果表明,与正常组相比,模型组GRP78、ERO1L、CHOP的蛋白表达量明显升高(P<0.05);与模型组相比,治疗组GRP78、ERO1L、CHOP的蛋白表达量显著下降(P<0.05)。结果见表4、图2。
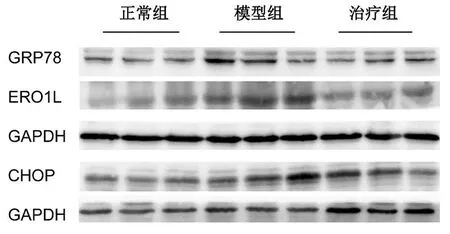
图2 各组小鼠心脏组织中GRP78、ERO1L、CHOP蛋白表达情况

表4 各组小鼠心脏组织中GRP78、ERO1L、CHOP蛋白表达水平比较
2.5 半夏厚朴汤对CIH暴露小鼠心肌细胞凋亡的影响
TUNEL染色结果显示,与正常组相比,模型组心肌细胞中凋亡小体的数量明显增多;与模型组相比,半夏厚朴汤治疗组心肌细胞中凋亡小体的数量出现下降。结果见图3。
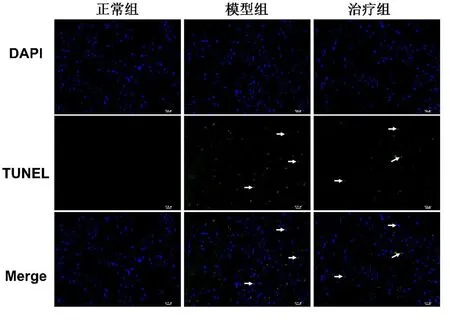
图3 各组小鼠心脏组织TUNEL染色(×400,鼠只=3)
3 讨论
OSA作为一种慢性进行性疾病,其最主要的病理特征是CIH,能够引起氧化应激和ERS水平升高,日久会导致包括心血管疾病在内的多种并发症,所以在早期进行干预十分必要[7-9]。大多数OSA患者表现为形体肥胖,痰、气是其主要的病理因素,贯穿整个发病过程[10],而半夏厚朴汤重在行气降逆化痰[11],与OSA的病机基本相符。
本课题组前期研究证实,CIH过程中反复的低氧—复氧循环可以通过加重铁沉积导致氧化应激,进而造成心肌线粒体损伤和心功能障碍,而半夏厚朴汤处理可以降低氧化应激损伤从而改善心功能[5-6]。内质网在对缺血—再灌注损伤的适应性反应中发挥核心作用,而CIH的缺氧/复氧变化类似于缺血—再灌注[12]。同时有研究证实,CIH也可以造成大鼠ERS水平的升高[13]。目前对于ERS在OSA病理生理反应中的作用研究较少,且半夏厚朴汤是否能通过降低ERS反应改善CIH导致的心脏损伤尚不明确。故本实验在此基础上探讨半夏厚朴汤发挥预防心脏损伤的具体机制,进一步研究半夏厚朴汤与ERS反应之间的调控关系。
ERS参与多种心血管疾病的发生和发展,包括缺血性心脏病、心力衰竭、动脉粥样硬化等[14]。有研究显示,大鼠心肌缺血再灌注损伤时心肌ERS可显著激活,而ERS预处理可以减轻糖尿病大鼠心肌缺血再灌注损伤[15-16]。当细胞受到缺血、缺氧的刺激时,未折叠蛋白和错误蛋白在内质网中积累,触发未折叠蛋白反应称为ERS[17]。长期的ERS可造成促凋亡蛋白GRP78、CHOP升高,通过ERO1L-肌醇1,4,5-三磷酸受体途径触发钙依赖性ERS诱导细胞凋亡和细胞的功能障碍[18-19]。本研究结果显示,半夏厚朴汤处理3周后,小鼠心功能明显改善,心肌酶水平下降,心肌细胞凋亡情况减轻,说明半夏厚朴汤可以改善CIH引起的小鼠心脏损伤。后续结果表明,CIH暴露可以导致ERS关键蛋白GRP78、CHOP、ERO1L的表达明显上升,ERS水平升高,而半夏厚朴汤可以下调这些蛋白的表达,这说明半夏厚朴汤可能是通过抑制ERS发挥心脏保护作用。
综上所述,半夏厚朴汤可以改善CIH暴露引起的小鼠心功能障碍,其作用机制可能与抑制ERS反应、减轻细胞凋亡有关,这为半夏厚朴汤治疗OSA引起的心脏损伤提供了新的实验基础和治疗思路。
