SMILE术中大Kappa角的调整对术后全眼高阶像差的影响△
2023-10-07康婷婷尹连荣刘沙沙吕文豪
康婷婷 尹连荣 刘沙沙 王 瑶 吕文豪
近年来,随着角膜屈光手术的发展和广泛应用,越来越多的屈光不正患者通过手术获得了较好的裸眼视力。飞秒激光小切口角膜基质透镜取出术(SMILE)是目前世界上最先进的角膜屈光手术方式之一,因其具有较高的安全性、有效性、稳定性、可预测性而广受欢迎[1]。视轴与角膜的交点是角膜屈光手术最理想的切削中心,以视轴代替瞳孔轴作为切削中心是优化视觉效果的关键[2]。但SMILE缺乏眼球追踪系统,视轴无法准确定位。研究发现,当Kappa角≥0.2 mm时,瞳孔中心定位法易导致偏中心切削,术后引入更多高阶像差(HOA),出现眩光、夜视力下降等现象[3-4]。因此,术前评估Kappa角,术中对大Kappa角患者进行Kappa角调整,对避免大Kappa角患者术后视觉质量下降具有重要意义。本研究拟分析当Kappa角≥0.2 mm时,SMILE术中进行Kappa角调整对术后全眼高阶像差HOA的影响,以期为大Kappa角患者SMILE术后获得更好的视觉质量提供参考。
1 资料与方法
1.1 一般资料
选取2021年1月至6月于中国中医科学院眼科医院屈光手术科行SMILE的近视及近视散光患者162例(162眼),均纳入右眼进行研究。依据Sirius眼前节分析系统测量术前Kappa角(Kappa角大小定义为角膜顶点距瞳孔中心的位移距离,角膜顶点默认为视轴与角膜前表面的交点),将Kappa角≥0.2 mm 者作为大Kappa角组,Kappa角<0.2 mm 者作为小Kappa角组。大Kappa角组75例(75眼),男32例,女43例,年龄18~45(28.64±8.44)岁,等效球镜度数(SE)为-2.00~-10.25(-6.07±2.46)D,裸眼视力(UCVA)为0.80~2.00(1.74±0.32)。小Kappa角组87例(87眼),男27例,女60例,年龄18~44(28.74±8.24)岁,SE为-1.50~-10.75(-5.85±2.12)D,UCVA为0.70~2.00(1.78±0.29)。两组患者性别、年龄、SE、UCVA比较,差异均无统计学意义(均为P>0.05),具有可比性。纳入与排除标准参见我国SMILE手术规范专家共识(2018年)中全飞秒手术适应证与禁忌证[5],且患者柱镜度数<-1.50 D。本研究遵守《赫尔辛基宣言》,并经我院伦理委员会批准(批号:YKEC-KT-2018-006),所有患者均知情同意并签署知情同意书。
1.2 手术方法及围手术期用药
术前3 d予3 g·L-1加替沙星滴眼液(中国大冢制药有限公司)及1 g·L-1普拉洛芬滴眼液(山东海山药业有限公司)滴眼,每天4次,每次1滴。所有手术均由同一位医师完成。手术当日使用5 g·L-1丙美卡因滴眼液(南京瑞年百思特)行表面麻醉3次,消毒铺巾,置开睑器开睑。当Kappa角≥0.2 mm时,在吸负压前嘱患者双眼睁开观察绿指示灯,此时,手术医师可以看到角膜顶点处的绿光和显微镜下的瞳孔中心的反射,根据术前角膜地形图Kappa角大小和方向,显微镜下调整负压吸引环的中心与角膜顶点重合;当Kappa角<0.2 mm时,负压吸引环的中心与瞳孔中心对齐。对位满意后,启动负压,使用VisuMax 500-Hz飞秒激光系统(德国Carl Zeiss公司)制作透镜及角膜切口,激光能量120 nJ,点间距4.5 μm,光斑大小1.5 μm,角膜帽厚度 110~130 μm,光学直径6.0~6.5 mm,120°方位 2 mm 边切口,制作微透镜后分离取出透镜。术后所有患者给予3 g·L-1加替沙星滴眼液(中国大冢制药有限公司)滴眼,每天4次,共用1周;5 g·L-1氯替泼诺滴滴眼液(山东博士伦福瑞达制药有限公司)滴眼,每天4次,共用2周;1 g·L-1玻璃酸钠滴眼液(德国URSAPHARM Arzneimittel GmbH)滴眼,每天6次,共用6个月。
1.3 检查项目及随访
所有患者均进行屈光手术术前检查,术后3个月、6个月及1年进行随访。使用综合验光仪(日本尼德克公司,型号:AOS-1500)获得红绿平衡下的最佳矫正视力(BCVA)、SE、球镜度数、柱镜度数,Sirius眼前节分析系统 (意大利C.S.O SRL公司,型号:SIRIUS SYSTEM) 测量Kappa角和视轴。波前像差仪(法国Imagine Eyes SA,型号:irx3)测量6 mm瞳孔直径下全眼总HOA、球差、彗差及三叶草差,像差数值以Zernike系数表示。对手术有效性、安全性和可预测性进行分析,有效性指数=术后平均UCVA/术前平均BCVA,安全性指数=术后平均BCVA/术前平均BCVA,可预测性用术后SE在±0.5 D和±1.0 D 的眼数百分比来表示。
1.4 统计学分析
采用SPSS 22.0统计软件分析数据。对计量资料进行正态性检验(Kolmogoron-Smirnov检验),数据符合正态分布,用均数±标准差表示。组内手术前后不同时间点UCVA、BCVA、SE、球镜度数、柱镜度数、总HOA、球差、彗差、三叶草差比较采用重复测量方差分析,两两比较运用LSD-t检验。组间计量资料比较采用独立样本t检验,组间计数资料比较采用卡方检验。小Kappa角及调整后的大Kappa角与术后各时间点HOA的相关关系采用Person相关分析;计数资料比较采用卡方检验。检验水准:α=0.05。
2 结果
2.1 两组患者手术前后不同时间点屈光指标比较
与术前比较,小Kappa角组和大Kappa角组患者术后各时间点UCVA均明显改善,SE、球镜度数、柱镜度数均明显降低,差异均有统计学意义(均为P<0.05)。小Kappa角组和大Kappa角组患者术后各时间点BCVA与术前比较,差异均无统计学意义(均为P>0.05)。两组患者间术前及术后各时间点UCVA、BCVA、SE、球镜度数、柱镜度数比较,差异均无统计学意义(均为P>0.05)(表1)。
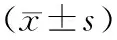
表1 两组患者术前及术后不同时间点UCVA、BCVA、SE、球镜度数、柱镜度数比较
2.2 两组患者术后有效性、安全性、可预测性比较
术后3个月、6个月、1年,小Kappa角组与大Kappa角组患者间手术有效性指数和安全性指数相比,差异均无统计学意义(均为P>0.05);两组患者间术后3个月、6个月、1年的残余SE在±0.5 D和±1.0 D的眼数百分比相比,差异均无统计学意义(均为P>0.05)(表2和表3)。
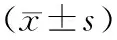
表2 两组患者术后不同时间有效性指数和安全性指数比较

表3 两组患者术后不同时间可预测性比较 (眼)
2.3 两组患者手术前后各项HOA比较
与术前比较,小Kappa角组和大Kappa角组患者术后各时间点总HOA、球差、彗差均升高,差异均有统计学意义(均为P<0.05);两组患者三叶草差手术前后相比差异均无统计学意义(均为P>0.05)。两组患者间术前及术后各时间点总HOA、球差、彗差、三叶草差比较,差异均无统计学意义(均为P>0.05)(表4)。
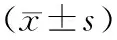
表4 两组患者术前及术后不同时间点总HOA、球差、彗差、三叶草差比较
2.4 小Kappa角及调整后的大Kappa角与术后各时间点HOA的相关性
术后3个月、6个月、1年,小Kappa角组Kappa角大小与总HOA、球差、彗差、三叶草差均无明显相关性(均为P>0.05)。术后3个月、6个月、1年,大Kappa角组调整后的Kappa角大小与总HOA、球差、彗差、三叶草差均无明显相关性(均为P>0.05)。
3 讨论
Kappa角是视轴(光源与视网膜黄斑中心的连线)与瞳孔轴(与角膜垂直并连接瞳孔中心的连线)的夹角。Kappa角越大,视轴与瞳孔中心的距离越大,术中偏中心切削的概率越高,术源性HOA越大,术后视觉质量下降[6]。因此,在SMILE中,尤其对于大Kappa角患者,应根据Kappa角大小及方向进行调整,使手术切削中心尽可能接近视轴。本研究旨在分析当Kappa角≥0.2 mm时,术中调整Kappa角后,Kappa角大小对术后全眼HOA及手术有效性、安全性、可预测性的影响。
本研究中,小Kappa角组和大Kappa角组患者术后UCVA均明显提高,术后各时间点屈光状态稳定,残余度数较小。两组患者间术后有效性指数、安全性指数、可预测性比较差异均无统计学意义(均为P>0.05)。说明调整Kappa角后,大Kappa角患者可获得与小Kappa角患者一样的术后视觉质量,且具有良好的手术有效性、安全性、可预测性。
像差是人眼看到的实际物象与理想物象间的差别,其与人眼视觉质量关系密切,波前像差是衡量视觉质量的客观指标。部分角膜屈光术后患者出现眩光、光晕、夜视力下降等问题,这与术后HOA(主要是球差、彗差)的增加密切相关[7]。本研究中两组患者术后各时间点总HOA、球差、彗差均较术前增加,而术后三叶草差无明显变化,这与既往研究结果相同[8]。影响术后HOA产生的因素主要有手术方式、角膜愈合、术前屈光度、角膜偏中心切削、角膜生物力学等。SMILE不需要制作角膜瓣,只有2 mm微切口,激光能量均匀,角膜生物力学稳定,术后角膜皱缩反应小,比FS-LASIK等术式术后引入像差更小[9]。SMILE术后球差增加,考虑与术后角膜曲率变小,角膜形状相对变平,通过角膜中央光线与周边光线无法聚集在同一点相关。SMILE切口通常位于角膜上方,角膜愈合可能会引起角膜上下方不对称,这可能是术后垂直彗差增加的原因。本研究中所有患者均纳入右眼进行研究且术中切口方向均一致,排除了眼别和切口对像差的影响。
邵婷等[10]研究发现,采用瞳孔中心定位法,SMILE术中未对Kappa角进行调整时,大Kappa角组(Kappa角≥0.2 mm)患者比小Kappa角组(Kappa角<0.2 mm)患者引入更多HOA,大Kappa角组患者总HOA、球差、彗差均显著大于小Kappa角组患者;相关性分析发现,Kappa角越大患者术后HOA越大。本研究中两组患者间术后各时间点总HOA、球差、彗差、三叶草差比较,差异均无统计学意义(均为P>0.05),小Kappa角及调整后的大Kappa角与SMILE术后各项HOA均无相关关系,这可能是因为大Kappa角组患者调整Kappa角后,手术切削中心更接近视轴,减少了偏中心切削,避免引入更大的术源性HOA,说明对大Kappa角进行调整后,患者术后同样可获得较好的视觉质量。Chan等[11]研究发现,LASIK术中调整Kappa角可明显减少偏中心切削。因此,SMILE术中,对于大Kappa角患者应优先考虑调整Kappa角,减少偏中心切削可能性。
在角膜屈光手术中,中心定位的意义在于避免术中偏中心切削,以减少术后出现视敏度降低、眩光、夜视力下降等视觉质量问题。但SMILE设备因缺乏眼球跟踪系统及虹膜识别技术,其对切削中心的准确定位依赖于患者的配合以及术者的经验[12-13]。视轴与角膜的交点是最理想的切削中心,但因视轴无法直接追踪,一般选择瞳孔中心、角膜顶点、共轴角膜反光点为切削中心[14-16]。但瞳孔大小受光线明暗影响较大,瞳孔中心的位置也会随其变化而偏移。Wong等[17]研究发现,SMILE术中对于Kappa角≥0.2 mm的患者采用瞳孔中心定位法,术后患者视觉质量明显下降,并建议对于大Kappa角患者不宜采用瞳孔中心定位法。单纯以瞳孔中心为扫描中心,缺乏对Kappa角个性化考虑,大Kappa角患者易造成透镜偏心。有研究报道,在角膜屈光手术中,对于大Kappa角患者,将共轴角膜反光点作为切削中心,患者术后对比敏感度、夜间视力、高阶像差等均明显优于瞳孔中心定位法[15]。Arbelaez等[18]对52例行LASIK治疗近视的大Kappa角患者术后视觉质量进行比较,发现选择更靠近视轴的角膜顶点为切削中心患者术后HOA和角膜非球面数值更小。因此,对于行SMILE矫正近视的大Kappa角患者,我们应优先考虑调整Kappa角,使切削中心尽可能靠近视轴,尽量避免偏中心切削所导致的术后视觉质量下降。本研究纳入的患眼柱镜度数均<-1.50 D,避免了因高度散光造成的矫正偏差。
4 结论
SMILE具有良好的安全性、可预测性与稳定性,当Kappa角≥0.2 mm时,术中调整Kappa角后,术后患者HOA不受Kappa角大小的影响,不同大小Kappa角患者术后均可以获得同样良好的视觉质量。术中对Kappa角的调整矫正了视轴与瞳孔轴间的偏移,减少了术后偏中心切削的可能性,降低了HOA的产生。临床中建议术者应充分考虑患者Kappa角因素,制定个性化手术方案,尽量减少术源性HOA的产生,力求为每一位患者提供完美的术后视觉质量。
