α-硫辛酸对蓝光诱导损伤的ARPE-19细胞的保护作用△
2023-10-07余洋洋周文杰俞永珍章梦一程天豪邹秀兰邹玉平
余洋洋 周文杰 俞永珍 章梦一 程天豪 邹秀兰 邹玉平
蓝光为400~500 nm的短波长可见光[1]。已有证据证明短波长蓝光对视网膜具有更大的光毒性[2]。年龄相关性黄斑变性(AMD)是一种由于黄斑退化而导致视力丧失的眼科疾病,它最常发生在50岁以上的人群中。在早期阶段,视力障碍程度并不严重,但中心视力逐渐丧失,影响日常生活[3]。有研究表明,暴露在蓝光下可能会导致 AMD 或其他视网膜病变的发展[4]。α-硫辛酸(ALA)是一种作用强大而广泛的抗氧化剂[5],它除了直接的抗氧化作用以外,对于其他抗氧化剂如维生素C、D及辅酶Q10的抗氧化效应也具有加强作用,临床已广泛用于治疗和预防心脏病、糖尿病等多种疾病。本研究拟通过观察ALA对蓝光诱导损伤的人视网膜色素上皮细胞(ARPE-19)的保护作用,为蓝光所致视网膜光损伤的临床治疗提供实验依据。
1 材料与方法
1.1 主要试剂与仪器
ARPE-19细胞(广州莱赛生物科技有限公司);胎牛血清(FBS,以色列Bioind公司)、DMEM/F12培养基(美国Gibco公司)、CCK-8试剂盒(上海东仁化学科技有限公司),Annexin V-FITC/PI细胞凋亡检测试剂盒(爱必信上海生物科技有限公司),活性氧(ROS)检测试剂盒(北京索莱宝科技有限公司)。低温高速离心机(广州火元医疗器械有限公司),酶标仪(美国赛默飞世尔科技有限公司),FACSAriaⅡ型流式细胞检测仪(美国BD公司),实时荧光定量PCR(RT-qPCR)仪(澳大利亚Corbett Life Science公司),微量核酸定量仪(北京天根生化科技公司)。
1.2 方法
1.2.1 药品配制
ALA溶解于含体积分数10%FBS的培养基中,使溶解于培养基后的ALA终浓度为150 μmol·L-1,保存在4 ℃冰箱中。
1.2.2 细胞培养
ARPE-19细胞放置在37 ℃、含体积分数5%CO2的培养箱中,用已配制的新鲜的含体积分数10%FBS及10 g·L-1双抗的DMEM/F12培养基培养。分别按每孔约4 000个和5×106个的细胞密度接种于96孔板和6孔板中,接种体积分别为0.2 mL和2.0 mL;置于37 ℃、含体积分数5%CO2的培养箱内。在培养过程中,倒置显微镜下观察,选生长状况良好的细胞进行分组处理。
1.2.3 细胞分组
蓝光(456 nm)照射ARPE-19细胞损伤模型造模方法参考课题组前期研究及相关文献[6-8],选定蓝光照射ARPE-19细胞时间为12 h。实验分为4组,正常组(N组): 体外培养ARPE-19细胞;药物组(D组):含体积分数10% FBS、10 g·L-1双抗、ALA(药物终浓度为150 μmol·L-1)的DMEM/F12培养基孵育体外培养的ARPE-19细胞36 h;光照组(L组):含体积分数10% FBS、10 g·L-1双抗的DMEM/F12培养基孵育体外培养的ARPE-19细胞,并使用光照强度为1×104lx的LED灯蓝光照射12 h;药物+光照组(D+L组):先将体外培养的ARPE-19细胞进行D组处理后,再使用光照强度为1×104lx的LED灯蓝光照射12 h。
1.2.4 构建ARPE-19细胞光损伤模型
将3~6代ARPE-19细胞培养于细胞板,光照在培养箱内密闭进行,无自然光干扰。以自制蓝光LED作为光源,悬空于细胞之上10 cm处,采取直落式照射。用多光源照度计(中国德力西公司)测量细胞生长平面光照强度。已有研究证实,光照强度为1×104lx,照射细胞12 h即可产生细胞光损伤[9]。光照时,细胞平面的温度变化控制在 36.5~37.5 ℃,排除温度升高引起细胞光热损伤的可能。
1.2.5 倒置显微镜下观察ARPE-19细胞形态结构
取对数生长期的ARPE-19细胞,胰蛋白酶消化后制成单细胞悬液,于细胞培养瓶中培养。造模结束后,倒置显微镜下观察N组、D组、L组及D+L组细胞形态。
1.2.6 CCK-8法检测细胞活性
取ARPE-19细胞消化、离心,以每孔4×103个细胞接种于96孔板上,置于37 ℃细胞培养箱中孵育。在细胞贴壁生长后弃上清,换无血清DMEM/F12培养基,培养箱中孵育过夜,使细胞同步化。各组造模结束后终止培养,每孔加入10 μL CCK-8溶液+90 μL DMEM/F12培养基,培养箱中孵育2 h。96孔板,每组5个复孔,同时设立空白组(即96孔板中的无细胞的孔),酶标仪检测450 nm处各孔的吸光度(OD),实验重复3次,取平均值。计算数据并绘制细胞存活率图,细胞存活率=(OD实验组-OD空白组)/(OD正常对照组-OD空白组)×100%。
1.2.7 流式细胞仪检测细胞凋亡率
Annexin V-FITC/PI双染色法测定细胞凋亡率。ARPE-19细胞经PBS清洗,胰蛋白酶消化液消化后,按每孔3×105个细胞接种于6孔板上,培养箱内培养24 h,分组处理后继续培养24 h。弃上清,PBS洗涤,加入适量胰蛋白酶消化液消化,2 min后加入相同体积培养基终止消化,将细胞悬液移入相应离心管中,1 200 r·min-1离心5 min,弃上清,用PBS重悬细胞并计数。取8×104个细胞,1 200 r·min-1离心5 min后,弃上清,此步骤重复2次;将细胞悬浮于400 μL Annexin V结合液中,避光加入5 μL FITC,4 ℃ 放置15 min;上机前5 min避光加10 μL PI,在1 h内完成流式细胞仪检测。
1.2.8 倒置荧光显微镜检测细胞ROS水平
取对数生长期的ARPE-19细胞,按每孔5×103个细胞接种于48孔板上,待细胞贴壁后分组造模。按ROS检测试剂盒操作说明检测各组细胞ROS水平。造模完成后,弃上清,每孔加入120 μL 2 μmol·L-1DCFH-DA,37 ℃细胞培养箱内孵育20 min,弃DCFH-DA,无血清培养基洗涤2遍,加入100 μL PBS,倒置荧光显微镜下检测ROS水平。设置倒置荧光显微镜激发波长为488 nm,发射波长为525 nm。
1.2.9 RT-qPCR检测细胞mRNA表达
应用Trizol试剂提取经过不同处理后各组 ARPE-19细胞总RNA。使用第一链cDNA合成试剂盒(美国赛默飞世尔科技有限公司)将总RNA反转录为cDNA,使用SYBR Premix Ex TaqTM试剂盒行RT-qPCR检测,所有操作均严格按照试剂盒说明书进行。设定PCR程序:95 ℃ 预变性10 min,95 ℃ 10 s,55 ℃ 20 s,72 ℃ 35 s,扩增40个循环。使用2-ΔΔCt方法检测细胞mRNA表达水平。用β-actin作为内源对照,检测ARPE-19细胞核因子E2相关因子2(Nrf2)、谷胱甘肽巯基转移酶(GST)、NAD(P)H:醌氧化还原酶1(NQO1)、血红素氧合酶-1(HO-1) mRNA转录水平;Nrf2上下游引物序列分别为:5’-TTCTGTTGCTCAGGTAGCCCC-3’,5’-TCAGTTTGGCTTCTGGACTTGG-3’;GST上下游引物序列分别为:5’-ACTTCATCTCCCGCTTTGTG-3’,5’-AGGTCTTGCCTCCCTGGT-3’;NQO1上下游引物序列分别为:5’-TATCCTGCCGAGTCTGTTCTG-3’,5’-ACTGGAATATCACAAGGTCTGC-3’;HO-1上下游引物序列分别为:5’-CCAGCGGGCCAGCAACAAAGTGC-3’,5’-AAGCCTTCAGTGCCCACGGTAAGG- 3’;β-actin上下游引物序列分别为:5’-CCACACCTTCTACAATGAGC-3’,5’-GGTCTCAAACATGATCTGGG-3’。
1.2.10 Western blot检测细胞蛋白表达水平
各组细胞造模完成后,向各组细胞加入适量的蛋白裂解液(含PMSF),冰上裂解30 min,将细胞裂解液移入EP管中,4 ℃离心15 min,采用BCA法对样品进行蛋白定量检测。取40 μg蛋白样品进行SDS-PAGE电泳后,将蛋白转移至PVDF膜上,5 g·L-1脱脂奶粉室温下封闭1 h,加入兔抗细胞天冬氨酸特异性半胱氨酸蛋白酶-3(Caspase-3)或兔抗Nrf2或兔抗NQO-1一抗于4 ℃过夜,二抗室温孵育2 h,以β-actin作为内参。暗室下加发光液并进行曝光。采用ImageJ软件测定ARPE-19、Caspase-3、Nrf2、NQO1蛋白表达水平。
1.3 统计学分析

2 结果
2.1 各组ARPE-19细胞形态结构
N组及D组细胞均呈贴壁生长,分布均匀,形态清晰;与N组相比,L组细胞皱缩、变小、变圆,失去正常形态,部分细胞不能贴壁生长;与L组相比,D+L组细胞形态改善,大部分细胞呈梭形贴壁生长,细胞轮廓较清晰,小部分细胞失去正常形态结构(图1)。
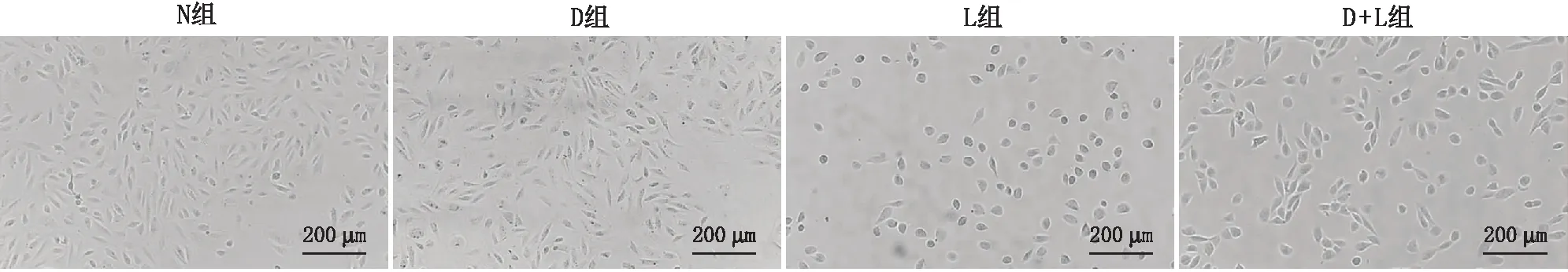
图1 倒置显微镜下观察各组细胞形态结构
2.2 CCK-8法检测细胞存活率
N组、D组、L组、D+L组细胞存活率差异有统计学意义(P<0.05)。两两比较结果显示,与N组相比,D组细胞存活率无明显变化(P>0.05);与N组相比,L组细胞存活率降低(P<0.05);与L组相比,D+L组细胞存活率升高(P<0.05)(表1)。

表1 各组APRE-19细胞存活率、凋亡率、ROS水平
2.3 ALA对蓝光诱导的ARPE-19细胞凋亡率的影响
D组与N组ARPE-19细胞形态无差异,细胞存活率差异无统计学意义(P>0.05),证明药物ALA对ARPE-19细胞无损伤作用。在后续的实验中仅设立N组、L组和D+L组。N组、L组和D+L组细胞凋亡率差异有统计学意义(P<0.05)。两两比较结果显示,与N组相比,L组细胞凋亡率升高(P<0.05);与L组相比,D+L组细胞凋亡率降低(P<0.05)(表1、图2)。

图2 流式细胞仪检测各组细胞凋亡率
2.4 倒置荧光显微镜检测细胞ROS水平
N组、L组和D+L组细胞ROS水平差异有统计学意义(P<0.05)。两两比较结果显示,与N组相比,L组细胞ROS水平升高(P<0.05);与L组相比,D+L组细胞ROS水平降低(P<0.05)(表1、图3)。

图3 倒置荧光显微镜检测细胞ROS水平
2.5 RT-qPCR检测各组细胞mRNA表达
N组、L组和D+L组3组细胞间Nrf2、GST、NQO-1、HO-1的mRNA相对表达量差异均有统计学意义(均为P<0.05)。两两比较结果显示,与N组相比,L组细胞NQO-1、HO-1的mRNA相对表达量均升高(均为P<0.05),Nrf2、GST的mRNA相对表达量均有所升高,但差异均无统计学意义(均为P>0.05);与L组相比,D+L组细胞Nrf2、GST、NQO-1、HO-1的mRNA相对表达量均升高(均为P<0.05)(表2)。

表2 各组ARPE-19细胞Nrf2 、GST、NQO-1、HO-1的mRNA相对表达量
2.6 Western blot检测各组细胞蛋白表达
N组、L组和D+L组3组细胞间Caspase-3、Nrf2、NQO-1蛋白相对表达量差异均有统计学意义(均为P<0.05)。两两比较结果显示,与N组相比,L组细胞Caspase-3、Nrf2蛋白相对表达量均升高(均为P<0.05);与L组相比,D+L组细胞Caspase-3蛋白相对表达量降低(P<0.05), Nrf2、NQO-1蛋白相对表达量均升高(均为P<0.05) (图4、表3)。

表3 各组ARPE-19细胞Caspase-3、Nrf2、NQO-1蛋白相对表达量

图4 各组ARPE-19细胞Caspase-3、Nrf2、NQO-1蛋白表达情况
3 讨论
日常生活中常见的短波长高强度蓝光,可穿透角膜和晶状体直接到达视网膜,对视网膜造成光化学损伤[10]。其中,光感受器和视网膜色素上皮细胞最受关注,主要是因为这些细胞类型能够表达吸收蓝光的光敏剂,从而对视网膜造成损伤[11]。因此,本研究中选用ARPE-19细胞作为研究对象,以蓝光(456 nm)损伤ARPE-19细胞进行造模研究药物ALA的保护作用。
本研究中D组采用150 μmol·L-1ALA孵育ARPE-19细胞36 h后,其细胞形态和存活率与N组相比均未发生明显变化,此结果与Jia等[12]研究结果一致,证明ALA对ARPE-19细胞无毒副作用。在此基础上,后续实验仅检测N组、L组以及D+L组,进一步研究ALA的保护性作用。我们观察到与N组相比,L组ARPE-19细胞在蓝光照射后失去正常形态,细胞存活率下降,细胞凋亡率和ROS水平明显上升,结合相关文献[13]中蓝光损伤模型指标,说明我们采取的造模方法效果达到预期。与L组相比,D+L组添加了ALA的ARPE-19细胞再次暴露在蓝光下,细胞形态明显改善,大部分细胞呈梭形贴壁生长,细胞轮廓较清晰,仅小部分细胞失去正常形态结构,细胞的存活率明显提高,凋亡率与ROS水平降低。以上结果表明,ALA能够有效保护ARPE-19免受蓝光损伤。
视网膜细胞中含有吸收接近蓝光(400~500 nm)的发色团,其与蓝光相互作用后产生大量的ROS[4]。Pilat等[14]研究结果表明,蓝光诱导的氧化应激可上调抗氧化酶HO-1的表达,表明视网膜细胞对于蓝光损伤存在保护应答机制。本研究进一步进行RT-qPCR检测和Western blot检测,结果显示,L组细胞抗氧化酶NQO-1、HO-1 mRNA相对表达量以及Nrf2蛋白相对表达量均较N组有所上升,表明ARPE-19细胞对蓝光照射产生的氧化应激起保护作用,这与上述研究结果相符。与N组相比,L组ARPE-19细胞存活率下降、ROS水平升高、凋亡蛋白Caspase-3相对表达量增多,推测为ARPE-19细胞的保护应答机制不足以应对蓝光照射所造成的氧化应激损伤;而与L组相比,添加了ALA的D+L组ARPE-19细胞再次暴露在蓝光下照射时,细胞存活率得到明显提高,Nrf2、GST、NQO1、HO-1 mRNA相对表达量和保护性蛋白Nrf2、NQO-1相对表达量均明显升高,Caspase-3蛋白表达相对量明显下降,我们推测ALA通过促进ARPE-19细胞的保护应答机制进而提高ARPE-19细胞对蓝光照射的防护能力。
Nrf2作为内源性抗氧化应激通路的信号分子,在氧化应激反应应答中起关键作用[15]。静息状态下,Nrf2在细胞质中与Keap1结合,经泛素化-蛋白酶体降解。氧化应激状态下,Nrf2被活化,从Keap1中释放并转移至细胞核,与核内的抗氧化反应元件结合,调节多种抗氧化酶及保护性蛋白如GST、NQO1、HO-1等的表达水平,提高 SOD 等抗氧化酶表达水平,维持细胞内氧化还原的平衡状态的同时抑制细胞凋亡[16]。在其他领域已有研究表明,ALA通过激活Nrf2/HO-1通路发挥抗氧化作用,抑制甲氨蝶呤诱导的大鼠肝星状细胞活化[17]。说明ALA可能通过Nrf2相关的内源性抗氧化应激通路发挥对蓝光损伤ARPE-19细胞的保护作用,下一步拟行相关研究。
4 结论
蓝光会导致ARPEA-19细胞产生氧化应激损伤并最终导致细胞凋亡,而ALA能够增强ARPE-19细胞对蓝光损伤的抗氧化保护作用。本研究为蓝光所致视网膜光损伤的防护措施研发提供了新思路。
