蒸馏水促进人晶状体上皮细胞(SRA01/04)凋亡并抑制其增殖、迁移、侵袭及转分化能力研究
2023-10-07程心璇刘亚军张文文陈菲菲何自芳解正高
程心璇 刘亚军 张文文 陈菲菲 何自芳 张 司 解正高
后囊膜混浊(PCO)是白内障手术的常见并发症,PCO通常与术后残留晶状体上皮细胞 (LECs)的病理进展有关,包括LECs的增殖、迁移和上皮-间质转化(EMT)[1]。目前PCO常采用的治疗方法为Nd:YAG激光囊膜切开术,但有发生各种并发症的风险[2]。因此,术中药物预防PCO仍是目前研究的重要目标。既往已研究多种药物预防PCO的发展,然而由于眼内使用药物的高安全标准,现在仍无药物对预防PCO足够有效和安全。蒸馏水(DW)价格便宜,使用安全,并可通过滴注平衡盐溶液迅速被中和,已作为“药物”被用来研究其对继发性囊膜混浊的影响。DW通过低渗透压,使细胞吸收水分引起细胞破裂而起到预防继发性囊膜混浊的作用[3]。但有研究发现,细胞在低渗溶液中具有调节性容积减小的作用,可防止细胞胀破[4]。目前,DW处理后未破裂的LECs,其凋亡、增殖、迁移及EMT是否有改变尚未足够了解。因此,本研究探索DW对LECs的增殖、迁移及EMT的影响,为DW用于预防继发性囊膜混浊提供实验依据。
1 材料与方法
1.1 实验细胞与主要试剂、仪器
人晶状体上皮细胞系SRA01/04由上海通派有限公司提供。胎牛血清、胰蛋白酶(GIBCO公司);青霉素及链霉素(南京凯基生物);Transwell 细胞培养小室(赛默飞公司);Annexin V-FITC/PI凋亡检测试剂盒(Biolegend公司);CCK-8试剂盒、5-乙炔基-2’-脱氧尿苷(EdU)、BCA试剂盒(碧云天公司);RIPA试剂(贝斯特生物公司);羊抗兔辣根过氧化物酶标记的二抗(南京百世生物科技有限公司);显影液试剂(上海翊圣生物公司);α-平滑肌肌动蛋白(α-SMA)(Proteintech公司);Bcl-2抗体、Bax抗体、Caspase-9抗体、N-钙黏蛋白(N-cadherin)抗体、 纤连蛋白(Fibronectin)抗体、 波形蛋白(Vimentin)抗体(Abcam公司);流式细胞仪(BD公司);凝胶成像仪(上海勤翔公司);荧光显微镜(OLYMPUS公司)。
1.2 方法
1.2.1 细胞培养与处理
SRA01/04细胞在DMEM / F12培养基中生长,培养基添加体积分数10%胎牛血清和10 g·L-1青霉素以及10 g·L-1链霉素,细胞在含体积分数5% CO2和37 ℃的细胞培养箱中正常生长,每3 d更换一次培养液。取贴壁培养的细胞,用2.5 g·L-1胰蛋白酶(含EDTA)37 ℃消化细胞1 min后,1 000 r·min-1室温离心5 min,弃上清,加入4 mL新鲜培养液,吹打混匀。取细胞悬液18 μL,加2 μL的4 g·L-1台盼蓝溶液,进行细胞计数,细胞存活率需在90%以上。调节细胞密度至1×105个·mL-1,取6孔板,加入细胞悬液,每孔2 mL,于37 ℃、含体积分数5% CO2的细胞培养箱中培养过夜。
1.2.2 实验分组
细胞贴壁后,将细胞随机分为6组,对照组不作处理,其余细胞弃去培养液,BBS组采用BBS处理3 min;DW组分别采用DW处理30 s(DW 30 s组)、1 min(DW 1 min组)、2 min(DW 2 min组)、3 min(DW 3 min组)。除对照组外,其余组加入2 mL细胞培养液终止作用,继续培养24 h。
1.2.3 流式细胞仪检测
采用Annexin V-FITC/PI凋亡检测试剂盒测定SRA01/04细胞的凋亡。分组处理细胞,用不含EDTA的胰蛋白酶消化各组细胞并收集。PBS洗涤细胞2次,再使其重新悬浮于缓冲液中。细胞浓度为1×105个·mL-1,缓冲液500 μL,分别添加Annexin V-FITC/PI和PI各5 μL,室温下黑暗中放置15 min。最后使用流式细胞仪分析伴随光散射的荧光信号。
1.2.4 EdU检测
为评估DW对LECs增殖的影响,进行EdU染色。将SRA01/04细胞接种于6孔板(1×105个·mL-1),分组处理后,用含20 μmol·L-1EdU的新鲜培养液培养细胞2 h。之后,将细胞固定在40 g·L-1多聚甲醛中15 min,PBS洗涤3次,每次5 min,用含FITC的Apollo染色反应液于黑暗中孵育30 min,采用DAPI孵育细胞并贴壁,最后用共聚焦荧光显微镜捕获EdU阳性细胞,ImageJ软件计数。
1.2.5 CCK-8实验检测
采用CCK-8实验检测DW对SRA01/04细胞增殖的影响。将分组处理后的细胞分别接种于96孔板中,每组6个复孔,培养箱培养24 h,然后分别加入CCK-8试剂10 μL和含体积分数0.5%胎牛血清的培养液100 μL,37 ℃孵育2 h,分光光度计检测450 nm光密度。
1.2.6 Western blot检测
SRA01/04细胞分组处理后采用RIPA试剂裂解,采用BCA试剂盒对总蛋白进行定量。采用100 g·L-1电泳凝胶分离,之后将蛋白质转移至PVDF膜上,体积分数5%脱脂牛奶封闭,孵育一抗α-SMA、N-cadherin、Fibronectin、Vimentin、Bax、Bcl-2、Caspase-9在4 ℃过夜。采用羊抗兔辣根过氧化物酶标记的二抗在室温下孵育1 h。最后,采用显影液试剂暴露条带,并使用ImageJ软件进行定量分析。
1.2.7 细胞划痕实验
将SRA01/04细胞接种于6孔板中,生长至60%~80%融合。更换培养基,用不含血清的培养基再培养18 h。使用1个200 μL移液管尖端于每孔中央沿直线刮擦细胞单层,采用PBS洗涤受伤的单层以除去分离的细胞和碎片,分组处理后,采用无血清培养基培养48 h,显微镜测量伤口闭合情况,ImageJ软件测定和分析细胞迁移的距离。数据基于平均距离的百分比进行量化;0 h的伤口被认为是100%的平均距离。
1.2.8 Transwell迁移和侵袭分析
将SRA01/04细胞接种于孔径为8 μm的24孔板的Transwell小室的内室中,用于细胞迁移测定。每孔4×104个细胞,使用DMEM/F12无血清培养,在下部孔中,使用含体积分数10% FBS的DMEM作为化学引诱剂。细胞经过分组处理后培养24 h,PBS洗涤3次,40 g·L-1多聚甲醛固定10 min并用10 g·L-1结晶紫染色15 min,观察染色的细胞并在显微镜下拍照。随机选择6个视野,使用ImageJ软件进行细胞计数。细胞侵袭的测定:Transwell小室采用Matrigel预涂覆,其余实验程序与用于迁移测定的程序相同。
1.3 统计学处理
使用GraphPad Prism 5.0进行统计分析。所有实验均重复3次或3次以上。使用单因素方差分析(ANOVA)进行多组间的比较,组间两两比较采用Tukey检验,检验水准:α=0.05。
2 结果
2.1 DW对SRA01/04细胞凋亡及凋亡相关蛋白的作用
使用流式细胞仪检测SRA01/04细胞凋亡情况。早期和晚期凋亡细胞的百分比分别显示在直方图的右下和右上象限(图1)。多组间比较,差异有统计学意义(P<0.05)。对照组及BBS组中凋亡细胞少见,随着DW作用时间的逐渐增加,SRA01/04细胞凋亡率逐渐增加,DW 3 min组中凋亡最为显著。DW 2 min组[(19.23±1.19)%]及DW 3 min组[(60.87±9.32)%]的细胞凋亡率与对照组[(3.87±1.84)%]及BBS组[(4.37±1.86)%]相比,差异均有统计学意义(均为P<0.05)。SRA01/04细胞中凋亡相关蛋白Bax、Bcl-2及Caspase-9的表达结果显示,DW处理后与处理前相比,Bax和Caspase-9蛋白水平升高,而Bcl-2蛋白水平降低(图2)。多组间比较,差异有统计学意义(P<0.05)。DW 2 min组(3.64±0.62)及DW 3 min组(14.19±0.52)的Bax/Bcl-2与对照组(1.00±0.01)及BBS组[(1.18±0.09)%]相比,差异均有统计学意义(均为P<0.05);DW 1 min组[(3.01±0.18)%]、DW 2 min组[(3.64±0.62)%]及DW 3 min组[(4.60±0.52)%]的Caspase-9蛋白水平与对照组[(1.01±0.01)%]及BBS组[(1.10±0.14)%]相比,差异均有统计学意义(均为P<0.05)。
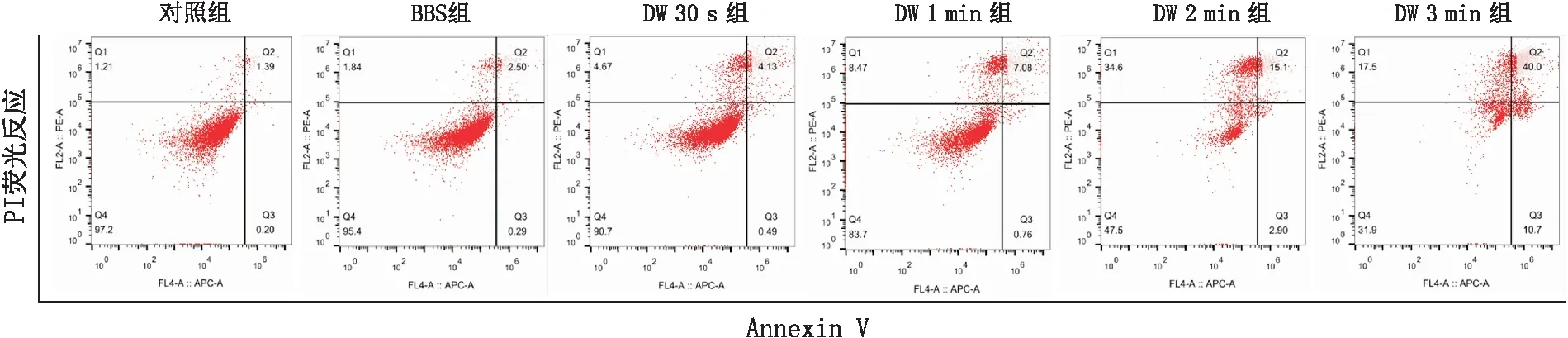
图1 流式细胞仪检测各组SRA01/04细胞凋亡图

图2 Western blot检测各组SRA01/04细胞凋亡相关蛋白表达条带图
2.2 DW对SRA01/04细胞增殖的抑制作用
DW处理SRA01/04细胞不同时间后检测EdU阳性细胞率,多组间比较,差异有统计学意义(P<0.05)。随着DW处理时间的增加,EdU阳性细胞数逐渐减少,SRA01/04细胞增殖能力逐渐下降(图3)。在3个单独的图像中测量EdU阳性细胞数,将EdU阳性细胞数除以细胞核数以计算EdU阳性细胞率。DW 30 s组[(44.82±2.50)%]、DW 1 min组[(37.79±0.26)%]、DW 2 min组[(28.76±4.00)%]及DW 3 min组[(26.07±0.93)%]EdU阳性细胞率与对照组[(58.07±6.85)%]及BBS组[(55.00±2.82)%]相比,差异均有统计学意义(均为P<0.05)。CCK-8实验检测发现,SRA01/04细胞活性随着DW处理时间的增加逐渐降低(图4)。DW 2 min组及DW 3 min组细胞活性与对照组相比,差异均有统计学意义(均为P<0.05)。其他组与对照组相对,差异均无统计学意义(均为P>0.05)。

A:对照组;B:BBS组;C:DW 30 s组;D:DW 1 min组;E:DW 2 min组;F:DW 3 min组。红色:EdU染色;蓝色:DAPI染色。图3 各组SRA01/04细胞中EdU细胞阳性染色共聚焦图像(×200)

注:与对照组相比,**P<0.01,***P<0.001。图4 各组SRA01/04细胞活性对比分析折线图
2.3 DW对SRA01/04细胞迁移的抑制作用
细胞划痕实验结果显示,与对照组相比,DW处理组SRA01/04细胞的48 h迁移能力降低,且DW对SRA01/04细胞迁移的抑制作用随着DW处理时间的增加而增强(图5A)。Transwell小室迁移和侵袭实验发现,DW处理后,DW处理各组SRA01/04细胞穿过聚碳酸酯膜的细胞明显少于对照组(图5B),SRA01/04细胞的运动迁移能力减弱。多组间比较,差异有统计学意义(P<0.05)。DW 1 min组[(44.25±13.25)%]、DW 2 min组[(34.70±14.56)%]及DW 3 min组[(22.38±14.95)%]SRA01/04细胞迁移距离与对照组[(79.09±6.59)%]相比,差异均有统计学意义(均为P<0.05)。其他组与对照组相对,差异均无统计学意义(均为P>0.05)。

A:各组SRA01/04细胞伤口闭合情况的显微图像;B:各组SRA01/04细胞Transwell小室迁移和侵袭实验显微图像。图5 各组SRA01/04细胞的迁移和侵袭能力(×200)
2.4 DW对SRA01/04细胞EMT的抑制作用
Western blot检测结果显示,SRA01/04细胞中转分化相关蛋白α-SMA、N-cadherin、Fibronectin、Vimentin的表达随DW处理时间呈依赖性降低(图6)。多组间比较,差异有统计学意义(P<0.05)。DW 1 min组(0.53±0.14)、DW 2 min组(0.33±0.10)及DW 3 min组(0.20±0.10)SRA01/04细胞中α-SMA蛋白表达水平与对照组(0.97±0.07)及BBS组(0.93±0.06)相比,差异均有统计学意义(均为P<0.05);DW 30 s组(0.78±0.16)、DW 1 min组(0.56±0.11)、DW 2 min组(0.44±0.08)及DW 3 min组(0.23±0.05)SRA01/04细胞中N-cadherin蛋白表达水平与对照组(1.06±0.10)相比,差异均有统计学意义(均为P<0.05);DW 1 min组(0.64±0.06)、DW 2 min组(0.42±0.04)及DW 3 min组(0.29±0.03)SRA01/04细胞中Fibronectin蛋白表达水平与对照组(0.95±0.09)相比,差异均有统计学意义(均为P<0.05);DW 30 s组(0.78±0.14)、DW 1 min组(0.64±0.05)、DW 2 min组(0.41±0.02)及DW 3 min组(0.30±0.02)SRA01/04细胞中Vimentin蛋白表达水平与对照组(1.06±0.07)相比,差异均有统计学意义(均为P<0.05)。DW抑制了SRA01/04细胞的EMT作用。其他组与对照组相对,差异均无统计学意义(均为P>0.05)。

图6 Western blot检测各组SRA01/04细胞EMT相关蛋白表达
3 讨论
PCO是白内障手术最常见的术后并发症,可导致视力丧失,其发病率在成人中为30%~50%,在接受白内障手术的患儿中为100%[5]。手术后晶状体赤道部和前囊膜下残余的上皮细胞增殖、迁移至人工晶状体和后囊膜之间,发生EMT,转化成为成纤维细胞和纺锤形的肌成纤维细胞,导致囊膜发生混浊。因此,抑制LECs增殖和迁移可能是预防PCO的有效策略。
DW又称无菌注射用水,通常用作无菌粉剂和稀释剂的注射用溶剂,是一种广泛应用于外科的洗涤液。其渗透压低于人体组织细胞的渗透压,研究认为,DW是通过低渗透压,使细胞吸收水分引起细胞破裂而起到预防继发性囊膜混浊的作用[6-7]。本研究发现,DW能够促进LECs凋亡,抑制其增殖、迁移和EMT作用。
LECs的增殖在白内障的发病机制中起重要作用。DW处理SRA01/04细胞不同时间后采用EdU和CCK-8实验检测细胞增殖情况,发现SRA01/04细胞的增殖能力随DW处理时间呈依赖性下降。细胞凋亡是一种细胞程序性死亡,具有独特的生化和遗传途径,在维持组织的发育和稳态中起关键作用[8]。本研究通过流式细胞仪检测发现,DW可以促进SRA01/04细胞的凋亡。内在细胞凋亡的关键事件是线粒体外膜透化(MOMP)。MOMP 受促凋亡和抗凋亡Bcl-2家族蛋白之间的相互作用调节。促凋亡蛋白 Bax和 Bak在线粒体外膜形成孔,细胞色素c 和其他可溶性蛋白质从线粒体膜间隙释放,导致Caspase 激活和细胞死亡[9]。本研究检测了SRA01/04细胞中凋亡相关蛋白Bax、Bcl-2和Caspase-9在DW处理后的蛋白水平,结果表明,DW促进了促凋亡蛋白Bax和Caspase-9的表达,同时下调抗凋亡蛋白Bcl-2水平,Bcl-2/Bax比值逐渐下降。本研究结果表明,DW不仅可以有效抑制LECs的增殖,还可以促进其体外凋亡。白内障术后LECs的迁移可能导致PCO,本研究细胞划痕实验及Transwell细胞迁移实验结果表明,DW抑制了SRA01/04细胞的迁移和侵袭。因此,DW可能是安全有效预防PCO发生的方法之一。
PCO 的特征之一是LECs完整性的丧失,这与异常增殖、迁移和细胞形态变化有关,这种生物学过程称为EMT[10]。EMT是上皮细胞将其表型改变为(肌)成纤维细胞的表型,细胞失去细胞间黏附,极性丧失,并获得间充质表型,包括增强细胞的迁移能力、侵袭性、细胞凋亡抵抗力,并大大增加细胞外基质组分,包括Fibronectin和胶原纤维的产生[11]。α-SMA是活性成纤维细胞的常见标志物,E-钙黏蛋白(E-cadherin)在上皮细胞中表达,并且在胚胎发育、组织纤维化和癌症的EMT期间降低表达,从E-cadherin到N-cadherin的钙黏蛋白转化可以用于监测EMT的发生[12]。Vimentin是正常表达于间充质来源细胞的最主要的中间丝蛋白,Vimentin 现也认为是EMT的生物标志物之一[13]。EMT增加了Vimentin、Fibronectin、N-cadherin、α-SMA的表达[14]。本研究发现,DW处理SRA01/04细胞后,相关蛋白α-SMA、Fibronectin、Vimentin及N-cadherin表达量均随DW处理时间的增加而减少,说明DW对SRA01/04细胞的EMT有抑制作用。
4 结论
DW能够促进SRA01/04细胞体外凋亡,并抑制SRA01/04细胞在体外增殖、迁移和转分化的能力,但仍需要进一步的研究来探索DW对体内白内障手术后PCO进展的影响。本研究为继发性囊膜混浊的防治提供了一个新的思路,对于临床工作有一定指导意义。
