血管内皮生长因子-A165对形觉剥夺性近视豚鼠视网膜中多巴胺水平的影响
2023-10-07孙瑞婷高洪莲张凤一彭庆生
孙瑞婷 高洪莲 张凤一 彭庆生 王 磊 张 磊
近视是视力损害的主要原因,由于其在全球范围内的患病率越来越高,已成为一个重大的公共卫生问题[1]。据估计,2050年全球会有接近47.58亿近视患者,其中高度近视患者将有9.38亿人[2]。目前青少年近视发病低龄化,发生率也逐渐增高,近视相关的眼部并发症也随之增多。随着近视度数的增高,眼轴进行性延长,视网膜脉络膜发生退行性改变,会导致视网膜脱离、黄斑出血甚至失明等严重的并发症[3-4]。近视的病因复杂,至今还不能完全解释近视的发病机制,采取有效的防控措施,对于避免进展为高度近视至关重要。多巴胺(DA)是一种重要的神经递质,在调控视网膜信号传递、光刺激的反应以及对比敏感度视力等过程起着重要的作用[5],被认为是近视的终止信号[6-7]。血管内皮生长因子(VEGF)作为血管生成因子大家族的一员,是与新生血管密切相关的多肽类生长因子,其中VEGF-A165是主要的同种型[8],不但具有促进新生血管形成、血管重建的作用,还具有直接和间接的神经营养和神经保护作用[9]。有研究证明,VEGF-A165在体内外均能促进多巴胺能神经元的存活和功能恢复[10-13]。本课题组前期实验已经证明,形觉剥夺性近视(FDM)豚鼠玻璃体内注射抗VEGF药物可以进一步抑制视网膜中DA的含量,加重近视程度[14],初步证实了VEGF对视网膜DA含量的影响。基于此,本研究拟对FDM豚鼠玻璃体内注射不同剂量的VEGF-A165,研究其对视网膜DA水平的影响及对新生血管的影响,为控制近视的发生发展寻找新的思路和可能的药物治疗方式。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组
选取健康3周龄三色豚鼠90只(济南金丰实验动物有限公司提供),体重150~200 g,雌雄不限。自然照明环境下12 h/12 h昼夜循环,自由摄水摄食,维持温度为22~25 ℃,湿度为50%~70%。按照随机数表法将豚鼠分为空白组、FDM组、PBS组、10 ng组、5 ng组、1 ng组,共6组,每组15只。空白组豚鼠双眼不做任何处理,FDM组豚鼠右眼建立FDM模型,PBS组、10 ng组、5 ng组、1 ng组豚鼠右眼玻璃体内分别注射PBS缓冲液及10 ng、5 ng、1 ng VEGF-A165重组人蛋白缓冲液,之后右眼建立FDM模型。本研究经滨州医学院附属医院伦理委员会审批(审批号:20220128-78),实验动物的喂养和使用严格遵循滨州医学院动物管理委员会相关规定。
1.1.2 主要试剂及仪器
重组人蛋白VEGF-A165(美国 R&D Systems公司);Bouin固定液(福建飞净Phygene公司);酪氨酸羟化酶(TH)兔单克隆抗体(美国Cell Signaling Technology 公司);山羊抗兔IgG(英国 Abcam公司);带状光检影镜(苏州六六视觉科技有限公司);A型超声仪(法国Quantel公司);OCT冰冻切片包埋耦合剂(美国Sakura公司);冰冻切片机(德国Leica公司);正置荧光显微镜(日本Olympus公司);高效液相色谱仪(美国Thermo Fisher公司);苏木精-伊红染色试剂盒、抗荧光衰减封片剂(含DAPI)(北京Solarbio公司)。
1.2 方法
1.2.1 FDM豚鼠模型的建立
采用半透明无毒乳胶气球套头处理,只遮盖右眼,充分暴露左眼、口鼻和两侧耳部,每日清洗头套1次,保持头套清洁。分笼饲养,连续遮盖14 d建立FDM豚鼠近视模型。
1.2.2 玻璃体内注射
于造模前对PBS组、10 ng组、5 ng组、1 ng组豚鼠右眼分别行玻璃体内注射PBS溶液及10 ng、5 ng、1 ng VEGF-A165。注射前1 d使用妥布霉素滴眼液滴眼(每天3次),注射前用复方托吡卡胺滴眼液散瞳,50 g·L-1水合氯醛腹腔注射麻醉,眼周用碘伏消毒完毕后铺无菌洞巾,聚维酮碘滴眼液消毒结膜囊及眼表,1 min后用氯化钠注射液冲洗干净。在显微镜下用显微有齿镊固定眼球,微量注射器在颞侧角膜缘后1 mm处垂直巩膜进针,针头向眼球壁倾斜20°避开晶状体推进约3 mm后注射,注射完毕后用齿镊轻轻夹住针孔30 s,氧氟沙星眼膏涂眼,无菌纱布遮盖包扎10 min后进行FDM豚鼠造模,术后第2天、第3天右眼涂氧氟沙星眼膏(每天3次)。
1.2.3 眼部生物学参数测量
于造模前1 d和造模后14 d测量各组豚鼠眼球的屈光度和眼轴长度。屈光度测量前用复方托吡卡胺(美多丽)滴眼液滴右眼,待瞳孔充分散大后使用带状光检影镜测量屈光度,由验光经验丰富的检查者检影,以等效球镜度(球镜度+1/2柱镜度)进行数据分析,连续测量5次计算平均值作为该眼的屈光值。屈光度测量后20 min测量眼轴长度,盐酸丙美卡因滴眼液滴右眼行表面麻醉后,应用眼部A型超声仪测量眼轴长度,测量时探头对准角膜中心并垂直于角膜平面,测定右眼眼轴长度,手动模式连续测量5次计算平均值,精确到0.01 mm。
1.2.4 免疫荧光法检测豚鼠视网膜中TH的阳性细胞数
每组各随机取3只豚鼠,在造模后14 d颈椎脱臼法处死;取出右侧眼球置于冰上,在显微镜下剔除多余结缔组织与眼外肌,保留视神经并保持眼球完整性,置于Bouin固定液中固定,显微镜下去除角膜、虹膜、晶状体、玻璃体后将眼球从中间分开制成眼杯,使视网膜保持完整,冲洗干净后将组织依次放入100 g·L-1、200 g·L-1和 300 g·L-1的蔗糖溶液中梯度脱水, 4 ℃存放。充分脱水后取出眼杯置于滤纸上,去除多余溶液,OCT包埋眼杯后冰冻切片机切片,切片厚度为8 μm。将冰冻切片吸附于黏性载玻片上,4 ℃丙酮处理,PBS 溶液洗涤3次, 3 g·L-1Trition-100漂洗3次;滴加50 g·L-1BSA封闭液,37 ℃ 孵育30 min;滴加TH兔单克隆抗体(1:100),4 ℃过夜;次日置于37 ℃孵育箱复温1 h;PBS 溶液洗涤3次;避光状态下,滴加山羊抗兔IgG(1:500),37 ℃孵育1 h;滴加含DAPI的抗荧光衰减剂封片,在正置荧光显微镜400 倍视野下观察TH分布,每组分别选取6个不同视野计算TH阳性细胞数,以平均值进行对比分析。
1.2.5 高效液相色谱法测定视网膜中DA及DOPAC的含量
每组各随机取6只豚鼠,在造模14 d后颈椎脱臼法处死,摘取右侧眼球置于冰上,取出视网膜并称重,每毫克组织样加入新鲜配制的匀浆液20 μL(H3ClO40.1 mol·L-1, EDTA-Na20.1 mmol·L-1,内标物DHBA),-40 ℃冷冻匀浆(2 mm氧化锆珠,60 Hz,30 s,4次);低温离心(20 000 r·min-1,30 min,4 ℃)后取上清保存于-80 ℃冰箱。测样前取出再次离心(20 000 r·min-1,30 min,4 ℃)后取上清液上机检测。色谱柱:Thermo Acclaim Rapid Separation Liquid Chromatography (RSLC) 2.1×100 mm C18 2.2 μm,柱温40 ℃;流动相:含90 mmol·L-1NaH2PO4,50 mmol·L-1柠檬酸,1.7 mmol·L-1OSA,50 μmol·L-1EDTA和体积分数4.5%乙腈;Chromeleon 6.9色谱工作站采集与分析数据,以内标法计算DA和DOPAC浓度,并计算DA代谢率。
1.2.6 HE染色观察视网膜中血管内皮细胞核数
每组随机选取6只豚鼠颈椎脱臼处死,摘取右侧眼球,固定后经常规脱水、OCT包埋后,制成8 μm切片,每组小鼠随机选取20张切片行HE染色,随机选取6张切片于400倍光学显微镜下观察小鼠视网膜情况,并对血管内皮细胞核数进行计数。
1.3 统计学分析
采用统计学软件SPSS 25.0进行统计分析。本研究的计量资料数据经Shapiro-Wilk检验证实呈正态分布,以均数±标准差表示,组间数据经Levene检验方差齐性。各组数据总体比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准:α=0.05。
2 结果
2.1 豚鼠眼球生物学参数分析
造模前6组豚鼠双眼均呈现远视状态,各组豚鼠间眼球屈光度和眼轴长度差异均无统计学意义(均为P>0.05)。造模后14 d,与空白组相比,FDM组豚鼠的等效球镜度数和眼轴长度均增加,差异均有统计学意义(均为P<0.001);与FDM组相比,PBS组豚鼠等效球镜度数和眼轴长度差异均无统计学意义(P=0.622、0.948);与FDM组相比,10 ng组、5 ng组、1 ng 组豚鼠近视程度减轻,眼轴长度变短,差异均有统计学意义(均为P<0.001)。与FDM组相比,1 ng组豚鼠的近视程度减轻最明显,眼轴长度明显变短,差异均有统计学意义(均为P<0.001)(表1)。
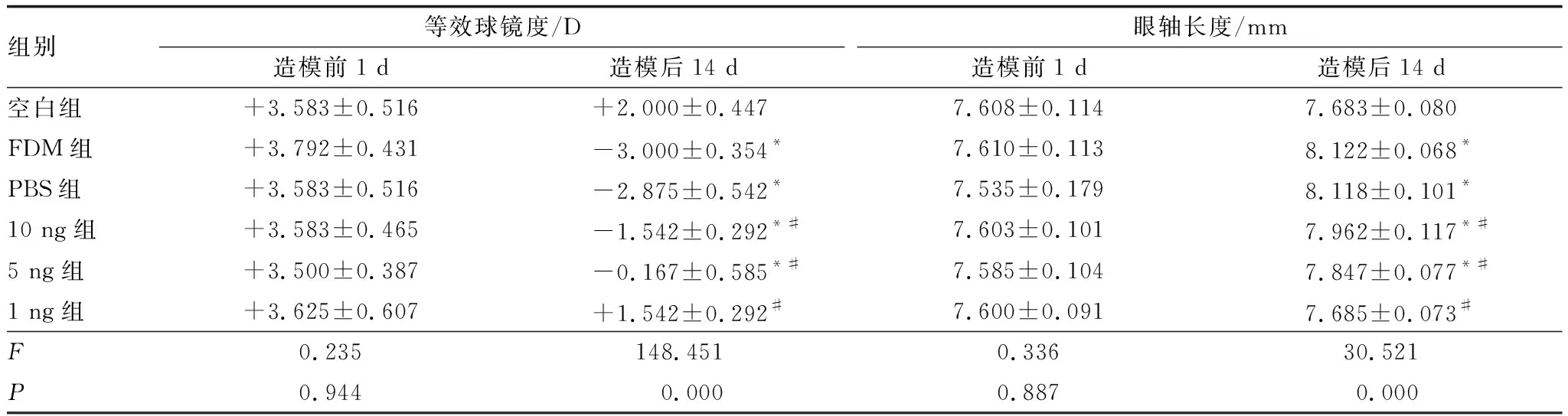
表1 各组豚鼠造模前1 d和造模后14 d屈光度和眼轴长度
2.2 免疫荧光法检测豚鼠视网膜中TH阳性细胞数
免疫荧光法检测结果显示,各组豚鼠视网膜结构完整,各层排列整齐,视网膜中TH阳性细胞表达呈绿色点状荧光(图1箭头所指区域),主要位于内侧神经细胞层(无长突细胞层)。空白组、FDM组、PBS组、10 ng组、5 ng组、1 ng组豚鼠视网膜中TH阳性细胞数分别为(34.833±2.137)个、(8.000±2.608)个、(8.833±2.563)个、(17.167±2.137)个、(21.667±3.266)个、(32.667±2.422)个,各组间总体比较差异有统计学意义(F=121.429,P<0.001)。两两比较结果显示,FDM组豚鼠视网膜中TH阳性细胞数明显低于空白组(P<0.001);FDM组豚鼠视网膜中TH阳性细胞数与PBS组相比差异无统计学意义(P=0.576);与FDM组相比,10 ng组、5 ng组、1 ng组豚鼠视网膜中TH阳性细胞数均增多(均为P<0.05),其中5 ng组豚鼠视网膜中TH阳性细胞数比10 ng组多,1 ng组TH阳性细胞数比5 ng组多,差异均有统计学意义(均为P<0.05)(图1)。
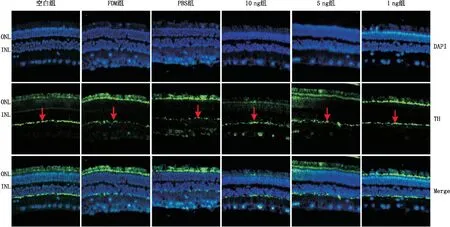
ONL:视网膜外核层;INL:视网膜内核层。箭头示TH阳性细胞。图1 各组豚鼠视网膜中TH的表达(×400)
2.3 高效液相色谱法检测结果
造模后14 d,与空白组相比,FDM组豚鼠视网膜DA和DOPAC含量均明显降低,差异均有统计学意义(均为P<0.05);与FDM组相比,PBS组豚鼠视网膜DA、DOPAC含量未发生明显变化,差异均无统计学意义(P=0.811、0.682);与FDM组相比,10 ng组、5 ng组、1 ng组豚鼠视网膜DA和DOPAC含量均增加(均为P<0.05),其中1 ng组豚鼠视网膜中的DA和DOPAC含量均较5 ng组明显增加,5 ng组豚鼠视网膜中的DA和DOPAC含量均较10 ng组明显增加,差异均有统计学意义(均为P<0.05)。6组豚鼠间视网膜DA 代谢率差异无统计学意义(P=0.574)(表2)。
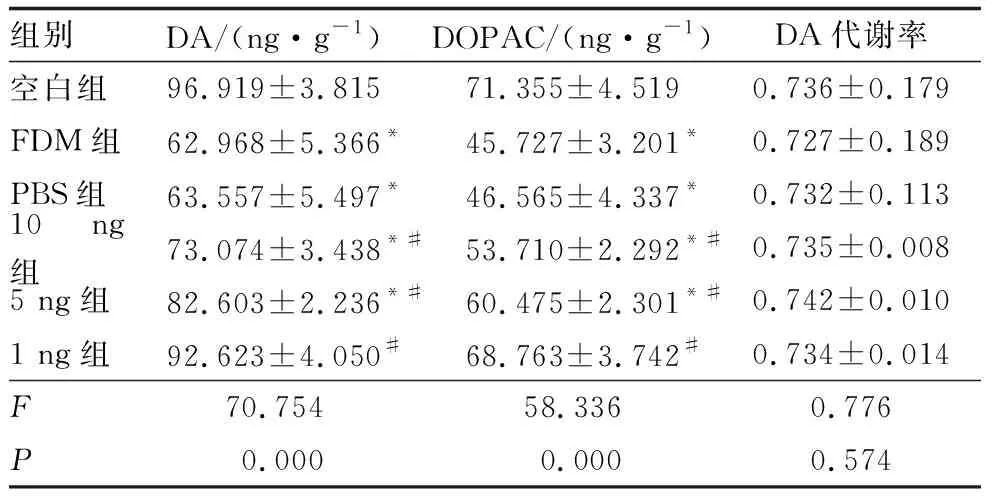
表2 各组豚鼠视网膜中DA、DOPAC的含量及DA代谢率
2.4 HE染色观察结果
豚鼠视网膜切片HE染色结果显示,空白组、FDM组、PBS组豚鼠视网膜各层排列整齐,未见或偶见血管内皮细胞分布在内界膜内;10 ng组、5 ng组、1 ng组豚鼠视网膜内界膜内血管内皮细胞核均有不同程度的增多,随着VEGF-A165剂量的增加,血管内皮细胞核数也随之增加(图2)。空白组、FDM组、PBS组、10 ng组、5 ng组、1 ng组豚鼠视网膜中血管内皮细胞核数分别为(1.500±1.049)个、(2.500±1.517)个、(2.333±1.211)个、(12.167±1.722)个、(9.000±1.414)个、(4.500±1.049)个。两两比较结果显示,与空白组相比,FDM组、PBS组豚鼠视网膜中血管内皮细胞核数差异均无统计学意义(P=0.209、0.293);10 ng组、5 ng组和1 ng组豚鼠视网膜中血管内皮细胞核数与空白组相比均明显增多,差异均有统计学意义(均为P<0.001);10 ng组豚鼠视网膜中血管内皮细胞核数较 5 ng组明显增多(P<0.001);5 ng组豚鼠视网膜中血管内皮细胞核数较 1 ng 组明显增多(P<0.001)。
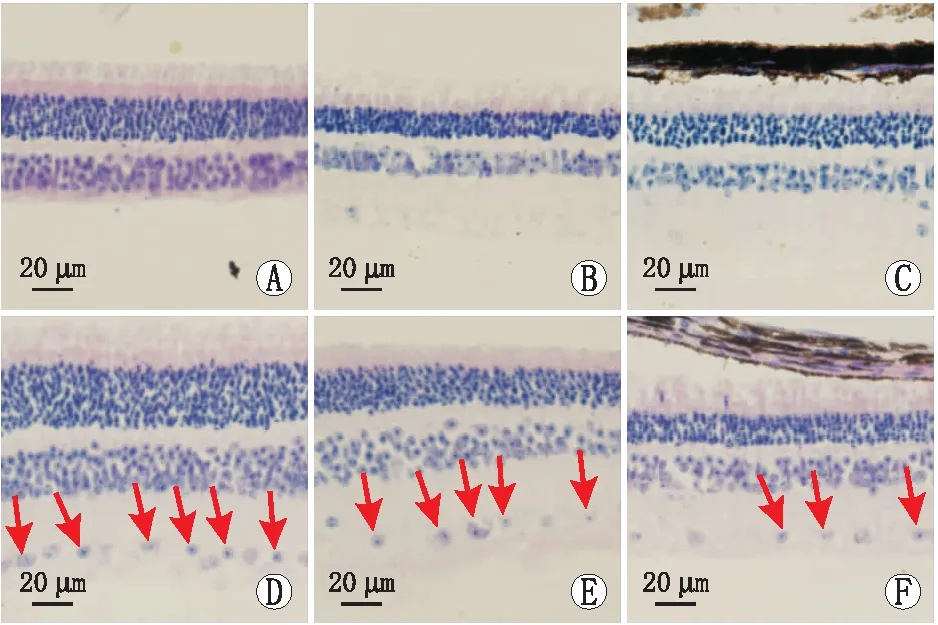
A:空白组;B:FDM组;C:PBS组;D:10 ng组;E:5 ng组;F:1 ng组。箭头示视网膜内血管内皮细胞核。图2 各组豚鼠视网膜切片HE染色
3 讨论
近年来,近视发病率逐年增高,已成为全球性的公共卫生问题。近视的发病机制目前仍不明确[1,15],因此近视的具体发病机制一直是眼科研究的热点。近视动物模型的成功建立以及对实验性近视眼分子生物学等方面的研究发现,近视眼的特点是眼球的前后径变长,局部视网膜调控、巩膜重塑等过程在近视的发病中起到了重要的作用[16-17]。对包括人类在内的许多生物而言,视觉信号刺激的剥夺可使眼轴前后径异常生长而致FDM。形觉剥夺通过某些神经递质、信号分子使局部视网膜成像改变,调控眼球生长的微环境,其中DA的参与最为密切[18]。DA作为一种重要的神经递质,与眼球的生长发育和近视的形成密切相关。
DA属儿茶酚胺类神经递质[19],主要由视网膜内核层的多巴胺能无长突细胞分泌[20]。DA的合成起源于酪氨酸。酪氨酸在被多巴胺能神经元摄取后,在TH的作用下先转变为左旋多巴,再经多巴脱羧酶催化形成DA。合成的DA在单胺氧化酶的作用下分解为DOPAC和高香草酸。TH是DA合成过程中的限速酶,DOPAC是反映DA释放量的重要标志物。视网膜中的DA释放后,通过与DA受体结合参与细胞的营养凋亡、眼球的生长发育及视觉信号转导活动[21]。本实验结果显示, FDM组豚鼠视网膜中DA和DOPAC的含量均明显较空白组降低,通过测量等效球镜度和眼轴长度确定豚鼠近视模型建造成功,说明DA可能参与了近视的发生发展。
目前的近视治疗方法如配戴多焦点眼镜、角膜塑形镜和屈光手术等,可部分控制但不能完全抑制近视进展,药物治疗近视主要是通过视网膜及巩膜的信号分子起作用,或者有望解决近视进展的难题。现在临床应用的控制近视药物,如低浓度阿托品、派仑西平等,都可能产生副作用,如畏光、视物模糊、无症状的乳头状结膜炎等[22-23]。有研究证明,在6-羟基DA神经毒素介导的帕金森病临床前模型中,VEGF过表达或在纹状体中植入包被的VEGF分泌细胞可降低苯丙胺诱导的旋转行为,并预先服务于黑质中的TH神经元[10-12]。这种神经保护作用归因于VEGF对神经细胞和血管的双重作用。由此我们推断,VEGF可能会对视网膜中多巴胺能无长突细胞有神经营养和神经保护等作用,本课题组前期实验证明,玻璃体内注射抗VEGF药物(康柏西普)会使近视加重,视网膜中DA水平降低更明显[14],间接证明了VEGF对视网膜DA含量的影响。本实验在FDM豚鼠玻璃体内注射VEGF-A165观察视网膜中DA的变化,探讨VEGF对视网膜中DA水平的影响,以及对近视的作用。
本研究选择玻璃体内注射不同剂量VEGF-A165验证视网膜中DA和DOPAC含量的变化及对FDM的影响,实验分为三个不同剂量进行注射,分别为10 ng、5 ng、1 ng。实验结果显示,与空白组相比,FDM组豚鼠的等效球镜度变为负值,为明显的近视状态,眼轴长度明显延长,视网膜中DA和DOPAC的含量均明显降低,TH阳性细胞数减少,DA代谢率不变;与FDM组相比,10 ng组、5 ng组、1 ng组豚鼠遮盖眼近视程度均降低,眼轴延长幅度减小,视网膜中DA和DOPAC的含量均有升高,TH阳性细胞数增加,但DA代谢率均不变。由于各组豚鼠视网膜中DA代谢率均未发生变化,可分析出其DA的升高是因为 DA 的合成增加而非代谢的减少引起。其中,5 ng组豚鼠视网膜DA和DOPAC含量、TH阳性细胞数均比10 ng组豚鼠多,1 ng组豚鼠视网膜DA和DOPAC含量、TH阳性细胞数均比5 ng组豚鼠多,这说明VEGF-A165在低剂量下对近视的抑制效果最好,这与Meng等[24]的研究结果一致,VEGF-A165对DA神经元的作用与剂量有关,在低剂量下获益最大,更高的剂量则会引起过度的血管生成甚至水肿。在各组豚鼠视网膜切片HE染色实验中可以看到,10 ng 组、5 ng组、1 ng组豚鼠视网膜内界膜内血管内皮细胞核均有不同程度的增多,10 ng组豚鼠视网膜中血管内皮细胞核数较1 ng组明显增多,由此可见,VEGF-A165在低剂量下对视网膜中多巴胺能神经元起到明显促进作用,而高剂量 VEGF-A165对多巴胺能神经元的促进作用反而不明显。我们结合相关文献推测,过量的VEGF-A165可能通过引发胞外Ca2+内流,激活前列腺环素和血小板活化因子等增加血管渗透性[12],从而影响了其对多巴胺能神经元的神经营养作用。也有实验研究表明,在早产儿视网膜病变小鼠模型中,VEGF过量表达使视网膜出现大量新生血管,新生血管长入玻璃体导致视网膜脱离,从而对视网膜神经结构造成损害,使得视网膜中DA含量反而降低[25]。由此可见,如果我们加大VEGF-A165玻璃体内注射剂量则会损害视网膜神经系统,反而使得DA水平下降。因此,眼内注射VEGF剂量的选择至关重要。
4 结论
本研究进一步证明了FDM豚鼠玻璃体内注射VEGF-A165可以使视网膜中DA含量增加,抑制FDM的发展,对近视的形成有抑制作用,其机制可能是VEGF-A165通过与视网膜中的VEGF受体结合发挥其对多巴胺能神经元的神经营养和神经保护作用,导致TH表达增多,DA分泌增加,从而使近视得到控制,但具体通过结合哪些VEGF受体和通过哪些通路发挥作用尚不明确,具体发生机制还需要进一步研究,本研究为今后近视的防治提供更多实验依据。
