规模化猪场猪繁殖与呼吸综合征病毒和猪圆环病毒2型混合感染的控制
2023-09-22周宏超郭抗抗许信刚
周宏超,贾 佩,张 琪,郭抗抗,许信刚
(1.西北农林科技大学动物医学院,陕西杨凌 712100;2.陕西正能农牧科技有限责任公司,陕西高陵 7102011)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种重要的猪传染性疾病,该病以母猪繁殖障碍、新生仔猪高死亡率、各年龄段猪呼吸困难为主要特征[1]。2006年我国暴发的高致病性猪繁殖与呼吸综合征(HP-PRRS)具有极高的发病率和病死率[2],对养猪业造成了严重经济损失,初步统计,HP-PRRS感染猪的发病率达50%以上,病死率可达30%以上[3]。2021年,NADC30-LIKE PRRSV已成为我国的主流毒株,多种毒株的田间重组使得该病的防控难度加大。
猪圆环病毒( Porcine circovirus,PCV)属于圆环病毒科( Circoviridae)圆环病毒属其中一员 ,是单股环状DNA 病毒,病毒无囊膜,被认为是最小的动物病毒之一[4],在PCV的4个血清型中,PCV2可导致猪群发病[5],并将PCV2引起的疾病统称为圆环病毒相关疾病[6]。
PRRSV和PCV2均侵害猪的免疫系统并导致免疫抑制,两者的混合感染导致机体的抵抗力下降[7],引起多种病毒性疾病和细菌性疾病的继发感染[8],严重影响猪场的经济效益。本文通过总结1例规模化猪场PRRSV和PCV2混合感染的诊断、防治,跟踪病毒血症及抗体水平的持续变化,以期为规模化猪场PRRSV和PCV2混合感染的防控提供参考。
1 基本情况
1.1 仔猪种源情况
陕西省某规模化猪场基础母猪存栏4 800头,兽医部检测实验室对4批次3日龄仔猪的断尾去势液检测PRRSV核酸阳性,4批次仔猪大群临床表现无异常,猪群处于平稳状态。
1.2 育肥猪群发病情况
3 000头4批次仔猪21日龄断奶直接转入育肥猪场,猪进场第3天大群陆续表现咳嗽、食欲减退、精神沉郁、消瘦苍白猪数量增多,死亡率明显升高。
1.3 诊断及评估检测
1.3.1 主要试剂 PRRSV抗体检测试剂盒(DU-763),北京爱德士元亨生物科技有限公司产品;PCV2抗体检测试剂盒(20220531),北京金诺百泰生物科技有限公司产品;科牧丰磁珠法核酸提取试剂(32A6)购自北京科牧丰生物科技有限公司;PRRSV qPCR检测试剂盒(211227)购自北京爱德士元亨生物科技有限公司;PCV2 qPCR检测试剂盒(20220418P),哈尔滨元亨生物药业有限公司产品;所有样品的检测试剂为同批次试剂盒,试剂均在规定有效期内使用,PRRSV和PCV2抗体试剂盒置于4℃冰箱冷藏保存备用,核酸提取试剂置于常温保存备用,PRRSV和PCV2扩增试剂盒置于-25℃冷冻保存。
1.3.2 主要仪器 -25℃冰箱(YCD-265),澳柯玛股份有限公司产品;离心机(D3024),大龙医疗设备有限公司产品;离心管架、加样槽;电热恒温箱(DHP-2),上海一恒科技有限公司产品;移液器(F3),赛默飞世尔科技公司产品;酶标仪(multiskan fc),赛默飞世尔科技公司产品;荧光定量PCR仪(48),北京爱德士元亨生物科技有限公司;核酸提取仪(32孔),北京科牧丰生物制药有限公司。
1.3.3 方法
1.3.3.1 病原检测 参照科牧丰磁珠法病毒提取试剂盒说明书进行病毒核酸的提取,操作程序为:从试剂盒中取出预分装深孔板,颠倒混匀(目的是重悬磁珠),撕去铝箔封口膜,加300 μL样本在提取孔,放置于核酸提取仪中,选择DNA/RNAM同提程序运行,运行结束后收集核酸即可。PRRSV扩增参照爱德士PRRSV qPCR检测试剂盒说明书进行PRRSV扩增,对于试验不成立的样本需重新进行试验。PCV2扩增参照世纪元亨 PCV2 qPCR检测试剂盒说明书进行,对于试验不成立的样本重新进行试验。
1.3.3.2 抗体检测 PRRSV抗体:参照爱德士PRRSV抗体检测试剂盒说明书进行,在试验成立的情况下(阳性对照OD值-阴性对照OD值0.15且阴性对照OD值0.15),计算每个样本的S/P值,若S/P值<0.4为阴性,若S/P值0.4为阳性。对于试验不成立的样本重新进行试验。PCV2抗体:参照金诺PCV2抗体检测试剂盒说明书进行操作,在试验成立的情况下(阳性对照OD值>0.4且阴性对照OD值<0.3),计算每个样本的S/P值,若S/P值<0.4为阴性,若S/P值0.4为阳性。对于试验不成立的样本需重新进行试验。
1.4 诊断检测结果
1.4.1 qPCR结果 对采集的咳嗽猪口腔液(1~5号样本)和瘦弱发白猪扁桃体、淋巴结、胸腺、肺脏(6~10号样本)用qPCR方法检测PRRSV和PCV2。PRRSV qPCR结果显示:试验成立(阳性对照具有标准“S”型扩增曲线且Ct值=30.05、阴性对照FAM通道无“S”型扩增曲线且无Ct值),2、3、6号样本检测结果为PRRSV阳性(样本对应的FAM通道有标准“S”型扩增曲线且Ct值<38),其余样本为阴性(图1)。PCV2 qPCR结果显示:试验成立(阳性对照具有标准“S”型扩增曲线且Ct值=21.2、阴性对照FAM通道无“S”型扩增曲线且无Ct值),6、9号样本检测结果为PCV2阳性(6、9号样本对应的FAM通道有标准“S”型扩增曲线且Ct值<30),其余样本为阴性(图2)。
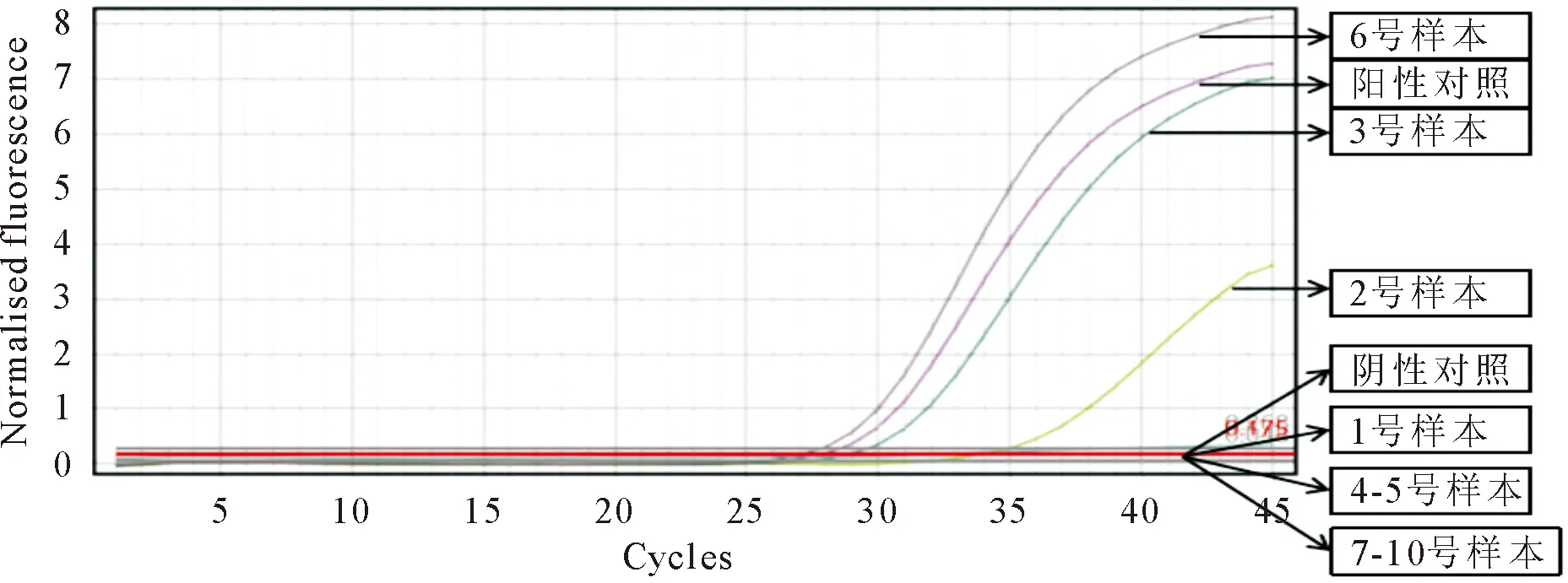
1~5.咳嗽猪口腔液;6~10.发白瘦弱猪解剖扁桃体、淋巴结、胸腺和肺脏的组织混合样本
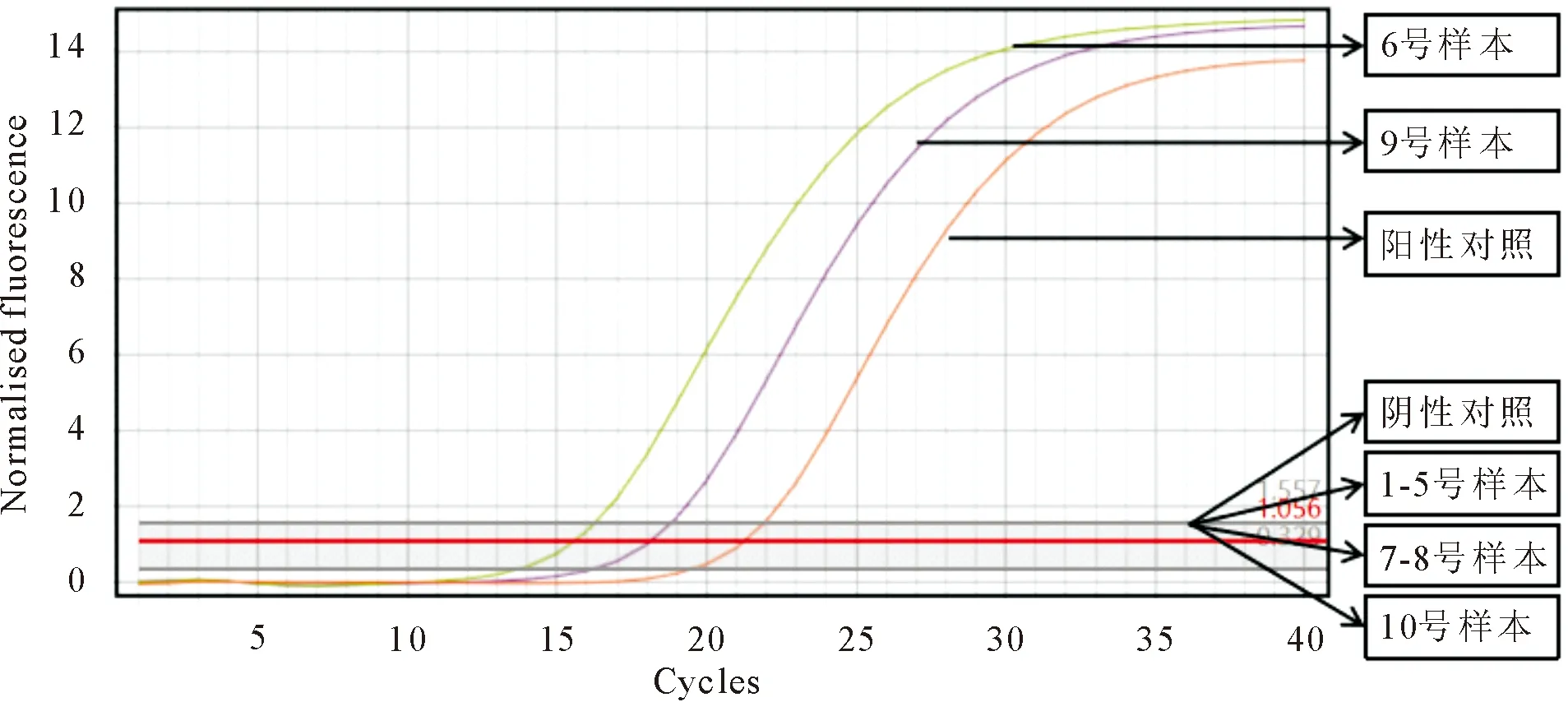
1~5.咳嗽猪口腔液;6~10.发白瘦弱猪解剖扁桃体、淋巴结、胸腺和肺脏的组织混合样本
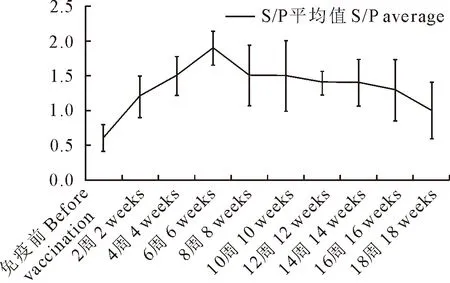
图3 PRRSV抗体水平跟踪检测结果
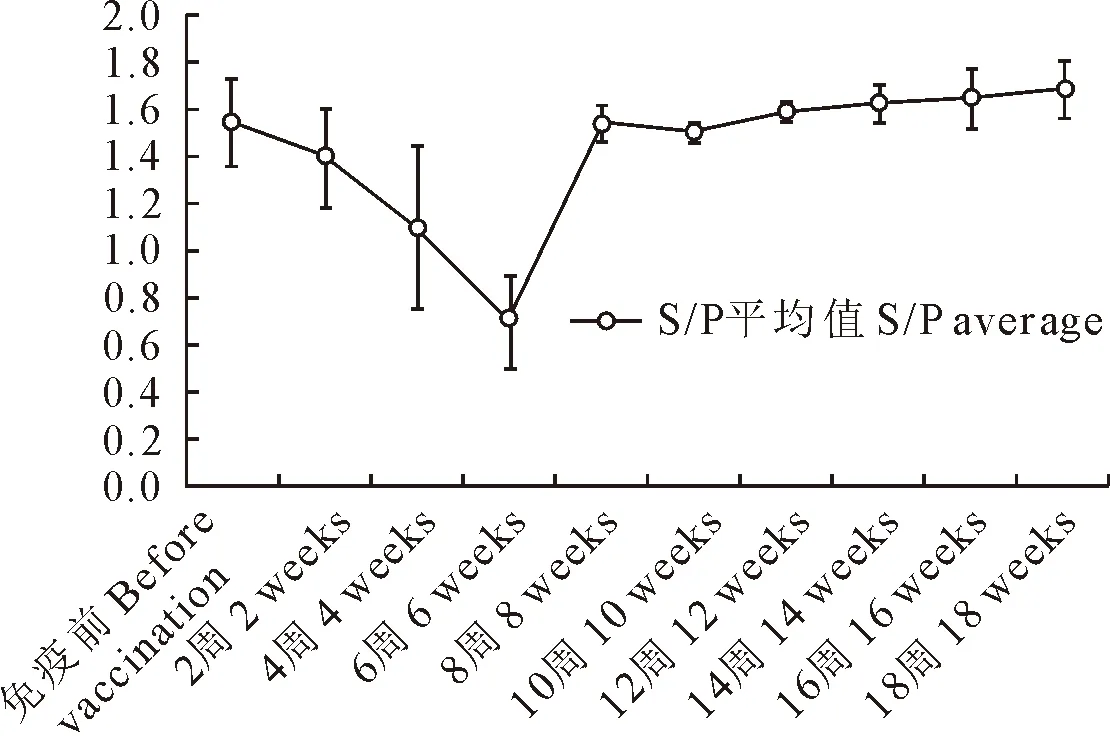
图4 PCV2抗体水平跟踪检测结果
1.5 诊断结果
根据猪群整体情况、发病猪临床症状、死亡猪剖检病理变化及实验室检测结果综合分析,该病例诊断为PRRSV和PCV2混合感染。
2 防控方案及猪健康度跟踪
2.1 防控方案
该批仔猪在14日龄接种PCV2全病毒灭活疫苗(1头份/头)和PRRSV(CH-1R株)弱毒疫苗(1头份/头),25日龄确诊为PRRSV和PCV2的混合感染。在疾病确诊后立即将病弱咳嗽猪隔离饲养,对全群进行7 d的药物保健,保健方案为用泰万菌素(800 g/t)+磺胺间甲氧嘧啶(1 kg/t)+电解多维(2 kg/t),治疗结束后同时免疫PRRSV(CH-1R株)弱毒疫苗(1头份/头)和PCV2全病毒灭活疫苗(1头份/头)。
2.2 猪健康度跟踪
2.2.1 病毒血症检测
2.2.1.1 PRRSV病毒血症跟踪检测 在启动猪群防控方案后每间隔2周对猪群的固定猪采集30份血清(直至该批育肥猪出栏),6份样本合为1份样本检测PRRSV,以此评估该批育肥猪PRRSV病毒血症的持续时间(表1)。
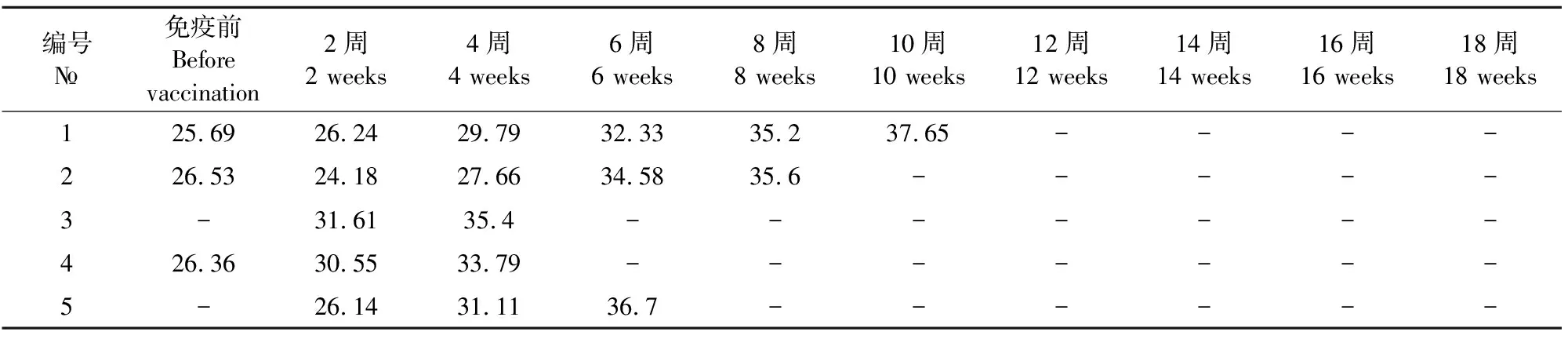
表1 PRRSV病毒血症跟踪检测结果
对该批次发病猪PRRSV病毒血症的跟踪检测发现:1号样本的病毒血症期在疫苗免疫后10周消失,2号样本的病毒血症期在疫苗免疫后8周消失,3号样本的病毒血症期在疫苗免疫后4周消失,4号样本的病毒血症期在疫苗免疫后4周消失,5号样本的病毒血症期在疫苗免疫后6周消失。
2.2.1.2 PCV2病毒血症跟踪检测 在启动猪群防控方案后每间隔2周对猪群的固定猪采集30份血清(直至该批育肥猪出栏),6份样本合为1份样本检测PCV2,以此评估该批育肥猪PCV2病毒血症的持续时间(表2)。对该批次发病猪PCV2病毒血症的跟踪检测发现,1号样本的病毒血症期持续到该批次猪出栏;2号样本的病毒血症期在疫苗免疫后8周消失;3号样本的病毒血症期在疫苗免疫后4周消失,在12周重复出现直至猪出栏;4号样本的病毒血症期在疫苗免疫后4周消失,在16周重复出现直至猪出栏;5号样本的病毒血症期在疫苗免疫后6周消失。
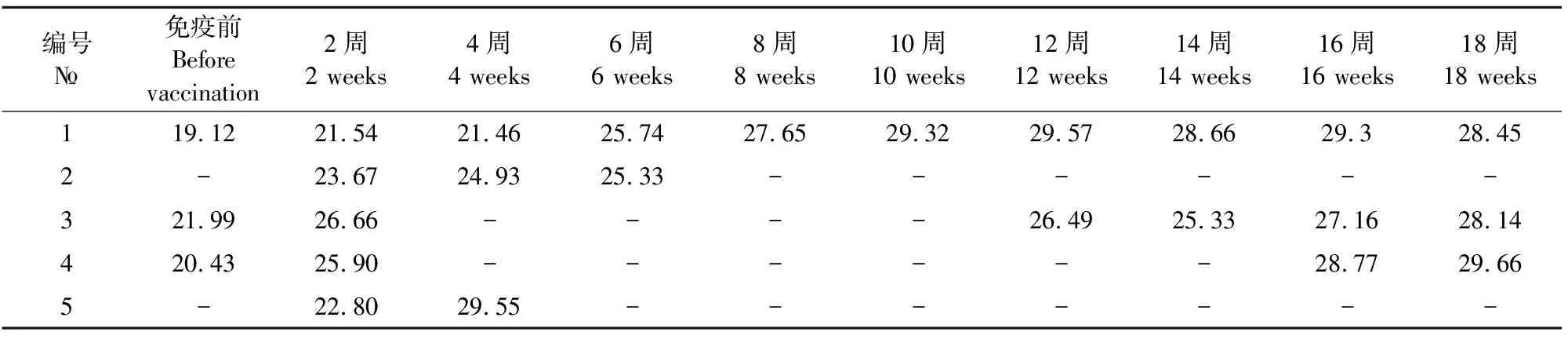
表2 PCV2病毒血症跟踪检测结果
2.2.2 抗体水平跟踪检测
2.2.2.1 PRRSV抗体水平跟踪检测 在启动猪群防控方案后每间隔2周对猪群的固定猪采集30份血清(直至该批育肥猪出栏),检测PRRSV抗体,以此总结该批次育肥猪PRRSV抗体水平变化规律(图1)。
对该批次发病猪PRRSV抗体水平跟踪检测发现:虽然各阶段PRRSV抗体阳性率均为100%,但是各阶段猪群的S/P值有明显变化。S/P值从疫苗免疫前的0.6上升到免疫后6周龄的1.9,随后持续降至免疫后18周龄的1.0。
2.2.2.2 PCV2抗体水平跟踪检测 在启动猪群防控方案后每间隔2周对猪群的固定猪采集30份血清(直至该批育肥猪出栏),检测PCV2抗体,以此了解该批次育肥猪PCV2抗体水平变化规律(图2)。
对该批发病猪PCV2抗体水平跟踪检测发现:虽然各阶段的PCV2抗体阳性率均为100%,但是各阶段猪群的S/P值有明显变化。S/P值从疫苗免疫前的1.55下降到免疫后6周龄的0.7,随后持续上升至免疫后18周龄的1.6。
4 讨论
PRRSV和PCV2做为呼吸道疾病的主要病毒性疾病[9],在猪群中诱发的混合感染屡见不鲜[10-14],临床防控除加强生产管理外,疫苗免疫是有效的措施之一。PCV2疫苗主要包括灭活疫苗、弱毒活疫苗及基因工程苗三大类,其中,PCV2弱毒活疫苗存在毒力返强的风险[15],Fenaux M等人将PCV2在PK-15细胞上连续传代培养,结果验证了毒力返强的事实[16],而且PCV2弱毒疫苗免疫引起的疑似PCV的案例已被报道[17],可见PCV2商业化弱毒活疫苗的选择需谨慎。疫苗免疫也是防控PRRS的核心手段[18]。用于PRRSV防控的主流疫苗为PRRSV弱毒疫苗和PRRSV灭活疫苗。有学者研究了PRRSV-2弱毒疫苗对PRRSV-1和PRRSV-2异种单独攻毒和联合攻毒的保护力,发现弱毒疫苗免疫可产生较好的抗体,并能降低PRRSV的病毒血症[19],PRRSV特异性IFN-γ的高水平分泌能降低病毒攻毒后对肺脏的损伤,说明弱毒疫苗免疫可在一定程度上提高猪的免疫保护作用。PRRSV灭活疫苗具有安全性好、免疫力差的特点[20],其使用效果也倍受争议。有学者称[21]虽然PRRSV灭活疫苗的保护效率并不高,但灭活疫苗新型佐剂的研发(山药多糖、黄芪多糖等)可提高PRRSV灭活疫苗的保护率。弱毒疫苗和灭活疫苗的联合使用是PRRSV疫苗免疫防控的新趋势[22-23]。
该猪场此次疫情发生,产房仔母猪的PRRSV水平传播是主要原因,转群应激是引起疾病波动的次要原因。在本次疫情中,通过药物保健后PRRSV弱毒疫苗和PCV2灭活疫苗的紧急免疫,大群2周内基本趋于稳定。在以往的PRRSV和PCV2的混合感染案例中,大家倾向于提高管理水平、病弱猪隔离饲养及添加抗生素防止细菌的继发感染[24-25]等综合防控措施,疫苗紧急免疫的措施采取较少,但从笔者的疾病临床防控经验来看,猪群在发生PRRSV波动早期时,弱毒活疫苗的紧急免疫有利于猪群微生态平衡的重新建立,短时期内使大群趋于稳定,减少猪伤亡。PCV2做为最小的动物病毒之一,在自然界中广泛存在,PCV2单独感染仔猪不会出现严重的临床症状,PCV2与PRRSV的混合感染可彼此促进感染进程和加重临床症状,本案例发现PCV2疫苗免疫能降低猪群PCV2的病毒血症发生率,受野毒刺激的影响,康复的猪会再次感染出现PCV2病毒血症;PCV2疫苗免疫后6周抗体S/P均值从1.55降至0.7,8周以后PCV2抗体水平持续增高到猪出栏,说明猪群中一直有PCV2的循环感染。为了提高猪场经济效益,建议养殖户从引种源头把好健康关,杜绝PRRSV和PCV2阳性猪群的引入。从环境控制、饲养管理水平、预防用药及合理免疫四方面协同提高猪健康度,避免疾病困扰造成的经济损失。
