塞内卡病毒3D蛋白的截短表达及多克隆抗体的制备
2023-09-22莫勇芳刘文波何启杰隋梦琪欧阳康黄伟坚韦祖樟
莫勇芳,王 豪,刘文波,何启杰,隋梦琪,陈 樱,2,3,欧阳康,2,3,黄伟坚,2,3,韦祖樟,2,3*
(1.广西大学动物科学技术学院,动物传染病与分子免疫学实验室,广西南宁 530005;2.广西壮族自 治区兽用生物制品工程研究中心,广西南宁 530005;3.广西高校动物疫病预防与控制重点实验室,广西南宁 530005)
A型塞内卡病毒(Senecavirus A,SVA)又称塞内卡山谷病毒(Seneca vally virus,SVV),是塞内卡病毒属的唯一成员[1-6]。该病毒2002年首次被分离,命名为SVV-001[1,6-7]。SVV-001对猪无致病性,人工感染SVV-001的猪无临床症状[5,8]。2007年SVA逐渐在加拿大、美国、巴西等国家出现并蔓延,感染猪以水疱损伤为临床症状[9-10]。2015年我国广东省最先检测到该病毒并对其报道,而后在湖北、福建、河南等省份也逐渐出现了塞内卡病毒感染的病例[1,9-11]。猪感染SVA后的临床症状为:鼻部及口腔黏膜、蹄部冠状带出现水疱,同时可以观察到发病猪跛行、站立困难,严重者还会出现蹄壳脱落。SVA感染在新生仔猪和母猪中发病率较高,7日龄以内的新生仔猪死亡率高达30%~70%[1,6-7],严重影响了养猪业的健康发展。SVA作为一种新出现的传染病病原对养猪业存在重大威胁。
SVA基因组为单股、线性、正义RNA,长度约为7.2 kb。SVA基因组仅含有一个开放阅读框(ORF),编码一个大型多聚蛋白,被切割为典型的小RNA病毒L-4-3-4布局,可裂解为12个成熟的病毒蛋白,即前导蛋白L,结构蛋白VP1、VP2、VP3、VP4,非结构蛋白2A、2B、2C、3A、3B、3C、3D[1-2,5,7,11]。SVV-001的非结构蛋白中,2C、3C、3D的多肽区域较为保守。3D蛋白是RNA依赖的RNA聚合酶的主要成分,在病毒复制和VPg尿苷酰化中起着重要作用[1-3,7]。本研究拟通过构建表达截短3D蛋白的原核表达载体,表达纯化截短3D蛋白后免疫新西兰大白兔制备大量多克隆抗体,对获得的抗体鉴定成功后为后续对3D蛋白的功能研究以及SVA病毒致病机制的深入研究储备材料。
1 材料与方法
1.1 材料
1.1.1 病毒、细胞、质粒和实验动物 本研究所用SVA毒株为SVA/GX/CH/2018(GenBank登录号:MK039162.1)[10]、原核表达载体pET-32a(+)和BHK-21细胞由广西大学动物科学技术学院动物传染病与分子免疫学实验室分离保存。4 kg左右的新西兰大白兔购自广西大学实验动物中心。
1.1.2 主要试剂 引物合成于北京擎科生物科技有限公司;PrimeStar Max DNA Polymerase、T4 DNA Ligase、BCA蛋白定量试剂盒,宝生物工程(大连)有限公司产品;Gel Extraction Kit、Cycle Pure Kit,美国OMEGA公司产品;AxyPrep体液病毒DNA/RNA小量制备试剂盒,爱思进生物技术(杭州)有限公司产品;内切酶EcoRⅤ、EcoRⅠ,纽英伦生物技术(北京)有限公司产品;Trans5α Chemically Competent Cell、BL21(DE3)Chemically Competent Cell、FITC标记的山羊抗兔IgG(H+L),北京全式金生物公司产品;异丙基-β-D-硫代吡喃半乳糖苷(IPTG),北京索莱宝科技有限公司产品;Ni琼脂糖凝胶,北京康为世纪生物技术有限公司产品;5×蛋白上样缓冲液、HRP-山羊抗兔IgG,上海碧云天生物技术有限公司产品;预染蛋白质分子量标准,南京翼飞雪生物科技有限公司产品。
1.1.3 主要仪器设备 移液枪和离心机,Eppendorf公司产品;PCR仪、细菌恒温培养箱、细胞恒温培养箱及荧光倒置显微镜,Thermo公司产品;无菌操作台,苏州安泰空气技术有限公司产品;琼脂糖凝胶电泳仪,北京六一生物科技有限公司产品;凝胶成像仪和垂直电泳仪,Bio-Rad公司产品;Western blot化学发光成像仪,Cytiva公司产品;恒温水浴锅,邦西仪器科技有限公司产品;倒置显微镜,Nikon公司产品;超声波破碎仪,宁波新芝生物科技股份有限公司产品。
1.2 方法
1.2.1 引物设计与扩增 用Protean软件分析SVA 3D基因的全序列。由于3D蛋白的100 aa-300 aa具有丰富的抗原表位,因此将其编码该段的基因作为目的片段进行扩增,大小共计600 bp。分别设计上游引物:5′-acgGATATCatccctggactagacccta-3′,下划线处为引入的酶切位点EcoRⅤ;下游引物:5′-cgtGAATTCggtcgcggcacaaccagag-3′,下划线处为引入的酶切位点EcoRⅠ。使用抽提试剂盒提取SVA/GX/CH/2018毒株的RNA,以SVA/GX/CH/2018毒株RNA为模板进行反转录,RT反应程序为:42℃ 1 h;以获得的cDNA为模板扩增3D截短基因,PCR反应程序为:95℃ 3 min;98℃ 10 s,56℃ 5 s,72℃ 10 s,共计32个循环;72℃ 10 min,扩增目的片段。
1.2.2 重组质粒的构建 将pET-32a载体与扩增的截短3D基因胶回收产物分别与限制性内切酶EcoRⅤ和EcoRⅠ于37℃孵育5 h后回收酶切产物。将回收产物按照载体∶目的片段=1∶7的比例用T4连接酶16℃过夜连接,连接产物转化Trans5α感受态细胞,转化产物涂布于含氨苄青霉素钠的LA平板过夜培养。挑取单个菌落,37℃、200 r/min振荡培养16 h,抽提质粒,经EcoRⅤ和EcoRⅠ双酶切鉴定,质粒送上海生工生物工程公司测序。
1.2.3 目的蛋白的原核表达 选取测序正确的重组质粒转化BL21(DE3)感受态细胞,涂板、培养后挑取单个菌落进行少量表达鉴定。经37℃、200 r/min恒温培养箱震荡培养至菌液OD600nm=0.4~0.6时加入终浓度为0.5 mmol/L的IPTG溶液,再将菌液转移至16℃、200 r/min低温摇床振荡培养过夜。取部分诱导后菌液,离心获得菌体,PBS重悬后超声破碎菌体,4℃离心获得上清和沉淀。将诱导菌体、上清、沉淀与5×SDS Loading buffer混合,处理变性后经SDS-PAGE和考马斯亮蓝染色观察目的蛋白表达情况。
1.2.4 重组SVA 3D蛋白的纯化与鉴定 菌液经大量扩繁诱导后,离心、超声、沉淀溶解后4℃离心10 min,按照Ni-NTA说明书的方法对重组蛋白进行纯化。纯化后的蛋白使用BCA蛋白定量试剂盒测定蛋白浓度。将纯化的蛋白样品煮沸变性后上样进行SDS-PAGE及考马斯亮蓝染色。
1.2.5 SVA 3D蛋白多克隆抗体的制备 首免前先在免耳缘静脉采集分离血清作为后续试验的阴性对照血清。首免时将纯化的3D蛋白与弗氏完全佐剂按照1∶1比例充分乳化,按照1 mg/只的剂量于兔颈部、背部、臀部的皮下多点注射免疫。二免与三免时将纯化蛋白与弗氏不完全佐剂按照1∶1比例充分乳化免疫,免疫剂量为500 μg/只。三免4 d后可采集耳缘静脉血测定抗体效价决定是否需要四免,本研究三免1周后心脏采血,分离血清,分装保存。
1.2.6 间接ELISA测定SVA 3D蛋白多克隆抗体的效价 所有血清样本设置3个重复。200 ng/孔的蛋白在4℃条件下包被过夜。孵育后弃液,TBST振荡洗涤3次,每次5 min。然后加入含50 g/L脱脂乳的封闭液,37℃恒温箱内封闭2 h。洗板3次,以TBST稀释的待检阳性血清与未免疫兔的阴性血清为一抗,一抗稀释梯度按1∶1 000、1∶2 000、1∶4 000、1∶8 000、1∶16 000、1∶32 000、1∶64 000、1∶128 000、1∶256 000、1∶512 000进行,每孔加入100 μL稀释的血清,37℃孵育 1 h。洗板3次,加入100 μL稀释比例为1∶10 000的HRP标记羊抗兔IgG,37℃孵育1 h。洗板3次,使用TMB显色液显色,常温下避光放置10 min,再加入终止液。5 min内使用酶标仪测定每个孔在OD450nm的吸光度。
1.2.7 SVA 3D蛋白多克隆抗体间接免疫荧光分析 BHK-21细胞消化后铺12孔板,待细胞长成单层后按照MOI=0.1的剂量接种SVA/GX/CH/2018毒株,准备进行间接免疫荧光测验(indirect immunofluorescence assay,IFA)。18 h后用冰甲醇固定细胞。同时设置未接毒的BHK-21细胞作为阴性对照。固定后用PBS洗3次,加入含50 g/L脱脂乳的封闭液,37℃封闭1 h。洗板3次,加入一抗,一抗为稀释的SVA 3D蛋白多克隆抗体血清,37℃静置2 h。为了确定3D蛋白多克隆抗体的最佳使用浓度,一抗设置4个稀释梯度,即1∶50、1∶100、1∶200、1∶400。PBST洗板5次,加入1∶500稀释的FITC标记山羊抗兔IgG,37℃避光作用45 min,洗板5次,DAPI染色,室温下静置10 min,洗板2次后于倒置荧光显微镜观察结果。
1.2.8 SVA 3D蛋白多克隆抗体Western blot分析 BHK-21细胞消化后铺6孔板,待细胞长成单层后按照MOI=0.1的剂量接种SVA/GX/CH/2018毒株,24 h后收集细胞。同时收集未接毒的BHK-21细胞作为阴性对照。细胞样品变性后上样进行SDS-PAGE,电泳完成后将蛋白转印至PVDF膜,使用含50 g/L脱脂乳的封闭液于37℃封闭2 h,PBST洗3次,每次5 min;按照1∶500的比例用PBST稀释3D蛋白多克隆抗体作为一抗,4℃孵育过夜。洗膜5次,加入1∶2 000稀释的HRP标记的山羊抗兔IgG,37℃孵育45 min,洗膜5次。用ECL超敏化学发光试剂盒显色后于Western blot化学发光成像仪曝光成像。
2 结果
2.1 重组质粒的构建与鉴定
以SVA/GX/CH/2018 cDNA为模板,通过PCR扩增截短3D基因片段(图1A),将扩增片段克隆至载体pET-32a(+)中,获得携带3D基因片段的重组原核表达质粒pET-32a-3D。使用EcoRⅤ和EcoRⅠ对重组质粒进行双酶切鉴定,如图1B所示,除了载体片段外,还切出大小为600 bp的目的条带,与预期大小一致;测序后结果显示插入的片段为扩增的3D基因片段。

A.M1.DNA标准DL 2 000; 1.SVA 3D基因; B.M2.DNA标准DL 10 000; 1.重组质粒pET-32a-3D的EcoRⅤ和EcoRⅠ双酶切
2.2 SVA 3D截短蛋白的诱导表达
诱导目的蛋白表达后,进行SDS-PAGE发现目的蛋白均在沉淀中表达,大小约39.5 ku,上清未见符合预期大小的蛋白条带。大量诱导目的蛋白表达后进行纯化,经SDS-PAGE分析获得了与预期相符大小的单一条带(图2)。对纯化蛋白用BCA蛋白定量试剂盒检测,浓度为1.5 mg/mL。

M.蛋白分子质量标准; 1.未诱导pET-32a(+); 2.未诱导pET-32a-3D; 3.IPTG诱导pET-32a; 4.IPTG诱导pET-32a-3D; 5.诱导的pET-32a-3D上清; 6.诱导的pET-32a-3D沉淀;7.纯化3D重组蛋白
2.3 SVA 3D蛋白多克隆抗体效价测定
采用间接ELISA方法,以纯化的3D蛋白作为包被抗原,三免后1周采集兔血清作为一抗对制备的多克隆抗体进行效价测定。以阳性与阴性血清的OD450nm之比(P/N)大于或等于2.1时的血清最高稀释倍数作为抗体效价,结果如图3所示,制备的多克隆抗体在1∶256 000时P/N仍然大于2.1(图3),说明制备的3D蛋白多克隆抗体效价超过1∶256 000。

图3 SVA 3D蛋白多克隆抗体效价测定
2.4 SVA 3D蛋白多克隆抗体IFA分析
SVA/GX/CH/2018接种于BHK-21细胞,18 h后固定,3D蛋白多克隆抗体分别按照1∶50、1∶100、1∶200、1∶400的比例稀释后作为一抗进行IFA试验。在荧光显微镜下观察试验结果(图4),可观察到在1∶50至1∶400的条件下,感染SVA的细胞中均呈现明显的绿色荧光,而未接种SVA/GX/CH/2018的BHK-21细胞中未观察到荧光,结果表明制备的3D蛋白多克隆抗体能够识别SVA的3D蛋白。
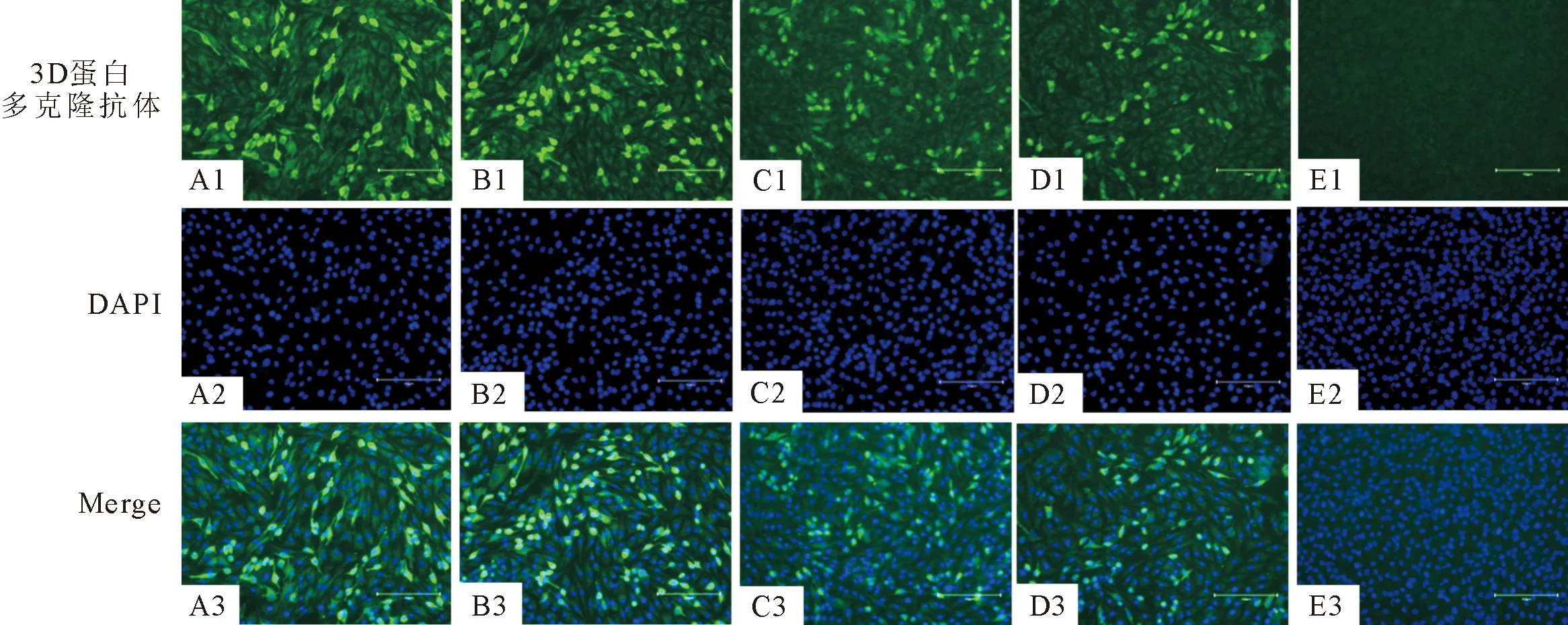
A1~A3.感染SVA的BHK-21细胞(1∶50);B1~B3.感染SVA的BHK-21细胞(1∶100);C1~C3.感染SVA的BHK-21细胞(1∶200);D1~D3.感染SVA的BHK-21细胞(1∶400); E1~E3.未感染SVA的BHK-21细胞
2.5 SVA 3D蛋白多克隆抗体的Western blot分析
SVA/GX/CH/2018以MOI=0.1接种BHK-21细胞,24 h后收集细胞,同时设置未接种SVA/GX/CH/2018的BHK-21细胞作为阴性对照。对细胞裂解液处理后进行Western blot分析,在51 ku左右出现与预计3D蛋白大小相符合的印迹条带(图5),表明制备的多克隆抗体能够与SVA 3D蛋白结合。

M.蛋白分子质量标准;1.感染SVA的BHK-21细胞;2.未感染SVA的BHK-21细胞
3 讨论
SVA感染己经在美国、加拿大、巴西、中国、泰国和越南等国家猪场暴发,并造成较严重的经济损失[2,5,10,12]。SVA作为引发猪水疱性疾病的主要病原之一,各年龄段的猪均可感染[1,7,13]。通过序列比较和遗传进化分析表明,当前流行的对猪具有致病性的SVA毒株与原型毒株SVV-001遗传距离较远,表明SVA的毒力明显增强且还在不断进化[1,13-14]。目前针对SVA的商品化疫苗及检测试剂还不成熟[11],因此还需要继续深入SVA的相关研究。本研究通过表达SVA 3D截短蛋白并制备了相应的多克隆抗体,为后续开展3D蛋白功能的研究以及SVA致病机制研究提供材料储备。
本研究中3D截短蛋白以包涵体形式表达,纯化后的重组蛋白浓度为1.5 mg/mL,达到了免疫试验动物的要求。用间接ELISA方法对制备的抗血清进行抗体测定,其效价超过了1∶256 000,后续对抗体进行IFA和Western blot鉴定,IFA检测后在荧光显微镜下,SVA感染的BHK-21细胞中能够观察到明显的荧光,表明制备的抗体能够与SVA 3D蛋白发生特异性结合;从SVA感染的BHK-21细胞样品中采用Western blot方法能检测到与预期大小相符条带,虽然存在部分杂带,可能是多克隆抗体与其他蛋白非特异性结合所致。总体来说,本研究成功制备了SVA 3D蛋白的多克隆抗体,且该抗体具备良好的反应性。
