脂多糖对牛乳腺上皮细胞自噬和凋亡的影响
2023-09-22高英魁郝中华刘静静张华强张珂菲周广薇邓立新王学兵
张 兴,高英魁,郝中华,刘静静,张华强,归 荣,张珂菲,周广薇,邓立新,王学兵,2*,童 超,2*
(1.河南农业大学动物医学院,河南郑州 450002;2.河南农业大学动物免疫学国际联合研究中心,河南郑州 450046)
奶牛乳腺炎给奶牛养殖业造成了巨大的经济损失[1],造成产奶量降低、奶牛淘汰和治疗费用等。发病因素主要以细菌性感染为主,分为传染性和环境性乳腺炎。前者主要由大肠埃希氏菌(E.coli)、链球菌(S.aureus)、无乳链球菌(S.agalactiae)和支原体(Mycoplasma)感染等。在挤奶过程中,通过手、毛巾或者被细菌污染的挤奶器将将病菌传染给了健康母牛。环境性乳腺炎发病原因主要是奶牛周围环境的污染,如垫料、土壤、排泄物、污水等[2]。该病发病率高流行广泛,对全球奶牛生产都产生了严重的影响[1]。据统计,奶牛乳腺炎的发病率高达50%,且在全球每年造成的损失高达约350亿美元[3]。预防和治疗奶牛乳房炎是国内外亟待解决的问题。
脂多糖(lipopolysaccharides,LPS)是一种位于革兰氏阴性菌细胞壁上的糖脂质,包括核心多糖、类脂A和O-抗原[4],是革兰氏阴性菌的主要致病性物质。类脂A是 LPS的关键毒性部位,它能诱导细胞对 LPS产生应答,进而导致炎症和细胞凋亡。细胞外LPS的刺激可以被细胞膜上的TLR4/MD-2受体复合物识别,使髓样分化因子 88与TLR4结合,导致NF-κB活化后进入细胞核内诱导特定基因的转录和表达,从而引起炎症反应和细胞凋亡信号的活化[5-7]。LPS的刺激可以激活促凋亡因子BAK、BAX过表达,导致细胞色素C和其他蛋白进入细胞质,活化caspase-3、caspase-9引起细胞凋亡[8-9]。也有其他研究表明,LPS可通过TIR结构域衔接蛋白信号途径诱导上皮细胞凋亡,TIR结构域衔接蛋白的连接蛋白IRAK-1能与Fas死亡结构域相关蛋白结合,激活 caspase凋亡相关蛋白酶,从而诱导细胞凋亡[10-12],但是LPS诱导上皮细胞凋亡的确切机理尚待深入探讨。
细胞自噬在演化过程中表现出高度的保守性,其发生和发展受许多与自噬相关的基因控制[13]。哺乳动物的自噬诱导机制主要是由Atg12的结合和LC3的修饰作用引起的[14]。Atg12的结合作用是一个类似泛素化的过程,需要泛素活化酶E1、E2的参与。Atg12先被Atg7 (E1样酶)激活,然后用Atg10(E2样酶)将其转移到Atg5,最终与Atg16结合形成多聚体复合体,并参与自噬扩展[15-16]。LC3 前体形成后,被Atg4 加工成胞浆可溶性的 LC3-Ⅰ,在Atg7和Atg3的作用下形成LC3-Ⅱ参与自噬体膜的延伸直到自噬溶酶体的形成,因此LC3-Ⅱ被作为自噬形成的标志物,也是目前唯一发现定位于自噬泡膜上多种信号传导的调节蛋白[17-18]。本试验以不同浓度的LPS处理MAC-T细胞诱导自噬和凋亡,检测LPS对MAC-T细胞自噬和凋亡的影响,为大肠埃希氏菌诱导牛乳腺炎发生机制的研究提供参考,为临床应用奠定试验基础。
1 材料与方法
1.1 材料
1.1.1 细胞 牛乳腺上皮细胞(MAC-T)来自河南农业大学生理生化实验室。
1.1.2 主要试剂 连翘酯苷A(纯度>98%),成都普飞德生物科技有限公司产品;脂多糖(LPS),美国Sigma公司产品;Trizol、反转录试剂盒,南京诺唯赞公司产品;2×RealStar Fast染料法qPCR预混液,北京康润公司产品;qPCR引物,上亚生物科技有限公司产品。试验所用抗体LC3α/β、P62、BAX、BCL-2、ATG5、ATG7、Beclin-1、caspase-3,万类生物科技公司产品。
1.1.3 主要仪器 CO2培养箱,美国Thermo公司产品;冷冻离心机,Eppendorf公司产品;超净工作台,苏州金燕净化设备厂产品; 酶标仪,Tecan公司产品;倒置相差显微镜,Leica公司产品; 蛋白电泳仪,Bio-Rad公司产品;qPCR设备,德国Analytik-Jena公司产品;显影仪,上海Tanon公司产品。
1.2 方法
1.2.1 细胞培养和分组 试验前从液氮罐中取出冻存的MAC-T牛乳腺上皮细胞,复苏后在含100 mL/L胎牛血清的DMEM培养液、37℃、体积分数为5%的CO2培养箱中培养。2~3 d传代1次,取处于对数生长期MAC-T细胞用于自噬和凋亡模型的建立,用 LPS(0、50、100、200 μg/mL)不同浓度处理MAC-T细胞12 h,查看自噬和凋亡基因和蛋白的表达。
1.2.2 CCK-8法检测细胞活力 按细胞计数板法计数,以1×104细胞/cm2的密度将MAC-T细胞接种于96孔板。根据使用说明,采用CCK-8试剂盒对细胞活性进行测定。将 LPS加入到细胞中12 h和24 h后,加入10 μL CCK-8溶液在37℃的遮光环境中培养1 h~4 h。用酶标仪测定450 nm波长的吸光度,检测细胞的活性。
1.2.3 LDH法检测细胞上清液中乳酸脱氢酶含量 以1×104细胞/cm2的密度将MAC-T细胞接种于96孔板,收集细胞培养液并以1 100 r/min离心5 min,取20 μL培养液上清于全新的96孔板中。向各孔中加入25 μL基质缓冲液和5 μL辅酶溶液,轻微震荡混匀后,放入37℃恒温水浴锅温浴15 min。加入25 μL 2,4-二硝基苯肼混匀后继续37℃水浴15 min。加入250 μL 0.4 mol/L的NaOH溶液混匀,室温静置5 min。使用酶标仪检测450 nm波长处的吸光度,每个处理组6个重复,取平均值记录。按照说明书要求将2 μmol/mL的丙酮酸标准品用双蒸水分别稀释200倍、100倍、50倍、20倍、10倍、5倍、2倍,按照上述操作测得吸光度后绘制标准曲线。计算各处理组LDH的含量。
1.2.4 RT-qPCR(荧光定量PCR) 用移液枪吸弃4组样本的细胞培养上清,用PBS洗细胞2次,加入1 mL Trizol溶液,吹打混匀,静止10~15 min使细胞充分裂解。裂解后的细胞移到1.5 mL的EP管中,12 000 r/min、4℃离心5 min,移液枪吸取上清液至新的1.5 mL的EP管中,管中加0.2 mL氯仿,混匀,静置,12 000 r/min、4℃离心15 min,加1 mL异丙醇,混匀,静置,12 000 r/min、4℃离心10 min,接下来弃上清,加入1 mL的DEPC水配制的750 mL/L的乙醇,7 500 r/min、4℃离心5 min,用移液枪小心的把上层乙醇吸出只留下沉淀,将EP管倒扣在吸水纸上使乙醇挥发,加20 μL的DEPC水将沉淀溶解,测定各样品RNA浓度,4组样品浓度稀释至1 000 ng/μL,根据反转录体系合成cDNA。采用两步法进行RT-qPCR扩增。20 μL体系,上、下游引物各0.5 μL,cDNA 1 μL,2×RealStar Fast染料法qPCR预混液10 μL,无菌无酶水8 μL,以上所有步骤均在冰上进行,引物序列信息见表1。

表1 引物序列信息
1.2.5 蛋白质免疫印迹分析 使用RIPA裂解液提取细胞的总蛋白,用BSA试剂盒测定总蛋白浓度,在SDS凝胶电泳每孔上样30 μg进行电泳后,将蛋白转印到PVDF膜上,在37℃下用50 g/L的脱脂奶粉进行封闭,一抗孵育4℃过夜,用二抗孵育1 h,然后用ECL显色液检测膜上的信号,并通过Tanon 5200收集数据。
1.3 数据处理
数据采用SPSS 24.0进行统计分析,各组试验数据均用“平均值±标准差”表示。组间比较采用单因素方差分析,差异显著性以P<0.05表示。
2 结果
2.1 细胞活性的测定
在12 h处理组中,50 μg/mL~100 μg/mL LPS处理细胞活力无明显变化,在150、200、250 μg/mL处理下细胞活力显著下降。在LPS 24 h处理组中,50、100、150、200、250 μg/mL LPS处理下MAC-T细胞活力显著下降(图1)。表明MAC-T细胞的活力会随着LPS浓度和处理时间增加而下降。
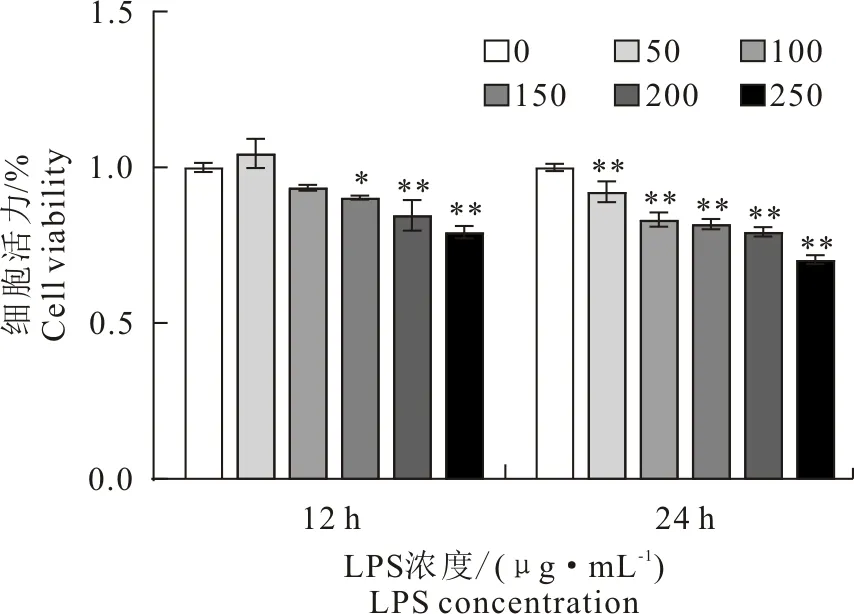
与对照组相比,*P<0.05,**P<0.01
2.2 LPS对MAC-T细胞上清LDH的含量影响
与对照组相比,用50、100、150、200、250 μg/mL LPS处理的细胞,细胞上清中的LDH显著升高,呈现出梯度依赖性,表明随着LPS浓度的增加,对细胞的损伤程度加重(图2)。
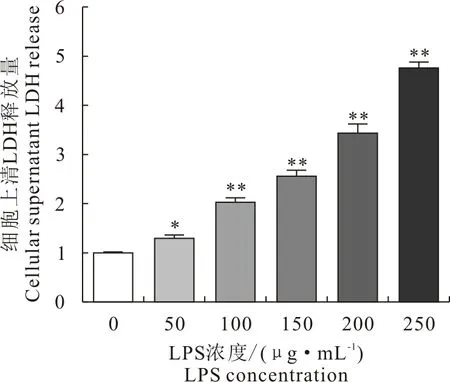
与对照组相比,*P<0.05,**P<0.01
2.3 LPS对MAC-T细胞核形态的影响
Hoechst33342染色观察不同浓度的LPS(0、50、100、200 μg/mL)处理12 h对MAC-T细胞核的影响(图3)。对照组细胞核呈卵圆形,染色质均匀分布,LPS处理后,细胞核形态出现异型性,染色质碎裂、固缩(图3白色箭头)。随着LPS浓度增加,形态异常细胞核数目逐渐增多。
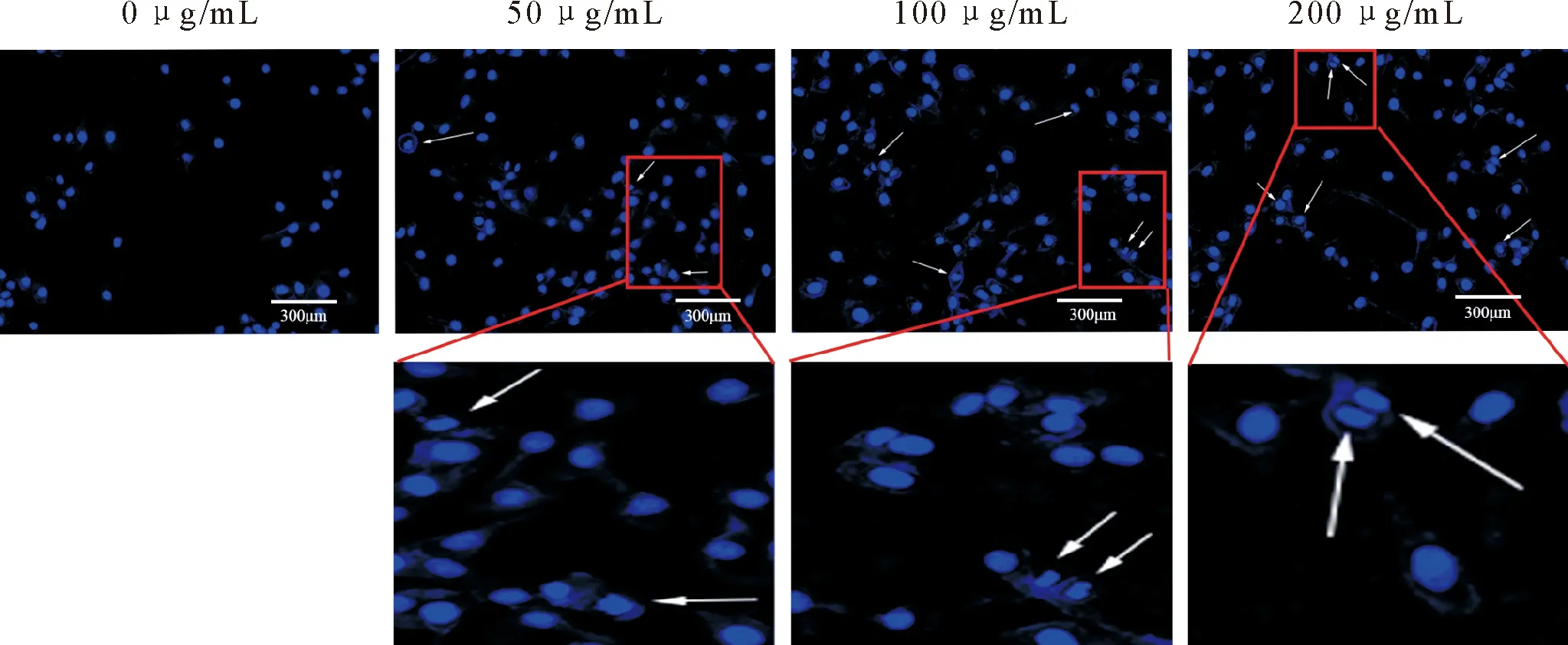
白色箭头指示发生形态变化的细胞核White arrows indicate morphologically altered nuclei
2.4 LPS处理MAC-T细胞自噬和凋亡相关基因的表达
与对照组相比,不同浓度LPS(50~100 μg/mL)处理后,自噬相关基因LC3B、P62、ATG5、ATG7、Beclin-1的mRNA表达量极显著上升(P<0.01),与LPS 100 μg/mL浓度对比,在200 μg/mL浓度LPS处理组,LC3B、P62、ATG5、ATG7、Beclin-1的mRNA表达量极显著下降(P<0.01)(图4A~图4E)。凋亡相关基因在不同浓度LPS(50、100、200 μg/mL)处理后,BAX和caspase-3表达极显著升高(P<0.01),BCL-2表达呈现出极显著下降(P<0.01)(图4F~图4H)。

A.LC3B mRNA; B.p62 mRNA; C.ATG5 mRNA; D.ATG7 mRNA; E.Beclin-1 mRNA; F.BAX mRNA; G caspase-3 mRNA; H.BCL-2 mRNA;与对照组相比,*P<0.05,**P<0.01,##P<0.01
2.5 LPS处理MAC-T细胞自噬和凋亡相关蛋白的表达
与对照组相比,LPS(50、100 μg/mL)处理下自噬相关蛋白LC3B、P62、ATG5、ATG7和Beclin-1的表达极显著上升(P<0.01),与LPS 100 μg/mL浓度对比,在200 μg/mL浓度LPS处理组,自噬相关蛋白LC3B、ATG5、ATG7和Beclin-1的表达呈现下降趋势(图5A~图5E)。与对照组相比,凋亡相关到蛋白在不同浓度LPS(50、100、200 μg/mL)处理后,BAX和caspase-3表达显著升高,BCL-2表达呈现出极显著下降(图5F~图5H)。
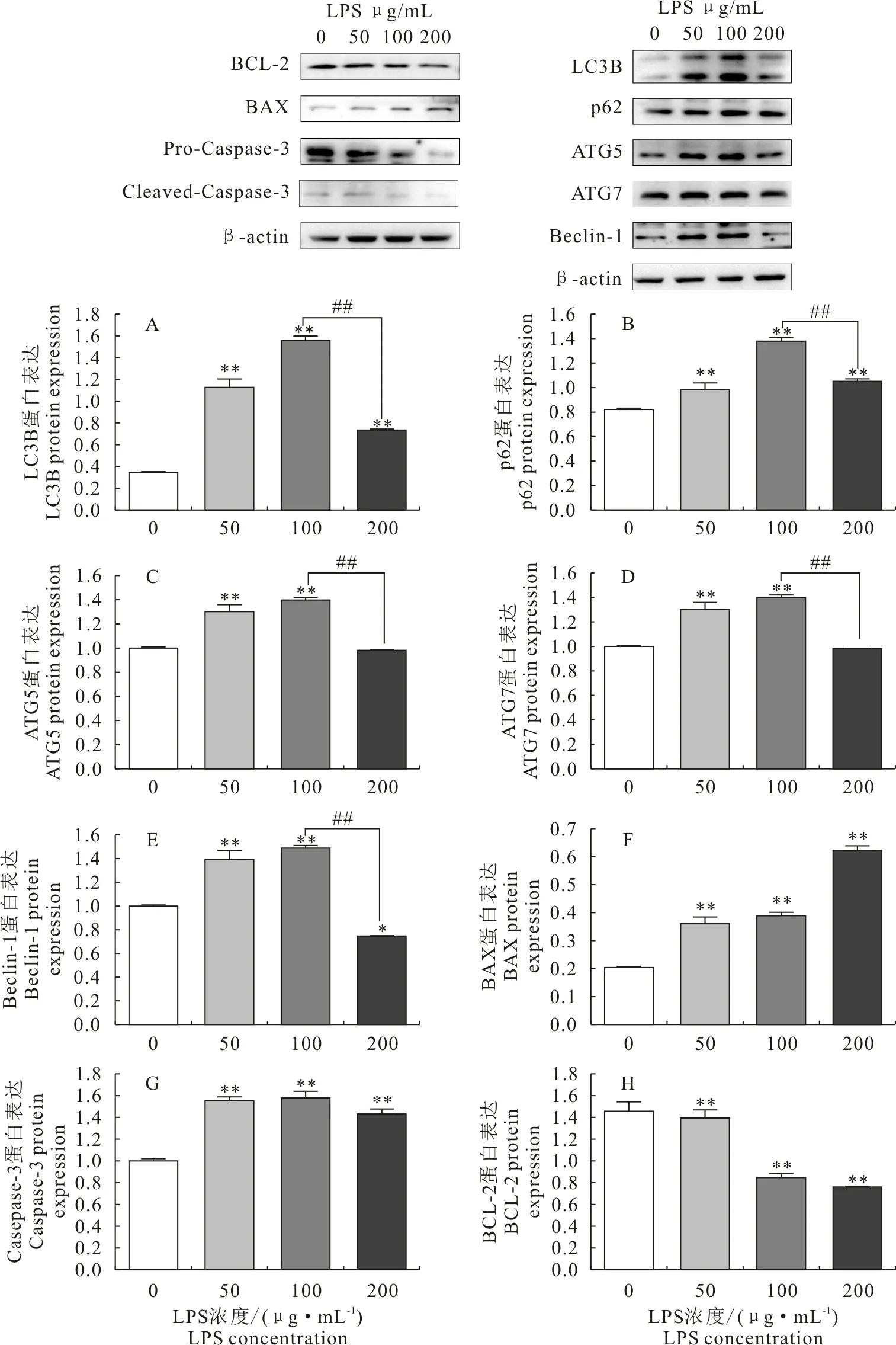
A.LC3B protein; B.p62 protein; C.ATG5 protein; D.ATG7 protein; E.Beclin-1 protein; F.BAX protein; G.Caspase-3 protein; H.BCL-2 protein;与对照组相比,*P<0.05,**P<0.01,##P<0.01
3 讨论
乳腺上皮细胞是乳腺天然免疫屏障的主要组成成分,是研究泌乳机制、乳腺炎发病机制的重要细胞模型。本研究以MAC-T细胞为研究对象,探究不同浓度的LPS对MAC-T细胞自噬和凋亡的影响。自噬在真核细胞中是一种独特的现象,是细胞在饥饿时通过循环利用细胞质的物质来补充自己的能量,自噬分为4种,微自噬、分子伴侣介导的自噬、非典型自噬及巨自噬[19],本文主要适用于巨自噬。自噬对维持细胞的结构具有重要意义,ATG5、ATG7和Beclin-1在巨自噬中是必须的基因[20]。体外试验表明,ATG5作为自噬的关键枢纽,被敲除后可以抑制自噬的发生并且促进细胞凋亡[21],还可以激活NF-κB信号通路产生一系列炎症损伤[22]。ATG7敲除会影响自噬体的形成及线粒体的形变,产生自噬性的损害。本文研究显示,LPS可以使LC3和p62蛋白水平升高,证明了LPS可以提升MAC-T细胞自噬的水平,p62的下降代表自噬流顺畅[23-24],p62升高代表自噬小体降解受到抑制,可以推测LPS在引起MAC-T细胞自噬增加的同时,阻滞细胞内自噬溶酶体的降解。研究发现,在巨噬细胞中LPS的刺激可以使p62升高,与本试验研究结果一致。在内皮细胞中低于1 μg/mL的LPS造成p62表达上升,高于1 μg/mL的LPS会使p62表达下降[25]。这种差异可能与细胞种类和LPS的浓度不同有关。
细胞凋亡是细胞程序性死亡的一种类型,分为内源性和外源性两种途径[26],这两种途径均可以导致caspase-3的激活,促进细胞色素C的释放,产生凋亡小体诱导caspase-9的活化并最终产生细胞凋亡[27]。ATG5在凋亡细胞中起到了关键的作用,在细胞凋亡发生时ATG5会被钙蛋白酶切割导致其N端片段进入线粒体和BCL-2家族受体结合相互作用,导致细胞色素C的释放促进细胞凋亡[28],且内质网中的BCL-2可以和Beclin-1的BH3结构域结合从而抑制自噬的发生,也可以被caspase-3、6、7、8、9、10进行剪切,C末端进入线粒体导致细胞色素C的释放从而导致促进凋亡的发生[29]。在本研究中200 μg/mL的LPS浓度对比100 μg/mL浓度处理MAC-T细胞自噬相关蛋白表达水平下降,很可能是凋亡的发生抑制了自噬的进程,细胞自噬不足以挽救细胞从而过度到了凋亡阶段。
综上所述,低浓度LPS(50~100 μg/mL)处理增加MAC-T细胞自噬,高浓度的LPS(200 μg/mL)可抑制此过程。同时伴随着LPS浓度梯度的上升(50~200μg/mL),细胞凋亡逐渐增加。
