猪NLRP3基因Real-time PCR检测方法的建立及应用
2023-09-22林盼盼谷英华刘海隆蔡青云王文秀
刘 博,张 倩,莫 玲,林盼盼,谷英华,刘海隆,蔡青云,张 艳*,王文秀,2*
(1.山东省滨州畜牧兽医研究院,山东滨州 256600; 2.山东省院士工作站,山东滨州 256600; 3.山东绿都生物科技有限公司,山东滨州 256600; 4.滨州市沾化区科技创新发展研究中心,山东滨州 256600; 5.滨州市滨城区农业农村综合服务中心,山东滨州 256600; 6.海南省农业科学院畜牧兽医研究所,海南海口 571100)
炎症反应是机体对感染和组织损伤的急性反应,可以抑制感染和组织损伤对机体造成的伤害,也可能导致继发性损伤和宿主免疫病。炎症小体是细胞免疫应答过程中产生的一种复合物,是天然免疫系统重要的组成部分[1-3]。它由胞浆内的模式识别受体(pattern recognition receptors,PRRs)参与并招募其他蛋白组装而成的。迄今为止发现的炎症小体中,NLRP3炎症小体研究最广泛。NLRP3属于NOD样受体(NOD-like receptors,NLRs)家族成员,可以被多种病原体如细菌、病毒、真菌、原虫感染所激活,也能够被各种不同结构的病原相关分子模式(pathogen-associated molecular patterns,PAMPs)、宿主内源危险信号(danger associated molecular patterns,DAMPs)和环境因素所刺激[4-6]。猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、猪链球菌2型(Streptococcussuis)、经典猪瘟病毒(Classical swine fever virus,CSFV)等猪流行性病原体均能激活NLRP3的转录[7-9]。
猪支原体肺炎(Mycoplasmalpneumoniaof swine,Mps)是由猪肺炎支原体((Mycoplasmahyopneumoniae,Mhp))引起的一类慢性呼吸道传染病,该病对各个年龄阶段的猪均易感且具有较高的感染率[10-11],给我国养猪业带来严重的经济损失。Mps的发病机理主要是Mhp先通过黏附素p97、p102和p159与呼吸道黏膜纤毛上皮细胞黏附引起病变[12],诱导炎性细胞聚集、细支气管扩张、单核细胞浸润等炎症反应,造成纤毛脱落以及对呼吸道上皮损害,引起继发性呼吸道感染。探究Mhp激活炎症反应的机制,找到有效抑制炎症反应的方法是降低猪支原体肺炎等呼吸道疾病的重要手段。猪是Mhp的唯一宿主,引起的猪呼吸道系统疾病及免疫能力下降已严重威胁我国养猪业的发展。本研究根据NCBI中猪NLRP3基因序列设计了一对特异性引物,建立了猪肺脏组织中NLRP3基因的SYBR GreenⅠ real-time PCR检测方法,并用该方法对Mhp感染后不同天数的猪肺组织中NLRP3转录水平变化进行分析,为进一步研究Mhp感染猪后NLRP3等炎症因子的作用机理提供技术支持。
1 材料与方法
1.1 材料
1.1.1 毒种与实验动物 猪肺炎支原体强毒JN-1株(滴度 1×109CCU/mL)由山东省滨州畜牧兽医研究院保存,5~15 日龄巴马香猪仔猪由山东绿都生物科技有限公司提供。
1.1.2 主要试剂与仪器 Roche FastStart Universal SYBR Green Master(Rox),猪肺炎支原体ELISA检测试剂盒,济南承森生物技术有限公司产品;Total RNA KitⅡ、Gel Extraction Kit、Plasmid Mini KitⅠ,OMEGA bio-tek公司产品;RevertAidTMFirst Strand cDNA Synthesis Kit,Thermo公司产品;Light Cycler®480型实时荧光定量PCR仪,Roche 公司产品。
1.2 方法
1.2.1 引物设计与合成 对GenBank数据库中猪NLRP3 cds序列进行分析,在其高度保守区域设计一对特异性引物,引物序列为YG-NLRP3-F:5′-AGCCTTGAAGAGGAATGGATGG-3′;YG-NLRP3-R:5′-GCCTGGTGAAGCGTTTGTTGAG-3′,预扩增片段长度为189 bp,引物由上海生工生物工程技术服务有限公司合成。
1.2.6 Mhp感染猪肺脏组织样品转录水平分析 选取30头5~15日龄健康仔猪,利用PCR或RT-PCR检测几种病原体,包括Mhp、PRRSV、圆环病毒-2、猪传染性胸膜炎病毒均为阴性。选择其中15头感染Mhp,气管注射,5 mL/头。感染后7 d采集鼻拭子样品,猪肺炎支原体ELISA检测试剂盒进行鉴定。根据猪肺炎支原体感染后发病的潜伏期、发病时间的长短及参考前期猪肺炎支原体攻毒试验,分别在感染后7、14、21、28、35、42 d各处死感染猪3头,并同时剖杀相应阶段的健康仔猪,取新鲜肺组织0.1 g在液氮中研磨后按OMEGA total RNA kitⅡ说明书提取总RNA,按建立的SYBR GreenⅠreal-time RT-PCR方法进行检测。
(2)以目标管理为导向,建立综合的指标考核体系。综合的指标体系至少应包含:利润总额、国有资产保值增值率和上缴学校利润、对学校教学科研的服务和支持力度、重大决策合规性、承担重大专项任务完成度、对国有资产的维护和保护程度、财务风险、安全生产、廉政建设等因素。
1.2.5 稳定性试验 分别取等量的8.4×107、8.4×106、8.4×105copies/μL的重组质粒,按上述方法进行实时荧光定量PCR扩增,每份样品设3个重复,进行批内重复性试验;同取以上3份样品,在相同反应条件下进行3次独立的检测,进行批间重复性试验。
RT-PCR扩增获得猪NLP3 cds基因片段(图1),克隆至pMD18-T载体中构建重组质粒,对其进行PCR检测得到1条大小为189 bp的特异片段,与预期目的片段大小相符,表明克隆载体pMD18T-NLRP3-189构建成功。取1 μL测定标准质粒的浓度为261 ng/μL,经计算重组阳性标准质粒的DNA分子数为 8.4×1010copies/μL。
结果显示,20 μL反应体系中加入引物终浓度为0.15 μmol/L 时目的条带最亮且没有引物二聚体可确定为最佳引物浓度。
1.2.4 标准曲线的建立及敏感性试验 将标准品质粒做10倍梯度稀释,获得8.4×108、8.4×107、8.4×106、8.4×105、8.4×104、8.4×103、8.4×102、8.4×101copies/μL的系列标准模板,采用优化的最佳反应条件进行SYBR GreenⅠ实时荧光定量PCR,得到各自的Ct 值,以Ct值为横坐标,以起始模板浓度的对数为纵坐标,制作标准曲线并确定最低检测量。
“这些纯正粮食酒绝无勾兑,案上各樽不仅酒精度不同,而且酿造年份也不同,按烈度由低到高、年份由短到长依次排列。想必您已品出差别,先是淡雅清香,渐次沁脾芬芳,继而浓郁醇厚,终于回甘无穷。”
1.2.2 阳性标准品的制备 从巴马香猪体内剖取猪肺组织0.1 g研磨后提取总RNA ,方法按OMEGA Total RNA KitⅡ说明书进行,得到的RNA测定浓度后利用RevertAidTMFirst Strand cDNA Synthesis Kit进行反转录,合成的cDNA置于-80℃保存备用。PCR扩增目的片段,反应体系为MixTaq25 μL,YG-NLRP3-F和YG-NLRP3-R(10 μmol/L)各1 μL,cDNA 2 μL,用无菌水补足至50 μL;反应程序为95℃ 3 min;95℃ 30 s,60℃ 30 s,72℃ 30 s,共35个循环;72℃延伸5 min。PCR产物在10 g/L琼脂糖凝胶上电泳检测扩增结果。回收纯化目的片段,将其连接至pMD18-T载体,构建阳性质粒并测序。测定阳性标准品浓度,计算拷贝数。
2.形象诊断式教学。形象诊断式教学是指在教学过程中,对着装、仪容、表情、体态、举止等内容学习后,教师现场组织形象诊断活动,包括自我诊断、相互诊断、集体诊断。其中相互诊断、集体诊断后,教师要对学生进行点评,通过学生对所学礼仪规范的掌握,进行诊查判断。最终达到学生对警察礼仪理论知识的掌握。这种方法适合在一个完整章节完成之后进行。
2 结果
2.1 阳性标准品的制备
拷贝数换算公式:拷贝数(copies/μL)=

M.DNA标准 DL 2 000; 1.NLRP3目的片段; 2.空白对照
M.DNA标准 DL 2 000; 1~10.不同引物浓度PCR扩增的NLRP3目的片段

1~8.8.4×108~8.4×101 copies/μL 1-8.8.4×108-8.4×101 copies/μL

图4 实时荧光定量RT-PCR标准曲线
2.2 PCR引物浓度的优化
1.2.3 PCR反应体系优化 以10倍稀释得到质粒标准品为模板,反应体系为20 μL,一对引物分别按0.1、0.2、0.3、0.4、0.5、0.6、0.7 、0.8、0.9、1.0 μL的量加入体系中进行PCR反应,10 g/L琼脂糖凝胶电泳分析结果,获得最佳引物浓度。
2.3 标准曲线绘制及敏感性试验
经反应条件的优化,确定荧光定量PCR 最佳反应体系为20 μL,包括2×SYBR Green Ⅰ Mixture 10 μL,上、下游引物(10 μmoL/L)各0.3 μL,模板(质粒或cDNA)2 μL,无菌水7.4 μL。反应条件为:95℃ 2 min;95℃ 10 s,60℃ 20 s,72℃ 20 s,40个循环。将阳性重组质粒经10倍系列稀释为8.4×108~8.4×101copies/μL共8个浓度作为标准品进行实时荧光定量PCR反应,结果各浓度之间均具有良好的线性关系,得到标准曲线方程为y=-3.5196x+36.968;Efficiency:0.96,R2为0.9996,最低检出量为84个拷贝。
2.4 熔解曲线
根据参数95℃ 15 s、65℃ 1 min、95℃ 30 s绘制熔解曲线。结果显示,标准样品均出现了窄且尖的单峰,而阴性对照没有出现熔点峰,熔解温度为(82±0.5)℃(图5),表明该反应为特异性扩增。

图5 质粒标准品实时荧光定量RT-PCR熔解曲线
2.5 稳定性试验
本研究建立的real-time PCR批内变异系数为0.067%~0.184%,批间变异系数为0.221%~0.594%(表1),表明该方法的检测稳定性良好。

表1 猪NLRP3基因SYBR GreenⅠreal-time PCR 检测方法稳定性
2.6 Mhp感染猪肺脏组织样品转录水平分析
感染组仔猪在人工感染Mhp强毒后7 d内,肺组织中NLRP3基因表达量明显增加;在感染后14 d可达到高峰,平均NLRP3拷贝数达18 000左右;在感染21 d后,NLRP3拷贝数缓慢下降,到本试验监测周期末(感染后42 d),NLRP3的平均拷贝数依然保持较高的水平,且感染组和健康组间整体差异显著(P<0.01)(图6)。
石灰活性对硬硅钙石纤维合成的影响规律可由溶解-吸附理论进行阐释。在初始阶段,随着环境的升高,石英粉和石灰开始溶解,由于石英粉的溶解度较低,石英粉颗粒表面会吸附溶液中的Ca2+形成一层CaSiO3水化膜,而后由于扩散和迁移作用,水化膜内部颗粒的逐渐溶解,同时硬硅钙石纤维开始形成。因此,在硅质原料活性不变的条件下,硬硅钙石纤维的合成速率和反应程度主要取决于石灰的活性。石灰活性越高,Ca(OH)2的溶解速率越快,溶液中Ca2+浓度越高,硬硅钙石纤维的合成速率也越快。因此,石灰活性越高,合成的硬硅钙石纤维晶型越好。
镁对作物养分效率的提高具有重要作用。作物养分效率可分为吸收效率和利用效率:吸收效率取决于植物根系对养分的选择性吸收和转运能力、根际养分供应能力和土壤养分有效性;利用效率一般以植物组织内单位养分所生产的干物质重量来衡量。
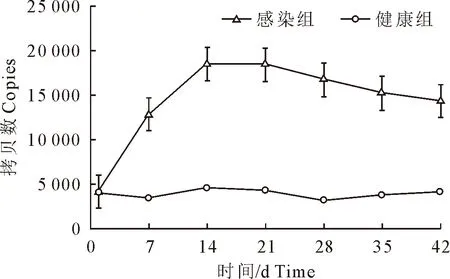
图6 Mhp感染后猪肺组织NLRP3表达水平变化
3 讨论
肺炎支原体(Mycoplasmapneumoniae,Mp)是一种非典型的细菌性呼吸道病原体,可引起一系列气道炎症、肺及肺外病变[13]。肺炎支原体能够触发NLRP3炎症体激活和白细胞介素-1β在巨噬细胞内的分泌[14]。正常RAW264.7细胞是可以表达NLRP3、ASC和caspase-1基因,而不同感染复数的Mp感染RAW264.7细胞4 h后,NLRP3、ASC和caspase-1表达均显著增加,说明NLRP3炎症体与Mp早期感染过程有关。在对绵羊肺炎支原体体外感染绵羊巨噬细胞分子机制的研究中发现,绵羊肺炎支原体及其脂质相关膜蛋白可引起绵羊肺泡巨噬细胞表面TLR2及胞内NLRP3受体基因转录水平和蛋白表达水平升高[15]。对于Mhp是否能激活猪体内NLRP3炎症小体的表达还未见报道。因此,建立一种快速、准确的猪NLRP3检测方法,对猪肺炎支原体致病机理进行深入研究非常必要。
本研究通过优化反应条件和特异性、敏感性、重复性试验,建立了猪NLRP3基因SYBR GreenⅠ荧光定量PCR检测方法。建立的检测方法特异性强,熔解曲线有单一峰;灵敏度高,最小检出量可达84 copies/μL,比常规PCR检测方法敏感100倍;稳定性好,批内变异系数小于0.2%,批间变异系数小于0.6%,具有良好的重复性。用该方法对健康仔猪和Mhp感染仔猪的肺脏中NLRP3进行检测,与健康仔猪相比Mhp感染7~42 d猪肺脏中的NLRP3表达水平明显提升,在14 d时达到峰值,表明Mhp感染可诱导NLRP3的激活,NLRP3的过量表达和释放与Mhp的感染引起猪肺组织的炎症反应存在密切的关系。本研究建立的SYBR GreenⅠ荧光定量PCR检测方法。可以用于检测NLRP3的转录水平的变化,为研究NLRP3在天然免疫细胞应答和猪支原体肺炎发病机理研究及抗炎药物的筛选提供了技术支持。
