山羊支原体山羊肺炎亚种重组酶聚合酶扩增技术的建立
2023-09-22王志宇康文彪
豆 玲,周 峰,张 莉,王志宇,康文彪*
(1.甘肃省动物疫病预防控制中心,甘肃兰州 730046;2.英科新创(苏州)生物科技有限公司,江苏苏州 215000)
山羊传染性胸膜肺炎(Contagious caprine pleuropneumonia,CCPP)[1-3]的病原体为山羊支原体山羊肺炎亚种(Mycoplasmacapricolumsubsp.capripneumoniae,Mccp)[4-6],其区别于绵羊支原体(Mycoplasmaovipneumoniae,Mo)与丝状支原体山羊亚种(Mycoplasmamycoidessubsp.capri,Mmc)[2-3]。Mccp只感染山羊[1,7],感染羊主要临床症状为发热、咳嗽和呼吸困难,剖检变化以纤维素性肺炎和胸膜炎为特征[8]。山羊传染性胸膜肺炎是世界动物卫生组织(WOAH)规定需要报告的疫病[1,4,9-10]。该病在我国流行比较严重,给山羊养殖业造成较大损失[11]。因此,建立一种检测时间较短、操作简便快捷、结果准确可靠且适合临床应用的检测方法对山羊传染性胸膜肺炎防控具有重要意义。重组酶聚合酶扩增(RPA)技术是2006年英国公司Twist DxInc研发的一种核酸恒温扩增技术[12],其运用生物酶的作用,模拟体内DNA复制,在25~42℃恒温下30 min左右即可完成对目的片段的扩增,操作简单[12-14]。目前RPA技术已被用于如丝状支原体山羊亚种[15]、动物衣原体[16]、非洲猪瘟病毒[17]等的检测,但未见报道用于Mccp的检测。2007年我国首次分离出山羊支原体山羊肺炎亚种[18]。有研究选择Mccp的arcA基因作为靶基因[19],经基因序列分析发现Mo不含arcA基因,与Mmc种间有较大的差异,且种间特异性高,所以本研究选择arcA假基因序列作为Mccp的检测靶基因,建立一种适用于检测山羊支原体山羊肺炎亚种的RPA方法。
1 材料与方法
1.1 材料
1.1.1 模拟样本和临床样本 Mccp-arcA假基因片段克隆至重组大肠埃希氏菌pUC57载体后制作成重组质粒,作为模拟样本。8份临床样品采自甘肃省庆城县和景泰县,临床上疑似山羊传染性胸膜肺炎,发病羊临床症状表现为流鼻涕、呼吸困难。2株羊传染性胸膜肺炎疫苗,Mo、Mmc细胞培养物。
1.1.2 试剂和仪器 核酸提取试剂盒(磁珠法)、核酸检测试纸条,英科新创(苏州)生物科技有限公司产品;TwistAmp®Basic试剂盒、TwistAmp®nfo RPA恒温扩增试剂盒,英国Twist Dx公司产品;Auto-Pure 32A全自动核酸提取仪,杭州奥盛仪器有限公司产品;Qubit荧光定量仪,Thermo Fisher公司产品;电热恒温培养箱,上海一恒科学仪器有限公司产品;生物安全柜,力康精密科技(上海)有限公司产品;超低温冰柜,日本SANYO公司产品。
1.2 方法
1.2.1 靶基因选择 经文献检索与基因分析,选择Mccp-arcA假基因作为靶基因。从NCBI上下载绵羊支原体(Mo)与山羊支原体山羊亚种(Mmc)基因组序列,用SnapGene软件进行种内保守性比对,用NCBI Blast进行种间特异性比对。用于种间比较的Mccp登录号:AY529462.1、CP041701.1、CP041712.1、CP041711.1、CP041707.1、CP041706.1、LN515398.1、CP041710.1、CP041709.1、CP017125.1、LM995445.1、CP041703.1、CP041702.1、CP041705.1、CP041708.1、CP041700.1、CP040917.1、CP101367.1、CP041704.1、CP030266.1、CP031288.1、CP031287.1、CP019061.1、LN515399.1、CP006959.1、CP000123.1。用于种间比较的Mmc登录号:CP065581.1、CP065580.1、CP065579.1、CP068010.1、CP065576.1、CP065574.1、CP065577.1、CP065588.1、CP065575.1、CP065586.1、CP065583.1、CP065582.1。
1.2.2 筛选引物及探针
基于CIM/G的电网调度控制系统Web图形展示技术//王民昆,韩晓,伍凌云,孙云枫,汪燕,翟明玉//(6):81
为了减少生活污水悬浮杂质进入处理系统,避免水泵及管线堵塞,同时使中水系统运行处理流量平稳,对沉淀池的出水口及厌氧池的转水进行了改造[4-5]。
张广才岭属于长白山支脉,位于中国东北地区东部山地北段的中轴部位(孙红阳等,2015),近年来,该区域大面积成熟林被砍伐,随后建立了落叶松(Larix gmelinii)人工林,同时部分裸地形成次生林。尽管如此,张广才岭地区仍然残余部分成熟森林,此区域的成熟林至少达 400 a,自禁止商业性采伐政策执行后,次生林和人工林林龄也约达50 a。目前,此区域由人工林、次生林和成熟林形成的森林景观为研究不同森林类型中生物多样性模式提供了理想的环境。
1.2.5 准确性与特异性试验 用2株羊传染性胸膜肺炎疫苗、阳性样本、阴性样本及Mo、Mmc细胞培养物标准株作为样本,用建立的RPA方法进行检测,验证RPA方法的准确性和特异性。
随着我国社会经济的不断发展,我国比较稳定系统的发展格局也逐渐形成,这样不仅仅为我国企业发展带来了较大的机遇,也带来了较大的挑战,这样不仅提高了企业竞争力,也促进了企业进一步发展创新。因此企业要不断加强自身的发展。在一个企业中,财政部门管理是最重要的工作,这也是企业工作的核心,有利于避免财务风险的产生。财政管理贯穿在企业发展的始终,其发现程度也决定了其他部门的顺利发展。以下为企业发展过程中出现的相关问题和解决措施。
1.2.2.2 引物探针筛选 用TwistAmp®Basic 试剂盒进行RPA扩增,用英科新创核酸检测试纸条进行LFA技术(侧向层流技术)检测,对3对引物探针进行检测效果筛选。将合成的含有arcA基因的质粒作为模拟样本,用TE(Tris-EDTA)分别稀释至100 copies/μL、10 copies/μL作为阳性样本,用TE作为阴性样本。取1.5 mL离心管,分别加入上、下游引物各2.1 μL,探针0.6 μL,复溶缓冲液29.5 μL,ddH2O 12.2 μL,配制成复溶液。吸取复溶液45.5 μL,加入含有冻干组分的PCR反应管中,混匀复溶。再在加入复溶后的PCR反应管中加入2 μL模拟阳性及阴性样本,随后加入2.5 μL醋酸镁溶液。混匀后放入37℃金属浴中,反应20 min。
2.1.1 种内保守性 从NCBI上下载绵羊支原体(Mo)与山羊支原体山羊亚种(Mmc)基因组序列,发现Mo不含arcA假基因。
1.2.3.2 反应时间优化 用模拟样本以及确定的引物探针组及扩增检测方法,测试37℃分别反应10、15、20、25、30 min后的检测结果进行比较,选择最优化的时间。
解读材料,提炼出一个观点,并结合中国古代史的其他相关史实,加以论述。(要求:写出观点,观点合理、明确,史论结合。12分)
1.2.3.3 灵敏性试验 用Thermo Fisher公司Qubit荧光定量仪测得标准阳性羊传染性胸膜肺炎DNA的浓度,通过质粒分子质量,换算得到为10 000 copies/μL,再将其分别进行10倍稀释至1 copies/μL,以10 000、1 000、100、10、1 copies/μL等5个浓度来检验建立的RPA方法的敏感性。
1.2.3 反应条件优化
1.2.4 重复性试验 将模拟样本稀释至10 copies/μL,重复检测10次以确认该方法重复性。
LFA检测:待反应结束后,取5 μL扩增产物,放到1.5 mL离心管中,然后加入95 μL稀释液(PBST),将核酸检测试纸条插入1.5 mL离心管中,看到胶体金移动时开始计时,5 min后看试纸条上的结果。
1.2.2.1 引物探针设计 针对arcA假基因Mccp与Mmc差异区域,用Primer 3 plus软件设计并调整引物、探针长度,对上、下游引物Tm值评分、分析差异等参数,使符合RPA引物探针设计最优化的原则,设计合成了3对RPA引物见表1。
1.2.6 临床样品检测
1.2.6.1 对8份临床疑似山羊传染性胸膜肺炎疑似样本进行病原DNA提取 用一步式核酸提取试剂盒提取。对提取好的DNA模板,加入配制好的反应液中,加入醋酸镁放置于37℃水浴锅或金属浴上,开始进行RPA检测。
发 行: 国内邮发代号:8-276 国际邮发代号:BM 4887 每期10.00元,全年120.00元
1.2.6.2 临床样品常规PCR检测 依照文献[20]4.4中规定的PCR方法进行。
2 结果
2.1 靶基因的选择
1.2.3.1 反应温度优化 由于RPA反应在25~42℃均能反应,所以选择25℃与37℃作为典型反应温度,进行反应温度的测试,选择最优化的温度。
2.1.2 种间特异性 将arcA基因进行Mccp与Mmc种间特异性比对(图1)。在arcA基因区域,Mccp与Mmc种间有较大的差异,且种间特异性高,所以,选择arcA假基因序列作为Mccp的检测靶基因。
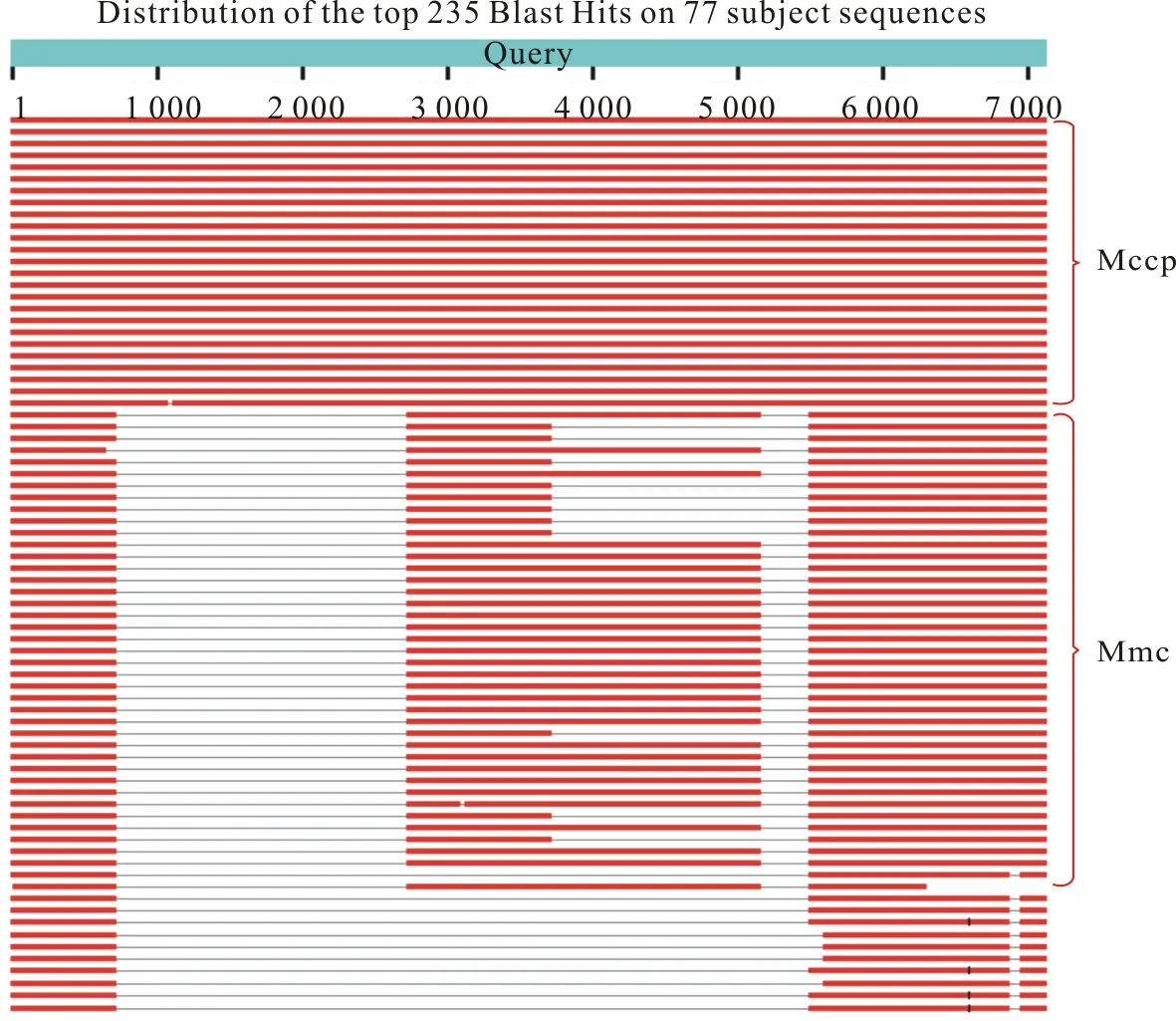
图1 arcA基因种间特异性比较
2.2 Mccp-arcA假基因引物探针筛选
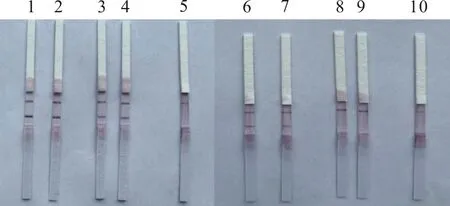
引物探针筛选结果见图2。3对引物探针均能顺利扩增100 copies/μL的模拟样本,而在扩增10 copies/μL的模拟样本时,第2对引物探针出线最早,且亮度与均匀性最好,后续试验选择第2对引物探针进行。

1~2.第1对引物探针100拷贝/μL;3~4.第1对引物探针10拷贝/μL;5~6.阴性;7~8.第2对引物探针100拷贝/μL;9~10.第2对引物探针10拷贝/μL;11~12.阴性;13~14.第3对引物探针100拷贝/μL;15~16.第3对引物探针10拷贝/μL;17~18.阴性。
2.3 反应温度优化
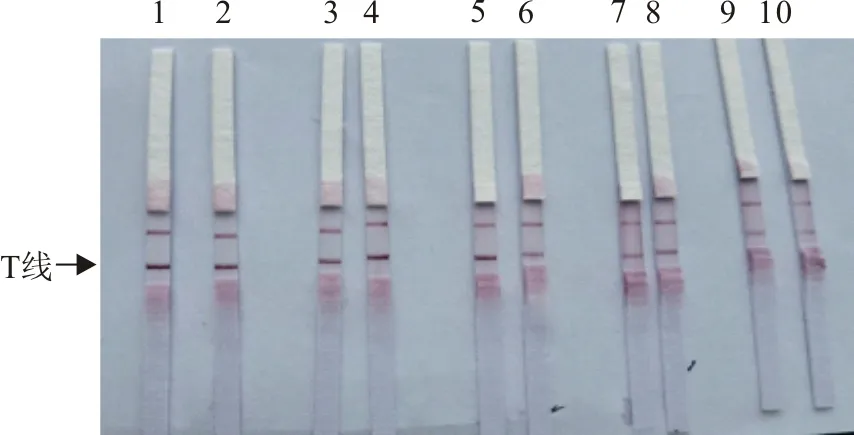
37℃反应30 min能够满足要求,而25℃条件下,可能需要继续延长反应时间。因此,选择37℃作为反应温度(图3)。
大学英语四六级考试作为全国大型标准化英语等级考试之一,每年都有数额庞大的高校考生参加并且通过考试。然而,在真正的学习、生活,甚至工作场合中,遇到外宾,能够开口用英语与之进行流利交谈的同学,实在是寥寥无几。中国学生耗费十余载学习英语,最后学成了听不懂、说不出的“聋哑英语”。众多国人在英语学习上高付出,低产出的现象,其根源值得探究。
1~2.37℃ 100拷贝/μL;3~4.37℃ 10拷贝/μL;5.阴性;6~7.25℃ 100拷贝/μL;8~9.25℃10拷贝/μL;10.阴性
2.4 反应时间优化
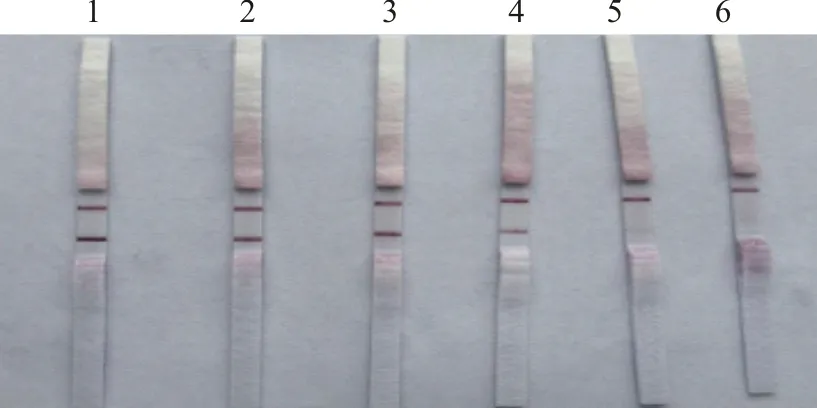
随着反应时间的延长,T线逐渐加深,25 min与30 min已没有差异。所以,选择25 min作为反应时间(图4)。
1~2.30 min;3~4.25 min;5~6.20 min;7~8.15 min;9~10.10 min
2.5 灵敏度试验
能够顺利检测到10 copies/μL的模拟样本,说明建立的RPA方法灵敏度良好(图5)。
1.10 000 copies/μL;2.1 000 copies/μL;3.100 copies/μL;4.10 copies/μL;5.1 copies/μL;6.Negative control
2.6 重复性试验
将模拟样本稀释至10 copies/μL,重复检测10次以确认该方法重复性(图6),试验证明重复性好。
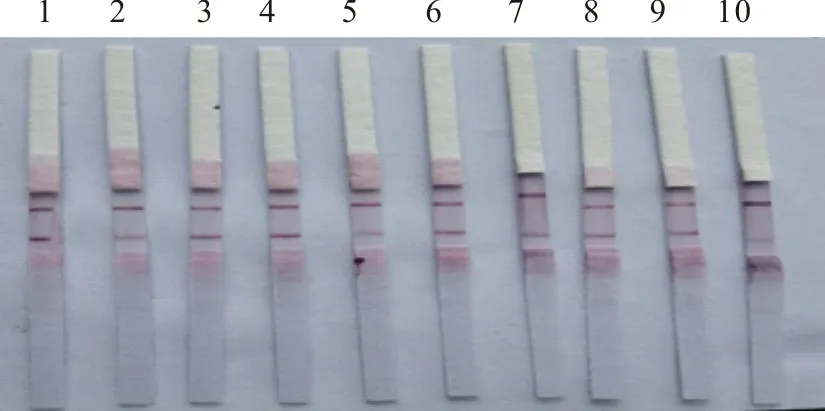
1~10.重复检测10次1-10.Repeat for 10 times
2.7 准确性与特异性
建立的方法对疫苗、阳性样本有很好的检出性,对阴性样本及非Mccp样本有很好的特异性。建立的RPA方法准确性与特异性良好(图7)。

1~2.疫苗1和疫苗2;3~5.阳性样本1~3;6~8.阴性对照;9~11.Mo细胞培养物标准株;12~14.Mmc细胞培养物标准株
2.8 临床样本检测
对8份临床疑似山羊传染性胸膜肺炎样本同时进行常规PCR和RPA检测(图8、图9)。图9中8
“嗯,那么背书’什么局。什么的,是什么意思?”孟导一边听老贾说单口相声,一边把他那堆‘乾隆通宝’按大小分好。

M.DNA标准DL 2 000;1~5.庆城县5份临床疑似样本;6~8.景泰县的3份临床疑似样本;9.阳性对照;10.阴性对照
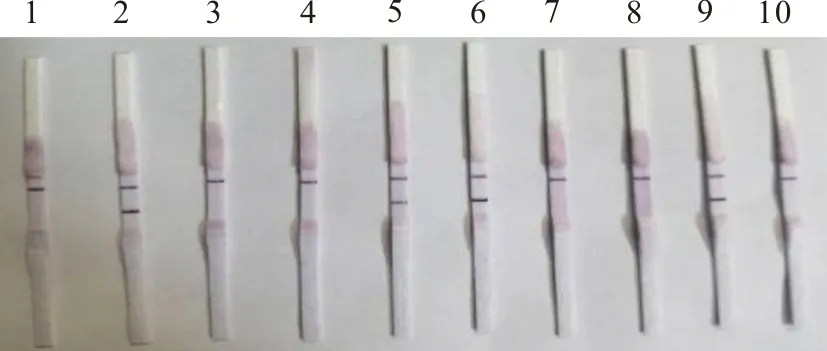
1~5.庆城县5份临床疑似样本;6~8.景泰县的3份临床疑似样本;9.阳性对照;10.阴性对照
份临床疑似山羊传染性胸膜肺炎样本检出3份阳性,5份阴性,与图8常规PCR检测结果完全一致,说明本研究建立的RPA技术对山羊传染性胸膜肺炎有很好的检出率。
3 讨论
山羊传染性胸膜肺炎(CCPP)在国内外均有报道,Mccp已被公认为山羊传染性胸膜肺炎的唯一病原[1]。2006年第1次分离鉴定出Mccp存在[21]。CCPP所有年龄阶段羊均可发病,怀孕羊易流产,高热、剧烈咳嗽和呼吸困难,剖检可见肺部大面积肝样变和纤维胸膜炎[1,8]。该病的诊断以支原体的分离鉴定和常规PCR为主,支原体生长缓慢,培养困难[18],PCR方法需要特定的试验环境和仪器。RPA技术只需要简单的水浴锅或金属浴即可一步式完成检测,使用设备简单,检测时间更短,适合临床快速检测[22]。
由于RPA技术较其他核酸扩增技术具有灵敏度高、特异性强、操作快速便捷等优点[12,22],在细菌、病毒等各种病原体的诊断方面已取得良好的效果[23]。本试验建立的RPA检测浓度为10 copies/μL,检测灵敏度有较大提升,对临床疑似山羊传染性胸膜肺炎8份样本检测与常规PCR检测结果一致,为山羊传染性胸膜肺炎的有效防控提供了技术支撑。
我国《山羊接触传染性胸膜肺炎诊断技术》(GB/T 34720-2017)规定的山羊传染性胸膜肺炎的实验室诊断方法有常规PCR和支原体分离鉴定,尚无用于临床检测的商品化试剂盒。本研究建立的山羊传染性胸膜炎RPA检测方法,反应时间短(仅为25 min),特异性好(仅检测Mccp)。对扩增产物的鉴定通过优化反应条件适配于核酸检测试纸条,操作更加简单快捷,降低了检测成本,适合基层疫病防控工作。
