不同浓度二甲双胍对人卵巢颗粒细胞增殖、凋亡和miR-409-3p表达的影响
2023-08-26马静杜鑫张慧敏郝翠芳
马静 杜鑫 张慧敏 郝翠芳


[摘要]目的觀察不同浓度二甲双胍对人卵巢颗粒细胞增殖、凋亡和miR-409-3p表达的影响。方法选取2020年6—12月在青岛市妇女儿童医院生殖医学中心进行体外受精/卵胞浆内单精子显微注射(IVF/ICSI)助孕的多囊卵巢综合征(PCOS)病人(PCOS组)和无PCOS不孕病人(对照组)各20例,收集其卵巢颗粒细胞。采用实时荧光定量PCR(Q-PCR)方法检测卵巢颗粒细胞中miR-409-3p的相对表达量。体外培养人卵巢颗粒细胞系KGN,采用CCK8法检测不同浓度(2.5、5.0、10.0、20.0、40.0 mmol/L)二甲双胍作用KGN细胞24、48和72 h的细胞活力,并计算半抑制浓度(IC50)值;采用流式细胞术检测细胞凋亡率;应用EDU染色试剂盒检测细胞增殖活性;采用Q-PCR方法检测KGN细胞中miR-409-3p表达水平的变化。结果PCOS组的黄体生成素(LH)、LH/卵泡刺激素(FSH)、抗缪勒管激素(AMH)、睾酮(T)和获卵数均显著高于对照组(t=3.49~9.79,P<0.05)。与对照组相比,PCOS组卵巢颗粒细胞中miR-409-3p相对表达量显著降低(t=2.91,P<0.05)。二甲双胍对KGN细胞有抑制增殖和促进凋亡的作用,且具有浓度依赖性;二甲双胍可以促进KGN细胞miR-409-3p的表达(F=556.63,P<0.01)。结论5.0、10.0、20.0 mmol/L的二甲双胍对人卵巢颗粒细胞增殖和凋亡均可发挥调节作用。二甲双胍可能通过上调miR-409-3p的表达调控颗粒细胞的增殖和凋亡,对PCOS排卵异常的恢复可能有积极作用。
[关键词]多囊卵巢综合征;二甲双胍;卵巢;颗粒细胞;微RNAs;细胞增殖;细胞凋亡
[中图分类号]R711.75[文献标志码]A[文章编号]2096-5532(2023)03-0383-06
doi:10.11712/jms.2096-5532.2023.59.090[开放科学(资源服务)标识码(OSID)]
[网络出版]https://kns.cnki.net/kcms2/detail/37.1517.R.20230801.1100.002.html;2023-08-0114:52:15
EFFECTS OF DIFFERENT CONCENTRATIONS OF METFORMIN ON PROLIFERATION, APOPTOSIS AND MIR-409-3P EXPRESSION OF HUMAN GRANULOSA CELLS MA Jing, DU Xin, ZHANG Huimin, HAO Cuifang (Centre for Reproductive Medicine of Qingdao Woman and Childrens Hospital, Qingdao University, Qingdao 266011, China)
[ABSTRACT]ObjectiveTo observe the effects of different concentrations of metformin on proliferation, apoptosis, and miR-409-3p expression of human granulosa cells. MethodsThe granulosa cells were collected from 20 polycystic ovarian syndrome(PCOS) patients (PCOS group) and 20 infertile patients without PCOS (control group) assisted by in vitro fertilization/intracytoplasmic sperm injection (IVF/ICSI) in the Center for Reproductive Medicine of Qingdao Women and Childrens Hospital from Jun to Dec. 2020. The expression of miR-409-3p in granulosa cells was detected by Quantitative real time polymerase chain reaction (Q-PCR). Human ovarian granulosa cell line KGN was cultured in vitro. CCK8 was used to detect the cell viability of KGN cells treated with different concentrations of metformin (2.5, 5.0, 10.0, 20.0, 40.0 mmol/L) for 24, 48 and 72 h respectively, and calculated the semi-inhibitory concentration (IC50). The apoptosis rate was detected by flow cytometry, cell proliferation activity was observed by EDU staining kit and Q-PCR was used to detect the miR-409-3p expression of KGN cells. ResultsThe luteinizing hormone (LH), LH/ follicle-stimulating hormone (FSH), Anti-Mullerian hormone (AMH), testosterone (T) and the number of oocyte obtained in PCOS roup were significantly higher than those in control group (t=3.49-9.79,P<0.05). Compared with the control group, the expression of miR-409-3p in granulosa cells of PCOS group was significantly decreased (t=2.91,P<0.05). Metformin could inhibit the proliferation and promote the apoptosis of KGN cells in a dose-dependent manner. Metformin could promote the expression of miR-409-3p in KGN (F=556.63,P<0.01). ConclusionMetformin of 5.0, 10.0 and 20.0 mmol/L can regulate the proliferation and apoptosis of human granulosa cells. Metformin may regulate the proliferation and apoptosis of granulosa cells by up-regulating the expression of miR-409-3p. It suggests that metformin has a positive effect on the recovery of abnormal ovulation in PCOS.
[KEY WORDS]polycystic ovary syndrome; metformin; ovary; granulosa cells; microRNAs; cell proliferation; apoptosis
多囊卵巢综合征(PCOS)是育龄妇女最常见的生殖内分泌疾病[1]。PCOS病人通常有复杂的临床表现,包括月经不调、卵泡发育不良、高雄激素血症、胰岛素抵抗和不孕等[2]。尽管有越来越多的证据表明PCOS的发生与环境和遗传因素有关,但目前对PCOS的具体发病机制尚不明确[3]。卵巢颗粒细胞产生的雌激素是卵泡发育成熟的重要条件,颗粒细胞的凋亡在卵泡闭锁中起主导作用。有研究表明,PCOS病人的颗粒细胞凋亡率明显低于正常排卵周期的妇女,其机制可能与凋亡效应物表达减少和细胞生长因子表达增加有关[4]。因此,促进颗粒细胞凋亡或抑制颗粒细胞的生长可能是治疗PCOS的一种潜在方法。二甲双胍是治疗2型糖尿病的有效药物,是一线降糖药,在胰岛素抵抗的PCOS病人中普遍应用。microRNA(miRNA)是由21~25个核苷酸残基组成的小型非编码RNA,在转录后水平上调节细胞的增殖、分化以及凋亡等活动[5-6]。张坤等[7]综合多项研究结果表明,miRNA可通过调节颗粒细胞增殖、胰岛素抵抗、高雄激素血症等促进PCOS的发生发展。尽管二甲双胍在PCOS伴胰岛素抵抗的病人中常规使用,但是该药对PCOS卵巢颗粒细胞功能的影响目前仍不清楚。本研究旨在观察不同浓度二甲双胍对人卵巢颗粒细胞增殖、凋亡及miRNA表达水平的影响,探讨二甲双胍对卵巢颗粒细胞的可能调控机制。
1资料与方法
1.1研究对象
选取2020年6—12月在青岛大学附属青岛市妇女儿童医院生殖医学中心进行体外受精/卵胞浆内单精子显微注射(IVF/ICSI)助孕的PCOS病人(PCOS组)和无PCOS不孕病人(对照组)各20例。记录两组病人的基本临床资料并收集其卵巢颗粒细胞进行后续研究。PCOS组病人均基于Rotterdam标准(2004年)严格筛选[8];对照组病人均因输卵管或者男方因素而寻求IVF/ICSI治疗;两组病人的年龄均≤35岁。排除标准:先天性肾上腺增生、库欣综合征和雄激素分泌性肿瘤等高雄激素血症疾病;甲状腺功能亢进、高泌乳素血症等内分泌性疾病;夫妇双方染色体异常等。本研究获医院伦理委员会批准。
1.2主要材料
人卵巢颗粒细胞(KGN,购自上海酶联生物科技有限公司);二甲双胍(北京索莱宝);miRNA分离试剂盒(山东思科捷);miRcute Plus miRNA第一链cDNA试剂盒(北京天根生化); SPARKscript Ⅱ RT-Plus逆转录试剂盒(山东思科捷);AceQ? qPCR SYBR? Green Master Mix(南京诺唯赞公司);QuantStudioTM 5实时荧光定量PCR(Q-PCR)仪(Applied Biosystems,美国);Q-PCR引物(北京擎科新业生物技术有限公司合成);CCK8 solution(北京索莱宝);Annexin V-FITC/PI细胞凋亡检测试剂盒(上海翌圣);EDU细胞增殖测试试剂盒(广州锐博生物)。
1.3研究方法
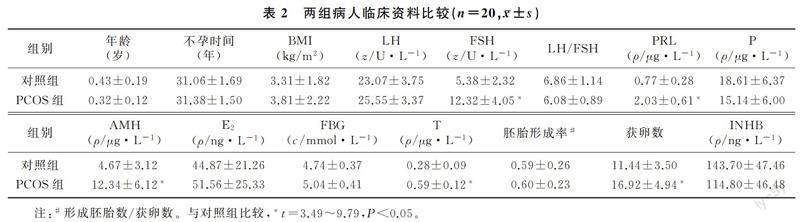
1.3.1临床资料的收集收集两组病人的基本临床资料,其内容包括:年龄、不孕时间、体质量指数(BMI)、抗苗勒管激素(AMH)、黄体生成素(LH)、卵泡刺激素(FSH)、LH/FSH、雌二醇(E2)、睾酮(T)、孕酮(P)、催乳素(PRL)、抑制素(INHB)、空腹血糖(FBG)以及获卵数和胚胎形成率。
1.3.2卵巢颗粒细胞的收集和培养卵巢颗粒细胞的收集采用拮抗剂方案,当目标卵泡直径至少有1个≥18 mm、有2个≥17 mm时,给予人绒毛膜促性腺激素(HCG)扳机,在注射HCG后36 h,进行超声引导下穿刺取卵以获得卵丘-卵母细胞复合体,用注射器针头仔细分离每个卵母细胞周围的颗粒细胞。将获得的卵巢颗粒细胞用PBS清洗3次后,保存于-80 ℃,直至RNA提取。收集的颗粒细胞和KGN细胞采用含有体积分数0.10胎牛血清、青霉素-链霉素的DMEM/F-12培养液,置于37 ℃、体积分数0.05 CO2培养箱中常规培養。
1.3.3Q-PCR检测卵巢颗粒细胞中miR-409-3p的表达按照miRNA分离试剂盒说明书提取收集的颗粒细胞以及KGN细胞中的miRNA,应用NanoDrop One紫外分光光度计测定其浓度以及纯度,按照miRcute Plus miRNA第一链cDNA试剂盒说明书将miRNA逆转录为cDNA。然后再按照AceQ? qPCR SYBR? Green Master Mix说明书进行操作,应用QuantStudioTM 5 Q-PCR仪进行扩增反应,以U6作为miRNA的内参。引物序列见表1。扩增反应条件:95 ℃预变性5 min; 95 ℃ 10 s,60 ℃ 30 s,40个循环。每个样本设置3个复孔,实验重复3次,采用2-△△CT法计算miR-409-3p的相对表达量。
1.3.4CCK8法检测细胞活力取对数生长期的KGN细胞铺设96孔板,每孔100 μL,细胞密度为5×107/L。贴壁培养6 h后加入各浓度(2.5、5.0、
3期马静,等. 不同浓度二甲双胍对人卵巢颗粒细胞增殖、凋亡和miR-409-3p表达的影响385
10.0、20.0、40.0 mmol/L)的二甲双胍进行处理,分别于处理24、48和72 h后每孔加入10 μL CCK8溶液继续反应2 h,用酶标仪在450 nm波长下检测各孔光密度(OD)。细胞活力(%)=(加药细胞OD-空白OD)/(对照细胞OD-空白OD)×100%;抑制率(%)=(对照细胞OD-加药细胞OD)/(对照细胞OD-空白OD)×100%。
1.3.5细胞凋亡检测取对数生长期的KGN细胞铺设6孔板,用细胞计数器计数,每孔5×105个细胞。贴壁培养6 h后加入各浓度(根据CCK8实验中的抑制率选择浓度为5.0、10.0、20.0 mmol/L)的二甲双胍进行处理,48 h后收集细胞。用500 μL Annexin V结合缓冲液重悬细胞,加入5 μL的 Annexin V-FITC染色液以及10 μL 的PI染色液后混匀,4 ℃避光孵育15 min。用流式细胞仪评估细胞凋亡情况。
1.3.6EDU实验取对数生长期的KGN细胞,按照每孔5×104个细胞的密度接种至24孔板。贴壁培养6 h后加入各浓度(5.0、10.0、20.0 mmol/L)的二甲双胍进行处理,48 h后使用含有1∶1 000 EDU溶液的DMEM/F-12完全培养液孵育细胞2 h,用40 g/L多聚甲醛固定细胞30 min,用Apollo染料染色。根据试剂盒说明书,使用Hoechst33342反应液进行细胞核染色。在荧光显微镜下随机获取5个视野的荧光图像并计算EDU阳性细胞率,EDU阳性细胞率(%)=(EDU和Hoechst阳性细胞数)/Hoechst阳性细胞数×100%。
1.4统计学处理
采用Graphpad Prism 8软件(GraphPad Software,美国)进行数据的统计学处理。计量资料以±s表示,两组数据比较采用独立样本t检验,多组数据比较采用单因素设计方差分析,组间两两比较采用LSD法。以P<0.05为差异有统计学意义。
2结果
2.1两组病人临床资料比较
PCOS组病人的LH、LH/FSH、AMH、T均显著高于对照组(t=3.62~9.79,P<0.05),促排卵之后的获卵数也显著高于对照组(t=3.49,P<0.05);两组之间年龄、不孕时间、BMI、FSH、PRL、P、E2、FBG、INHB和胚胎形成率比较差异均无统计学意义(P>0.05)。见表2。
2.2两组病人卵巢颗粒细胞中miR-409-3p表达水平的比较
Q-PCR检测结果显示,PCOS组和对照组病人卵巢颗粒细胞中miR-409-3p的表达水平分别为0.70±0.44、1.82±1.68。与对照组相比,PCOS组病人miR-409-3p的表达量显著降低,差异具有统计学意义(t=2.91,P<0.05)。
2.3二甲双胍对KGN细胞增殖的影响
CCK8法检测结果显示,经不同浓度(2.5、5.0、10.0、20.0、40.0 mmol/L)的二甲双胍处理不同时间(24、48、72 h),细胞生长出现不同程度的抑制(F=96.63~630.60,P<0.01)。见图1。根据二甲双胍对KGN细胞增殖的抑制率,计算出二甲双胍作用24、48和72 h对KGN细胞的半抑制浓度(IC50)分别为30.93、15.37和6.92 mmol/L。
2.4二甲双胍对KGN细胞凋亡的影响
使用5.0、10.0、20.0 mmol/L浓度的二甲双胍处理KGN细胞48 h后,Annexin V-FITC/PI双染色细胞凋亡检测结果显示,随着二甲双胍浓度的增加,细胞凋亡率增加(图2)。
2.5二甲双胍对KGN细胞增殖抑制活性
EDU实验细胞增殖检测结果显示,使用5.0、10.0、20.0 mmol/L浓度的二甲双胍处理KGN细胞48 h后,EDU阳性细胞率分别为(18.67±2.08)%、(16.00±1.00)%和(12.33±1.16)%。与对照组(不加二甲双胍)的(23.67±1.16)%相比较,5.0、10.0、20.0 mmol/L二甲双胍处理组细胞的增殖活性呈浓度依赖性降低(F=34.11,P<0.001)。见图3。
2.6二甲双胍对KGN细胞miR-409-3p表达影响
根据IC50值,选择10.0和20.0 mmol/L浓度的二甲双胍作用KGN细胞48 h。对照组(不加二甲双胍处理组)和10.0、20.0 mmol/L二甲双胍处理组细胞中miR-409-3p的表达水平分别为1.00±0.07、4.02±0.13和6.41±0.31。与对照组比较,给予二甲双胍处理组KGN细胞中miR-409-3p的表达显著上调(F=556.60,P<0.001)。
3讨论
PCOS是育龄妇女常见的内分泌紊乱综合征,因稀发排卵或无排卵而导致不孕,PCOS所致不孕约占无排卵不孕的75%[9]。卵泡的发育成熟是一个复杂的生理过程,卵巢颗粒细胞合成的激素与生长因子通过缝隙连接影响卵泡膜细胞和卵母细胞的生长分化、成熟,进而影响卵泡的发育[10]。目前的研究表明,PCOS妇女早期生长卵泡中的颗粒细胞增殖增加和凋亡减少,这可能导致卵泡的发育异常和排卵障碍[4,11-12]。因此,抑制颗粒细胞的生长或促进颗粒细胞凋亡有可能恢复PCOS病人卵泡发育和排卵的异常。
二甲双胍广泛用于治疗PCOS胰岛素抵抗的病人,是胰岛素的增敏剂[13]。大量证据表明,二甲双胍可以有效地调节代谢紊乱与性激素水平,例如减轻体质量,降低胰岛素、血脂和雄激素水平,恢復正常月经周期和排卵[14]。但是,目前关于二甲双胍对PCOS病人卵巢颗粒细胞的影响研究还很少。因此,本研究用不同浓度的二甲双胍处理KGN细胞,采用CCK8实验来检测细胞活力,流式细胞术检测细胞凋亡率,EDU实验观察细胞增殖活性,结果显示,二甲双胍对KGN细胞增殖有明显的抑制作用,对细胞凋亡有明显的促进作用,且上述作用均具有浓度依赖性。宋霁[15]研究结果表明,二甲双胍影响PCOS病人颗粒细胞的增殖和凋亡,这与本研究结果相一致。
近年来miRNA在卵巢颗粒细胞生长和卵母细胞发育中作用的研究报道越来越多,即使是单一的miRNA的变化也会对细胞表型或卵母细胞发育产生不利影响[16]。本研究分离了PCOS病人的卵巢颗粒细胞并测定其miR-409-3p表达,结果显示,与对照组相比,PCOS病人卵巢颗粒细胞中miR-409-3p的表达水平显著降低。目前有相关研究报道,PCOS病人卵巢颗粒细胞中miR-17-5p表达下降,而miR-130b-3p、miR-9、miR-186和miR-135a的表达水平升高[17-20]。有研究发现,miR-99a、miR-424和miR-206可抑制人卵巢颗粒细胞的增殖,促进其凋亡[21-23]。也有研究发现,miR-16和miR-155可促进人卵巢颗粒细胞的增殖,抑制其凋亡[24-25]。有生物信息学研究结果表明,二甲双胍可改变miRNA的表达,如可以降低PCOS病人血清中miR-122、miR-223和miR-29a的表达[26-27]。但是目前尚未有人研究二甲双胍是否可影响PCOS病人颗粒细胞中miR-409-3p的表达。本研究体外实验结果显示,10.0和20.0 mmol/L浓度的二甲双胍作用于KGN细胞48 h,细胞中miR-409-3p的表达水平显著上调,说明随着miR-409-3p的表达上调,KGN细胞增殖率降低、凋亡率增加。提示二甲双胍可能通过上调miR-409-3p表达,抑制PCOS病人卵巢颗粒细胞的增殖并促进其凋亡。
综上所述,二甲双胍能够明显促进卵巢颗粒细胞的凋亡,抑制细胞增殖,并且抑制增殖作用呈浓度依赖性,其机制可能与上调miR-409-3p的表达有关。本文研究结果为临床二甲双胍的使用提供了新的认识。
[参考文献]
[1]MACUT D, BJEKI-MACUT J, RAHELI D, et al. Insulin and the polycystic ovary syndrome[J]. Diabetes Research and Clinical Practice, 2017,130:163-170.
[2]DIAMANTI-KANDARAKIS E, DUNAIF A. Insulin resis-tance and the polycystic ovary syndrome revisited: an update on mechanisms and implications[J]. Endocrine Reviews, 2012,33(6):981-1030.
[3]FRANKS S, MCCARTHY M I, HARDY K. Development of polycystic ovary syndrome: involvement of genetic and environmental factors[J]. International Journal of Andrology, 2006,29(1):278-285,discussion286-290.
[4]DAS M, DJAHANBAKHCH O, HACIHANEFIOGLU B, et al. Granulosa cell survival and proliferation are altered in polycystic ovary syndrome[J]. The Journal of Clinical Endocrinology and Metabolism, 2008,93(3):881-887.
[5]HE L, HANNON G J. microRNAs: small RNAs with a big role in gene regulation[J]. Nature Reviews Genetics, 2004,5(7):522-531.
[6]WILUSZ J E, SHARP P A. Molecular biology. A circuitous route to noncoding RNA[J]. Science, 2013,340(6131):440-441.
[7]張坤,孙秀芹. microRNA与多囊卵巢综合征关系的研究进展[J]. 中国现代医学杂志, 2020,30(2):66-71.
[8]Rotterdam ESHRE/ASRM-Sponsored PCOS ConsensusWorkshop Group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome[J]. Fertility and Sterility, 2004,81(1):19-25.
[9]DIAO F Y, XU M, HU Y Q, et al. The molecular characte-ristics of polycystic ovary syndrome (PCOS) ovary defined by human ovary cDNA microarray[J]. Journal of Molecular Endocrinology, 2004,33(1):59-72.
[10]EPPIG J J. Oocyte control of ovarian follicular development and function in mammals[J]. Reproduction (Cambridge, England), 2001,122(6):829-838.
[11]STUBBS S A, STARK J, DILWORTH S M, et al. Abnormal preantral folliculogenesis in polycystic ovaries is associated with increased granulosa cell division[J]. The Journal of Clinical Endocrinology and Metabolism, 2007,92(11):4418-4426.
[12]ALMAHBOBI G, ANDERIESZ C, HUTCHINSON P, et al. Functional integrity of granulosa cells from polycystic ovaries[J]. Clinical Endocrinology, 1996,44(5):571-580.
[13]PALA L, BARBARO V, DICEMBRINI I, et al. The therapy of insulin resistance in other diseases besides type 2 diabetes[J]. Eating and Weight Disorders: EWD, 2014,19(3):275-283.
[14]FRUZZETTI F, PERINI D, RUSSO M, et al. Comparison of two insulin sensitizers, metformin and myo-inositol, in women with polycystic ovary syndrome (PCOS)[J]. Gynecological Endocrinology, 2017,33(1):39-42.
[15]宋霁. 二甲双胍调控miRNA-133b对多囊卵巢综合征患者卵丘颗粒细胞增殖和凋亡的影响[D]. 广州:广州医科大学, 2017.
[16]JIANG L L, HUANG J, LI L, et al. MicroRNA-93 promotes ovarian granulosa cells proliferation through targeting CDKN1A in polycystic ovarian syndrome[J]. The Journal of Clinical Endocrinology and Metabolism, 2015,100(5):E729-E738.
[17]LIU G L, LIU S X, XING G L, et al. lncRNA PVT1/microRNA-17-5p/PTEN axis regulates secretion of E2 and P4, proliferation, and apoptosis of ovarian granulosa cells in PCOS[J]. Molecular Therapy Nucleic Acids, 2020,20:205-216.
[18]BAO D Q, LI M G, ZHOU D X, et al. miR-130b-3p is high-expressed in polycystic ovarian syndrome and promotes granulosa cell proliferation by targeting SMAD4[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2021,209:105844.
[19]KONG F J, DU C X, WANG Y. microRNA-9 affects isolated ovarian granulosa cells proliferation and apoptosis via targeting vitamin D receptor[J]. Molecular and Cellular Endocrinology, 2019,486:18-24.
[20]SONG Y X, YU G, XIANG Y G, et al. Altered miR-186 and miR-135a contribute to granulosa cell dysfunction by targeting ESR2: a possible role in polycystic ovary syndrome[J]. Mole-cular and Cellular Endocrinology, 2019,494:110478.
[21]GENG Y D, SUI C, XUN Y, et al. MiRNA-99a can regulate proliferation and apoptosis of human granulosa cells via targeting IGF-1R in polycystic ovary syndrome[J]. Journal of Assisted Reproduction and Genetics, 2019,36(2):211-221.
[22]DU J, LIN X F, WU R R, et al. miR-424 suppresses prolife-ration and promotes apoptosis of human ovarian granulosa cells by targeting Apelin and APJ expression[J]. American Journal of Translational Research, 2021,13(4):3917-3918.
[23]ZHOU J, JIN X J, SHENG Z M, et al. miR-206 serves an important role in polycystic ovary syndrome through modulating ovarian granulosa cell proliferation and apoptosis[J]. Experimental and Therapeutic Medicine, 2021,21(3):179.
[24]FU X F, HE Y L, WANG X F, et al. microRNA-16 promotes ovarian granulosa cell proliferation and suppresses apoptosis through targeting PDCD4 in polycystic ovarian syndrome[J]. Cellular Physiology and Biochemistry, 2018,48(2):670-682.
[25]XIA H J, ZHAO Y X. miR-155 is high-expressed in polycystic ovarian syndrome and promotes cell proliferation and migration through targeting PDCD4 in KGN cells[J]. Artificial Cells, Nanomedicine, and Biotechnology, 2020,48(1):197-205.
[26]LI J, LEI K C, WU Z R, et al. Network-based identification of microRNAs as potential pharmacogenomic biomarkers for anticancer drugs[J]. Oncotarget, 2016,7(29):45584-45596.
[27]UDESEN P B, GLINTBORG D, SRENSEN A E, et al. Metformin decreases miR-122, miR-223 and miR-29a in women with polycystic ovary syndrome[J]. Endocrine Connections, 2020,9(11):1075-1084.
(本文編辑马伟平)