黑质致密部-纹状体多巴胺能通路的上游脑区追踪
2023-08-26商晓钰张腾元谢俊霞徐华敏
商晓钰 张腾元 谢俊霞 徐华敏
[摘要]目的探究投射到纹状体(Str)的黑质致密部(SNpc)多巴胺(DA)能神经元的上游脑区。方法采用逆向病毒示踪技术逆向追踪SNpc-Str环路的上游脑区。应用立体定位技术在8周龄C57BL/6雄性小鼠Str区注射逆行追踪病毒rAAV-hsyn-cre-wpre-pA(retro);同时在SNpc注射病毒AAV-DIO-EF1α-GFP-TVA和AAV-DIO-EF1α-RVG(1∶2混合);3周后在SNpc注射逆行跨突觸狂犬病毒RV-Enva-ΔG-dsRed。1周后取脑进行冷冻切片,应用Olympus VS120荧光显微镜观察表达dsRed阳性细胞的脑区。结果应用荧光显微镜在SNpc可以观察到GFP(绿色)和dsRed(红色)阳性细胞,证明依赖Cre重组酶表达的AAV-DIO-EF1α-GFP-TVA病毒以及依赖TVA元件表达的狂犬病毒均在SNpc正常表达。同时在外侧下丘脑(LH)、前连合后肢间质核(IPAC)脑区观察到dsRed(红色)阳性细胞。结论LH和IPAC脑区可能是SNpc-Str环路DA能神经元的上游脑区。
[关键词]多巴胺能神经元;密部;纹状体;下丘脑区,侧;前连合,大脑;神经解剖束追踪技术
[中图分类号]R338.2[文献标志码]A[文章编号]2096-5532(2023)03-0349-04
doi:10.11712/jms.2096-5532.2023.59.099[开放科学(资源服务)标识码(OSID)]
[网络出版]https://link.cnki.net/urlid/37.1517.R.20230804.1521.001;2023-08-0715:34:53
A TRACING STUDY OF UPSTREAM BRAIN REGIONS OF DOPAMINERGIC PATHWAY PROJECTING FROM SUBSTANTIA NIGRA PARS COMPACTA TO STRIATUM SHANG Xiaoyu, ZHANG Tengyuan, XIE Junxia, XU Huamin (Department of Physiology and Pathophysiology, School of Basic Medicine, Medical College of Qingdao University, Qingdao 266071, China)
[ABSTRACT]ObjectiveTo investigate the upstream brain regions of dopaminergic neurons projecting from the substantia nigra pars compacta (SNpc) to the striatum (Str). MethodsThe retrograde virus tracing technique was used to identify the upstream brain regions of the SNpc-Str circuit. Eight-week-old male C57BL/6 mice received stereotactic injection of the retrograde virus rAAV-hsyn-cre-wpre-pA (retro) into the Str and also a 1∶2 mixture of AAV-DIO-EF1α-GFP-TVA and AAV-DIO-EF1α-RVG into the SNpc. After three weeks, the retrograde transsynaptic rabies virus RV-Enva-ΔG-dsRed was injected into the SNpc. After another one week, the brain was taken to prepare slices to observe dsRed-positive brain regions using an Olympus VS120 fluorescence microscope. ResultsCells positive for GFP (green) and dsRed (red) were observed in the SNpc under the fluorescence microscope, demonstrating that both Cre recombinase-dependent AAV-DIO-EF1α-GFP-TVA virus and TVA-dependent ra-bies virus were normally expressed in the SNpc. At the same time, dsRed-positive cells were observed in the lateral hypothalamus (LH) and the interstitial nucleus of the posterior limb of the anterior commissure (IPAC). ConclusionLH and IPAC might be the upstream brain regions of dopaminergic neurons of the SNpc-Str circuit.
[KEY WORDS]dopaminergic neurons; pars compacta; corpus striatum; hypothalamic area, lateral; anterior commissure, brain; neuroanatomical tract-tracing techniques
帕金森病(PD)是临床较为常见的神经退行性疾病,以静止性震颤、肌强直、运动迟缓等运动症状和嗅觉障碍、睡眠障碍、心血管功能异常等非运动症状为主要临床表现[1]。PD的主要病理变化为黑质(SN)多巴胺(DA)能神经元进行性退变[2],但其发病机制迄今尚不明确。目前有研究认为,SN区DA能神经元所参与的继发性神经环路功能异常可能是导致PD的重要机制之一[3]。SN分為两部分,即背侧的黑质致密部(SNpc)和腹侧的黑质网状带。其中DA能神经元主要分布于SNpc并向纹状体(Str)发出投射。此前关于SNpc所接受的脑区输入已有报道[4-6],但由于受传统技术的限制,无法区分DA和非DA能神经元所涉及的神经环路,阻碍了对DA能神经元输入的全面理解,且已有的研究也仅限于二级环路的研究[7-8]。因此,研究SNpc-Str环路DA能神经元所接受的上游脑区投射,从而确定一个三级环路对于PD的神经环路研究有重要意义。本实验采用南加州大学张砺教授实验室研发的逆向三级环路追踪病毒[9],对SNpc-Str环路DA能神经元的上游脑区进行了研究。
1材料与方法
1.1实验材料
1.1.1实验动物8周龄SPF级雄性C57BL/6小鼠,体质量为(21±2)g,购于北京维通利华实验动物有限公司。小鼠饲养于有适量食物和水的洁净动物房内,可以自由饮食。动物房室温(22±2)℃,湿度(50±2)%,12/12 h昼夜循环光照。小鼠适应性饲养1周后进行实验。动物使用和管理经青岛大学动物伦理委员会批准。
1.1.2实验病毒rAAV-hsyn-cre-wpre-pA(retro)(血清型2/9,滴度5.97E+15 vg/L),购于武汉枢密脑科学技术有限公司;AAV-DIO-EF1α-GFP-TVA(血清型9,滴度2.5E+15 vg/L)、AAV-DIO-EF1α-RVG(血清型9,滴度2.33E+15 vg/L)、RV-Enva-ΔG-dsRed(滴度2.0E+11 vg/L),购于布林凯斯(深圳)生物技术有限公司。
1.2实验方法
1.2.1立体定位注射实验小鼠用异氟烷麻醉后固定在脑立体定位仪上,麻醉后的小鼠放置在加热垫上保持正常体温。将玻璃电极中注满液体石蜡后固定于微量注射泵(瑞沃德,中国)上,并吸取适量病毒。待小鼠深度麻醉后调整耳杆使小鼠头部位于一平面上,用碘附消毒后剪开小鼠颅脑背侧头皮,用生理盐水擦拭颅骨表面至颅缝和前后囟清晰可见,调整前后囟位置及旁开位置,将前囟点设为零点。根据小鼠脑定位图谱定位注射点后利用颅骨钻进行颅骨钻孔(直径为0.5 mm),将玻璃电极插入目标脑区后以20 nL/min的流量进行病毒注射,注射完毕缝合头皮。
Str区病毒注射:将逆行追踪病毒rAAV-cre-wpre-pA(retro)单侧注射于C57BL/6成年雄性小鼠的Str脑区,以前囟点作为原点,定位坐标为前后+1.18 mm、侧偏-1.50 mm、深度-3.00 mm。SNpc病毒注射:将AAV-DIO-EF1α-GFP-TVA病毒和AAV-DIO-EF1α-RVG病毒以1∶2比例充分混合(简称混合病毒),单侧注射于C57BL/6成年雄性小鼠的SNpc脑区,以前囟点为原点,坐标为前后-3.16 mm、侧偏-1.42 mm、深度-4.30 mm。3周后向小鼠同侧SNpc原位置注射逆行跨突触狂犬病毒RV-Enva-ΔG-dsRed。病毒注射完成7 d后进行心脏灌流取脑。
1.2.2小鼠脑组织切片样本制备及观察小鼠腹腔注射12.5 g/L阿佛丁进行全身麻醉(注射剂量0.02 mL/g),等待小鼠深度麻醉后剪开胸廓充分暴露心脏,使用生理盐水(国药,中国)和40 g/L多聚甲醛(索莱宝,中国)进行灌注并取脑。将鼠脑置于40 g/L多聚甲醛中固定12 h,再放入300 g/L蔗糖中沉糖48 h,待样品沉入蔗糖溶液底部。取出脑组织,使用冷冻切片机制备30 μm厚脑切片。脑片在0.01 mol/L PBS中清洗3次,每次5 min,贴片,使用含DAPI封片液(碧云天,中国)封片,在Olympus VS120荧光显微镜20倍物镜下观察。
2结果
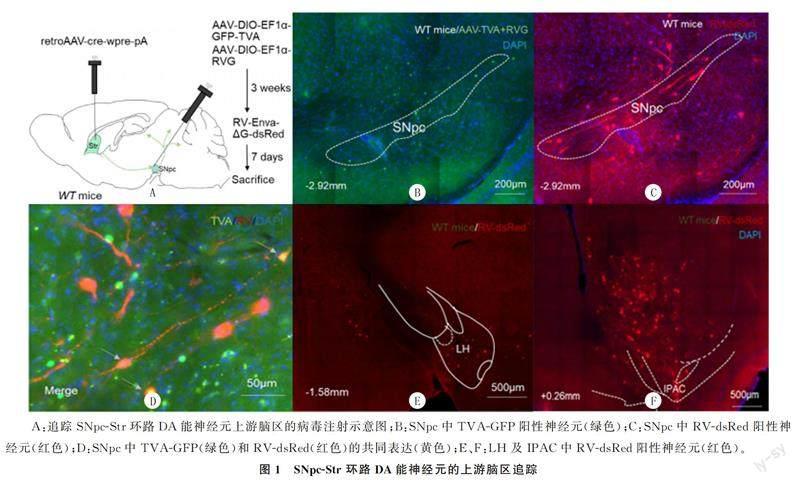
本实验首先将表达Cre重组酶的腺相关病毒rAAV-cre-wpre-pA(retro)注射到小鼠单侧背外侧纹状体,同时在同侧SNpc注射依赖Cre的混合病毒,3周后在SNpc再次注射依赖混合病毒的逆行狂犬病毒RV-Enva-ΔG-dsRed,注射1周后通过荧光显微镜观察荧光蛋白表达情况(图1A)。结果显示,在SNpc可见GFP阳性神经元(绿色荧光)(图1B),表明rAAV-cre-wpre-pA(retro)由Str逆行至SNpc胞体。同时,在SNpc还观察到dsRed阳性神经元(红色荧光)(图1C、D),说明TVA依赖的狂犬病毒在SNpc可正常表达。另外,在外侧下丘脑(LH)和前连合后肢间质核(IPAC)均可见明显的dsRed阳性神经元(图1E、F),这表明狂犬病毒和RVG在SNpc共同表达并具有逆向跨突触功能,可逆向追踪上游脑区。上述结果提示LH和IPAC可能是调控投射至Str的SNpc DA能神经元的上游脑区。
3讨论
PD是继阿尔兹海默病后的第二大神经退行性疾病,多发生于中老年人。自1817年由PARKINSON[1]首次报道以来,PD的研究已经取得了诸多重要进展。研究表明,PD的发病与年龄老化、氧化应激、炎症反应、环境因素、遗传因素等均有关[10]。PD主要临床表现有运动迟缓、静止性震颤、姿势反射障碍等[11-12]。有研究认为,投射至Str的SNpc DA能神经元退变和继发性神经环路功能异常,可能是导致PD症状发生发展的重要机制,也是脑深部电刺激(DBS)治疗PD的干预靶点[13-15]。
目前治疗PD最有效的方法依然是药物治疗,如左旋多巴类药物和多巴胺受体激动剂等[16]。近年来DBS也成为临床治疗PD的有效手段。例如在苍白球内侧[17]、丘脑底核[18]、脚桥核以及腹侧中间核[19]等部位进行DBS均对PD病人起到了较为明显的治疗效果。虽然DBS治疗已经初步取得成效,但是仍有许多DBS治疗靶点的作用机制尚待阐明。作为基底神经核重要组成部分和主要负责DA传输的SNpc,由于与PD密不可分的联系,更是许多研究的重点方向。而探究投射到Str的DA能神经元的上游脑区,对于进一步阐明PD在继发性神经环路方面的异常机制,以及提供新的PD治疗靶点均有重要意义。
本實验采用南加州大学张砺教授实验室研发的用于神经环路逆向追踪的病毒,在技术层面上实现了较为精确的三级环路追踪。首先在Str注射逆向追踪病毒rAAV-hsyn-cre-wpre-pA(retro),该病毒能够通过SNpc投射至Str的神经轴突末梢逆行至SNpc的神经元,使得SNpc神经元胞体表达Cre重组酶。同时在SNpc区注射AAV-DIO-EF1α-GFP-TVA和AAV-DIO-EF1α-RVG混合病毒,该混合病毒的表达同时依赖于SNpc中表达的Cre重组酶,其中AAV-DIO-EF1α-GFP-TVA病毒带有绿色荧光。最后在SNpc注射逆向跨突触狂犬病毒RV-Enva-ΔG-dsRed,该病毒依赖于TVA元件表达后可与RVG共同发挥作用追踪到相关神经元的上游脑区。本研究所追踪到的上游脑区中,LH为丘脑的外侧区域,对摄食、饮水、性行为和情绪等方面的调控有重要作用[20],尤其在情绪方面,已有研究证实LH与小鼠的焦虑行为有关[21]。目前有研究发现,LH与PD病人胃肠功能障碍有密切联系[22],但暂未涉及运动方面的研究报道。而有实验通过在LH注射逆行示踪剂发现,SNpc为LH其中一个上游脑区[4],这意味着LH和SNpc之间可能存在双向的投射关系,并可能控制不同的行为。
IPAC为延展杏仁核的主要结构,主要在饮食选择和协调影响代谢健康行为方面起着关键作用。目前对于该脑区的研究并不多见,有研究发现在IPAC注射顺行标记病毒后,在SNpc、LH等脑区均发现有轴突末梢投射[23],这表明LH、IPAC以及SNpc三者之间可能存在着十分复杂的投射关系,也为我们的进一步研究提供了新思路。
总之,本实验在先前研究的基础上确定了LH和IPAC两个可能调控SNpc-Str环路DA能神经元的上游脑区,这为进一步研究PD中可能的神经环路发病机制提供了基础,也有助于为PD的治疗提供新的靶点。
[参考文献]
[1]PARKINSON J Mr. Parkinsons letter on the committee of apothecaries[J]. The Medical and Physical Journal, 1813,29(168):132-133.
[2]ZHANG Z, ZHANG K K, DU X R, et al. Neuroprotection of desferrioxamine in lipopolysaccharide-induced nigrostriatal dopamine neuron degeneration[J]. Molecular Medicine Reports, 2012,5(2):562-566.
[3]MASINI D, KIEHN O. Targeted activation of midbrain neurons restores locomotor function in mouse models of Parkinsonism[J]. Nature Communications, 2022,13(1):504.
[4]YONEMOCHI N, ARDIANTO C, YANG L Z, et al. Dopaminergic mechanisms in the lateral hypothalamus regulate feeding behavior in association with neuropeptides[J]. Biochemical and Biophysical Research Communications, 2019,519(3):547-552.
[5]GEISLER S, ZAHM D S. Afferents of the ventral tegmental area in the rat-anatomical substratum for integrative functions[J]. The Journal of Comparative Neurology, 2005,490(3):270-294.
[6]PHILLIPSON O T. Afferent projections to the ventral tegmental area of Tsai and interfascicular nucleus: a horseradish peroxidase study in the rat[J]. The Journal of Comparative Neurology, 1979,187(1):117-143.
[7]CALLAWAY E M. Transneuronal circuit tracing with neurotropic viruses[J]. Current Opinion in Neurobiology, 2008,18(6):617-623.
[8]UGOLINI G. Rabies virus as a transneuronal tracer of neuronal connections[J]. Advances in Virus Research, 2011,79:165-202.
[9]ZINGG B, DONG H W, TAO H W, et al. Input-output organization of the mouse claustrum[J]. The Journal of Compa-rative Neurology, 2018,526(15):2428-2443.
[10]POSTUMA R B, BERG D, STERN M, et al. MDS clinical diagnostic criteria for Parkinsons disease[J]. Movement Di-sorders: Official Journal of the Movement Disorder Society, 2015,30(12):1591-1601.
[11]WIDNELL K. Pathophysiology of motor fluctuations in Parkinsons disease[J]. Movement Disorders: Official Journal of the Movement Disorder Society, 2005,20(Suppl 11):S17-S22.
[12]TOLOSA E, GARRIDO A, SCHOLZ S W, et al. Challenges in the diagnosis of Parkinsons disease[J]. The Lancet Neuro-logy, 2021,20(5):385-397.
[13]BEUDEL M, BROWN P. Adaptive deep brain stimulation in Parkinsons disease[J]. Parkinsonism & Related Disorders, 2016,22(Suppl 1):S123-S126.
[14]SWANN N C, HEMPTINNE C D, THOMPSON M C, et al. Adaptive deep brain stimulation for Parkinsons disease using motor cortex sensing[J]. Journal of Neural Engineering, 2018,15(4):046006.
[15]LERNER T N, SHILYANSKY C, DAVIDSON T J, et al. Intact-Brain Analyses Reveal Distinct Information Carried by SNc Dopamine Subcircuits[J]. Cell, 2015,162(3): 635-47.
[16]BORAUD T, BEZARD E, GUEHL D, et al. Effects of L-DOPA on neuronal activity of the globus pallidus externalis (GPe) and globus pallidus internalis (GPi) in the MPTP-treated monkey[J]. Brain Research, 1998,787(1):157-160.
[17]LILASCHAROEN V, WANG E H, DO N, et al. Divergent pallidal pathways underlying distinct Parkinsonian behavioral deficits[J]. Nature Neuroscience, 2021,24(4):504-515.
[18]OKUN M S. Deep-brain stimulation for Parkinsons disease[J]. The New England Journal of Medicine, 2012,367(16):1529-1538.
[19]LIN F B, WU D H, YU J, et al. Comparison of efficacy of deep brain stimulation and focused ultrasound in parkinsonian tremor: a systematic review and network meta-analysis[J]. Journal of Neurology, Neurosurgery, and Psychiatry, 2021,92(4):434-443.
[20]STAMATAKIS A M, VAN SWIETEN M, BASIRI M L, et al. Lateral hypothalamic area glutamatergic neurons and their projections to the lateral habenula regulate feeding and reward[J]. The Journal of Neuroscience: the Official Journal of the Society for Neuroscience, 2016,36(2):302-311.
[21]OWENS-FRENCH J, LI S B, FRANCOIS M, et al. Lateral hypothalamic galanin neurons are activated by stress and blunt anxiety-like behavior in mice[J]. Behavioural Brain Research, 2022,423:113773.
[22]YANG Y L, RAN X R, LI Y, et al. Expression of dopamine receptors in the lateral hypothalamic nucleus and their potential regulation of gastric motility in rats with lesions of bilateral substantia nigra[J]. Frontiers in Neuroscience, 2019,13:195.
[23]FURLAN A, CORONA A, BOYLE S, et al. Neurotensin neurons in the extended amygdala control dietary choice and energy homeostasis[J]. Nature Neuroscience, 2022,25(11):1470-1480.
(本文編辑马伟平)