大豆分离蛋白-卡拉胶-黄原胶三元复合Pickering 乳液的制备与特性分析
2023-08-15薛山庄凌凌
薛山 ,庄凌凌
(1.闽南师范大学生物科学与技术学院,福建漳州 363000;2.菌物产业福建省高校工程研究中心,福建漳州 363000)
皮克林乳液(Pickering emulsions)是采用胶体粒子取代传统表面活性剂进行稳定的乳液,较传统乳液更环保、安全和稳定,因其可以包埋生物活性物质、且能够用于制备新型材料而在多个领域广泛应用[1−2]。以食品科学领域为例,食品级颗粒的应用赋予了Pickering 乳液极广阔的前景,食品级颗粒大体分为三种类型:多糖颗粒、蛋白质基颗粒以及复合物颗粒[3]。其中,研究较多的是多糖和蛋白质复合颗粒,颗粒间通过静电吸引、氢键、疏水相互作用等非共价键结合[4−5],复合体系能够提高单一颗粒的ESI 以及乳液的热稳定性、pH 稳定性等环境应变能力,从而增强乳液及其凝胶体系的稳定性[6]。
SPI(Soybean protein isolate)是一种优质的植物蛋白,含有近20 种氨基酸,包括了人体必需的8 种氨基酸,其具有凝胶性、吸水性、乳化性、起泡性等多种功能特性[7−9]。卡拉胶(Carrageenan)是从红藻类海草中提炼出来的亲水性胶体,具有较强的稳定性,在食品工业中通常将其用作胶凝剂、乳化剂和稳定剂等,同时,它又因具有可溶性膳食纤维的基本特性而成为益生菌的能量源,具有一定的健康价值[10]。研究显示,卡拉胶添加能够显著提升乳液凝胶的可塑性、持水性、物理稳定性、硬度和粘弹性[11]。黄原胶(Xanthan)是一种由黄单胞菌属经有氧发酵产生的细胞外杂多糖,属于阴离子多糖,因其具有良好的水溶性、热稳定性等特点,在食品、石油、医药等十几个领域有着极其广泛的应用[12−13]。姜宗伯等[14]报道,黄原胶浓度的增加能够增加初榨椰子油乳液的机械强度,且降低油凝胶中油脂的损失。
研究显示,单一的大分子物质制备的Pickering乳液稳定性及流变特性较差,而通过分子间交联制备的复合乳液则表现出良好的理化性质[15]。朱秀清等[16]用不同添加量的不同种类多糖与SPI 复合,制备多糖-蛋白复合体系乳液及乳液凝胶,发现一定的多糖添加可以显著提高乳液及乳液凝胶体系的稳定性,并且可以改变SPI 的二级结构。SPI 与多糖复合,能够显著提高乳液凝胶体系的质构、保水性能及稳定性[17],且不同原料添加顺序的复合物其结合过程不同[18]。黄欢等[19]利用酪蛋白酸钠和黄原胶的复合物作为乳化剂,制备了具有高稳定性的椰子油乳液。
综上可知,SPI、卡拉胶和黄原胶都是稳定乳液及凝胶的原材料,但鉴于不同大分子性质各异,以不同配比制备的复合乳液及凝胶体系有着不同的理化特性。目前尚未见有关SPI-卡拉胶-黄原胶三元复合Pickering 乳液的报道。由此,本研究拟选用SPI、卡拉胶和黄原胶作为基础原料,通过调节SPI 与复合多糖(卡拉胶和黄原胶)的配比、乳液pH、卡拉胶质量浓度、黄原胶质量浓度以及大豆油内相体积等条件,制备具有良好稳定性的SPI-卡拉胶-黄原胶三元复合Pickering 乳液,并表征其理化特性,为功能性物质靶向递送和脂肪代替物的应用创新提供了技术参考。
1 材料与方法
1.1 材料与仪器
SPI、卡拉胶、黄原胶 浙江一诺生物科技有限公司;大豆油 上海益海嘉里金龙鱼粮油食品股份有限公司;甘氨酸、浓盐酸、柠檬酸、磷酸氢二钠(AR)、磷酸二氢钾(AR)、氢氧化钠 均为分析纯,西陇科学股份有限公司。
DF-101S 集热式恒温磁力搅拌器 上海力辰邦西仪器科技有限公司;AT12CN 电子天平 奥豪斯仪器(上海)有限公司;RMRH 高速剪切乳化机 江苏鲁米智能装备制造有限公司;NanoZS90 纳米粒度、Zeta 电位分析仪 马尔文仪器有限公司;Vortex-5 涡旋振荡仪 海门市其林贝尔仪器制造有限公司;CT3-10K 质构仪 美国博勒飞公司;UV5100B 紫外分光光度计 上海元析仪器有限公司;Nicolet iS50傅里叶红外分光光度计 美国赛默飞世尔公司;DM500-ICC50W 生物数码显微镜 徕卡显微系统有限公司。
1.2 实验方法
1.2.1 SPI-卡拉胶-黄原胶复合乳液的制备 参考Feng 等[20]的研究方法,略有修改。
SPI 溶液的制备:称取50 g 的SPI 粉,分散于1000 mL 的蒸馏水中,使得SPI 浓度为5%,在室温环境下1500 r/min 转速搅拌2 h,于4 ℃条件下过夜水化。调整pH 至7.0,于80 ℃加热1500 r/min 转速搅拌30 min,冷却至室温。
卡拉胶-黄原胶溶液的制备:分别称取一定质量的卡拉胶与黄原胶粉末,各自分散于1000 mL 的蒸馏水中,制得卡拉胶和黄原胶原液,将两种溶液按1:1(v/v)混合,充分搅拌均匀得卡拉胶-黄原胶溶液,于4 ℃存放备用。
SPI-卡拉胶-黄原胶复合乳液的制备:将SPI 与卡拉胶-黄原胶溶液以1:1(v/v)比例混合,用1 mol/L的HCl 或NaOH 调整混合溶液的pH,于65 ℃持续搅拌1 h,即得SPI-卡拉胶-黄原胶复合乳液。
1.2.2 SPI-卡拉胶-黄原胶复合乳液制备条件优化在SPI 与卡拉胶-黄原胶配比1:10 g/g、pH6.0、卡拉胶质量分数0.3%、黄原胶质量分数0.3%的条件下,分别考察不同SPI 与卡拉胶-黄原胶配比(1:20、1:10、1:5、1:1 g/g),pH(3.0、4.5、6.0、7.5、9.0、10.5),卡拉胶质量分数(0.1%、0.2%、0.3%、0.4%、0.5%),黄原胶质量分数(0.1%、0.2%、0.3%、0.4%、0.5%)条件下,SPI-卡拉胶-黄原胶三元复合乳液颗粒的粒径与Zeta 电位的变化。其他制备条件为:将制备的三元复合溶液于65 ℃ 1500 r/min 转速条件下持续搅拌1 h 使其充分混匀。
1.2.3 不同内相体积SPI-卡拉胶-黄原胶Pickering乳液的表征及理化特性分析
1.2.3.1 不同内相体积SPI-卡拉胶-黄原胶Pickering乳液的制备 基于1.2.2 的优化实验结果,向制备的三元复合乳液中分别加入体积分数为10%、30%、50%、75%、85%的大豆油,利用高速剪切乳化机将200 mL 不同油相体积分数的乳液在12000 r/min 下均质2 min 制备Pickering 乳液[21]。根据高内相乳液的定义,当内相体积大于74%的乳液即认为是高内相乳液[3],因此当大豆油体积大于74%时,即形成SPI-卡拉胶-黄原胶复合高内相Pickering 乳液。
1.2.3.2 Pickering 乳液的粒度及Zeta 电位测定 参照文献[22]的方法,在25 ℃下,采用纳米粒度及Zeta电位分析仪测定Pickering 乳液的粒径及Zeta 电位。用移液枪吸取20 μL 样品于玻璃容器中,加入20 mL 的0.01 mol/L 磷酸缓冲液(pH9.0)稀释1000倍。在颗粒折射率:1.450;颗粒吸收率:0.001;分散剂折射率:1.330 的参数设置下测定样品的粒径。
1.2.3.3 Pickering 乳液的EAI 及ESI 测定 根据Zhang等[23]的方法稍微改动,测定Pickering 乳液的EAI及ESI。取上述新鲜制备的乳状液70 μL,加入14 mL 0.1%十二烷基磺酸钠(SDS)溶液稀释200 倍,用涡旋振荡仪振荡30 s 使其充分混匀。以0.1% SDS 为空白,使用紫外分光光度计在500 nm 波长下测量稀释样品的吸光值,记为A0;静置10 min 后再次在500 nm 波长下测量样品的吸光值,记为A10。EAI和ESI 测定公式如下:
式中:EAI 为乳化活性指数(m2·g−1);ESI 为乳化稳定性指数(%);N 为稀释倍数(200);C 为SPI 的质量浓度(g/mL);φ为乳化液中油相的体积分数;L 为比色杯厚度,取1 cm;A0、A10分别为开始时稀释样品溶液的吸光值以及静置10 min 时稀释样品溶液的吸光值。
1.2.3.4 不同内相体积SPI-卡拉胶-黄原胶Pickering乳液的微观结构分析 使用生物数码显微镜对Pickering 乳液进行微观观察。吸取20 μL Pickering乳液滴到显微镜载玻片上,小心地使用盖玻片从一端开始缓慢盖上,固定乳液并确保内部没有气泡,图像以50 倍放大率拍摄[24]。
1.2.3.5 不同内相体积SPI-卡拉胶-黄原胶Pickering乳液的红外光谱(FTIR)分析 以大气作为背景,用酒精对测定台等进行擦拭消毒后,用移液枪吸取20 μL乳液,小心滴在测定台上,设置测定参数:波数为4000~500 cm−1,扫描次数为64,分辨率4 cm−1,得到红外吸收曲线,分析乳液中SPI 在不同条件下的二级结构含量变化。
1.2.3.6 不同内相体积SPI-卡拉胶-黄原胶Pickering乳液的环境稳定性 将不同油相体积分数的Pickering乳液置于常温25 ℃贮藏条件下,分别测定其1~5 d的粒径、电位、EAI、ESI 及SPI 二级结构变化。
1.3 数据处理
本实验均进行三次平行,结果表示为平均值±标准差,采用SPSS 25.0 软件对数据进行处理,并用ANOVA 和Duncan 检验(P<0.05)进行统计分析,用Excel 软件进行作图。
2 结果与分析
2.1 不同条件下SPI-卡拉胶-黄原胶复合乳液的粒径及电位分析
2.1.1 不同SPI 与卡拉胶-黄原胶配比复合乳液的粒径及Zeta 电位变化 由图1 可知,随着SPI 与卡拉胶-黄原胶配比的升高,三元复合乳液中颗粒物的平均粒径呈现先平缓降低后显著升高的趋势,Zeta 电位呈现先显著下降后升高的趋势(P<0.05)。当SPI与复合多糖的质量浓度比为1:10 时,三元复合乳液的颗粒平均粒径最小为758.23±29.47 nm,电位绝对值达到最大值53.1±1.45 mV,颗粒分布均一、稳定,形成良好的蛋白质-多糖复合凝胶体系。基于此,选择SPI 与复合多糖的质量浓度比为1:10 进行后续实验。
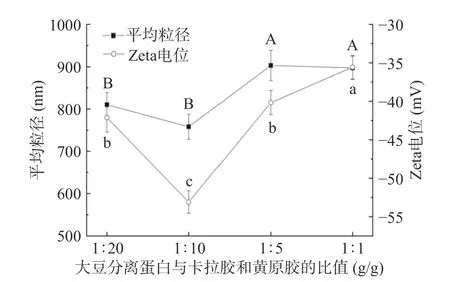
图1 不同SPI 与卡拉胶-黄原胶配比复合乳液的粒径及Zeta 电位变化Fig.1 Changes of particle size and Zeta potential of composite emulsion with different ratio of SPI to carrageenan-xanthan
2.1.2 不同pH 环境下复合乳液的粒径及Zeta 电位变化 如图2 所示,随着分散液pH 的逐渐升高,SPI-卡拉胶-黄原胶三元复合乳液的平均粒径和Zeta 电位均呈现整体下降趋势(Zeta 电位的绝对值显著升高)(P<0.05),在pH4.5~7.5 范围内,乳液中颗粒物的平均粒径和Zeta 电位下降相对平缓,当pH9.0~10.0 时,粒径和Zeta 电位显著下降,但pH9.0 和pH10.0环境下差异不显著(P>0.05)。江连洲等[25]研究显示,SPI 凝胶颗粒对pH 变化非常敏感,当Zeta 电位绝对值较小时,凝胶颗粒表面所带的同性电荷较少,减小了静电排斥作用,进而降低了分散液稳定性,使体系中蛋白分子倾向于相互聚集,在碱性条件下SPI凝胶颗粒表面同性电荷增多,同性电荷间的相互排斥使蛋白质溶液更稳定,从而促进SPI 凝胶颗粒作为Pickering 高内相乳液的稳定剂,这与本文结果基本一致。当pH 为9.0 时,三元复合乳液颗粒物的粒径较小(487.33±29.74 nm),此时电位绝对值最大(71.5±5.41 mV),颗粒粒度分布均匀,状态相对稳定,故调节体系pH 为9.0 进行后续实验。
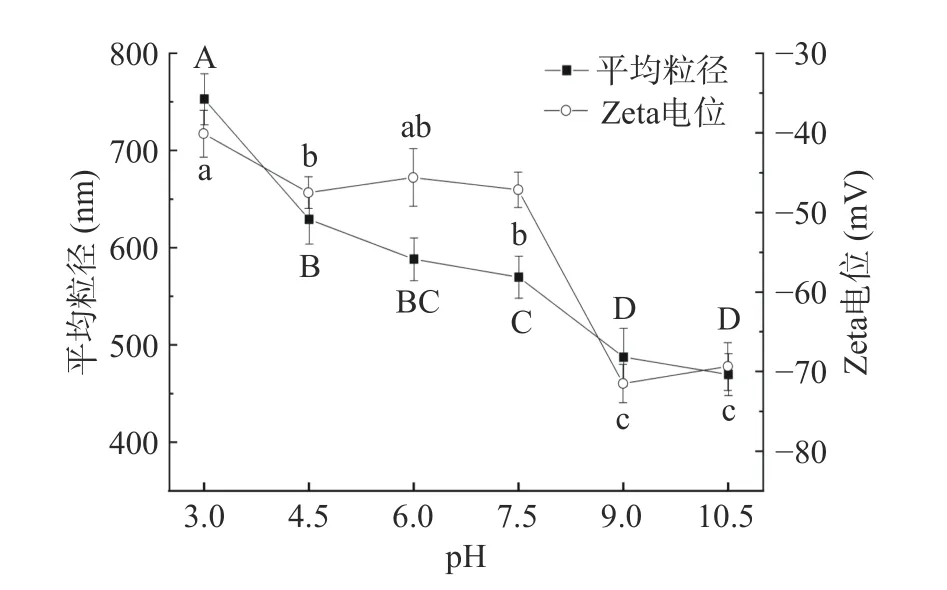
图2 不同pH 环境下复合乳液的粒径及Zeta 电位变化Fig.2 Changes of particle size and Zeta potential of composite emulsion at different pH values
2.1.3 不同卡拉胶质量分数复合乳液的粒径及Zeta电位变化 如图3 所示,随着卡拉胶质量浓度的升高,三元复合乳液中颗粒的平均粒径呈先显著减小后增大的趋势(P<0.05),Zeta 电位呈现先显著降低后平缓升高的趋势。较低浓度卡拉胶的加入有利于复合多糖与SPI 形成多糖-蛋白复合物,颗粒的稳定性增大,当卡拉胶质量浓度为0.2%时,SPI-卡拉胶-黄原胶三元复合乳液平均粒径有最小值,且Zeta 电位绝对值有最大值,故选择卡拉胶质量浓度0.2%进行后续实验。

图3 不同卡拉胶质量浓度复合乳液的粒径及Zeta 电位变化Fig.3 Changes of particle size and Zeta potential of composite emulsion with different mass concentration of carraneenan
2.1.4 不同黄原胶质量分数复合乳液的粒径及Zeta电位变化 如图4 所示,随着黄原胶质量浓度的升高,三元复合乳液中颗粒的平均粒径和Zeta 电位呈现先减小后增大的趋势(P<0.05),当黄原胶浓度在0.2%时颗粒粒径达到最小值246.7±21.65 nm,颗粒粒径小于300 nm,复合颗粒物粒度分布均一稳定,此时Zeta 电位的绝对值达65.03±1.67 mV,形成了较稳定的多糖-蛋白复合胶体体系,因此选择黄原胶质量浓度0.2%进行后续实验。该结果与Pickering粒子浓度充足时可稳定更大的油水界面,从而形成总表面积较大的小液滴的研究结果一致[26]。当与Pickering粒子浓度较低或者较高时,这些粒子不足以吸附到油水界面以形成粒径较小的乳液液滴,当SPI 与复合多糖的质量浓度比为1:10,pH 为9.0,卡拉胶质量浓度0.2%,黄原胶质量浓度0.2%时,粒子浓度充足且合适,能够形成具有更大总表面积且粒径较小的乳液液滴[27]。
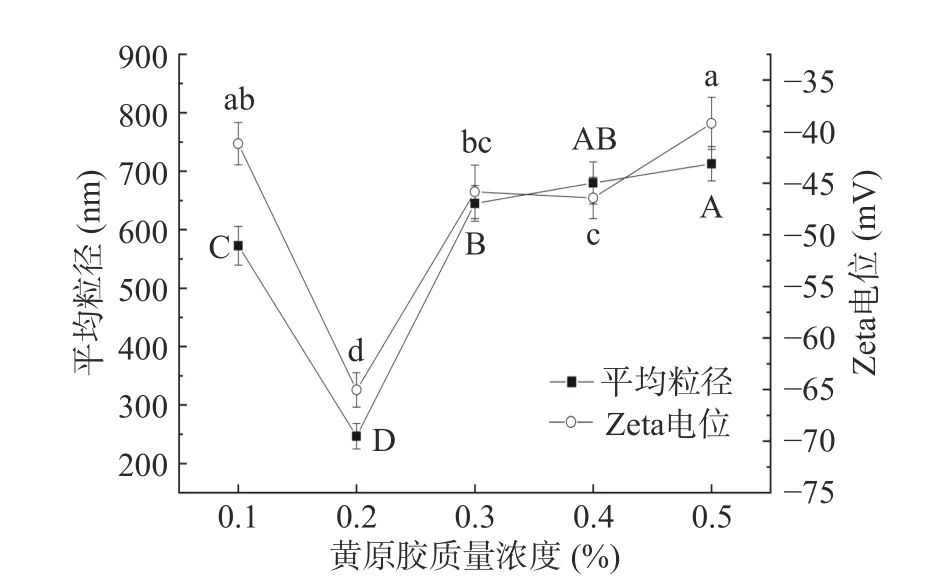
图4 不同黄原胶质量分数复合乳液的粒径及Zeta 电位变化Fig.4 Changes of particle size and Zeta potential of composite emulsion with different mass concentration of xanthan
2.2 不同内相体积SPI-卡拉胶-黄原胶Pickering 乳液的粒度及Zeta 电位分析
基于2.1 的研究结果,在SPI 与复合多糖质量比例1:10,溶液pH9.0,卡拉胶质量浓度0.2%,黄原胶质量浓度0.2%的条件下,随着大豆油内相体积分数的增加,三元复合乳液的平均粒径呈现逐渐下降的趋势(P<0.05);当大豆油体积10%~85%时,Zeta 电位绝对值显著增大(P<0.05)(如图5)。当油相体积10%~85%范围内,三元乳液能够形成较稳定的Pickering 乳液(图6),当油相体积75%~85%时,三元乳液能够形成较稳定的高内相Pickering 乳液,当油相体积75%时,乳液平均粒径有较小值(平均粒径达351±24.12 nm),Zeta 电位绝对值有最大值(99.4±1.4 mV),稳定性较其他组更优。Li 等[28]报道,随着内相体积分数的增加,液滴排列更加紧密、整齐,并相互连接,形成了致密的网络状油滴填充体系,此时乳液的液滴尺寸逐渐减小。内相体积分数的增大有利于油滴分散成更小的颗粒,形成更稳定的凝胶状结构[29]。高内相Pickering 乳液具有内相比例大、稳定性极佳、模版材料空隙均匀等特性,可应用于食品加工、医药用品[25,30]、生物组织工程[31]、化妆品[32]等多领域中。
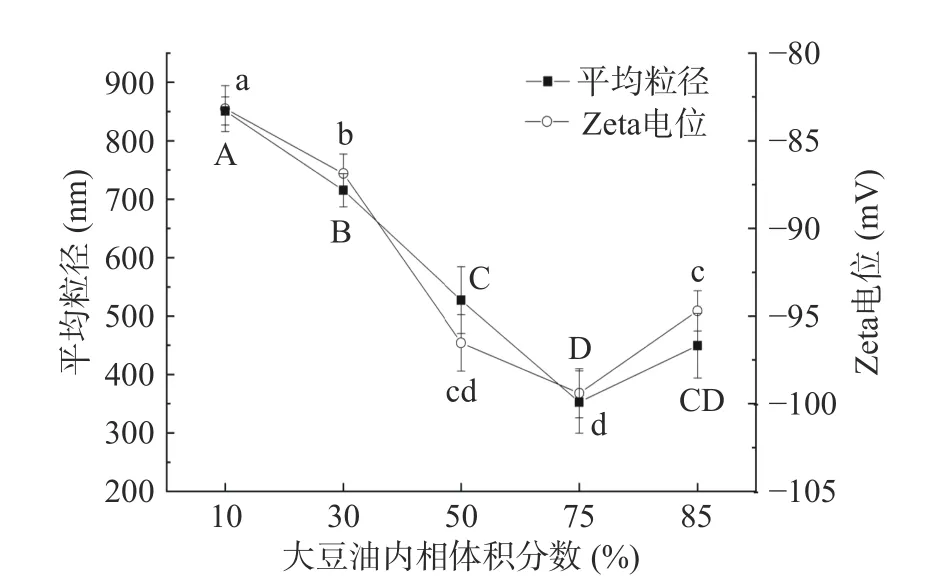
图5 不同油相体积分数下复合乳液的平均粒径及Zeta 电位Fig.5 The mean particle size and Zeta potential of composite emulsion with different inner phase volume of oil fraction

图6 不同油相体积分数下复合乳液外观图Fig.6 The appearance of composite emulsion with different inner phase volume of oil fraction
2.3 不同内相体积分数下Pickering 乳液的EAI 及ESI
不同内相体积分数下Pickering 乳液的EAI 及ESI变化如图7 所示。在大豆油内相体积10%~75%范围内,EAI 和ESI 均显著升高(P<0.05)。在添加量为75%时,乳液的EAI 和ESI 稳定性均达到最大值,此时,SPI-卡拉胶-黄原胶包埋了75%的油相,形成了紧密的填充状态,网络结构较强,而油相体积分数达85%时,乳液的EAI 和ESI 稍有下降,说明当油相体积75%时,SPI-卡拉胶-黄原胶乳液达到饱和状态,填充状态相对最为稳定。这与前文粒径结果一致,这是因为Pickering 乳液颗粒间的排斥力决定乳液稳定性,Zeta 电位的绝对值越大,说明分子间静电斥力越大,液滴之间不容易絮凝,乳液稳定性则越高[33]。
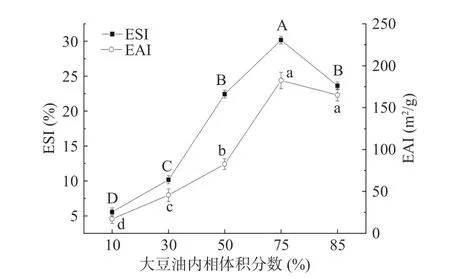
图7 不同油相体积分数下Pickering 乳液的EAI 及ESIFig.7 The EAI and ESI of Pickering emulsion with different inner phase volume of oil fraction
2.4 不同内相体积分数Pickering 乳液的微观结构
光学显微镜观察10%~85%大豆油内相体积分数下Pickering 乳液的微观结构如图8 所示,随着大豆油内相体积的增大,Pickering 乳液颗粒的粒径分布更加均一、稳定,当油相体积分数为75%时,乳液颗粒分散状态最佳,这与粒径、电位以及EAI、ESI的分析结果一致。
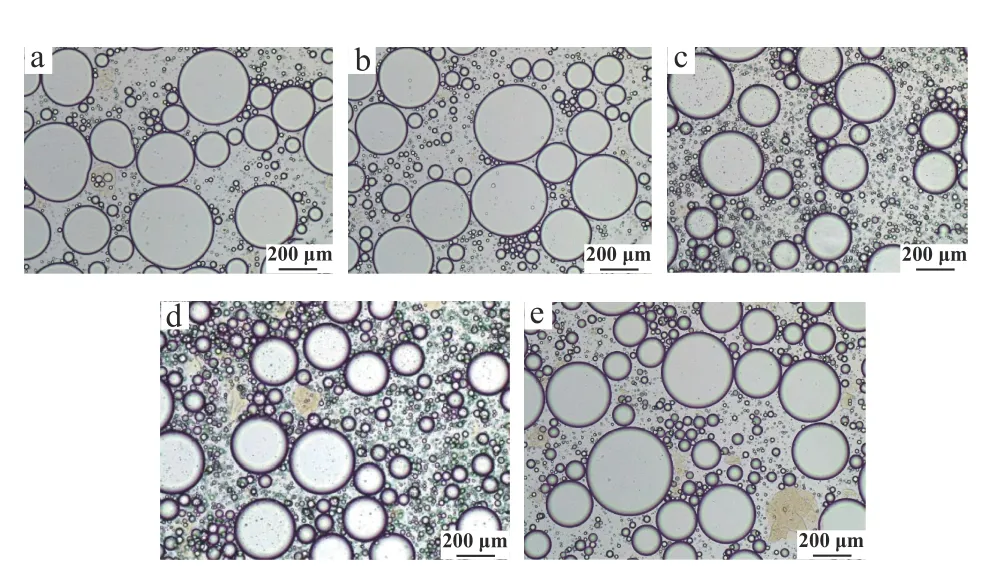
图8 光学显微镜观察不同油相体积分数下Pickering 乳液的微观结构Fig.8 The microstructure of Pickering emulsion with different inner phase volume of oil fraction observed by optical microscope
2.5 不同内相体积分数Pickering 乳液的红外光谱(FTIR)分析
通过傅里叶红外分光光度计测定乳液在不同内相体积分数下的红外光谱,表征不同内相体积分数SPI-卡拉胶-黄原胶三元复合Pickering 乳液中SPI二级结构含量变化(如图9 所示)。不同内相体积分数Pickering 乳液存在典型的蛋白特性峰,即1700~1600 cm−1的酰胺Ⅰ区和1230~1320 cm−1的酰胺Ⅲ区;同时,3500~3250 cm−1范围内的吸收峰反映OH、N-H 伸缩振动;2800~3000 cm−1范围内的吸收峰反映脂肪族C-H 伸缩振动峰;1700~1600 cm−1范围内的吸收峰反映C=O 和C-N 伸缩振动的酰胺I 带;1600~1500 cm−1范围内的吸收峰反映C-N 伸缩振动的酰胺Ⅱ带,1300~1000 cm−1左右的吸收峰主要反映C-O 键、C-N-C 键的伸缩振动[34−35]。
图9 不同油相体积分数Pickering 乳液的红外光谱Fig.9 The infrared spectra of Pickering emulsion with different inner phase volume of oil fraction
同时,利用PeakFit 拟合软件分析计算图谱分析(表1),当大豆油内相体积分数低于75%时,乳液中SPIα-螺旋含量整体随着内相体积分数的增加而增加,β-转角和无规则卷曲含量则整体随之减少。当大豆油内相体积分数达到75%时,α-螺旋含量最高,α-螺旋与蛋白质分子展开程度有关,其含量高说明蛋白分子展开程度低,结构稳定性较强[34]。随着油相体系的升高,β-转角的含量先下降后升高,而β-折叠的含量先升高后下降,β-转角的含量与蛋白柔性结构稳定相关,β-折叠的含量与蛋白分子聚集程度有关;SPI无规则卷曲含量变化较小,无规则卷曲的柔性构象结构利于连接结构相对刚性的α-螺旋和β-折叠[34]。
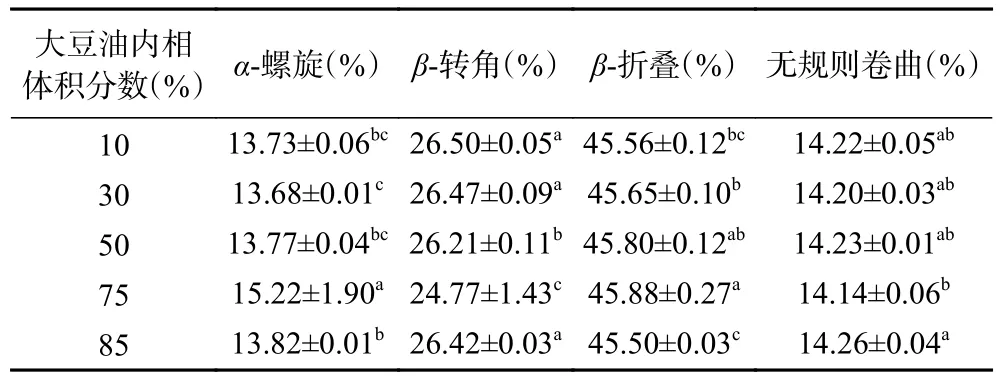
表1 不同油相体积分数Pickering 乳液SPI 的二级结构分析Table 1 Secondary structure analysis of SPI in Pickering emulsion with different inner phase volume of oil fraction
2.6 不同内相体积Pickering 乳液的环境稳定性
2.6.1 贮藏期间不同内相体积Pickering 乳液粒径及电位变化 贮藏期间不同大豆油内相体积Pickering乳液粒径及电位变化分别见图10 和图11,随着贮藏时间的延长,不同内相体积Pickering 乳液粒径呈整体升高趋势,Zeta 电位的绝对值呈整体下降趋势。当大豆油内相体积为10%~30%的乳液粒径在贮藏期间升高幅度较内相体积50%~85%的乳液更大,且贮藏后期(3~5 d)的粒径和Zeta 电位变化较之贮藏前期(1~2 d)更明显。许馨予等[15]研究显示,随着油脂内相体积的升高,析乳现象会明显降低,随着贮藏时间的延长乳液的粒径明显增大,乳液稳定性下降,这可能是因为常温条件下微生物生长繁殖破坏了乳液中的营养物质(蛋白质、多糖等),扰乱了乳液结构[36]。
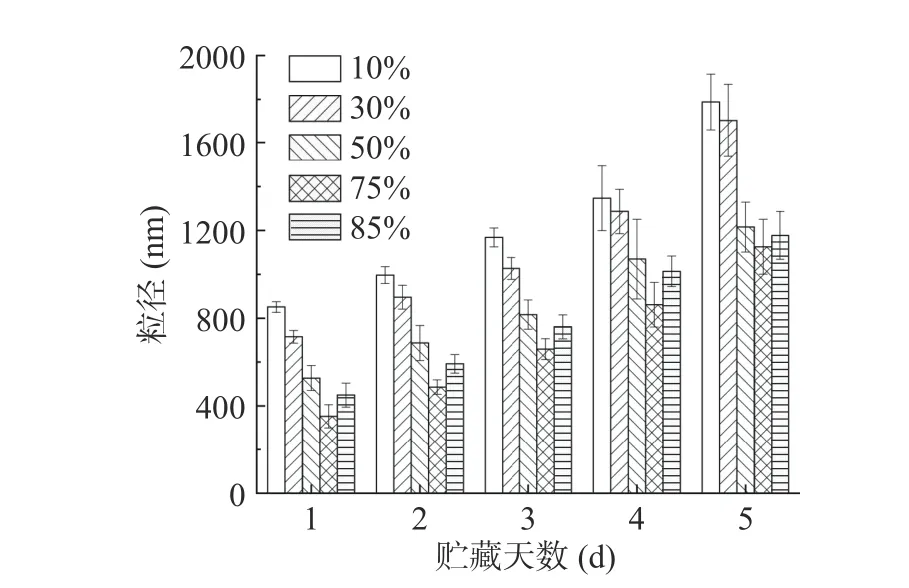
图10 贮藏期间不同油相体积Pickering 乳液粒径变化Fig.10 Changes of particle size of Pickering emulsion with different inner phase volume of oil fraction during storage

图11 贮藏期间不同油相体积Pickering 乳液Zeta 电位变化Fig.11 Changes of Zeta potential of Pickering emulsion with different inner phase volume of oil fraction during storage
2.6.2 贮藏期间不同内相体积Pickering 乳液EAI 及ESI 变化 贮藏期间不同内相体积Pickering 乳液EAI 及ESI 变化如图12 和图13 所示。随着贮藏时间的延长,Pickering 乳液EAI 和ESI 呈下降趋势,在贮藏后期下降较前期更明显;内相体积75%的三元Pickering 乳液EAI 和ESI 最高,且随着贮藏时间的延长下降幅度不明显;总体而言75%和85%的高内相乳液显示出更好的稳定性,这与前文研究一致。
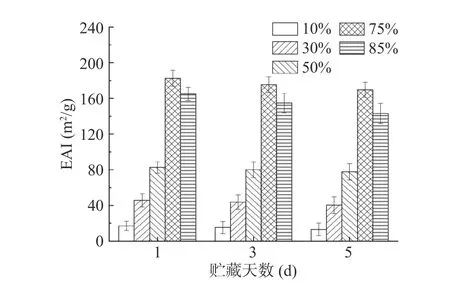
图12 贮藏期间不同油相体积Pickering 乳液EAI 变化Fig.12 Changes of EAI of Pickering emulsion with different inner phase volume of oil fraction during storage
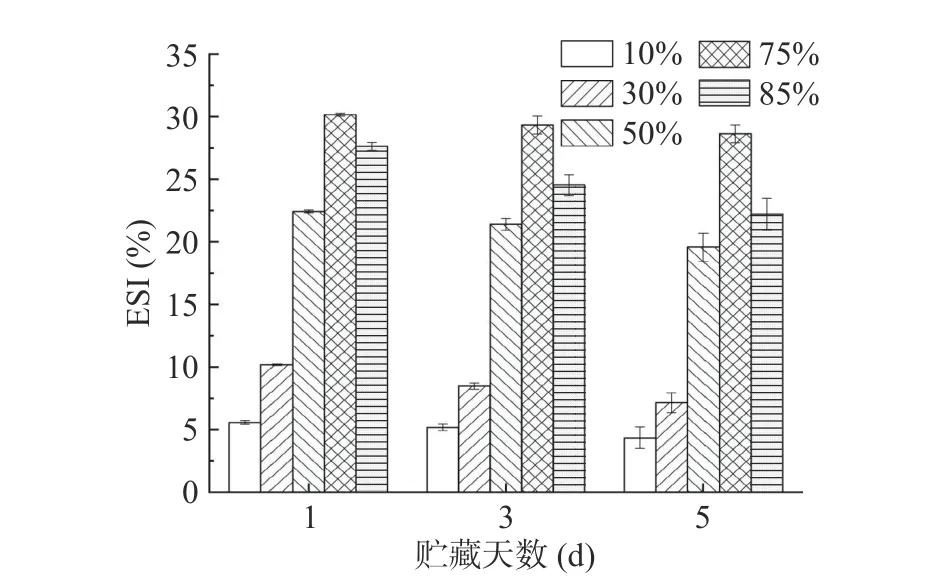
图13 贮藏期间不同油相体积Pickering 乳液ESI 变化Fig.13 Changes of ESI of Pickering emulsion with different inner phase volume of oil fraction during storage
2.6.3 贮藏期间不同内相体积Pickering 乳液SPI 二级结构变化 贮藏期间10%~85%内相体积Pickering乳液SPI 二级结构(α-螺旋、β-转角、β-折叠和无规则卷曲)变化如图14 所示。随着贮藏时间的延长,所有乳液的α-螺旋含量和β-转角含量有所下降,β-折叠有所增加,无规卷曲含量变化不明显。在常温贮藏条件下,油脂内相体积10%、30%、50%、75%和85%的Pickering 乳液α-螺旋分别从13.73%、13.68%、13.77%、15.22%、13.82%下降到12.39%、13.07%、12.85%、14.27%、12.71%,β-转角分别从26.50%、26.47%、26.21%、24.77%、26.42%下降到24.98%、25.77%、25.08%、22.82%、24.96%,β-折叠分别从45.56%、45.65%、45.80%、45.88%、45.50%升高至48.46%、47.08%、47.88%、48.76%、48.21%。以上变化说明贮藏期间Pickering 乳液SPI 分子展开程度有所增加,蛋白柔性结构的稳定性也有所降低,蛋白分子有所聚集[34−35]。相对而言,油相体积分数50%、75%和85%的Pickering 乳液均显示出较好的耐贮性,其中油相体积分数75%的Pickering 乳液贮藏期间稳定性最强,且变化幅度最低。

图14 贮藏期间不同油相体积Pickering 乳液SPI二级结构变化Fig.14 Secondary structure changes of SPI in Pickering emulsion with different inner phase volume of oil fraction during storage
3 结论
当SPI 与复合多糖的质量浓度比为1:10,pH 为9.0,卡拉胶和黄原胶质量浓度均为0.2%,油相体积10%~85%时,均能够制备出具有较稳定体系的SPI-卡拉胶-黄原胶复合Pickering 乳液,当油相体积分数为75%时,乳液颗粒分散状态最佳,EAI 和ESI 达到最大值,SPIα-螺旋和β-折叠含量最高。在常温贮藏条件下,随着时间的延长,不同内相体积Pickering 乳液粒径呈整体升高趋势,Zeta 电位的绝对值、EAI和ESI 呈整体下降趋势,α-螺旋含量和β-转角含量有所下降,β-折叠有所增加,无规卷曲含量变化不明显,其中内相体积75%和85%的高内相乳液显示出更好的稳定性。本研究制备的SPI-卡拉胶-黄原胶三元复合Pickering 乳液显示出优良的理化特性及贮藏稳定性,这为功能性物质靶向递送和脂肪代替物创新提供了一定技术参考,同时,其加工稳定性及体内功效特性将有待进一步探究。
