改性玉米秸秆纤维素的制备及其对Pickering 乳液稳定性的影响
2023-08-15邵添樊红秀刘炳莉刘婷婷张艳荣
邵添,樊红秀,刘炳莉,滕 旭,刘婷婷,张艳荣
(吉林农业大学食品科学与工程学院,农业农村部食用菌加工技术集成科研基地,吉林省粮食精深加工与高效利用工程研究中心,吉林省粮食精深加工与副产物高效利用技术创新重点实验室,吉林长春 130118)
纤维素是葡萄糖苷通过糖苷键连接而成的多糖类物质。由于其具有两亲性、稳定性好、无毒等优点,经常用来制备固体颗粒以作为Pickering 乳液的乳化剂[1]。其主要通过吸附行为不可逆地排列在液滴界面上,充当空间位阻,阻断界面间相互作用和液滴接触,以形成稳定的乳液[2]。然而,由于天然纤维素颗粒的粒径相对较大且具有紧凑的聚合结构难以暴露官能团[3],通常对其进行改性使其成为理想的固体乳化剂。其中酸解-机械联用的方法受到了广泛的关注。酸解-机械法改善了酸解过程难以控制和机械法能耗高的特点,同时使纤维素微观结构松散,暴露更多官能团,并且小颗粒纤维素具有更大的比表面积,可以更快的吸附在油水界面,有利于界面膜的形成,从而提高了纤维素的乳化能力[4]。Lu 等[5]通过盐酸水解-球磨的方式制备小颗粒纤维素,并以此稳定Pickering 乳液。发现小颗粒纤维素稳定的乳液在1 个月的贮藏期间表现出良好的稳定性。Luo 等[4]利用草酸水解纤维素,再利用高压均质获得不同尺度的纤维素,将其用作水包油型乳液的乳化剂。结果表明,纤维素尺度大小显著影响其乳化能力,尺度较小的纤维素颗粒可以产生稳定的Pickering 乳液。
玉米秸秆作为农业生产过程中的副产品,其年产量达2.2 亿吨,多被用作畜牧饲料。随着粮食增产,秸秆过剩问题凸显,造成违规焚烧秸秆等现象[6]。玉米秸秆纤维素含量约40%,因此是良好的纤维素来源[7]。玉米秸秆纤维素存在亲水性高和尺度较大的缺点,难以满足其作为固体乳化剂的要求,需要进一步改性,但其改性方法多为单一的改性方法[8]。并且,目前玉米秸秆纤维素在Pickering 乳液的应用研究还很少。由此可见,以硫酸水解-高压均质法改性玉米秸秆纤维素并使用其制备Pickering 乳液,既能为玉米秸秆纤维素的改性提供新方法还可以为其拓展应用途径。
百里香精油是一种天然疏水抗氧化剂和广谱抗菌剂,因此在食品、包装、医药等领域有着广泛的应用[9]。但是百里香精油的高挥发性、热分解性、低水溶性和不稳定性导致其在应用上有一定的局限性[10]。制备Pickering 乳液可以有效提高精油稳定性[11]。纤维素因其具有无毒、成本低、可降解及良好的生物相容性等特点常被用作Pickering 乳液的固体乳化剂[5]。但目前多数研究利用纤维素纳米晶制备Pickering 乳液提高精油稳定性[12],对于农产品加工副产物来源的纤维素制备Pickering 乳液的相关研究鲜有报道。此外,很少有研究关注不同改性方法制备的固体乳化剂对Pickering 乳液稳定性的影响。
因此,本文采用硫酸水解和硫酸水解-高压均质联用法对玉米秸秆纤维素改性。对改性前后纤维素进行表征与分析,探究改性处理对玉米秸秆纤维素结构与性质的影响,并探究改性前后纤维素稳定的Pickering 乳液的稳定性差异,以期提高玉米秸秆的附加值和综合利用率,同时为后续百里香精油的应用提供参考。
1 材料与方法
1.1 材料与仪器
玉米秸秆 购于长春市;百里香精油 吉安市绿源天然香料油有限公司;亚氯酸钠、氢氧化钠、硫酸、盐酸 分析纯,国药集团化学试剂有限公司;冰醋酸 分析纯,北京化工厂;尼罗红、荧光增白28分析纯,美国Sigma 试剂公司。
UV-2300 紫外分光光度计 北京普析通用仪器有限公司;TGL20M-Ⅱ高速冷冻离心机 盐城市凯特仪器公司;Malvern Mastersizer 3000E 激光粒度分析仪 英国马尔文仪器有限公司;Nicolet iS20 傅里叶变换红外光谱仪 美国赛默飞世尔公司;Tundra Cryo-TEM 扫描电镜 美国赛默飞世尔公司;Turbiscan AGS 多重光散射稳定性分析仪 法国Formulaction 仪器公司;Discovery HR-1 流变仪 美国TA 公司;ATS/AMF-5 高压均质机 苏州安托思纳米技术有限公司;LSM880 激光共聚焦显微镜 德国Carl Zeiss 公司;Leica DMI600B 倒置显微镜 德国Leica公司。
1.2 实验方法
1.2.1 纤维素的提取及改性 参考赵昊[13]的方法并稍作修改。将玉米秸秆清洗干净,晾干,粉碎并过80 目筛,以1:15(g/mL)料液比,将秸秆粉末浸没在5%亚氯酸钠溶液中,用10%醋酸将溶液pH 调节至3,在75 ℃的水浴中搅拌3 h 除去木质素,随后以4000 r/min 离心15 min,洗涤至中性。将得到的沉淀物用5%氢氧化钠溶液70 ℃浸泡5 h 除去半纤维素,然后用蒸馏水离心洗涤样品,直至上清液为中性,最后将得到的沉淀冷冻干燥,即得到CS。
参考郭艳等[14]的方法并加以改进。配制1 mol/L的硫酸溶液,按料液比1:10(g/mL)对上述得到的CS 进行水解,50 ℃水解1.5 h。随后加入硫酸溶液10 倍体积的蒸馏水以终止反应,离心去除上清液,得到沉淀即为CP。用大量蒸馏水将沉淀至中性,冷冻干燥,研磨成粉末状备用。然后用蒸馏水将冻干后的沉淀配制成质量分数为1%的悬浮液,超声分散后,将高压均质机压力设置为40 MPa,均质时长为5 min,得到HPC。
1.2.2 纤维素粒径分析 在室温下,使用马尔文激光粒度仪对不同纤维素颗粒的粒径进行测定,以蒸馏水为分散介质,逐滴加入样品,折光率达到14%~15%时开始测量,设置分散介质折射率1.330。
1.2.3 纤维素微观结构观察 在50 ℃烘箱中将纤维素样品烘干至恒重。采用电子扫描显微镜观察纤维素微观结构的变化,观察时采用高真空模式,工作电压为10 kV,将样品粘至导电台并喷金后以5000倍的放大倍率观察制备的纤维素样品。
1.2.4 纤维素傅里叶红外光谱分析 将纤维素和干燥至恒重的溴化钾粉末按质量比为1:100 放置于研钵中,充分研磨后,称取20 mg 混合物压片。测定范围为4000~400 cm−1,分辨率为4 cm−1。
1.2.5 纤维素静水接触角测定 参考Liu 等[15]的方法稍作修改,使用压片机将纤维素压制成表面光滑的薄片。然后将这些薄片放在样品台上,开始测量,并通过高速摄像机记录图像,使用停滴法和圆拟合法计算出静水接触角。
1.2.6 Pickering 乳液的制备 参考葛思彤等[16]的方法,将上述制备的纤维素用去离子水稀释,与一定比例的百里香精油混合,利用高速剪切机在11000 r/min条件下均质2 min,得到粗乳液,再将粗乳液在30 MPa的压力条件下,高压均质3 min 得到新鲜乳液。根据前期预实验的结果,确定纤维素质量浓度为0.50%,油相比例为10%,制备不同纤维素颗粒稳定的Pickering 乳液。将制备好的乳液密封在样品瓶中,放置于室温(25 ℃)下避光贮藏21 d,供后续观察及分析使用。
1.2.7 乳液界面微观结构观察 取10 μL 的尼罗红溶液(1 mg/mL)、10 μL 的荧光增白剂溶液与1 mL新鲜乳液混合均匀,静止30 min 后[17],吸取5 μL 染色乳液滴至载玻片,覆盖盖玻片后利用激光共聚焦扫描显微镜(CLSM)观察乳液液滴的界面微观结构。
1.2.8 乳液流变学分析 取5 mL 新鲜乳液,在25 ℃条件下测定0~100 s−1剪切速率范围内乳液黏弹性模量的变化[18]。同时在1 Pa 压力下,测定10~100 Hz 范围内乳液储能模量(G')与损耗模量(G'')的变化[19]。
1.2.9 乳液Zeta 电位和粒径分析 在室温下以蒸馏水为分散介质,将新鲜制备的乳液和贮藏21 d 后的乳液逐滴加入到样品池中,直到折光率达到14%~15%,分别设置蒸馏水和百里香精油的分散介质折射率为1.330 和1.502,进行Zeta 电位和粒径的测量。
1.2.10 乳液微观结构观察 参考Lu 等[20]的方法,吸取10 μL 新鲜制备的乳液和贮藏21 d 后的乳液分别置于载玻片上,使用荧光倒置显微镜对乳液的微观形态进行观察,并收集图像。
1.2.11 乳液物理稳定性测定 稳定指数(Turbiscan stability index,TSI)是指将样品在测试时间内扫描相同高度下透射光光强变化值,直至累加到样品总高度的结果,是评价样品稳定性的指标。参考邢琳琳等[21]的方法并稍作修改。用多重光散射仪以30 s的间隔,对新鲜制备的乳液和贮藏21 d 后的乳液分别扫描30 min。
1.3 数据处理
采用IBM SPSS Statistics 24 软件对数据进行分析,使用Origin 2019 和GraphPad Prism Version 8.02绘制图像。每个实验至少进行3 次平行实验,实验结果以平均数±标准差表示。
2 结果与分析
2.1 纤维素结构与性质的结果分析
2.1.1 纤维素粒径分析 纤维素的粒径分析结果如图1 所示,三种纤维素均呈现单峰分布且粒径大小存在明显差异,其中CS 平均粒径为110.17 μm。CS经硫酸水解后降解断裂,同时引入了SO42-,增加纤维素颗粒的表面电荷,增大颗粒间的静电排斥作用和位阻效应,从而减少颗粒的团聚[14],因此与CS 相比,CP 的粒径均显著减小(P<0.05),平均粒径为56.48 μm。随后在高压均质的过程中纤维素受到多种力的作用,包括粒子间的撞击力、剪切力,以及由于物体流速的极端变化而产生的空化力等[22]使得纤维素部分结晶区和非结晶区发生断裂,HPC 粒径分布曲线变窄,向较小粒径方向移动,表明粒径变小且粒径分布更均匀,HPC 的平均粒径为28.61 μm。
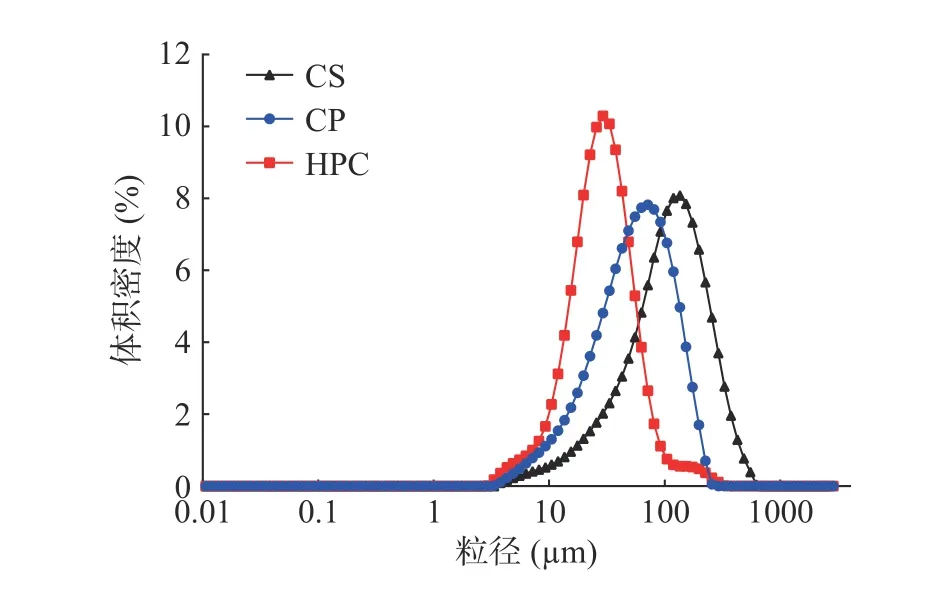
图1 不同纤维素的粒径分布图Fig.1 Particle size distribution of different cellulose samples
2.1.2 纤维素微观结构观察 由图2 的扫描电镜结果可以清晰地观察到CS 表面粗糙,呈现为较大的无规则片状颗粒,结构完整,但颗粒大小不均匀;而通过硫酸水解除去了结构中的无定形部分后[23],CP 的表面较为平整光滑,结构更为紧凑,呈现出短棒状形态;HPC 的表面与CS 和CP 的差别很大,部分结构被破坏,多处呈卷翘形,表面粗糙,疏松多孔的结构可能会暴露出更多活性基团。张益嘉等[24]研究表明,高压均质处理时纤维素与均质阀发生猛烈撞击,使得纤维素颗粒的形貌发生较大变化。以上微观结构结果表明,所制备的HPC 相较于CS 和CP 具有更小的粒度,这将有利于其暴露更多的活性基团,这些特点使得HPC 在作为固体乳化剂方面具有优势,与Lu 等[5]的研究结果一致。
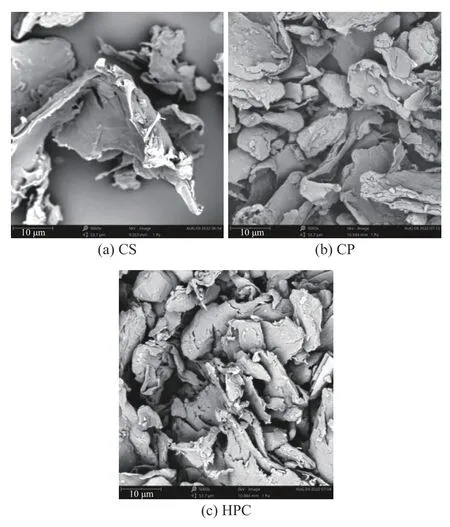
图2 不同纤维素的扫描电子显微镜图(5 k×)Fig.2 Scanning electron microscope images of different cellulose samples (5 k×)
2.1.3 纤维素傅里叶红外光谱分析 傅里叶红外光谱用于观察不同纤维素之间功能基团的差异。图3中,3 条红外吸收谱带均在3000~3650 cm−1处和1600 cm−1处附近出现强宽吸收峰,它们分别对应羟基(-OH)的拉伸振动和弯曲振动[25],是纤维素结构具有的特征吸收峰。这表明纤维素中存在大量分子内和分子间氢键。在3000~3650 cm−1处和1600 cm−1处,与CS 相比,CP 和HPC 波数向低波数移动[26],表明氢键数量增加。890 cm−1与1165 cm−1处为β-1,4-糖苷键的特征吸收峰[27]。890 cm−1处与1165 cm−1处,与CS 相比,CP 的峰减弱,HPC 的峰甚至消失,代表着β-1,4-糖苷键的断裂,说明纤维素聚合度减小,与上述粒径分析结果相一致。1353 cm−1处的吸收峰和纤维素中的C-H 键的伸缩振动有关[28−29]。其中与CS 相比,CP 与HPC 在1353 cm−1处的峰面积均有所增大,代表纤维素极性增加。以上结果表明,CS 经过硫酸水解和高压均质处理后,其主要成分和结构未发生明显变化,聚合度减小,极性增强,更有利于纤维素在乳液液滴表面的吸附[30]。
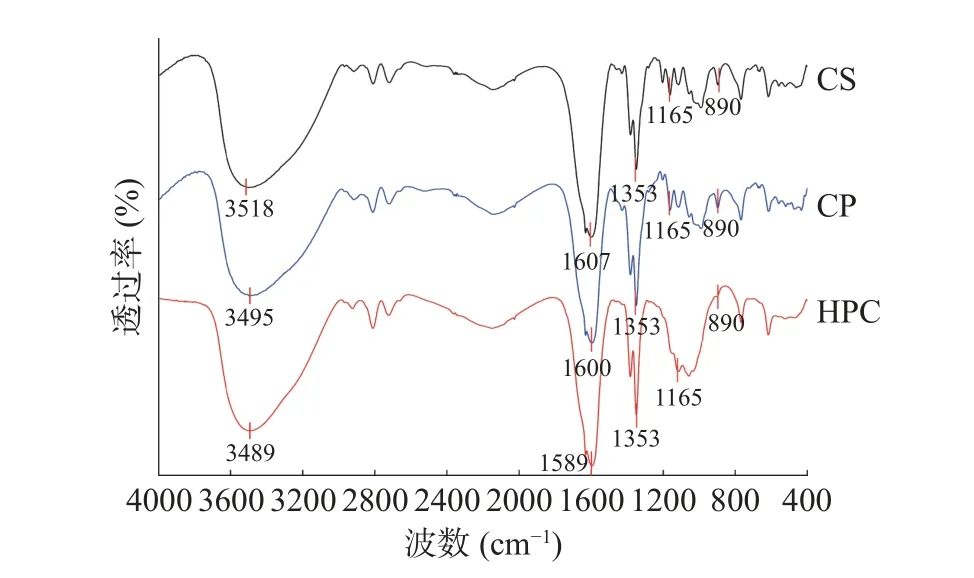
图3 不同纤维素的傅里叶红外图谱Fig.3 Fourier transform infrared spectroscopy of different cellulose samples
2.1.4 纤维素静水接触角的测定 当接触角接近90°时,纤维素表现出两亲性,可增强颗粒的吸附能力,并在乳液体系中充当空间位阻,防止乳液液滴发生聚结现象,更适合作为皮克林乳液的固体乳化剂使用[31]。结果如表1、图4 所示,与 CS 相比,CP 和 HPC的静水接触角均显著性增大(P<0.05),且HPC 达到了76.1°,约为CS 的2.4 倍。说明两种改性方法均使纤维素颗粒的疏水性提高。其原因是在机械力的作用下纤维素断裂,结晶区域会受到破坏,导致纤维素的结晶面((200)疏水平面和(200)β/(220)α疏水平面)在结构上不等价[32]。这与Costa 等[33]的研究结果类似,他们发现高压均质处理后的香蕉皮纤维素疏水性增加。
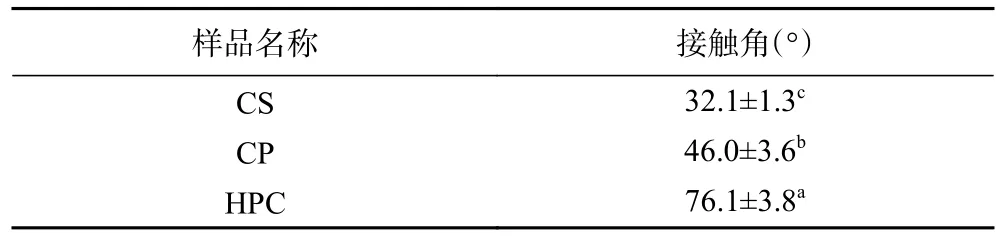
表1 改性前、后纤维素的接触角比较Table 1 Comparison of contact angle between cellulose before and after modification

图4 不同纤维素的静水接触角Fig.4 The static water contact angles of different cellulose samples
2.1.5 乳液界面微观结构观察 激光共聚焦法是一种常用来观测乳液界面微观结构的有效方法。如图5所示,乳液的油滴被激发为红色荧光,纤维素被激发为蓝色荧光。研究表明,固体颗粒不可逆地吸附在油水界面上,会在油滴周围形成一层屏障,防止油滴的聚结[34]。在图5 的所有图像中,观察到不规则的蓝色荧光分布在红色液滴的周围,证明该乳液是典型的O/W 型乳液,与Nomena 等[35]的研究结果相一致。在图5(a)中,CS 乳液液滴分布不均匀,且液滴较大;图5(b)中,CP 乳液液滴粒径减小,但依然出现分布不均匀的情况,形成这种情况的可能原因是SO42-的引入增加了纤维素的不可逆吸附作用[36]。图5(c)中,HPC 乳液液滴大小和分布相较于CS 乳液和CP乳液更加均匀、致密,液滴之间没有发生明显聚集现象,这表明HPC 吸附在液滴的油水界面上,紧密排列,形成致密的界面膜,充当空间位阻,防止乳油滴聚集,乳液稳定性较好[37],进一步证实了HPC 作为乳化剂稳定乳液的能力。
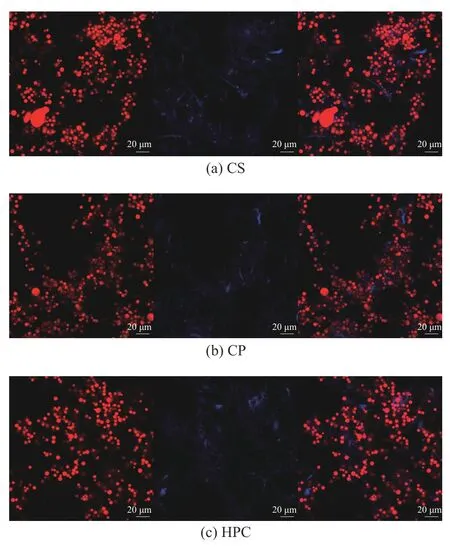
图5 不同纤维素乳液的CLSM 图Fig.5 CLSM images of different cellulose emulsion
2.1.6 乳液流变特性分析 流变特性是反映乳液的物理稳定性的重要指标之一。为进一步验证玉米秸秆纤维素在乳液体系中的作用,测定了由三种纤维素稳定的Pickering 乳液随剪切频率的改变,其表观黏度的变化。如图6(a)所示,所有乳液均随着剪切速率的增大,表观黏度值减小,这是典型的剪切稀化现象,证明三种Pickering 乳液均属于非牛顿流体[38−39]。在相同剪切速率条件下,随着纤维素颗粒粒径的减小,乳液表观黏度逐渐增加。这可能是因为CS 乳液的液滴分散不均一,液滴间网络断裂,导致分子间作用力降低,进而使黏度降低;而由CP 和HPC 稳定的乳液液滴粒径更小,分散性变好,形成的网络结构更稳定,乳液的黏度增大从而限制了液滴的移动,提高了乳液的抗剪切能力。
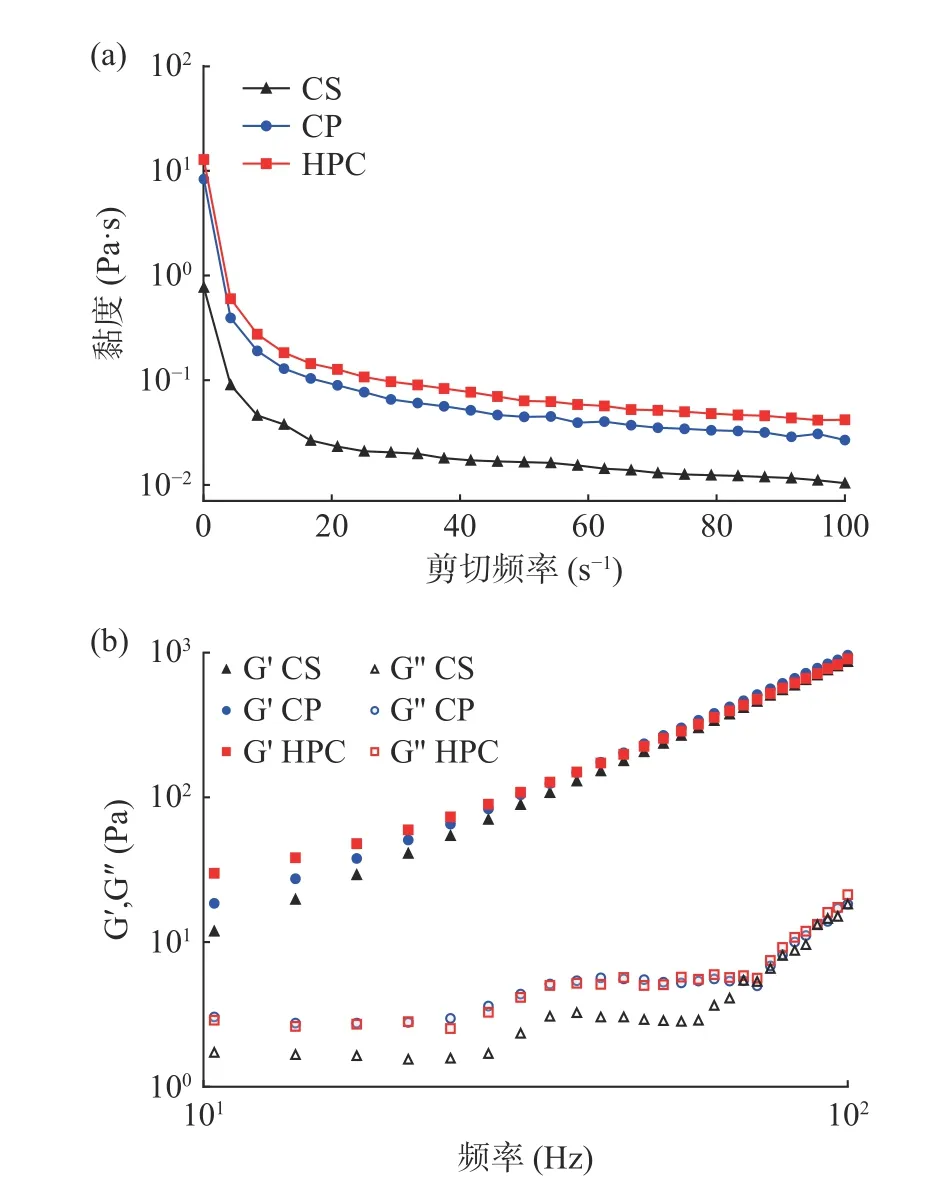
图6 不同纤维素乳液的黏度(a)、储能模量G′和损耗模量G″(b)Fig.6 Viscosity (a),storage modulus G′ and loss modulus G″(b) of different cellulose emulsion
储能模量(G′)和损耗模量(G″)的变化如图6(b)所示,在整个频率范围内所有样品的储能模量(G')始终高于损耗模量(G''),G′及G″都随频率增加而增加,表现出频率依赖性[40],这种结构有利于提高乳液的稳定性[41]。Ortiz 等[42]的研究表明,Pickering 乳液的G'值越高,在外力作用下产生形变的可能性就越低,从而显示出较好的高频稳定性。因此可以证明HPC乳液具有较强的物理稳定性。
2.2 不同纤维素乳液贮藏稳定性的结果分析
2.2.1 乳液Zeta 电位及粒径分析 Zeta 电位绝对值代表乳液所带静电荷数量[43],当Zeta 电位绝对值大于30 mV 时,液滴以及颗粒间的斥力具有抵抗聚结的能力[44]。图7 中,三种乳液中HPC 乳液的Zeta 电位绝对值最大。由表2 可知,在贮藏21 d 后,CS 乳液的平均粒径显著增大(P<0.05),达到11.43 μm,这有可能是液滴之间斥力变小,发生聚集或絮凝所致[45],这与Li 等[46]研究的结果一致。CP 乳液的粒径变化和液滴聚集现象有所减弱,这可能是由于强静电和空间斥力共同作用导致粒子难以聚集,液滴之间的静电斥力增加,可以保持液滴之间的平衡,从而减小粒径。HPC 乳液贮藏21 d 后平均粒径变化较小,粒径分布仅出现轻微移动并十分稳定。三种纤维素乳液的贮藏稳定性出现这种差异是因为纤维素中含有羟基等极性基团,溶于水后发生解离,带有负电荷,而HPC 经过硫酸水解和高压均质的剪切力,分子链之间的氢键发生断裂,使得极性基团增加,电负性随之增强[47],液滴之间表现出相对抗聚集的能力,液滴分散性变好,絮凝现象逐渐减弱。这一现象与2.1.3 中傅立叶红外光谱分析结果一致。

表2 不同纤维素乳液在第1 d 和贮藏21 d 后平均粒径变化Table 2 The change of average particle size of different cellulose emulsion on the first day and after storage for 21 days
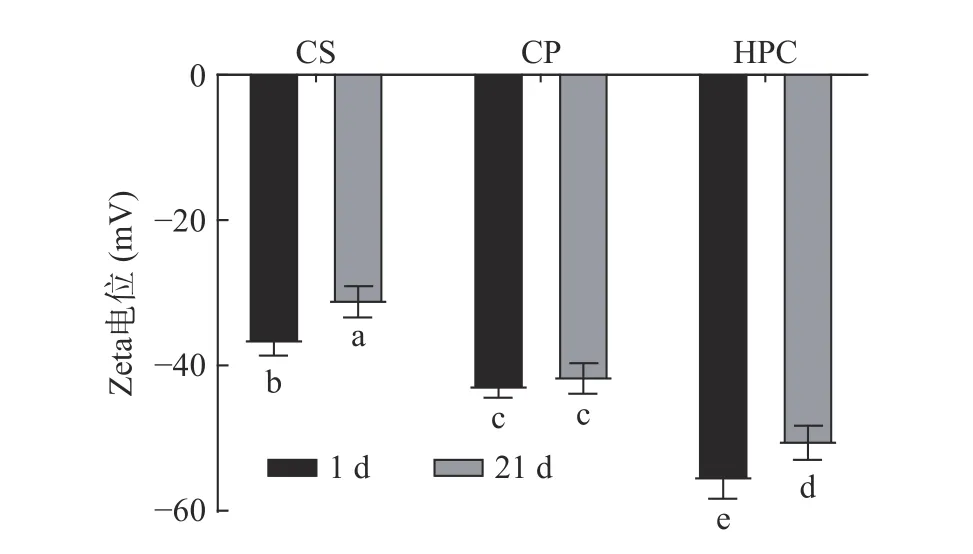
图7 不同纤维素乳液在第1 d 和贮藏21 d 后Zeta 电位变化Fig.7 The change of Zeta potential of different cellulose emulsion on the first day and after storage for 21 days
2.2.2 乳液微观结构分析 乳液的微观结构观察结果如图8 所示。CS 乳液液滴粒径分布不均匀且液滴絮凝状明显,这可能是CS 不足以在油水界面形成完整的膜,继而发生乳液失稳现象;CP 乳液液滴粘连现象减弱,但依旧出现了部分絮凝;新鲜制备的HPC 乳液液滴边缘清晰,结构完整,大小均一,没有出现液滴塌陷和液滴聚集现象,呈现均匀致密的球形分布,分散性最好。CS 乳液在贮藏21 d 后粒径增大,液滴粘连现象加剧。CP 乳液液滴之间表现出相对抗聚集的能力,絮凝现象逐渐减弱。对于HPC 乳液来说,在贮藏21 d 后没有明显的液滴粘连现象发生,乳液的分散性最好。这些观察结果表明HPC 乳液液滴表面被HPC 逐渐覆盖,与油相、水相形成了致密且稳定的网络结构[48],阻止液滴的聚集或絮凝。这与表2 中贮藏期间粒径变化的趋势相一致,再次证明了HPC 可以有效增强乳液在贮藏期间的稳定性能,防止乳液在贮藏期间发生失稳现象。
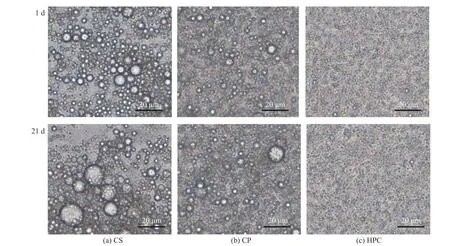
图8 不同纤维素乳液在第1 d 和贮藏21 d 后微观结构观察图像Fig.8 The microstructure observation figures of different cellulose emulsion on the first day and after storage for 21 days
2.2.3 乳液TSI 及外观形貌分析 TSI 值代表乳液体系的稳定性[49],TSI 值越小,说明液滴的吸附层稳定性更好,其在贮藏过程中发生液滴絮凝的几率越小。乳液TSI 值越大,其曲线斜率越大,表明乳液越不稳定[50]。图9(a)中,新鲜制备的乳液均具有较低的TSI 值,CS、CP 和HPC 乳液分别为0.408、0.317、0.199。贮藏21 d 后的TSI 分别为0.936、0.496、0.359,CS 乳液在900 s 时TSI 曲线还处于上升阶段,CP 乳液和HPC 乳液在900 s 后,TSI 值升高的趋势平稳,乳液体系逐渐稳定。贮藏前后CS 乳液的TSI 值显著增大,表明CS 乳液在长期贮藏的过程中发生了结构崩塌的现象,而HPC 乳液在静置21 d 内TSI 值波动最小,说明乳液储藏稳定性最好。
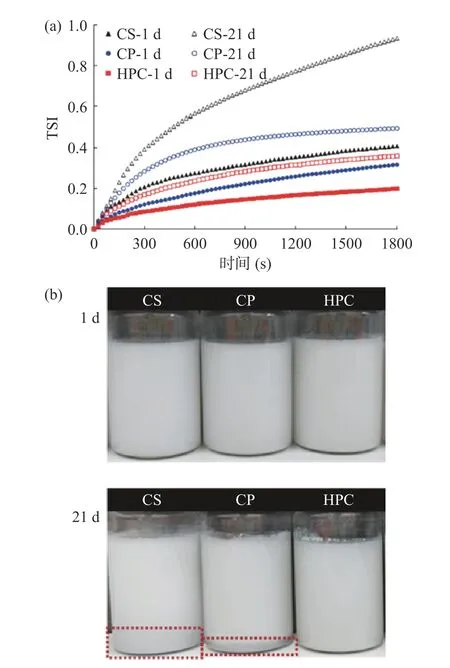
图9 不同纤维素乳液在第1 d 和贮藏21 d 后TSI 变化(a)和外观形貌图像(b)Fig.9 The change of TSI (a) and appearance (b) of different cellulose emulsion on the first day and after storage for 21 days
乳液是热力学不稳定体系,在制备和储藏过程中可能出现聚集、絮凝等现象,外观形貌可以直观地反映出乳液的稳定性[51]。三种纤维素稳定的Pickering乳液及贮藏21 d 后的外观形貌如图9(b)所示,图中新鲜乳液均具有较高的稳定性,其质地均一细腻,未发生油水分离现象。静置21 d 后,CS 乳液出现了油水分离现象,这是由于CS 乳液液滴粒径不均一,液滴间的网络结构不稳定,乳液流动性增加,乳液液滴间相互碰撞的频率增加,更容易发生聚集,因此乳液的物理稳定性变差;CP 乳液发生了轻微的乳析现象,表明乳液稳定性欠佳;HPC 乳液外观未发生分层现象,说明油滴被HPC 紧密包裹,形成了完整的界面屏障,乳液表现出更稳定的状态。这与上述TSI 测试结果相符。
3 结论
本研究以玉米秸秆为原料,采用亚氯酸钠-醋酸-氢氧化钠法提取纤维素,并通过硫酸水解和硫酸水解-高压均质联用改性方法制备了三种不同的纤维素颗粒,与CS、CP 相比,HPC 的粒径更小。扫描电镜结果和傅里叶红外光谱结果表明三种纤维素颗粒微观形态差异较大,HPC 的尺度更小,表面疏松多孔,暴露了更多活性基团,从而提升了其乳化性。此外,HPC 的静水接触角达到了76.1°,大大改善了CS 亲水性,这为提高Pickering 乳液的稳定性提供了结构基础。对不同乳液的乳化特性及稳定性进行分析发现,与CS 相比,CP、HPC 均能有效提高Pickering 乳液稳定性,其中HPC 乳液粒径最小、分布均一、储能模量最高且乳液在21 d 的贮藏中TSI 值变化最小,具有更高的抗聚结能力,且随着贮藏时间的延长乳液体系未发生明显变化。因此,硫酸水解-高压均质法可以提高玉米秸秆纤维素的乳化性,为其在Pickering乳液体系中的应用提供一定的理论基础,拓宽了玉米秸秆高值化利用的应用范围。
