卡拉胶多糖的分子修饰:卡拉胶酶和硫酸化酶的研究进展
2022-11-30魏衍尚宁利敏朱本伟
魏衍尚, 宁利敏, 姚 忠, 朱本伟
(南京工业大学 食品与轻工学院,江苏 南京 210009)
卡拉胶是一种从海洋红藻细胞壁中提取出来的多糖物质,是一种由D-半乳糖通过交替的α-1,3和β-1,4糖苷键连接而成的线性硫酸多糖[1]。因其具有多样的生物活性而受到广大关注。卡拉胶多糖根据硫酸基团的数量和位置以及α-1,4连接的半乳糖残基中3,6-内醚-α-D-吡喃半乳糖(3,6-AG)的存在,可将其分为κ-、ι-和λ-型3种卡拉胶,其对应的重复二糖结构分别为:G4S-DA、G4S-DA2S和G2S-D2S,6S(见图1)[2]。卡拉胶因其出色的物理功能特性而得到广泛的利用,如增稠、胶凝和稳定能力[1]。然而,由于这种硫酸多糖的高相对分子质量和较差的组织穿透能力,大大限制了它们的进一步应用。
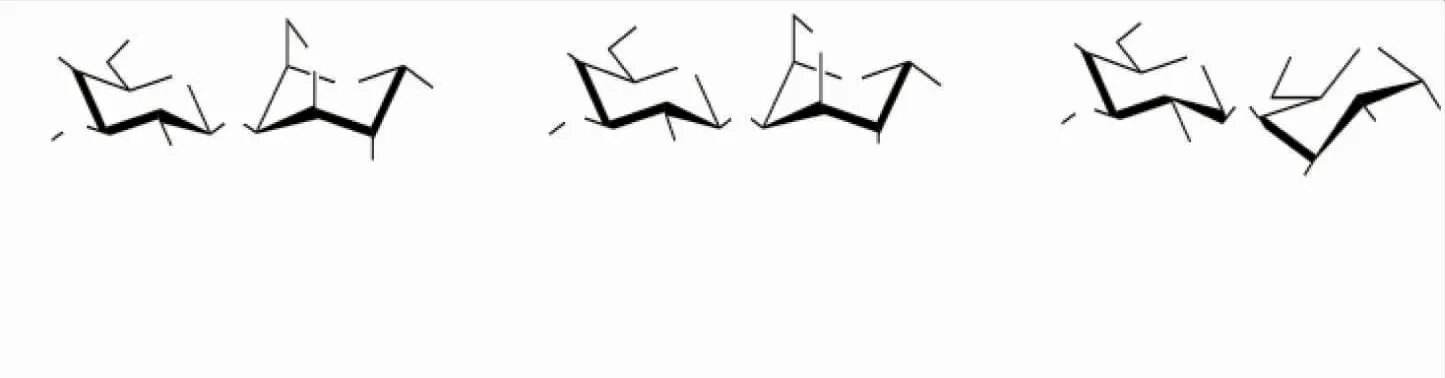
图1 不同类型卡拉胶的重复二糖结构Fig.1 Schematic diagram of repeated disaccharide structure of different types of carrageenan
研究表明,经过降解后产生的卡拉胶寡糖或者降解后的卡拉胶经过分子修饰的衍生物往往有着更强的生物活性[3]。卡拉胶的酶降解需要涉及卡拉胶酶和硫酸化酶两种酶的共同作用,前者降解糖苷键,后者脱去卡拉胶分子上的硫酸基团[4-6]。因此作者总结了卡拉胶的多种降解方法以及降解后的卡拉胶所进行的分子修饰,并对其降解后的生物活性做了简单的概述。同时重点概括了近20年来卡拉胶酶和硫酸化酶的研究进展,还在最后介绍了两种酶协同降解卡拉胶多糖的机制。
1 卡拉胶多糖的降解及分子修饰
天然提取的卡拉胶因相对分子质量太大、黏度高、溶解度低等特点,难以通过机体内的屏蔽作用,致使其应用受到很大程度的限制[7]。相比之下,卡拉胶寡糖及其分子修饰后的衍生物具有更为广泛的应用价值[8]。针对这一问题,目前对于卡拉胶多糖的研究主要集中在多糖降解或降解后的卡拉胶的分子修饰。
1.1 卡拉胶多糖的降解方法
1.1.1 化学降解在化学降解方面可通过用无机酸水解、硫醇水解、甲醇水解、还原水解、过氧化氢氧化水解等方法来将大分子卡拉胶降解为小分子多糖,甚至寡糖[3]。其中研究最多的为无机酸的水解,在酸性溶液中,卡拉胶多糖的糖苷键会发生断裂,从而使多糖降解为小分子片段[3]。通过控制酸的浓度、温度以及时间可获得相对分子质量大小不一的降解产物。
通过酸水解可以获得多种卡拉胶低聚糖及寡糖组分[9-10]。Yang等通过温和酸水解方法(用0.1 mol/L H2SO4在60℃降解1.5 h)得到聚合度3~17奇数κ-卡拉胶寡糖[11]。Hipolito等对κ-卡拉胶采用0.1 mol/L TFA在65℃降解30 min来进行部分水解,其水解产物为低相对分子质量多糖片段[12]。
对比其他降解方法,酸降解不易控制反应条件,降解产物复杂,并且会对多糖结构造成破坏,进而影响生物活性[13]。
1.1.2 物理降解物理降解主要有超声降解、辐射降解、微波降解。用γ射线在固体、凝胶或溶液中以不同剂量照射,可降解κ-、ι-和λ-卡拉胶,且得到的产物相对分子质量分布窄[14]。魏元臣等通过微波降解法得到的不同相对分子质量λ-卡拉胶,并且证明了降解产物能够使健康小鼠的免疫能力增强[15]。对于超声波降解多糖,其反应过程中易于控制反应条件,便于得到目标产物,且解聚物为具有较窄相对分子质量分布的产物。Tecson等采用低质量浓度的κ-卡拉胶底物(5.0 mg/mL)、高振幅的仪器处理(85%)和长处理时间(180 min)的超声波处理,获得了平均相对分子质量(AMW)为41 864的κ-卡拉胶,这比初始AMW为1 139 927的原始样品减少了1 098 063(96.3%)[16]。
1.1.3 酶降解由于化学降解和物理降解的降解条件不易控制,且极易引起多糖结构的破坏,因此生物降解法受到了研究者们极大的关注[17]。卡拉胶酶是一种糖苷水解酶,可以降解卡拉胶的β-1,4糖苷键,从而获得卡拉胶低聚糖。由于酶法降解具有底物专一性、高效性、对环境友好、无副反应、工艺易于控制等优点,是一种理想的降解方式,目前已逐渐代替传统的降解方法。
1.2 降解后的卡拉胶多糖的分子修饰
研究者提出了许多化学修饰方法来修饰卡拉胶的理化性质。大多数修饰的目的是通过用新的官能团取代生物聚合物D-半乳糖-4-硫酸盐部分中的原醇基团来诱导新的性质。改性反应包括硫酸化[18]和脱硫酸化[19]、乙酰化[20]、烷基化[12]、磷酸化[21]、自由基接枝共聚等[22]。
卡拉胶的硫酸化方法有很多,通过硫酸盐基团的引入,可以在一定程度上改变卡拉胶多糖的生物活性,其中最常用的3种包括氯磺酸-吡啶法[23]、硫酸化法[24]和三氧化硫-吡啶法[25]。对于脱硫酸化,则涉及卡拉胶硫酸化酶,详情见下文。乙酰化则通过酰基转移酶催化,这种化学修饰不仅可以影响不同化合物的功能,而且可以改变溶解度、稳定性或细胞靶的不同性质[26-27]。Yamada等发现,乙酰化的低相对分子质量硫酸卡拉胶具有潜在的抗HIV活性;同时,卡拉胶多糖在水中的溶解度直接受到乙酰化程度的影响;λ-和κ-卡拉胶的高取代率表明其不溶于水[28]。卡拉胶的烷基化也会对卡拉胶的生物活性产生影响。Uryu等对硫酸寡糖进行分子修饰,引入烷基,发现其修饰产物抗HIV的能力得到了提高,而不含烷基的硫酸寡糖抗HIV活性较低[29]。袁华茂通过对降解得到的卡拉胶寡糖混合物进行了磷酸化结构修饰,结果表明硫酸化后的卡拉胶在不同的抗氧化模型中具有较卡拉胶寡糖更高的抗氧化活性,说明卡拉胶寡糖的化学修饰可以增强其抗氧化能力[30]。
除了上述的功能化方法外,接枝和交联还可用于化学改性聚合物。将可聚合的合成部分接枝到天然卡拉胶多糖上,然后进行聚合,这是一种产生大分子的方法,合成的大分子具有每种聚合物的某些特性[31]。例如,在κ-卡拉胶上接枝丙烯酸,合成了κ-卡拉胶型高吸水凝胶[32]。
2 卡拉胶酶的研究
卡拉胶酶归属于糖苷水解酶家族,其作用模式均为内切型,可专一性的裂解卡拉胶分子内部的β-1,4糖苷键,产物为一系列聚合度为偶数的低聚卡拉胶[33]。由于卡拉胶酶在水解卡拉胶多糖的过程中,反应条件温和,底物具有专一性以及所产生的产物均一,因此该法正受到越来越多的关注[8]。近年来,针对海洋微生物所产生的卡拉胶酶对卡拉胶多糖的降解和利用的研究,主要集中在卡拉胶酶的性质、结构与功能之间的关系等。作者将从卡拉胶酶的来源、种类、酶学性质、结构和催化机制以及应用这几个方面来介绍卡拉胶酶的研究进展。
2.1 卡拉胶酶的来源与种类
卡拉胶酶的来源主要是海洋微生物和海洋动物。比如以海藻为食的软体动物,Mori等从海洋软体动物中纯化并鉴定了第一种卡拉胶酶[34]。Skea等在新西兰食草鱼内脏中曾提取到可降解卡拉胶的酶[35]。然而,对于大多数已报道的卡拉胶酶,均是从海洋微生物中分离出来的。产卡拉胶酶的海洋微生物种类主要包括Pseudomonas、Pseudoalteromonas、Vibrio、Shewanella、Cellulophaga、Cytophaga、Microbulbifer、Tamlana、Pedobacter、Alteromonas和Zobellia等。在已发现的卡拉胶酶中,根据其降解底物的专一性,主要分为κ-卡拉胶酶、ι-卡拉胶酶、λ-卡拉胶酶。
2.1.1 κ-卡拉胶酶κ-卡拉胶酶是所有卡拉胶酶中分布与应用最为广泛的一种酶,属于16糖苷水解酶家族。该类型的酶能够特异性水解β-4-硫酸-D-半乳糖和α-3,6内醚-D-半乳糖之间的β-1,4糖苷键,生成以硫酸化新κ-卡拉寡糖为主的产物[33]。具有一定活性的κ-卡拉胶酶可从海洋细菌或动物体内某些组织获得。根据目前已有报道,能够产生κ-卡拉胶酶的菌株包括Alteromonas macleodii KS62[36]、Bacillus sp.SYR4[37]、Cytophaga MCA-2[38]、Cellulophaga lytica[39]、Pedobacter hainanensis 13-Q[40]、Pseudoalteromonas sp.ZDY3[41]、Pseudomonas aeruginosa ZSL-2[42]、Pseudomonas elongata MTCC 5261[43]、Pseudomonas carrageenovora HLX250[44]、Pseudoalteromonas porphyrae LL-1[45]、Pseudoaltero-monas carrageenovora NCMB.302[46]、Shewanella sp.Kz7[47]、Vibrio sp.SY01[48]、Pseudoalteromonas tetraodonis JAMK142[49]、Tamlana sp.HC4[50]等。Kalitnik等 从 红 藻Tichocarpus crinitus中筛选出28株具有降解κ-卡拉胶能力的菌株,且他们均属于Phyla-bacteroidetes和Proteobacteria种类[51]。也有研究表明,海洋环境中存在大量的细菌细胞外膜囊泡携带具有活性的κ-卡拉胶酶[36]。海洋无脊椎动物Turbo cornutus的肠道中也被证明了可以分离出一种能降解琼脂、藻酸盐和κ-卡拉胶的Microbulbifer agarilyticus GP101[52]。
研究表明,κ-卡拉胶酶是对其κ-卡拉胶内部的β-1,4键上进行剪切[40]。在降解过程中,κ-卡拉胶酶对卡拉胶的降解是随机的,且当卡拉胶为凝胶状时卡拉胶酶对其的降解速率最快[46]。通过κ-卡拉胶酶降解卡拉胶得到的低聚糖具有更高的同质性和更低的多分散性[53]。对于高聚合度的κ-卡拉胶寡糖的制备,Cui等从Cellulophaga lytica strain N5-2中克隆并异源表达了一个新的κ-卡拉胶酶基因,其降解产物为新κ-卡拉辛糖和新κ-卡拉己糖[39]。
对于κ-卡拉胶的降解,酶法水解相较于化学水解有许多优点,但其明显的缺点是酶的活性低,需要较长的反应时间,其他缺点包括酶活性的自发丧失和酶具有更昂贵的价格,这意味着还需要进一步探索酶的再利用[54]。而对于自由酶来说,需面临较多工业挑战,包括在非自然环境中稳定性低、分离和回收困难[55]。为了克服这些问题,酶固定化技术已被广泛用于提高酶的稳定性和可重复使用性。通过分子动力学模拟以及圆二色光谱分析将κ-卡拉胶酶CgkPZ和Ca2+进行组装,合成一种新型的自组装κ-卡拉胶酶-无机杂化纳米花CaNF@CgkPZ,且催化效率增加了292%[56]。
在现有的实验中,通过重组菌株培育出的κ-卡拉胶酶对卡拉胶的降解可以获得很多具有活性的低聚卡拉胶。例如,Pseudoalteromonas porphyrae LL1的κ-卡拉胶酶的催化结构基因在Brevibacillus choshinensis中有效表达,且100.0 mmol/L的Mg2+能使PpCgkCD的活性显著提高97.5%[57]。张成昊等将Pseudoalteromonas JMUZ2的κ-卡拉胶酶基因在大肠杆菌中异源表达,结果表明,该酶属于GH16家族,最适反应温度和pH分别为50℃和8.0,重组酶对去垢剂Tween 20、Tween 80和Triton X-100有良好的耐受性,酶解产物对羟自由基、DPPH自由基、ABTS自由基具有一定清除作用,还具有良好的还原能力[58]。对从南极大型海藻表面分离的Polaribacter sp.NJDZ03的全基因组进行了分析,获得了一个推测的卡拉胶酶基因Car3206,且该基因被克隆并在大肠杆菌中获得高效表达[59]。
由于卡拉胶具有较高的结构异质性,存在着典型的杂交卡拉胶。其中一种其结构由交替β-卡拉胶和κ-卡拉胶基序组成。Cao等克隆、表达和表征了来自海洋细菌Wenyingzhuangia funcanilytica CZ1127的新型GH16_13 furcellaran(一种部分硫酸化的β/κ-卡拉胶)水解酶Cgbk16A_Wf,该酶被命名为βκ-卡拉胶酶,可以特异性地将β-卡拉胶和κ-卡拉胶之间的β-1,4糖苷键从非还原端切割到还原端,其相对分子质量为43 000,且作用模式不依赖于NaCl,被Cu2+、Mg2+、Hg2+、Mn2+、β-巯基乙醇抑制,在50℃和pH 6.0下表现出最大活性,并表现出高热稳定性[60]。
2.1.2 ι-卡拉胶酶有关ι-卡拉胶酶的报道较少,该酶属于82糖苷水解酶家族。该类型的酶能够特异性水解β-4-硫酸-D-半乳糖和α-2-硫酸-3,6-内醚-D-半乳糖之间的β-1,4糖苷键,生成以硫酸化新ι-卡拉寡糖为主的产物[33]。根据目前已有报道,能够产生ι-卡拉胶酶的菌株包括Alteromonas fortis[61]、Brevibacillus choshinensis[62]、Cellulophaga sp.QY3[63]、Flavobacterium sp.YS-80-122[64]、Microbulbifer thermotolerans JAMB-A94T[65]等。
Barbeyron等对来自Zobellia galactanovorans和Alteromonas fortis的两种ι-卡拉胶酶进行分析比对,结果表明,Z.galactanovorans和A.fortis ι-卡拉胶酶基因编码的同源蛋白质相对分子质量分别为53 400和54 800,相似性达到59%,同源性达到43%,且这两种酶都能专一性降解ι-卡拉胶,作用方式均为内切[66]。
ι-卡拉胶酶从Alteromonas fortis中首次被提取并表征其酶学性质[61]。Hatada等从Microbulbifer thermotolerans JAMB-A94T的基因组中获得一个ι-卡拉胶酶基因,酶解终产物ι-卡拉四糖占总产物的75%以上,这种酶可能有助于工业生产单一的ι-卡拉胶低聚糖,此外还证明了保守的Glu351对催化作用至关重要[65]。Ma等从Cellulophaga sp.和Cellulophaga sp.QY3中分离并鉴定了两种新的ι-卡拉胶酶,不仅丰富了GH82家族ι-卡拉胶酶资源,而且对GH82家族酶的结构与功能阐释有重要意义[63,67]。
有研究报道,ι-卡拉胶酶Cgi82A在大肠杆菌中表达,并对其生化特性、动力学常数和水解模式进行了表征,该酶在25℃时达到最高活性,低于迄今报道的所有GH82 ι-卡拉胶酶,它是一种内源性水解酶,可作为一种潜在的生物催化剂,制备不同聚合度的卡拉胶寡糖[68]。最近,来自Cellulophaga baltica的ι-卡拉胶酶的酶学性质也被进行报道,并且通过单因素实验优化了最大ι-卡拉胶酶产量[69]。
2.1.3 λ-卡拉胶酶对于λ-卡拉胶酶的报道很少,由于缺少其序列信息,因此该酶构成了与包含κ-卡拉胶酶的GH16家族和包含ι-卡拉胶酶的GH82家族没有关系的一个新的GHs家族[70]。该类型的酶能够特异性水解β-2-硫酸-D-半乳糖和α-2,6-硫酸-D-半乳糖之间的β-1,4糖苷键,生成以硫酸化新λ-卡拉寡糖为主的产物[33]。根据目前已有报道,能够产生λ-卡拉胶酶的菌株包括Bacillus sp.Lc50-1[71]、Pseudoalteromonas sp.CL19[72]、Pseudoalteromonas carrageenovora[73]等。
1955年,Gauthier等发现了一种来自海藻细菌Pseudoalteromonas carrageenovora的λ-卡拉胶酶,并对其基因进行了克隆[73]。2006年,Ohta等从深海沉积物样品中分离到一株含有λ-卡拉胶酶的Pseudoalteromonas sp.CL19菌株并对其进行了纯化及表征,这是首次分离λ-卡拉胶酶及其基因序列的报道[72]。2014年,首次证实温泉细菌中存在耐热性λ-卡拉胶酶,并且纯化并表征其生理活性[71]。2015年,有相关报道指出通过λ-卡拉胶酶降解所获得的λ-卡拉胶寡糖具有抗肿瘤和血管生成的活性,并且这种活性与该卡拉胶的聚合程度有关[74]。
2.2 不同种类卡拉胶酶的酶学性质
2.2.1 κ-卡拉胶酶的酶学性质已报道的κ-卡拉胶酶的相对分子质量分别在20 000~128 000。最小和最大的相对分子质量分别是来自Zobellia sp.ZM-2和Pseudomonas elongata MTCC 5261的κ-卡拉胶酶,其对应相对分子质量为20 000和128 000[43,75]。根据已有报道,大部分κ-卡拉胶酶的最佳温度在30~55℃。但也有一些酶的最适温度超出此范围,例如,来自Cytophaga sp.Ik-C783、Pseudoalteromonas sp.WZUC10和Wenyingzhuangia aestuarii OF219的κ-卡拉胶酶,其最佳温度为25℃[76-78]。 而来自Bacillus sp.HT19的κ-卡拉胶酶的最佳温度为60℃,是迄今为止最具耐热性能的κ-卡拉胶酶,具有一定程度的应用潜力[79]。大多数报道的κ-卡拉胶酶的最佳pH范围是7.2~8.0,这与海水的pH接近。然而,一些卡拉胶酶在酸性(pH 6)或中性(pH 7)条件下显示其最佳活性。例如,来自Zobellia sp.ZM-2和Cellulophaga lytica strain N5-2的κ-卡拉胶酶的最适pH分别为6和7[75,80]。此外,一个特殊的例子是,从Pseudomonas elongata MTCC 5261中分离出的κ-卡拉胶酶其活性在酸性(pH 5.6)和碱性(pH 7.7)中都是最佳的[43]。其他κ-卡拉胶酶的酶学性质见表1[36-50,53-54,59,75-88]。
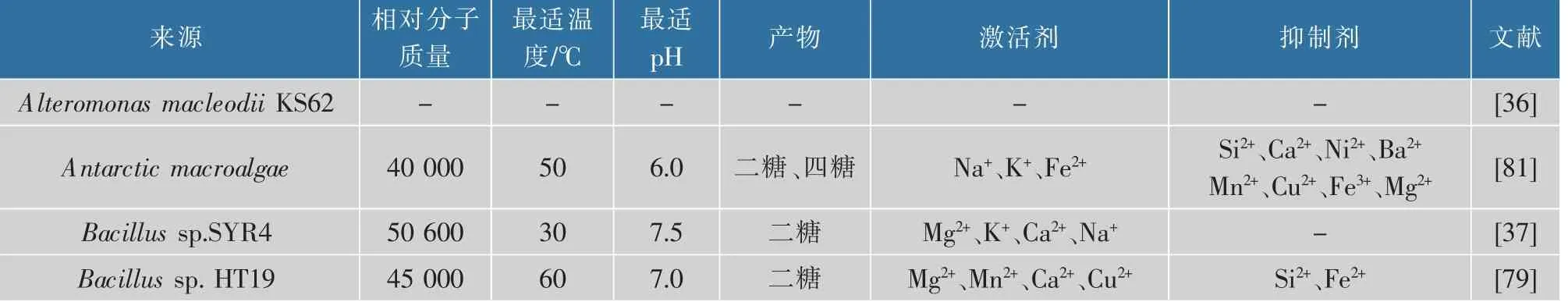
表1 κ-卡拉胶酶的酶学性质Table 1 Enzymatic properties of κ-carrageenase
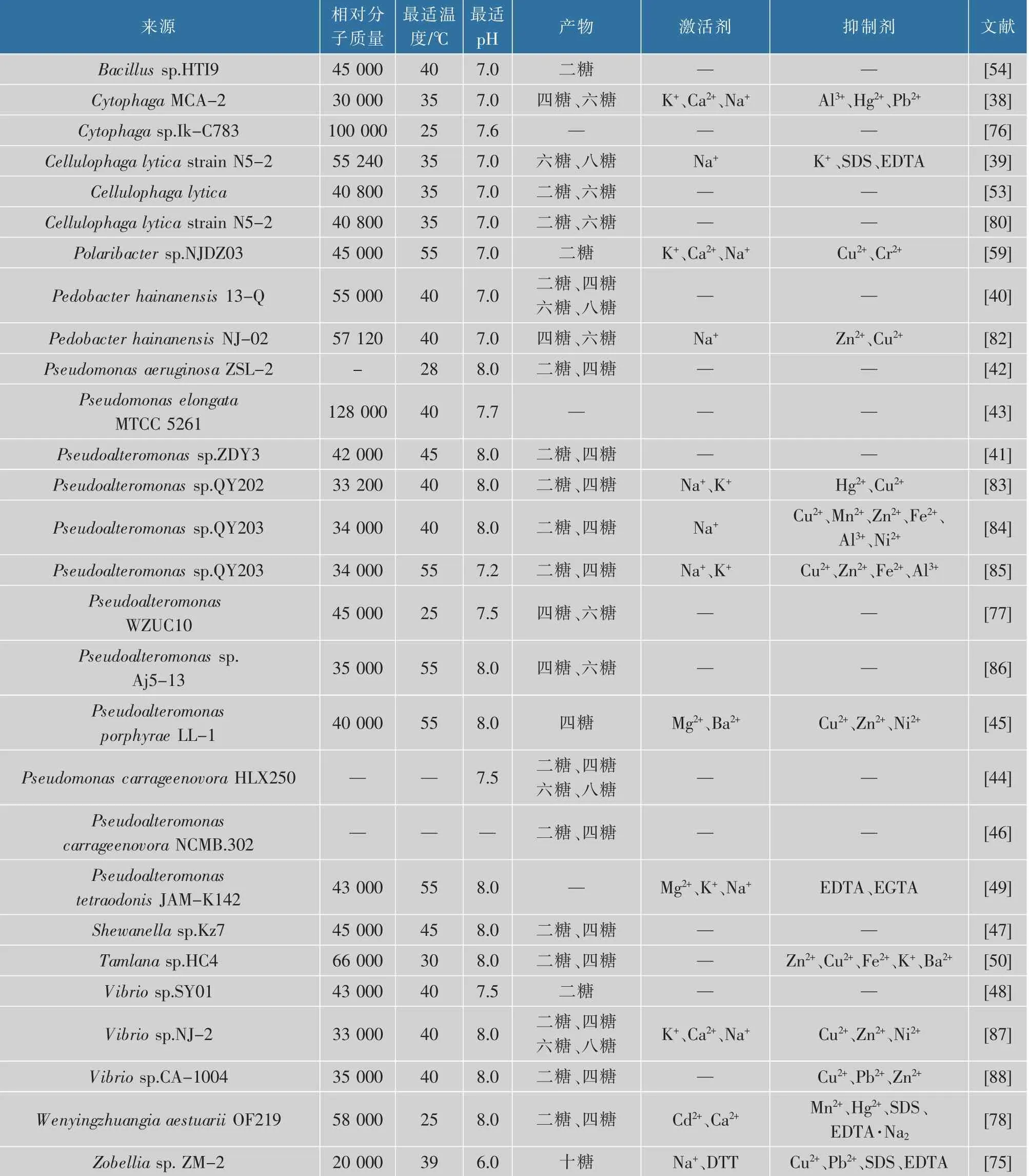
续表1
2.2.2 ι-卡拉胶酶的酶学性质有关ι-卡拉胶酶的酶学性质报道较少(见表2),其相对分子质量在31 000~58 000。最小的和最大的相对分子质量分别是来自Cellulophaga baltica和Brevibacillus choshinensis的ι-卡拉胶酶,其对应相对分子质量 为31 000和58 000[62,69]。来 自Cellulophaga sp.QY3、Microbulbifer thermotolerans JAMB-A94T的ι-卡拉胶酶最适温度为50℃,是迄今为止所报道的ι-卡 拉 胶 酶 的 最 佳 温 度[63,65]。 而 来 自Wenyingzhuangia fucanilytica的ι-卡拉胶酶在25℃时可达到最高活性,低于目前报道的所有GH82 ι-卡拉胶酶[68]。对于来自Flavobacterium sp.YS-80-122的ι-卡拉胶酶在温度为10℃和15℃下分别显示出最大活性的36.5%和57%,而且在热休克后恢复了58.2%的初始活性,这表明该酶是具有抗寒性、耐热性,同时该酶还表现出NaCl独立性和高的新ι-卡拉四糖产率,这将是海藻多糖生产ι-卡拉胶寡糖工业应用的优质候选者[64]。目前已报道的ι-卡拉胶酶的最适pH在6.5~8.0。值得注意的是,来自Brevibacillus choshinensis与Cellulophaga sp.的ι-卡拉胶酶分别在pH 6.0~11.0与pH 6.0~9.6相对较宽范围内表现出一定的稳定性[62,67]。
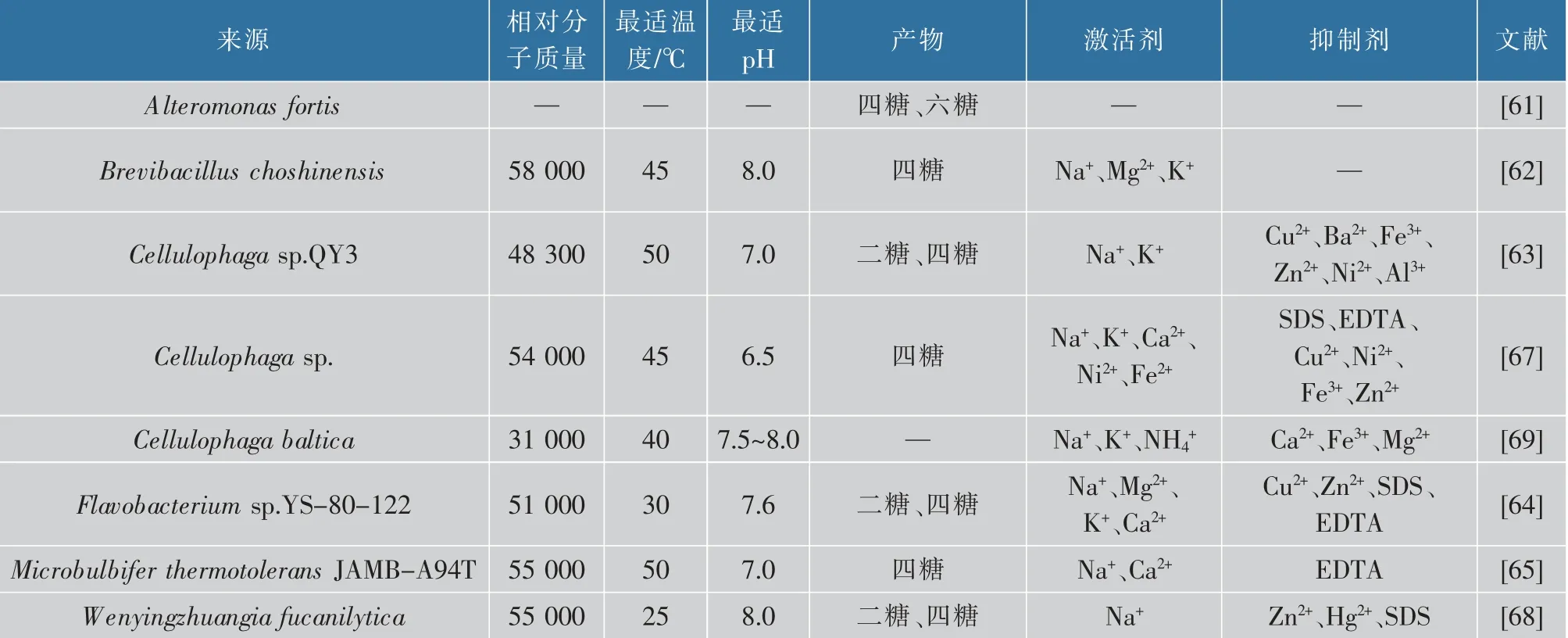
表2 ι-卡拉胶酶的酶学性质Table 2 Enzymatic properties of ι-carrageenase
2.2.3 λ-卡拉胶酶的酶学性质目前仅有3种λ-卡拉胶酶的酶学性质被报道(见表3)。1995年,Gauthier等报道了来自Pseudoalteromonas carrageenovora的λ-卡拉胶酶,其相对分子质量为105 000,是迄今为止相对分子质量最大的λ-卡拉胶酶[73]。2006年,Ohta等报 道了来 自Pseudoalteromonas sp.CL19的λ-卡拉胶酶,该酶的相对分子质量约为100 000,最佳pH和活性温度分别约为7和35℃,最终产物主要为λ-卡拉胶理想结构的四糖[72]。2014年,Li等报道了来自Bacillus sp.Lc50-1的λ-卡拉胶酶,该酶可以在75℃下降解λ-卡拉胶,属于一种耐热的λ-卡拉胶酶,并且该酶在pH 6~9下稳定,且在85℃下保持约50%的活性,并持续10 min[71]。

表3 λ-卡拉胶酶的酶学性质Table 3 Enzymatic properties of λ-carrageenase
2.3 不同种类的卡拉胶酶序列分析
序列比较是生物信息学中最基本、最重要的操作。比较序列之间的相似性和差异性对于分析序列的结构特征、亲缘关系、进化地位及生物功能等方面具有重要的意义和价值[89]。
针对κ-卡拉胶酶,Barbeyron等分别从Alteromonas carrageenovora与Cytophaga drobachiensis中克隆出两种新的κ-卡拉胶酶基因,并表明κ-卡拉胶酶中的Glu163残基对酶的催化作用很重要,且得出GH16糖苷水解酶家族之间的一般同源性是通过基因复制产生的结论[90-91]。近年来,相继从Pseudoalteromonas tetraodonis、Zobellia sp.ZM-2、Pseudoalteromonas sp.QY203中克隆并表征出几种新的κ-卡拉胶酶基因[49,75,84]。值得注意的是,来自Pseudoalteromonas tetraodonis与Pseudoal-teromonas carrageenovora的κ-卡拉胶酶具有高度相似性,同源性为94%[49]。对于以上几种κ-卡拉胶酶,做出序列比对,结果如图2所示 (其中GenBank为ADD92366.1、AHN05534.1的两种κ-卡拉胶酶的蛋白质序列已上传,但并未有相关文献进行描述)。结果 发 现,来 自Pseudoalteromonas sp.QY203与Pseudoalteromonas carrageenovora的同源性最高,达到了97%。对于参与底物结合和活性催化所必需的几个残基在这些序列中高度保守,如Glu171、Asp173、Glu176、Asp194、Leu197、Ser271和Leu274,其中3个残基(Glu171、Asp173和Glu176)参与底物的结合[92]。

图2 不同来源的κ-卡拉胶酶的多序列比对Fig.2 Multi-sequence alignment of κ-carrageenases from different sources
对于ι-卡拉胶酶,目前有7种基因已被克隆分析。早期,Barbeyron等从Zobellia galactanovorans中克隆出一种新的ι-卡拉胶酶基因,并表明该卡拉胶酶是一个与κ-卡拉胶酶家族不相关的新家族[66]。之后,随着对ι-卡拉胶酶的深入探索,又从Microbulbifer thermotolerans JAMB-A94T与Wenyingzhuangia fucanilytica、Brevibacillus choshinensis中鉴定出3种新的ι-卡拉胶酶基因[62,65,68]。值得注意的是,Ma等从Cellulophaga sp.和Cellulophaga sp.QY3克隆出两种新的ι-卡拉胶酶基因,并表明存在3个严格保守的残基(G228、Y229、R254)对底物结合起重要作用[63,67]。近年来,Li等从Flavobacterium sp.YS-80-122中克隆并表征了一种具有耐寒性、耐热性的新的ι-卡拉胶酶基因[64]。从ι-卡拉胶酶序列比对图得出,来自Cellulophaga sp.QY3与来自Zobellia galactanivorans的同源性最高,达到了79%(见图3)。

图3 不同来源的ι-卡拉胶酶的多序列比对Fig.3 Multi-sequence alignment of ι-carrageenases
关于λ-卡拉胶酶,目前已发现两种该酶的基因,且同源性达到98%,故不在此做序列分析。
2.4 卡拉胶酶结构和作用机制
2.4.1 卡拉胶酶的结构目前,针对卡拉胶酶的研究较少,仅有4个卡拉胶酶的晶体结构被完整表征出来。第一个得到结构解析的卡拉胶酶是来自于Pseudomonas carrageenovora的κ-卡拉胶酶(PcCgkA)[92]。 此 外, 还 有 来 自Zobellia galactanivorans DsiJT的ZgCgkA[93-95]、Alteromonas fortis的ι-卡拉胶酶(CgiA)[96]和来源于Bacteroides ovatus的外切卡拉胶酶[95-97]。
PcCgkA和ZgCgkA都属于κ-卡拉胶酶,它们两者的结构非常相似,都属于β-夹心结构,其中包括两个反向平行的β-折叠片和6个延伸带构成的活性裂缝[95]。在二级结构层面,该β型果冻卷折叠是由3个小的反平行的β-折叠片和一条α螺旋组成。β-折叠片两两反向堆积形成催化腔,如隧道状镶嵌在三明治状的结构中,隧道状催化中心的裂缝位置便是酶与底物的结合处,这种隧道活动场所暗示着一种过程性的作用模式(见图4(a)和(b))。

图4 不同家族的卡拉胶酶结构Fig.4 Structure of different families of carrageenan
PcCgkA和ZgCgkA之间也存在微小的差异。第一个明显区别是κ-卡拉胶酶的模块结构。即使两者都是分泌酶,但只有ZgCgkA拥有一个CBM(碳水化合物结合模块)。附加在催化GH模块上的CBM的存在,一般与相邻的酶在固体形式下处理顽固的、复杂的底物有关,如在植物细胞壁中所遇到的情况[98-100]。这也从一定方面说明从菌体中分泌的ZgCgkA可能会降解海藻细胞壁内的半结晶κ-卡拉胶。此外,与PcCgkA相反,DP6不被ZgCgkA水解,也就是说DP8是能被ZgCgkA降解的最小寡糖[101]。对于PcCgkA,DP6完全由随机加工产生,而DP4由随机和过程性作用模式产生[46]。对于同类型酶的结构多样性可能是由各种进化事件造成的,如水平基因转移或序列复制后的分化进化等。
CgiA晶体结构的分析是82家族糖苷水解酶的首次报道。CgiA的结构为右手平行的β-螺旋状结构,由10个完整的具有右旋性的平行β-螺旋结构和表面Loop组成 (见图4(c))。与PcCgkA和ZgCgkA相比,CgiA具有两个额外的C端结构域(A结构域和B结构域)。结构域A类似于DNA/RNA的结合蛋白质,结构域B则是由两个二硫键组成的环构成。Glu245、Asp247或Glu310在酶的裂缝中被认为是候选的催化残基。同时,该酶还含有一个钠和一个氯化物结合位点以及3个钙结合位点,这表明这些离子会参与稳定酶结构。
来自Bacteroides ovatus的卡拉胶酶(BovGH167)结构显示了4个结构域,其中3个在GH42家族中经常见到(见图4(d))。保守域是结构域A,催化(α/β)8-桶状结构域;结构域B是一个由α-螺旋包围的5股平行β片;结构域C是一个反平行的β-三明治状,独特的结构域是在N端有一个全α螺旋的区域。
2.4.2 卡拉胶酶的催化机制根据糖水解酶在水解过程中其异头碳的构象是否变化,可分为两类:保持型和倒置型。
1995年,Potin等从Alteromonas carrageenovora细菌中纯化出一种κ-卡拉胶酶,并且对其进化和水解机制进行了表述[102]。该酶的N末端的信号肽和C末端均被加工。通过免疫印迹法表明,成熟的κ-卡拉胶酶须由一个前体蛋白质在分泌过程中经过两次水解才能获得。在该酶水解κ-卡拉胶后,利用凝胶过滤色谱和13C-NMR分析水解产物新κ-卡拉六糖,发现该寡糖异头碳的构象并没有发生改变,这表明在酶解过程中异头碳的构象未发生变化是属于保持异构构型的分子机制(见图5)。这一结果同GH16糖苷水解酶家族的其他糖苷水解酶在酶解过程中的催化机制相一致。
κ-卡拉胶酶的反应机制如下,酶结构催化腔主要参与催化作用的氨基酸分别是Glu163、Glu168、Asp165,其中谷氨酸残基E163作为亲核催化,谷氨酸残基E168作为酸碱催化,而天冬氨酸D165可以促进中间转换状态的解体。在催化开始时,底物-1处的精氨酸残基R260将会结合κ-卡拉胶的硫酸脂基,其目的是用于识别底物,保证酶的专一性。该酶的反应机理为双置换反应,具体反应过程如图5所示。
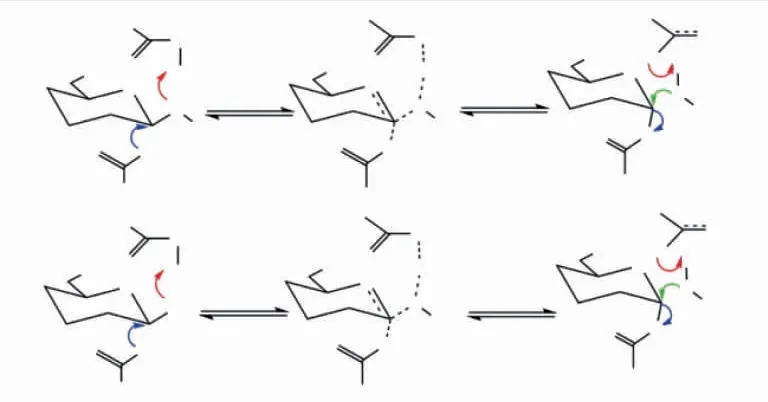
图5 κ-卡拉胶酶通过双置换反应降解卡拉胶的保留机制Fig.5 Retention mechanism of κ-carrageenase degradation of carrageenan by double substitution reaction
1)Glu的羧基发生亲核取代反应,与底物的异头碳C1生成共价键,在此过程中,Glu163和Asp165因为位阻较大暂时无法形成氢键。
2)Asp165作为质子供体与异头碳C1竞争性结合,由于位阻减小,因此Asp165和Glu163之间形成氢键,此时Glu163发生酸碱催化,导致水分子的电离。
3)Glu163和Asp165之间的低位阻氢键得以恢复,Glu163的亲核取代基保持负电的状态,并且开始准备参与新一轮的催化反应。
ι-卡拉胶酶的反应机制是通过一步亲核取代作用于β-1,4糖苷键,同时还发生转糖基和转变异构构型,因此该酶的催化机制为倒置型。这种相互作用机制主要体现在糖链上β-螺旋在凹槽上进行移动,形成一种酶-底物结合的开放式复合物;随着酶解过程的进行,该结构折叠闭合,其目的是保证糖链降解之后不会脱离酶的作用位点,使得催化反应能够继续进行。
Barbeyron等研究了ι-卡拉胶酶的降解机制,发现该酶是通过一步亲核取代作用于β-1,4糖苷键,同时还发生了转糖基和转变异构构型,其水解产物主要是硫酸化新ι-卡拉二糖[66]。Potin等对水解产物进行了分析,发现该酶降解ι-卡拉胶的方式是通过异头碳构象倒置,作用于其内部的β-1,4糖苷键,有别于κ-卡拉胶酶的保持型[102]。这种相互作用机制主要体现在糖链上β-螺旋在凹槽上进行移动,形成一种酶-底物结合的开放式复合物;随着酶解过程的进行,该结构折叠闭合,其目的是保证糖链降解之后不会脱离酶的作用位点,使得催化反应能够继续进行(见图6)。
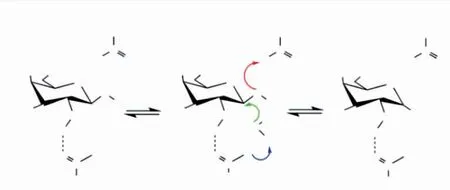
图6 ι-卡拉胶酶通过单置换反应降解卡拉胶的倒置机制Fig.6 Inversion mechanism of ι-carrageenase degradation of carrageenan via a monosubstitution reaction
2.5 卡拉胶酶的应用
目前,卡拉胶已被广泛应用于食品、医药等多方面的工业生产中。研究表明,降解后的卡拉胶具有抗凝血、抗肿瘤、增强人体体液免疫和细胞免疫,以及抗病毒等多方面生物活性[7]。通过酶解法降解卡拉胶,反应过程和条件易于控制且不破坏糖链结构,因此酶解法受到了越来越多的关注。卡拉胶酶是酶解过程中所需要的酶,因其具有底物的专一性,研究卡拉胶酶具有深远的应用价值和理论意义。
2.5.1 制备卡拉胶寡糖据报道的卡拉胶寡糖及其修饰后的衍生物具有很多功能的生物活性。郭丹等通过酶解法制备了低相对分子质量的卡拉胶,随后进行磺化修饰,获得了具有不同硫酸基含量的卡拉胶寡糖衍生物,发现新κ-卡拉胶寡糖具有显著的抗肿瘤活性,并证明了其空间结构、相对分子质量以及硫酸基团的含量和存在位置都会影响卡拉胶衍生物的生物活性[3]。又比如2019年,陈梦等通过酶解法和醇沉法,并与KCl溶液混合,以此获得高结合率的低相对分子质量的κ-卡拉胶钾(LCP),结果表明,LCP对自发性高血压大鼠有稳定且持续的降压作用,此外,还显著降低血液中脂多糖的水平(P<0.05),并显著改善了肠道上皮结构的完整性,该研究填补了LCP在心脑血管疾病领域的空白[103]。另外,卡拉胶寡糖还表现出抗氧化、抗血栓、增强免疫的作用[104-106]。
2.5.2 用于海藻遗传工程由于卡拉胶主要存在于红藻细胞壁中,其黏度很大,DNA提取困难。因此,可以通过卡拉胶酶和其他酶共同作用来降解海藻细胞壁,用于提取DNA、蛋白质和原生质体等物质。
1995年,Fleurence等通过使用不同的酶来降解细胞壁从而提取蛋白质,不同的酶与不同的海藻的反应均在最适反应条件下进行,结果表明,用纤维素酶与卡拉胶酶或琼脂酶结合使用,在2 h内可获得最高产量的蛋白质。该实验证明了多糖类的酶可以有效帮助降解细胞壁从而获得目的产物[107]。Zablackis等通过纤维素酶与卡拉胶酶的协同作用,从Kappaphycus alvarezii中分离出来原生质体[108]。
2.5.3 研究卡拉胶的结构卡拉胶是具有重复二糖单元的线性硫酸化多糖,因此可以通过卡拉胶酶水解其中糖苷键获得低聚卡拉胶,通过产物的结构分析来推测卡拉胶多糖的内部结构。Guibet等通过λ-卡拉胶酶来降解卡拉胶,并通过核磁共振技术研究寡糖产物,结果表明,λ-卡拉二糖单元中并不都含有3个硫酸基团,而是在部分单元中存在4个硫酸基团,该实验结果改变了人们先前所知的λ-卡拉胶结构特征[109]。Antonopoulos等通过重组ι-卡拉胶酶降解ι-卡拉胶,然后用高效液相色谱法进行分离,结合蒸发光散射测定ι-卡拉胶寡糖的结构[110]。
2.5.4 其他应用针对卡拉胶独特的生物活性,可以通过发酵改造的工程菌株获取重组卡拉胶降解酶,该重组酶的特点是为外切酶,专一识别单位仅为六糖,并且表现出抗阿尔兹海默症的活性[111]。此外,卡拉胶酶对于海藻废物处理的应用也引起越来越多的关注[37]。最后,有研究指出,以κ-卡拉胶为原料,经脱硫、专一降解酶系的定向水解及菌种发酵,从而实现其乙醇转化,获得可工业生产的生物乙醇,这一途径在未来将会极大程度上缓解不可再生资源的供给压力[112]。
3 硫酸化酶的研究
卡拉胶的生物降解涉及卡拉胶酶和硫酸化酶,前者裂解糖苷键,后者催化去除硫酸盐。尽管大量的卡拉胶酶已被描述,但只确定了少数硫酸化酶的生物化学特征。它们都是在海洋细菌中观察到的,但从红藻基因组的分析中还没有预测到硫酸化酶[113]。
根据序列同源性、晶体结构和机制,硫酸化酶被分为4类。I型硫酸化酶或依赖甲酰甘氨酸的硫酸化酶,包括绝大多数已知的硫酸化酶,以及迄今为止所有生化特性的碳水化合物硫酸化酶[114]。这个家族的成员是依赖α-甲酰甘氨酸(fgly-dependent)的酶,含有10个高度保守的极性残基,参与硫酸盐识别和硫酸酯水解[19]。该家族最明显的特征是其中一个极性残基半胱氨酸(Cys)或丝氨酸(Ser)经过翻译后将转化为具有催化活性位点的醛残基(α-Fgly残基)[114]。
II型硫酸化酶包括依赖于α-酮戊二酸的Fe(II)烷基硫酸化酶,属于双加氧酶超家族[115]。该酶的催化作用需要分子氧(O2)和α-酮戊二酸作为共同底物,导致醛中的初级硫酸酯基团被氧化,同时导致α-酮戊二酸氧化脱羧成琥珀酸。III型硫酸化酶的代表是与Zn2+或Mn2+依赖性金属-β-内酰胺酶有关的酶[116]。
IV型硫酸化酶指一个由非特征蛋白质组成的分支家族。其中具有代表性的酶是来自Pseudoalteromonas carrageenovora的ι-卡拉胶硫酸化 酶 (PSC ι-CgsA)。 研 究 表 明, 位 于P.carrageenovora的κ-卡拉胶酶产生的低聚κ-卡拉胶非还原端上的硫酸酯基团被特异性地消除,这表明硫酸化酶在κ-卡拉胶的酶解后进行干预[117-118]。Weigl等首次证明了从海洋细菌P.carrageenovora中获得了具有活性的卡拉胶硫酸化酶[119]。2014年,Genicot等纯化并表征了该酶。PSC ι-CgsA的相对分子质量为115 9 00,在pH 8.3和温度为(40±5)℃时表现出最佳的活性和稳定性。序列分析表明,PSC ι-CgsA与P.haloplanktis TAC 125的一个假定的非特征蛋白质Q3IKL4具有90%以上的序列同源性,但除此之外,与已鉴定的硫酸化酶没有任何同源性,因此PSC ι-CgsA做为代表了一个新的硫酸化酶家族的第一个特征化成员[120]。
近来,学者对能够降解卡拉胶的菌株Pseudoalteromonas atlantica T6c进行了类似的研究,其基因组已经被测序[121]。一种对ι-卡拉胶有活性的内切ι-卡拉胶硫酸化酶被分离出来,并进行了生物化学鉴定。该酶特异性地去除β-连接的半乳糖第4位的硫酸盐,导致ι-卡拉二糖重复单元转化为α-卡拉二糖重复单元(见图7中B)[4,122]。编码硫酸化酶的基因已被克隆并在大肠杆菌中重组表达。这些实验证明,内切-4S-ι-卡拉胶硫酸化酶是一种I型硫酸化酶,一种依赖甲酰甘氨酸的硫酸化酶。
另一种卡拉胶硫酸化酶是从P.atlantica T6c中分离出来的,但它催化κ-卡拉二糖单元的脱硫作用,产生中性的β-卡拉二糖重复单元(见图7)。这种内切-κ-卡拉胶硫酸化酶在大肠杆菌中的过度表达也验证了其在I型硫酸化酶家族中的分组[123]。结果表明,此类型的酶与第一种卡拉胶硫酸化酶的调查相反,此类型的酶是对聚合物发挥作用,而不是寡糖。这表明卡拉胶的降解可能遵循不同的途径,即一种途径是在寡糖卡拉胶脱硫之前卡拉胶的解聚,另一种途径是假设多糖的脱硫是在尚未发现的α-和β-卡拉胶酶降解α-或β-卡拉胶之前。
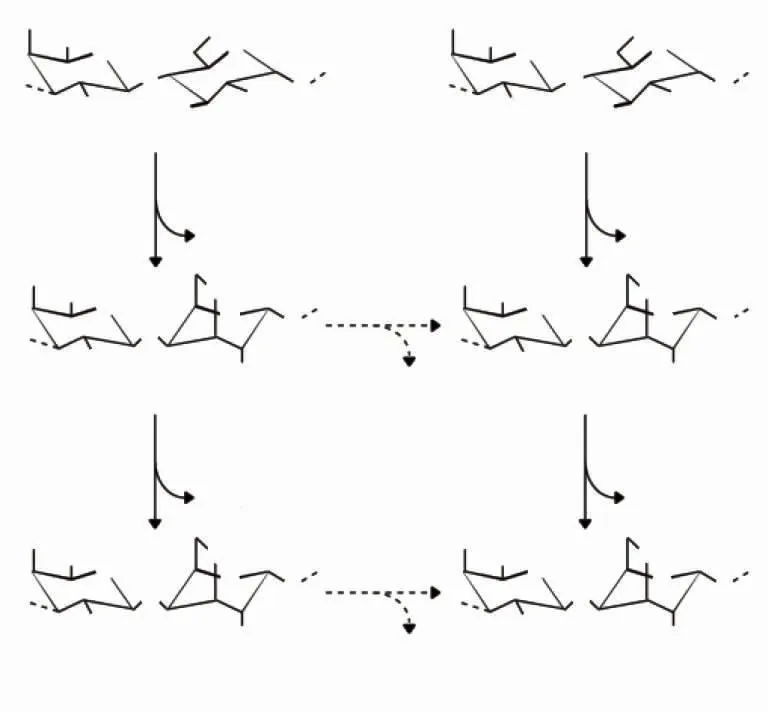
图7 在卡拉胶的生物合成和生物降解过程中观察到的卡拉胶硫酸化酶Fig.7 Carrageenan sulphatase observed in the biosynthesis and biodegradation of carrageenan
4 卡拉胶酶与硫酸化酶协同作用降解卡拉胶
由于卡拉胶是高度硫酸化的多糖,去除硫酸基团是实现卡拉胶完全分解所必需的。有研究证实,来自海洋异养细菌Zobellia galactinovorans中卡拉胶的完整分解代谢途径已被表述(如图8)。结果表明,Z.galactinovorans中的GHs和硫酸化酶对卡拉胶的降解具有协同作用。在这里,ι-和κ-卡拉胶需要由两个专门的硫酸化酶对D-半乳糖的C4硫酸基进行脱硫,从而产生α-或β-卡拉胶。对于α-卡拉胶将通过第3种硫酸化酶将其转化为β-卡拉胶,此过程是从脱水半乳糖中去除C2硫酸盐基团[124]。如果没有这些脱硫处理,低聚卡拉胶的进一步的降解步骤将会停止。具体步骤如下:

图8 来自海洋异养细菌Zobellia galactinovorans中卡拉胶的完整分解代谢途径Fig.8 Complete metabolic pathway of carrag eenan from the marine heterotrophic bacterium Zobellia galactinovorans
1)卡拉胶多糖的降解 ι-卡拉胶的降解是由GH82家族的ι-卡拉胶酶将多糖链裂解成更小的寡糖。而在κ-卡拉胶中,则是由GH16家族的一个κ-卡拉胶酶完成的。
2)低聚体卡拉胶上的G4脱硫 低聚体ι-卡拉胶需要由S1_19家族的ι-卡拉胶G4S-硫酸化酶对D-半乳糖残基进行脱硫,从而产生低聚体α-卡拉胶。同样的步骤发生在κ-卡拉胶中,在这里,一个κ-卡拉胶G4S-硫酸化酶水解了在D-半乳糖残基上的硫酸酯,结果产生了非硫酸化的β-卡拉胶。
3)α-卡拉胶的脱硫 为了将α-卡拉胶转化为非硫酸化的β-卡拉胶,需要用S1_17家族的α-卡拉胶DA2S-硫酸化酶对剩余的3,6-脱水-D-半乳糖残基进行脱硫。
4)β-卡拉胶的降解 未硫酸化的β-卡拉胶可以被GH127或GH129家族的3,6-脱水-D-半乳糖苷酶或GH2家族的β-半乳糖苷酶从非还原端继续连续降解。
5 展望
卡拉胶作为一种从海洋红藻的细胞壁提取出的多糖物质,具有广阔的应用价值和发展潜力。其已被证明具有多种生物活性,包括抗肿瘤、抗病毒、抗凝血等。降解后的卡拉胶及其分子修饰后的衍生物在某些方面已经展现出更强的生物活性。但由于目前所了解的卡拉胶分子修饰主要集中在构效方面,对于分子修饰的方法研究较少,因而在对卡拉胶进行设计改性从而获得高活性、高稳定性以及具有特定功能的卡拉胶衍生物仍然是今后的研究方向[8]。
卡拉胶多糖的酶降解需要卡拉胶酶和硫酸化酶的共同作用。卡拉胶酶的来源主要依靠于海洋细菌。但由于海洋环境的复杂性和特殊性,目前对海洋细菌的了解还远远不够。迄今为止,已有许多关于卡拉胶酶得到了分离纯化的报道,并且对其中的基因进行了克隆表达,但仍未能满足工业化生产与
应用的要求。其中一部分原因是缺乏相应的基因信息或者表达出来的酶具有过低的活性以及较差的稳定性。田琳曾通过优化κ-卡拉胶酶的发酵条件,使其酶活回收率高达72.4%,为其工业化生产打下基础[125]。因此,在以后的研究中仍然需要重点分析卡拉胶酶的基因序列以及优化表达条件[126-127]。而卡拉胶硫酸化酶的多样性在于卡拉胶多糖的多样性。其中卡拉胶硫酸化酶大部分的组成和结构都是未知的。因此,要全面分析硫酸化酶的功能,需要同时获得关于卡拉胶多糖的新数据。揭示海洋生物来源多糖中硫酸化酶和其他酶的转化过程,这将增强对海洋生物的分子层面理解。相信随着基因组学的不断进步以及科研技术的不断发展,将会实现卡拉胶多糖以及其他海洋类能源物质的可持续发展。
