基于网络药理学及分子对接技术探讨辣木叶抗肥胖的作用机制
2023-08-15李婷婷弘子姗
李婷婷,管 亚,弘子姗,解 静,3,4, ,田 洋,3,4,
(1.云南农业大学食品科学技术学院,云南昆明 650201;2.国家辣木加工技术研发专业中心,云南昆明 650201;3.教育部食药同源资源开发与利用工程中心,云南昆明 650201;4.云南省药食同源功能食品工程研究中心,云南昆明 650201)
随着饮食结构、生活方式等的改变,全球肥胖患病群体日益庞大,随之诱发的糖尿病、高血压、心脑血管疾病、癌症等多种疾病严重威胁人类健康,因此,肥胖已成为棘手的公共卫生问题。目前,欧盟批准的肥胖症治疗药物——奥利司他[1],可通过阻止脂肪摄入和卡路里吸收发挥减肥作用,但长期使用会引发胃肠及肝脏损伤等副作用。天然产物由于具有低毒、低副作用等特点,备受人们关注,因此,探究天然产物抗肥胖作用及机制是当前研究的重点和热点。
辣木(Moringa oleiferaLam.)又名辣根树、鼓槌树,为辣木科辣木属植物,广泛种植于热带、亚热带国家和地区[2]。辣木叶除了富含多种营养素外,还被作为一种传统药用植物被广泛使用。印度阿育吠陀药典记载,辣木叶具有消炎止痛、保肝利尿、降脂降压、明目醒脑等多种功效[3]。此外,随着对辣木研究的深入,大量研究发现辣木叶中富含多酚、黄酮、生物碱、糖苷及有机酸酯等多种生物活性物质,并且这些活性成分发挥着抗肿瘤、抗病毒、抗炎、抗氧化、降低血糖和血脂等作用[4]。2012 年,我国卫生部第19 号文件公布辣木叶为新资源食品,自此,辣木叶在食品、药物及功能性原料等方面的开发和应用深受人们重视。
目前已有大量研究报道了辣木叶抑制脂质积累的作用。例如,Ahmed 等[5]发现,辣木叶中的酚类化合物(阿魏酸、山奈酚、肉桂酸、鞣花酸等)可以逆转高脂饮食大鼠肝脏脂质积累,通过抑制脂质代谢基因的表达发挥抗肥胖活性。杨学芳等[6]证实,辣木叶水提物具有改善代谢紊乱小鼠暴饮暴食症状,调节瘦素和胃饥饿素表达水平,降低小鼠食物摄入及血脂水平的作用。此外,辣木叶提取物抑制了代谢综合征大鼠肥胖,改善了血清血脂四项水平,减少了大鼠脂肪堆积[7];辣木叶提取物还显著降低了高脂饮食大鼠血清、肝脏和肾脏中总胆固醇水平[8];辣木叶提取物可通过AMPK 信号通路促进3T3-L1 细胞凋亡而降低脂肪生成[9]。但是,尽管目前已有大量研究报道辣木叶具有抑制脂质积累的作用,但其研究多停留在提取物层面,关于其抗肥胖的主要活性成分及其作用机制仍不清楚。
近年来,随着生物信息学的快速发展,网络药理学分析为传统天然药物的现代研究提供了新的思路、理论和方法,其可全面阐释多成分天然植物的药用潜在活性与其疾病靶点的相互作用机制[10]。分子对接是一种流行且有效的计算机辅助药物开发技术,是基于靶蛋白(受体)的活性位点,利用空间和能量的作用模式通过药效团匹配小分子(配体)的研究策略。因此,本研究基于网络药理学结合分子对接技术,深入探究了辣木叶抗肥胖的活性成分及其作用机制,为辣木叶防治肥胖功能食品的开发和应用提供科学依据。
1 材料与方法
1.1 辣木叶成分靶点预测及肥胖靶点筛选
通过查阅文献,建立辣木叶活性成分虚拟文库(共111 个化合物)。通过PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov)下载辣木叶活性成分的化学结构并保存为SMILES 号。通过SwissADME平台(http://www.swissadme.ch)和Swiss Target Prediction(http://www.swisstargetprediction.ch/index.php)线上靶点筛选平台,设置靶点属性为“homo sapiens”,预测辣木叶活性成分的潜在靶点,剔除无法查询SMILES 号的化合物及重复靶点,选取Probability*≥0.1 的活性靶点,采用Excel 整合进行下一步分析。
以“obesity”为检索词,基因ID 为“C0028754”,在 DisGeNET 数据库(https://www.disgenet.org/Score gda),以“summary of Gene-Disease Associations”为条件检索基因疾病关联靶点,去除无Uniprot ID 的靶点及重复靶点,取Score_gda 值大于0.1 的肥胖相关靶点进行后续分析。
1.2 蛋白质-蛋白质相互作用(PPI)网络构建
利用Venny 2.0.1(https://bioinfogp.cnb.csic.es/tools/venny/index.html)平台将收集得到的辣木叶成分靶点与肥胖相关靶点,以Uniprot ID 作为筛选标准取交集,即得到辣木叶活性成分治疗肥胖的潜在作用靶点。将交集靶点和潜在活性成分导入Cytoscape3.8.2 软件,利用Network Analyzer 分析节点的拓扑参数并以Degree(自由度)为依据,绘制成分-靶点相互作用网络图,筛选出辣木叶防治肥胖的核心活性成分。
将交集靶点导入STRING 11.0 数据库(https://string-db.org/),设置生物属性为“homo sapiens”,“highest confidence”为0.4,删除无相互作用节点,构建PPI 相互作用网络图,并运用Cytoscape3.8.2 软件以不同颜色、大小、Degree(自由度)进行可视化,筛选出辣木叶活性成分作用的潜在核心肥胖靶点。
1.3 GO 和KEGG 功能富集分析
通过David 数据库(https://david.abcc.ncifcrf.gov)对辣木叶活性成分抗肥胖潜在靶点进行GO(Gene ontology)功能分析和KEGG(Kyoto encyclopedia of genes and genomes)通路富集分析。根据靶点数(Count)降序排列,分别选取GO 分析中生物过程(Biological process)、分子功能(Molecular function)和细胞成分(Cellular component)三大生物进程参数的前10 条绘制柱状图,进行下一步分析。根据P-value 值升序排列,选取P值前20 条通路绘制KEGG 通路富集分析气泡图并评估其相关性。
1.4 辣木叶成分-肥胖靶点-信号通路网络图的构建
为了进一步分析成分-靶点-信号通路之间的多层生物信息网络关系,运用Cytoscape 3.8.2 软件绘制“辣木叶活性成分-肥胖靶点-信号通路”互作网络图,利用拓扑分析筛选出生物学重要性最强的节点作为核心成分和靶点。
1.5 辣木叶活性成分与关键靶基因的分子对接验证
将辣木叶防治肥胖的相关核心活性成分作为Ligands(配体),通路富集的重要核心靶点作为受体分子,通过RCSB(PDB)数据库(http://www.rcsb.org/pdb/home/home.do)、TCMSP 数据库(http://tcmspw.com/tcmsp.Php)下载受体分子的晶体结构和核心活性成分的3D 结构。应用Auto Dock4.2 软件将活性成分的3D 结构加氢,检测扭转键,设置扭转键,设置为对接配体;将靶点蛋白的晶体结构去水、加氢,设置包裹整个蛋白的对接Gridbox,以及将处理好的成分和靶点进行Auto Dock vina 分子对接,采用PyMOL2.Ink 软件进行可视化绘制。
2 结果与分析
2.1 辣木叶活性成分及肥胖相关靶点筛选
经PubChem 数据库和Swiss Target Prediction数据筛选获得60 个水溶性的辣木叶活性成分(表1)。其中,满足辣木叶目标成分条件的有效活性成分50 个,潜在靶点2359 个,剔除重复值后共有靶点563 个。
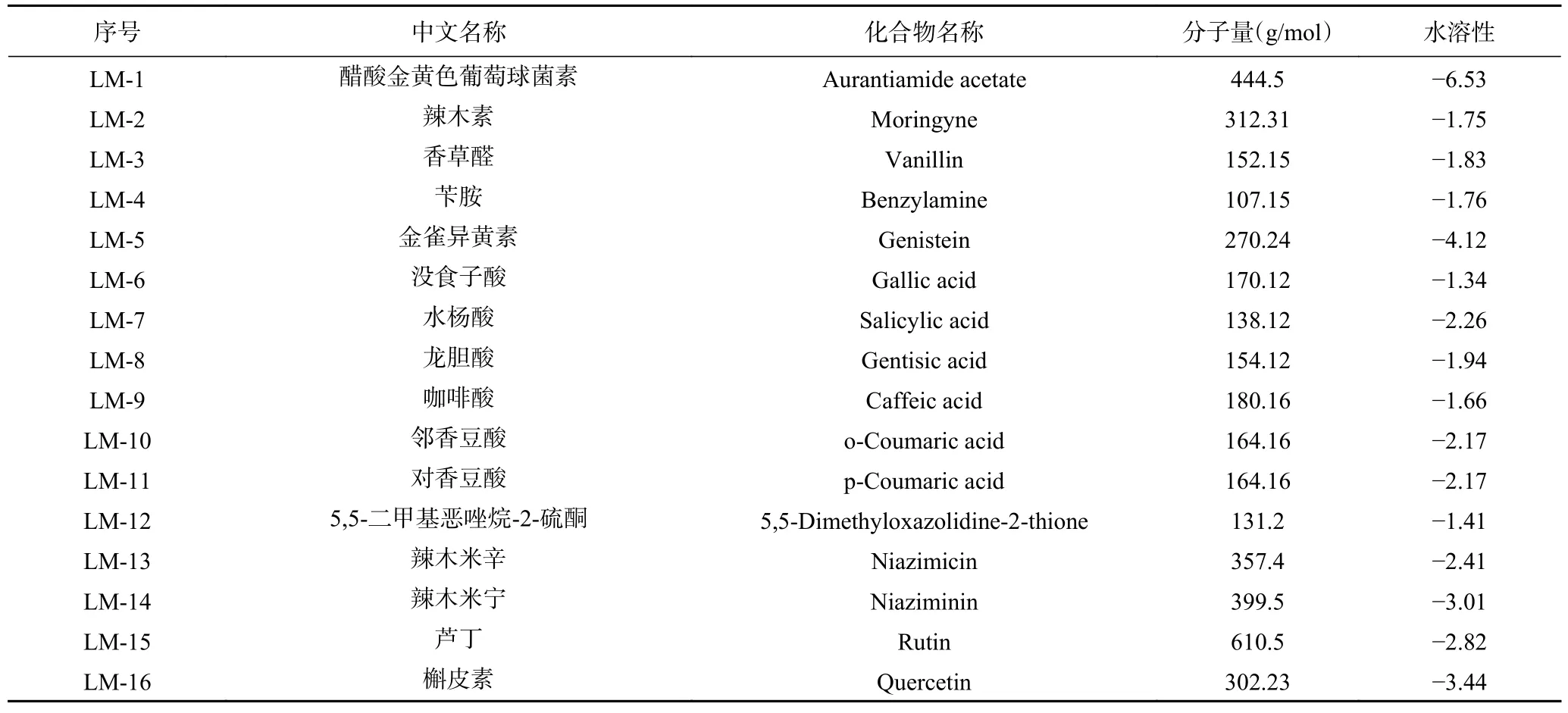
表1 辣木叶活性成分信息及其参数Table 1 The main active ingredients and parameters of Moringa oleifera Lam.leaves
从DisGeNET 数据库得到2821 个肥胖相关靶点,去除无Uniprot ID,Score_gda 值大于0.1 及重复项后共获得761 个满足条件的肥胖相关靶点。
2.2 辣木叶活性成分防治肥胖的靶点网络构建
将上述筛选的辣木叶活性成分-肥胖靶点通过Cytoscape 3.8.2 软件进一步绘制了辣木叶活性成分和疾病靶点相互作用网络图(图1),该网络包含181 个作用节点,640 条相互作用边,图中矩形表示成分作用于疾病的共同靶点,圆形表示辣木叶活性成分。此外,形状面积越大表示涉及Degree 值越大,参与直接作用节点数越多,同样说明高Degree 值的靶点参与生物学功能越多,涉及的生物学重要性越强。
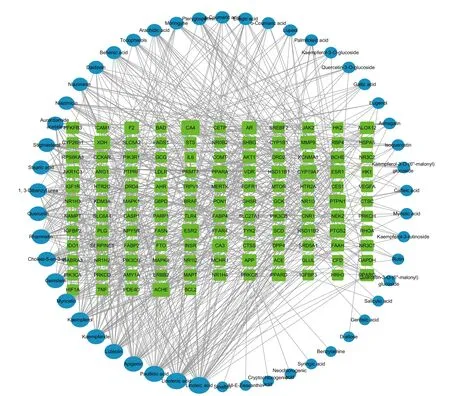
图1 辣木叶活性成分抗肥胖靶点的相互作用网络图Fig.1 Active ingredients of Moringa oleifera Lam.leaves of the anti-obesity target interaction network
由图1 可知,依据Degree 值筛选到相互作用靶点最多的前十一个活性成分分别为亚油酸(Linoleic acid)、亚麻酸(Linolenic acid)、泡桐酸(Paullinic acid)、芹菜素(Apigenin)、木犀草素(Luteolin)、山奈酚(Kaempferol)、山柰素(Kaempferide)、金雀异黄素(Genistein)、鼠李黄素(Rhamnetin)、杨梅素(Myricetin)和胆甾-5 烯-3 醇(Cholest-5-en-3-ol),其Degree 关联度值为35、33、31、27、26、25、25、25、24、24、24(表2),以上成分中亚油酸表现出最高关联度,涉及102 个作用节点,表明亚油酸及以上辣木叶活性成分可能具有较强的抗肥胖潜力。
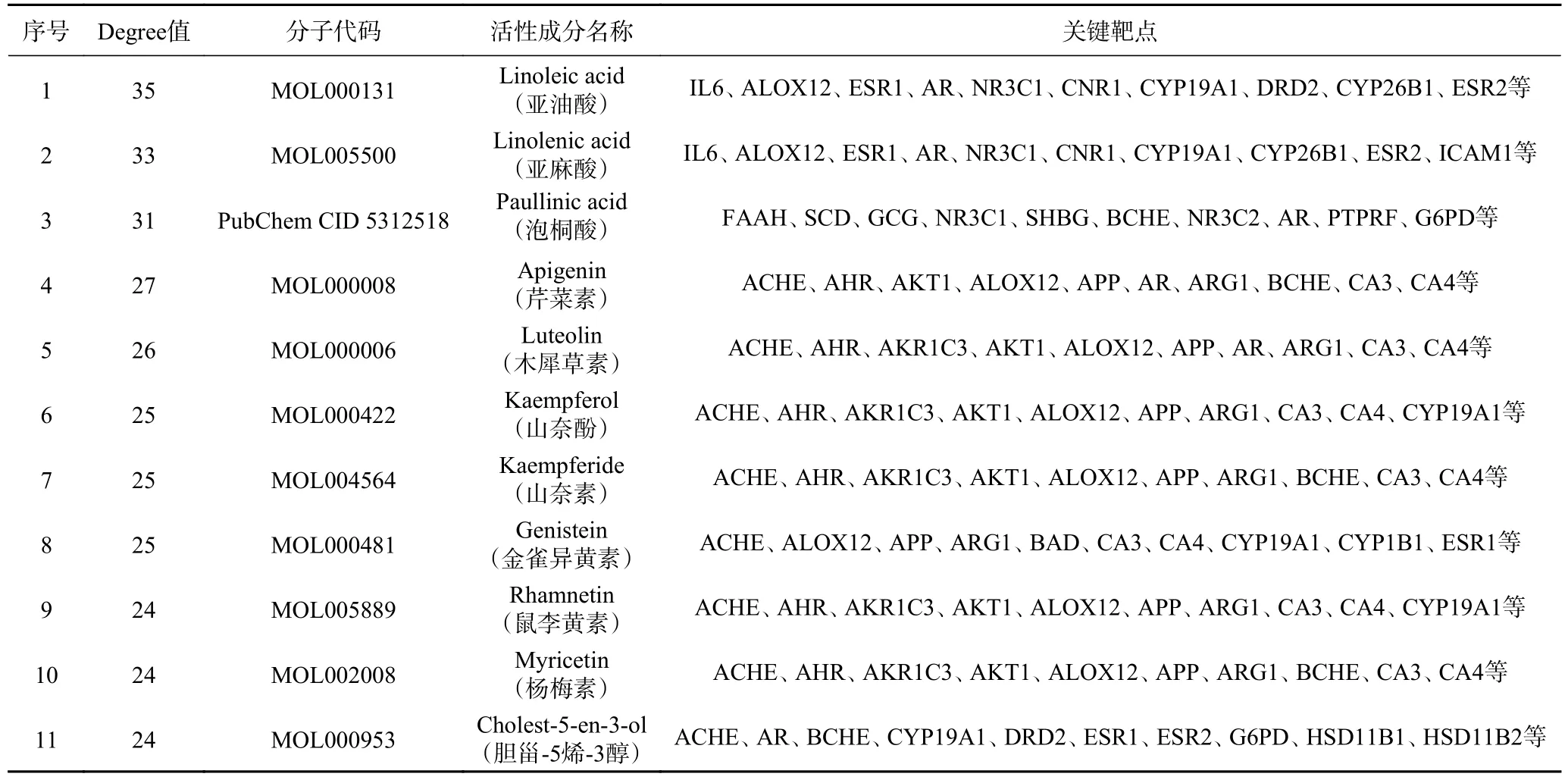
表2 辣木叶核心活性成分对应防治肥胖关键靶点基因Table 2 Core active ingredients of Moringa oleifera Lam.leaves correspond to key target genes in the fight against obesity
2.3 辣木叶防治肥胖潜在交集靶点及PPI 网络构建
将筛选出的辣木叶活性成分靶点与肥胖相关靶点导入Cytoscape 3.8.2 软件和Venny 2.1.0 平台构建交集靶点韦恩图(图2),将得到的126 个交集靶点移交至STRING 11.0 数据库进行辣木叶活性成分靶点-肥胖靶点PPI 网络可视化(图2),得到123 个作用节点,1124 条相互作用边,平均自由度为18.28。由图可知,辣木叶活性成分治疗肥胖的绝大多数靶点具有一至多条的网络互作关系,其中靶点颜色和形状可直观体现出辣木叶防治肥胖过程中可能通过这些靶点起到降脂作用。

图2 辣木叶活性成分靶点和肥胖靶点交集靶点和PPI 网络Fig.2 Active ingredient related targets of Moringa oleifera Lam.leaves and obesity target intersection targets and PPI network
2.4 GO 功能富集
将126 个核心靶点导入David 在线平台,以通路中的基因数(Count)和P值为条件进行生物过程(Biological process)、分子功能(Molecular function)和细胞组分(Cellular component)三方面GO 功能富集分析(图3)。结果显示,辣木叶防治肥胖的作用靶点在GO 生物进程中注释到细胞间信号调控、药物应答等496 个条目,包括RNA 聚合酶Ⅱ启动子转录的正调控(Positive regulation of transcription from RNA polymerase II promoter)、信号传导(Signal transduction)、基因表达的正正向调控(Positive regulation of gene expression)、蛋白质磷酸化(Protein phosphorylation)、DNA 为模板的转录正调控(Positive regulation of transcription,DNA-templated)、RNA 聚合酶Ⅱ启动子转录的负调控(Negative regulation of transcription from RNA polymerase II promoter)、RNA 聚合酶Ⅱ启动子的转录调控(Regulation of transcription from RNA polymerase IIpromoter)、药物反应(Response to drug)、凋亡表达的正调控(Positive regulation of apoptotic expression)及凋亡表达的负调控(Negative regulation of apoptotic expression)等。

图3 辣木叶活性成分治疗肥胖基因GO 富集分析结果Fig.3 The results of Moringa oleifera Lam.leaves active ingredient prevention and treatment of obesity gene GO enrichment analysis
在GO 细胞组分中主要被注释到细胞膜、质、核及其表面外环境等,包括质膜(Plasma membrane)、胞质溶胶(Cytosol)、细胞质(Cytoplasm)、核(Nucleus)、膜(Membrane)、膜的组成部分(Integral component of membrane)、核质(Nucleoplasm)、细胞外泌体(Extracellular exosome)、胞外区(Extracellular region)、细胞外空间(Extracellular space)等71 个条目。在GO 分子功能中被注释到分子间相互结合上,包括蛋白质结合(Protein binding)、相同的蛋白结合(Identical protein binding)、ATP 结合(ATP binding)、锌离子结合(Zinc ion binding)、酶结合(Enzyme binding)、序列特异性DNA 结合(Sequence-specific DNA binding)、蛋白质丝氨酸/苏氨酸/酪氨酸激酶活性(Protein serine/threonine/tyrosine kinase activity)、RNA 聚合酶II 核心启动子近端区域序列特异性DNA 结合(RNA polymerase II core promoter proximal region sequence-specific DNA binding)、RRNA 聚合酶II 转录因子活性的序列特异性DNA 结合(RNA polymerase II transcription factor activity,sequence-specific DNA binding)、DNA 结合(DNA binding)等118 个条目。结果表明辣木叶活性成分通过参与众多生命进程抑制肥胖。
2.5 KEGG 信号通路富集
为阐明辣木叶防治肥胖的作用机制,将126 个潜在核心靶点进行KEGG 信号通路注释分析,共富集到146 条相关信号通路,具有显著意义共117 条(P<0.01)。前20 条信号通路被认为在辣木叶防治肥胖的过程中发挥重要作用(图4a),由表3 可观察到辣木叶防治肥胖的信号通路显著富集在HIF-1 信号通路、胰岛素抵抗信号通路、癌症及炎症信号通路等,并且这些通路大量富集PIK3CA、PIK3CB、PIK3R1、AKT1、MAKP1、MTOR 等多个关键靶基因(图4b),间接表明机体的肥胖状态由多通路、多靶点调控,是一种复杂机制的代谢性疾病。

图4 辣木叶活性成分治疗肥胖的KEGG 通路富集图(a)和前20 条通路富集关键基因(b)Fig.4 KEGG pathway enrichment map of the active ingredients of Moringa oleifera Lam.leaves preventing and treating obesity (a)and the proportion of key target genes in the top 20 pathways (b)

表3 辣木叶活性成分防治肥胖的KEGG 通路排名前15 位富集分析Table 3 Enrichment analysis of the top 15 KEGG pathways ranking of active ingredients of Moringa oleifera Lam.leaves for obesity control
2.6 辣木叶活性成分-靶点-信号通路网络构建
为进一步探究辣木叶防治肥胖作用机制中活性成分、作用靶点与信号通路之间的相互作用关系,将关键降脂药效成分、肥胖靶点和信号通路运用Cytoscape 3.8.2 软件构建“成分-疾病-通路”相互作用网络图(图5),图中黄色菱形表示药效成分,蓝色矩形表示作用靶点,橙色三角形表示信号通路,利用图中连线表示各节点之间的互作关系和强度。结果显示,15 条信号通路富集到55 个靶基因,其中PIK3CA、PIK3CB、PIK3R1、AKT1、MAKP1、MTOR等关键靶点与成分之间存在重复多次作用于多条信号通路的情况,因此,辣木叶活性成分可能通过多靶点调节细胞间信号转导、增殖、分化、代谢及特异性结合等信号表达对防治肥胖发挥重要作用。研究表明辣木叶活性成分防治肥胖通过多个成分作用于同一靶点,同一靶点调节多条信号通路,实现多成分、多靶点、多通路的协同治疗作用。

图5 辣木叶活性成分-靶点-信号通路网络图Fig.5 Active ingredient of Moringa oleifera Lam.leaves-target-signaling pathway network diagram
2.7 辣木叶活性成分与关键靶基因的分子对接验证
应用AutoDock 4.2 软件对辣木叶11 种活性成分与通路富集前六的核心基因(PIK3CA、PIK3CB、PIK3R1、AKT1、MAPK1、MTOR)进行分子对接验证(图6)。在该软件的分子对接评分中,对接分数越低、构象越稳定,则结合活性越好,对接结果见表4,根据对接评分筛选最佳结合模式进行可视化分析(图7)。结果显示,靶点蛋白PIK3R1 与鼠李黄素呈现出最低的对接评分,为−9.2 kcal/mol;其次是PIK3CA 与胆甾-5 烯-3 醇,为−9.1 kcal/mol;PIK3R1与杨梅素,为−8.8 kcal/mol;AKT1 与木犀草素,为−8.7 kcal/mol。

图6 辣木叶活性成分与对应核心靶点的分子对接结合能热图(kcal/mol)Fig.6 Heat map of molecular docking binding energy between the active ingredients of Moringa oleifera Lam.leaves and the corresponding core targets (kcal/mol)
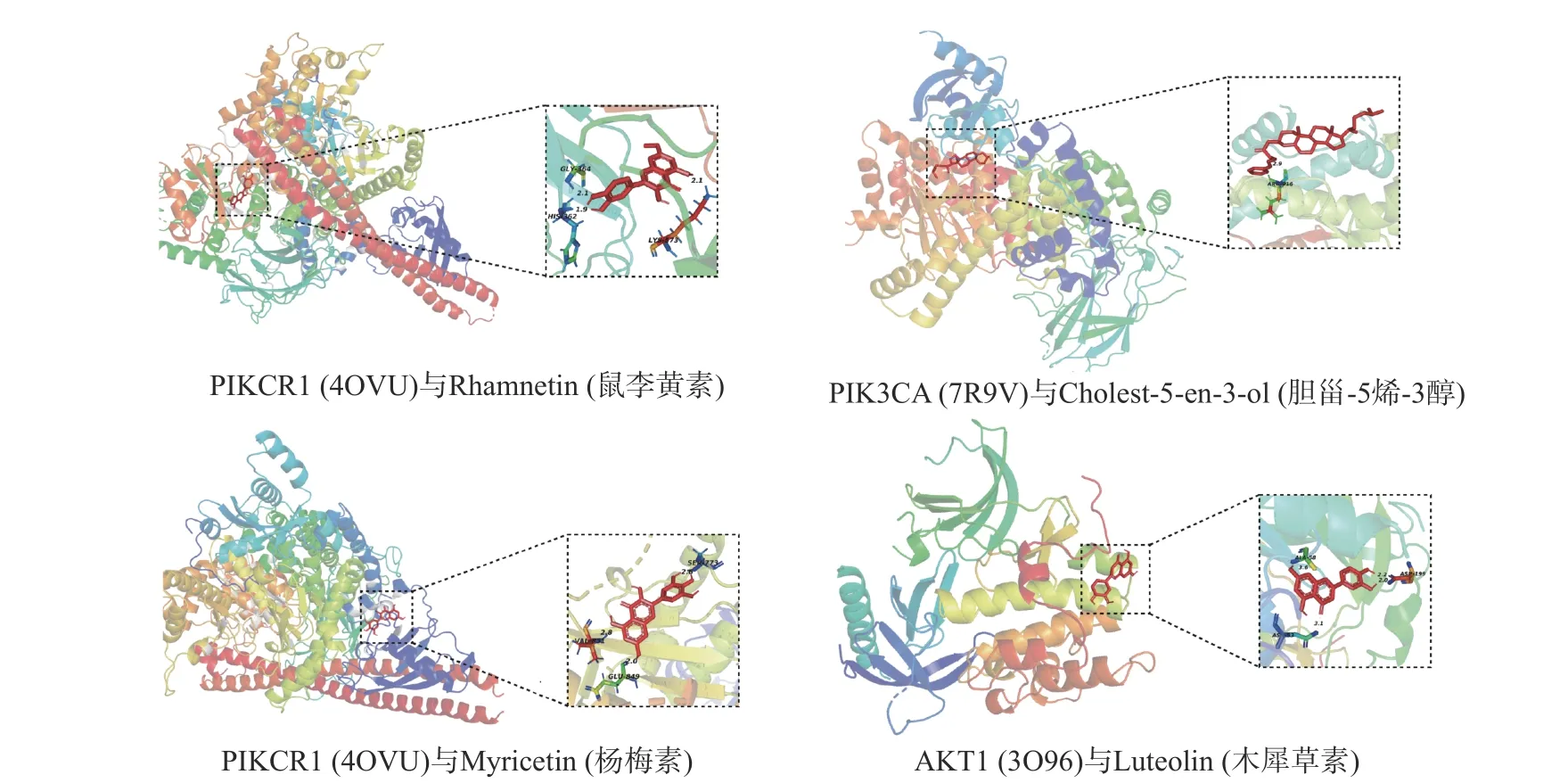
图7 前四个辣木叶活性成分与对应核心靶点的分子对接可视化图Fig.7 Molecular docking patterns of the first four Moringa oleifera Lam.leaves active ingredients to their corresponding core targets
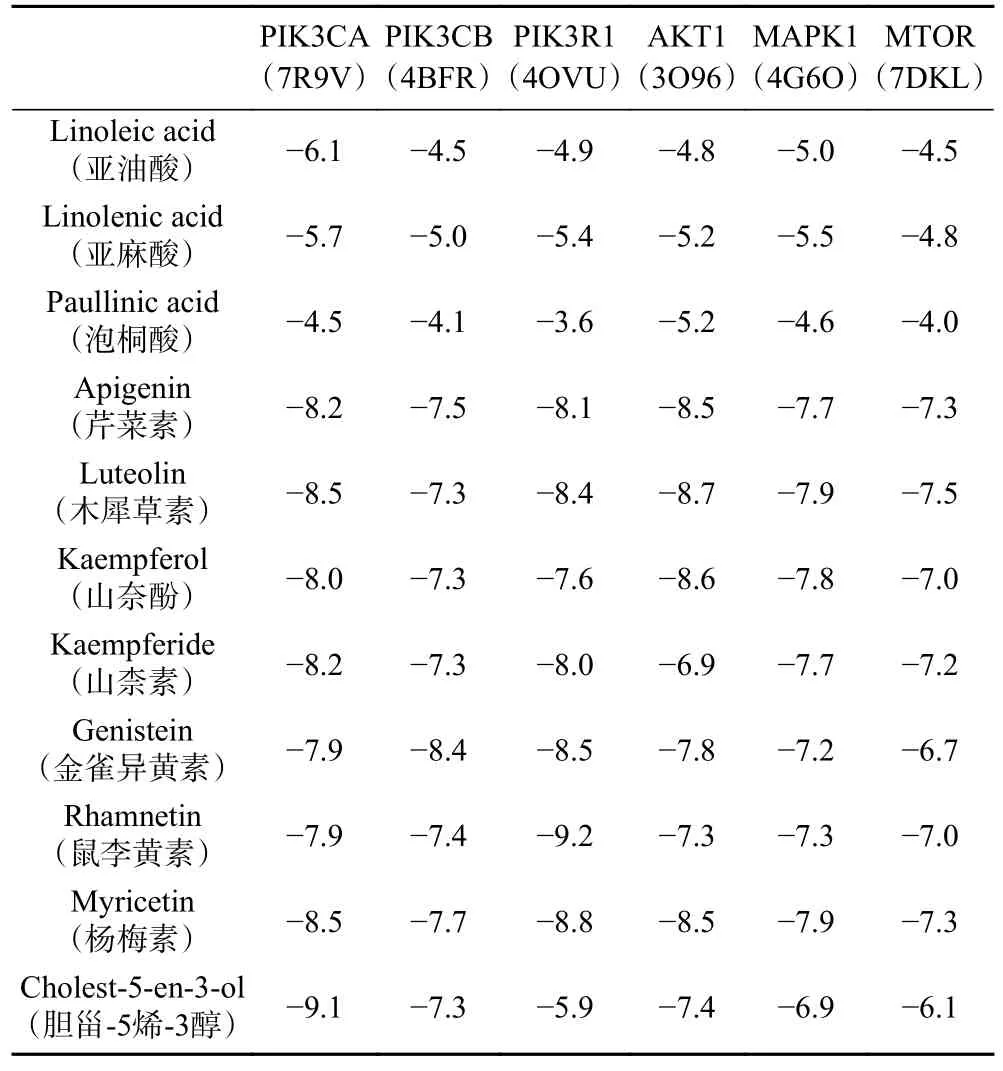
表4 辣木叶活性成分与对应核心靶点的分子对接结合能(kcal/mol)Table 4 Molecular docking binding energy of active ingredients of Moringa oleifera Lam.leaves with corresponding core targets(kcal/mol)
3 讨论
据报道,中国等亚洲国家近乎一半的成年人患有肥胖症[11],且全球每年至少280 万人死于代谢性疾病,超重和肥胖被认为是一场健康危机,给人类健康带来巨大挑战[12]。近年来,辣木叶的多种药理功效逐渐被挖掘和证实,是治疗肥胖的天然候选者。中药本身是一种“多成分-多靶点-多疗效”的复杂体系,而网络药理学可借助虚拟筛选和网络分析来预测新的药效成分,因此,本文基于网络药理学“成分-疾病-靶标”的研究策略,并结合分子对接技术,全面探究了辣木叶抗肥胖的活性成分及其作用机制。
本文通过数据库信息检索和相互作用网络的拓扑结构分析,获得辣木叶活性成分防治肥胖的126 个关键靶点。并且基于辣木叶活性成分和肥胖靶点相互作用网络图筛选,发现辣木叶中发挥抗肥胖作用的主要活性成分为亚油酸、亚麻酸、泡桐酸、芹菜素、木犀草素、山奈酚、山柰素、金雀异黄素、鼠李黄素、杨梅素、胆甾-5 烯-3 醇等。由其相互作用网络图可知,辣木叶活性成分防治肥胖的绝大多数成分和靶点具有一至多条的网络互作关系,表明辣木叶抗肥胖可能由多活性成分、多靶点发挥协同作用,可为辣木叶防治肥胖的进一步研究提供方向。
将126 个关键靶点进行GO 分析和KEGG 富集,发现辣木叶活性成分抗肥胖的核心靶点参与众多生命进程,主要涉及细胞组成、细胞间信号调控和分子间蛋白结合等。KEGG 信号通路主要注释到HIF-1 信号通路、胰岛素抵抗信号通路、表皮生长因子受体(EGFR)信号通路及癌症信号通路等。HIF-1α是细胞适应缺氧环境的重要调节因子,在低氧条件下,HIF 通过激活线粒体氧化磷酸化向无氧糖酵解的转换,还可通过丙酮酸转化为乙酰辅酶A,降低线粒体功能,防止肝脂质沉积[13],对维持细胞糖脂代谢起着关键作用。肥胖和2 型糖尿病是胰岛素抵抗(IR)的典型代谢综合征,IR 主要是胰岛素受体对胰岛素失去敏感性,使负反馈机制受损导致高血糖和高胰岛素发生[14],是诱发代谢性并发症的关键因素。PI3K/AKT信号通路是调节脂质代谢的经典信号通路,IRS/PI3K/AKT 是胰岛素信号传导的主要通路。胰岛素受体与胰岛素结合产生信号反应,使磷酸化的胰岛素受体底物IRS 激活下游PI3K-AKT 信号联动抑制糖异生,促进糖原合成并改善胰岛素抵抗[15]。而在癌症的发展过程中,机体内病变细胞同样发生过度增殖,激活生长因子和癌症调控受体,致使病变细胞不受控制的无限增殖、侵袭和转移。胰岛素信号传导的另一条重要通路(Ras-MAPK 信号通路)调控着细胞的增殖与分化,其下游ERK1/2 失调是导致癌症的重要级联蛋白之一。然而EGFR 激活的EGFR-PI3K/AKT信号通路同样控制着细胞增殖、迁移及血管生成,是引发肿瘤的经典途径[16]。并且PI3K/AKT 途径下游的mTOR 靶基因也被证明通过改变癌症代谢控制着绝大多数癌症细胞生命活动[17]。由此可知,PI3K/AKT 这条经典的信号通路与胰岛素信号传导、癌症的发生密不可分,同样直接或间接地证明肥胖的发生与该信号通路有着重要联系。
值得注意的是,由信号通路富集得到的关键基因主要包括PIK3CA、PIK3CB、PIK3R1、AKT1、MAPK1、MTOR 等,其中PIK3CA、PIK3CB 和PIK3R1均属磷脂酰肌醇-3-激酶(PI3K)的p110 催化亚基[18],PI3K 作为PI3K/AKT 信号通路的核心分子控制着重要的细胞生命活动。而AKT1[15]作为促进细胞存活的主要信号转导蛋白,受胰岛素和生长因子等多种激素的调节,增加AKT 磷酸化周期蛋白依赖性激酶的活性可影响3T3-L1 细胞的增殖分化[19]。AKT 作为通路中关键调节因子,磷酸化后可激活下游蛋白发挥级联效应,进一步抑制细胞增殖,但重要的是当AKT 活化受损时会导致胰岛素抵抗引起机体代谢紊乱。雷帕霉素靶蛋白(MTOR)是PI3K 相关激酶(PIKK)家族中的一种丝氨酸/苏氨酸蛋白激酶,是细胞营养状态的关键调节剂[20],参与控制脂肪细胞功能和PI3K/AKT/MTOR 途径的脂质代谢。此外,MTOR还是细胞自噬的主要调节因子[21],依靠PI3K/AKT的介导而激活参与蛋白质、核苷酸和脂质的生物合成,但是肥胖的发生往往使MTOR 过度激活导致脂肪组织的自噬信号失调和产生胰岛素抵抗。丝裂原活化蛋白激酶超家族(MAPKs)主要包括细胞外信号调节激酶(ERK1/2)、c-Jun 氨基末端激酶(JNK)和p38 MAPK 三 类[21]。MAPK1 是ERK/MAPK 信 号通路的重要靶蛋白,直接参与调控肿瘤细胞的增殖分化,且MAPK 的三级酶促级联放大反应可最终激活P38MAPK 途径引起炎症和胰岛素抵抗[22]。JNK 途径[23]则通过激活胰岛素受体底物AKT 磷酸化而调控机体代谢紊乱。因此,辣木叶活性成分可能通过HIF-1、胰岛素抵抗、EGFR 和癌症等多通路下游靶标作用于胰岛素受体,间接激活PI3K/AKT 经典信号通路起到抗肥胖作用。
研究显示,当分子对接分数小于0 时,表明配体分子与受体蛋白可自行结合;当对接分数小于−4 kcal/mol 时,表明两者间有一定的对接活性;当对接分数小于−5.0 kcal/mol 时,表明两者间有较好的对接活性;当对接分数小于−7.0 kcal/mol 时,表明两者间有强烈的对接活性[24]。通过11 个关键活性成分和6 个主要核心基因的分子对接研究,发现11 个关键活性成分与其中三个靶点(PIK3R1、PIK3CA、AKT1)的对接活性最强,尤其是关键靶点PIK3R1与鼠李黄素之间呈现最低的对接分数(−9.2 kcal/mol),结合构象最为稳定;其次是PIK3CA 与胆甾-5 烯-3 醇,为−9.1 kcal/mol;PIK3R1 与杨梅素,为−8.8 kcal/mol;AKT1 与木犀草素,为−8.7 kcal/mol。结果表明,以上四种化合物可能是辣木叶抗肥胖的主要活性成分,且其可能通过作用这些靶点发挥抗肥胖作用。鼠李黄素是一种天然类黄酮,在抗炎、抗氧化和抗肿瘤等方面表现出显著效果[25]。研究报道,鼠李黄素可通过降低C/EBPβ、PPARγ、C/EBPα等脂肪细胞分化标志物的表达来抑制3T3-L1 细胞脂肪早期的增殖分化,发挥抑制脂质积累作用[26];可通过抑制脂多糖(LPS)诱导的巨噬细胞中炎症通路MAPK、ERK、JNK 和环氧合酶-2(COX-2)途径中相关蛋白的表达发挥抗炎作用、抗肥胖和胰岛素抵抗作用[27−28]。胆甾-5 烯-3 醇又名胆甾醇、胆固醇,外源性膳食甾醇是人体不可缺少的营养物质,不仅参与调节质膜的流动性和渗透性,还是所有类固醇激素的前体物质[29]。膳食补充植物甾醇在一定程度上不仅降低血清中低密度脂蛋白水平[30],而且植物甾醇能够显著改善胆固醇代谢[31]。杨梅素以剂量依赖的方式显著下调脂肪生成转录因子CCAAT/PPARγ、C/EBPα及其他脂代谢相关基因mRNA 和蛋白表达水平[14],进而发挥抑制3T3-L1 前体脂肪细胞的脂质积累作用;此外,杨梅素可改善高脂饮食大鼠糖脂代谢紊乱和胰岛素抵抗作用,并且通过刺激β-肾上腺素能受体(betaAR),激活cAMP 依赖性途径,上调MAPK途径的磷酸化诱导脂肪分解[32]。同样地,He 等[33]的研究发现杨梅素还不同程度地调节了高脂高胆固醇血症小鼠血清中TC、TG、LDL-C、TBA 和LPS 的水平,显著减少了肝脏脂肪和附睾脂肪的沉积。木犀草素具有显著抑制高脂饮食诱导的肥胖和糖尿病小鼠体重增加、脂肪沉积和脂肪细胞增大的作用[34];其可通过调节HIF-1α、葡萄糖转运蛋白-4(GLUT-4)、PPARα、肉碱棕榈酰转移酶-1A(CPT-1A)和丙酮酸脱氢酶激酶-4(PDK-4)的蛋白表达水平以减少脂肪吸收[35];并通过活化JAK/STAT3 通路的信号传导促进瘦素分泌,改善肝脏脂质沉积和体重增加[36]。由上可知,筛选得到的活性成分在防治肥胖方面具有一定科学依据,表明网络药理学分析的科学性和可信性。因此,辣木叶中的鼠李黄素、胆甾-5 烯-3 醇、杨梅素、木犀草素等药效成分可能通过与PIK3R1、PIK3CA、AKT1 等关键靶点结合,调控HIF-1、胰岛素抵抗、EGFR 和癌症等多条信号通路发挥抗肥胖作用。
4 结论
综上所述,本文运用网络药理学结合分子对接技术对辣木叶防治肥胖的潜在药效成分、关键靶点及作用机制进行了初步预测,发现辣木叶治疗肥胖呈现多成分作用于同一靶点,同一靶点调节多条信号通路的协同效应。所以,辣木叶可能通过多成分、多靶点、多通路影响机体细胞增殖分化、脂质基因表达及炎症、癌症的产生等多维度生命进程而协同发挥降脂作用,为进一步实验验证辣木叶改善肥胖的作用机制及辣木资源的开发利用提供新的思路和方向。
