融合蛋白类抗VEGF药物治疗BRVO-ME的疗效及人房水细胞因子分析
2023-07-26徐一帆王瑞峰付政唐文建
徐一帆 王瑞峰 付政 唐文建
作者单位:郑州市第二人民医院眼科,郑州 450000
视网膜静脉阻塞(Retinal vein occlusion,RVO)是继糖尿病视网膜病变后中国第二大致盲性视网膜血管疾病[1-2]。流行病学调查显示RVO的发病率为1%~2%[3-6],且患病人数在逐年上升。根据血管阻塞部位的不同,可将RVO分为视网膜中央静脉阻塞(Central retinal vein occlusion,CRVO)和视网膜分支静脉阻塞(Branch retinal vein occlusion,BRVO)两类。BRVO 约占RVO 总数的80%[7]。BRVO患者主要临床特点为无痛性视力下降,而黄斑水肿(Macular edema,ME)是BRVO患者视力下降的最主要原因。随着人们对BRVO发病机制的深入了解,玻璃体腔注射抗血管内皮生长因子(Antivascular endothelial growth factor,anti-VEGF)成为治疗BRVO-ME的一线药物。阿柏西普与康柏西普是具有代表性的融合蛋白类anti-VEGF药物,但由于它们分子结构不同,对于BRVO-ME的治疗效果优劣的相关研究鲜有报道。临床中对于BRVO-ME治疗效果的评价多以影像学和功能学检测为主。药物使用后眼内各相关因子的真实变化情况缺乏详细的检测和分析对比。本研究中通过对BRVOME患者房水内细胞因子进行检测,了解不同融合蛋白类anti-VEGF药物注射后人眼内细胞因子的变化与波动,为BRVO-ME的治疗提供新的依据。
1 对象与方法
1.1 对象
纳入标准:①确诊为继发于视网膜分支静脉阻塞的黄斑水肿[视网膜厚度(Central retinal thickness,CRT)>300 μm];②发病时间小于1个月;③患者年龄≥18岁;④自愿参与本研究,并可按计划完成随访。
排除标准:①合并存在糖尿病视网膜病变等可能导致ME的疾病;②血压、血糖控制不佳者;③曾行眼内手术,包括玻璃体腔注药手术;④研究过程中出现眼内感染、视网膜脱离、玻璃体积血、中风等不良反应。
随机选取2018年1月—2019年4月就诊于郑州市第二人民医院眼科的BRVO-ME患者40例(40眼),分为康柏西普组和阿柏西普组,每组各20例(20眼)。本研究遵循赫尔辛基宣言,并获得郑州市第二人民医院医学伦理委员会批准(批号:KY2017016),所有患者知情同意并签署知情同意书。
1.2 检测指标
纳入患者由同一操作者在每次治疗前利用光学相干层析成像(OCT)仪测量CRT,并测量患者BCVA(LogMAR)。采集患者房水,检测房水中血管内皮生长因子(Vascular endothelial growth factor,VEGF)、胎盘生长因子(Placental growth factor,PlGF)、单核细胞趋化蛋白-1(Monocyte chemoattractant protein-1,MCP-1)和白介素-6(Interleukin-6,IL-6)因子浓度。
1.3 手术操作
注药及房水采集均在无菌层流手术室进行。房水采集及玻璃体腔注药前3 d,氧氟沙星滴眼液、双氯芬酸钠滴眼液每天3次点术眼。术前进用丙美卡因滴眼液点眼,5 min 1次,点眼3次。患者平卧于手术台,开睑器开睑。5%聚维酮碘消毒液与0.9%氯化钠溶液先后冲洗术眼。眼科有齿镊适当固定眼球,利用无菌27号微量穿刺针链接1 mL注射器,于10点位透明角膜穿刺,抽取房水0.15 mL。观察前房及眼压情况。房水样本冷冻保存备检。于11点钟距角膜缘3.5~4.0 mm巩膜垂直玻璃体腔将药物注入。康柏西普组注射康柏西普剂量为0.5 mg,阿柏西普组注射阿柏西普剂量为2 mg。拔出针头后无菌棉签按压10~20 s,观察无出血及药物溢出,指测眼压正常后术眼涂妥布霉素地塞米松眼膏,包扎遮盖患眼。术后持续氧氟沙星滴眼液点眼1 d 4次,持续1周。术后第2天复诊,检查眼部情况。
1.4 随访
患者自开始治疗后每月注射1 次,连续注射3个月,患者术后随访BCVA、眼压、裂隙灯显微镜及OCT检查,依据病情变化决定是否再次玻璃体腔药物注射。随访6个月。
1.5 统计学方法
前瞻性研究。采用SPSS 19.0统计学软件进行数据分析。计量资料采用±s表示。2组间计量资料采用两独立样本t检验,计数资料采用χ2检验进行分析。以P<0.05为差异有统计学意义。
2 结果
2.1 基线资料比较
2 组患者就诊时的年龄、BCVA、黄斑中心凹厚度,房水中VEGF、PIGF、MCP-1、IL-6因子浓度差异均无统计学意义(均P>0.05),见表1。

表1.康柏西普组与阿柏西普组患者基线资料对比Table 1.Baseline clinical features of eyes treated with conbercept and aflibercept
2.2 2组患者的临床指标分析
康柏西普组患者药物注射次数为(3.15±0.36)次,阿柏西普组为(3.07±0.24)次。与给药前相比,2组患者注药后第1、2、3、6个月随访时视力均有明显提高,且差异有统计学意义(均P<0.05)。药物治疗后,2 组患者CRT比给药前均明显下降,差异有统计学意义(均P<0.05)。在治疗后的第1、2、3、6个月,2组BCVA和CRT比较差异均无统计学意义(均P>0.05)。见表2。

表2.康柏西普组与阿柏西普组治疗后中央视网膜厚度和最佳矫正视力比较Table 2.Compare CRT and BCVA after injection for conbercept group and aflibercept group
2.3 2组患者房水细胞因子指标分析
与给药前相比,康柏西普组和阿柏西普组患者房水中VEGF、PIGF和IL-6在给药后第1、2、3个月均明显下降,差异均有统计学意义(均P<0.05);2 组MCP-1 在给药后第3 个月均出现明显下降(P=0.028、0.033)。治疗后第1、2、3个月,2组患者房水中VEGF、PIGF、IL-6、MCP-1浓度在组间比较差异均无统计学意义(均P>0.05)。见表3。
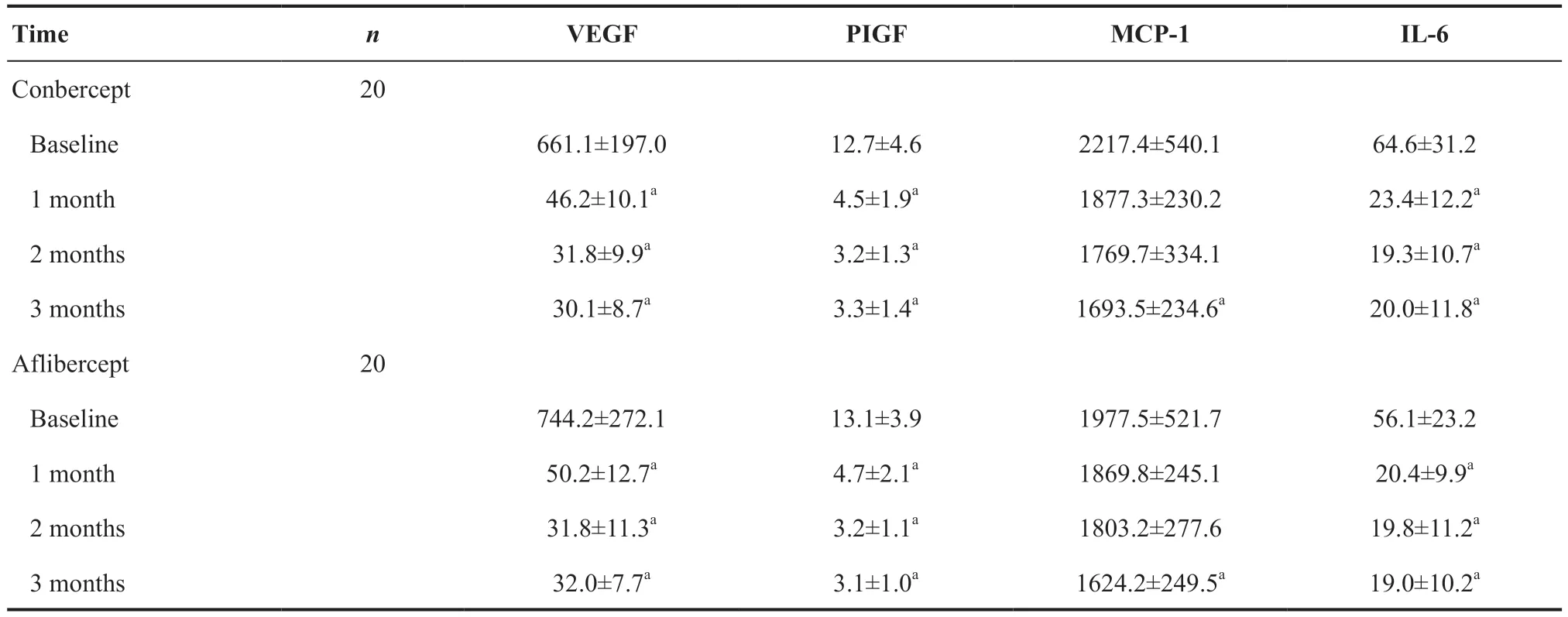
表3.康柏西普组与阿柏西普组治疗后房水细胞因子浓度(μm)比较Table 3.Compare the concentration of VEGF, PIGF, MCP-1 and IL-6 after injection for conbercept group and aflibercept group (μm)
3 讨论
RVO是世界范围内主要的致盲性血管疾病。相对于CRVO,对于BRVO的患者来说,ME对视力的影响更大,是视力下降的主要原因。随着对RVO认知的加深,anti-VEGF成为继发于血管性视网膜疾病黄斑水肿的一线治疗方式。在1项大型多中心临床研究[8]中,应用anti-VEGF药物,可以观察到RVO-ME患者明显的视力改善以及黄斑水肿的消退。融合蛋白类anti-VEGF药物是anti-VEGF药物中的代表,包括阿柏西普和国内原研药物康柏西普。与单抗类药物相比融合蛋白类anti-VEGF药物具有更强的结合能力。而这2 类融合蛋白类anti-VEGF结构也有所不同,康柏西普引入结构域D4,可以改善三维结构,提高二聚体形成效率,从而提高康柏西普对VEGF的结合能力。同时康柏西普拥有Fc片段结构,能够稳定药物与靶向分子的二聚体,从而提高药物的作用周期[8]。本研究中,BRVO-ME患者在接受融合蛋白类anti-VEGF药物治疗后,无论阿柏西普和康柏西普,都能迅速改善患者视力状况与中心视网膜的解剖结构,但是并没有观察到哪种融合蛋白类anti-VEGF药物表现出明显的治疗优势。
BRVO-ME的发病机制非常复杂,目前关于BRVO-ME的产生机制主要有2 种[5-7]:一种为机械性,在RVO产生过程中,由于机械性的血管阻塞,产生了远大于正常水平的静脉压。有研究证明静脉阻塞时视网膜血管的静脉压高达正常水平的24倍[6]。在血管高压的作用下,血液成份的漏出,形成了水肿。另一种为炎症因素,在RVO的病理情况下,高水平的细胞因子的表达在BRVO患者ME的形成中起着至关重要的作用。有研究表明[7,9]炎症被认为是RVO机械损伤的第1个关键机制,包括VEGF在内的各类细胞因子上调可能是继发于这种炎症反应。VEGF被认为是作用最强的血管生长因子,在BRVO病理过程中,VEGF因子的过量表达介导了一系列炎症反应,增加血管通透性,产生了黄斑水肿[10]。同为VEGF家族成员之一的PIGF,也是重要的致病因素。近年来,有研究发现PIGF能刺激内皮细胞的增生、迁移,促进新生血管形成,介导炎性细胞浸润,并与VEGF协同作用,提高血管活性,与眼部病理性新生血管有密不可分的关系[11]。先前有研究报道,除VEGF外,白介素家族和MCP-1也参与了继发于RVO的ME的发病机制[12-15]。MCP-1通常在血管内皮细胞受损时大量分泌,是主要的炎症趋化因子。它由视网膜内皮细胞产生的,与视网膜低氧性损伤的白细胞淤滞有关,它也被证明具有促进血管生成的作用。有研究证明RVO患者房水中MCP-1含量明显高于正常眼,CRVO患者房水中MCP-1含量也观察到明显升高,并发现MCP-1 水平与BRVO视网膜缺血的发生有关[15]。目前,对于BRVO-ME的研究多集中在影像学的组织结构检测和功能检查,用药方式也多以解剖学结构为指导。药物应用于玻璃体腔后对于不同治疗时期各类细胞因子在眼内的具体变化情况缺乏详细的检测和分析对比。随着眼科微创取材技术的进步,越来越多的眼科学研究者也形成了眼内液检测的思维。相对于传统的影像学和功能学检查,眼内液检测可以以更加直接和精准地反应眼内微环境的变化为精准治疗提供可能。本研究是通过对比检测不同融合蛋白类anti-VEGF药物对于BRVO-ME患者房水各种细胞因子的变化,可以帮助我们更加精准地判断该类患者的疾病进程,以及融合蛋白类抗VEGF药物的实际治疗效果。本研究中,尽管2种药物分子结构不同,2种融合蛋白类药物均可有效地降低人体房水中各类血管生成因子及炎性因子的浓度,但2种药物对细胞因子的抑制作用差异无统计学意义。BRVO患者病情与CRVO患者相比较轻,疾病过程中患者房水中相关细胞因子分泌较少,因此无论哪种anti-VEGF药物均可以中和产生的相关细胞因子。本研究中2 种anti-VEGF药物无论从临床实际效果还是对细胞因子的作用上都有着良好的效果。
本研究通过前瞻性研究对比了阿柏西普和康柏西普这2 种不同融合蛋白类anti-VEGF药物对BRVO-ME患者治疗过程中房水细胞因子变化情况,证实了2类药物均可有效地抑制房水中血管生成因子VEGF和PIGF以及促炎因子MCP-1 和IL-6的浓度,但并没有体现出哪种药物更具有优越性。本研究也存在一定的局限性,首先没有区别不同阻塞部位的BRVO患者,再者因为房水容积的限制,未能检测更多的细胞因子样本,接下来将进一步扩大样本数量,对不同阻塞部位BRVO患者进行细化分类,增加检测指标,以期更加精准地了解BRVOME患者应用anti-VEGF药物后房水微环境的变化。
利益冲突申明本研究无任何利益冲突
作者贡献声明徐一帆:课题设计,收集数据,资料分析及解释,撰写论文,并根据编辑部意见进行修改。王瑞峰:负责课题设计,参与修改论文中关键性结果、结论。付政:负责参与收集数据,资料分析及统计学运算。唐文建:参与收集数据,并完成实验过程中手术操作
