常氧和低氧条件下肌肽对脑胶质瘤细胞增殖的作用及其机制
2023-06-25段荣清厉柳岑汤旗梅蕾沈耀
段荣清,厉柳岑,汤旗,梅蕾,沈耀
温州医科大学 检验医学院(生命科学学院),浙江 温州 325035
胶质瘤是常见的原发性颅内肿瘤之一,也是最具侵袭性和最致命的脑肿瘤,分为不同的级别和组织学亚型[1]。流行病学表明胶质瘤发生在各个年龄段,但以成年人多见,男性比女性更容易患病[2]。 目前,胶质瘤的治疗主要通过手术切除和辅助放化疗。胶质瘤肿瘤细胞向周围正常组织明显侵袭性和浸润增殖大大降低了治疗效果,导致患者预后恶化,5年病死率超过90%[3-5]。肌肽是一种天然存在的二肽,广泛分布在肌肉、大脑等可兴奋组织中,具有多种有益作用,包括抗氧化、抗糖化、离子螯合剂、伤口愈合促进剂和自由基清除剂[6]。研究[7]表明,肌肽具有抑制体内恶性细胞生长的潜力,被视为潜在的抗癌药物。为了明确肌肽对胶质瘤的抗肿瘤作用,本研究探讨了常氧和低氧条件下肌肽对人脑胶质瘤细胞增殖的影响及其潜在的分子机制,为胶质瘤的临床治疗提供新思路。
1 材料和方法
1.1 细胞培养人胶质瘤细胞系U251和U87分别购自中国典型培养物保藏中心和中国科学院细胞生物学研究所。DMEM购自美国Gibco公司;FBS购自澳洲CLARK公司;L-Glutamine(100×)和青霉素-链霉素(100×)购自上海碧云天生物技术有限公司。U251和U87细胞均在补充有10% FBS、1% L-谷氨酰胺和1%青霉素链霉素的DMEM中培养。用DMEM溶解肌肽并配置成500 mmol/L的溶液。细胞样本分为常氧组、常氧+肌肽组、低氧组、低氧+肌肽组。常氧和低氧组加入适量完全培养基后分别放入常氧培养箱(21% O2、5% CO2、37 ℃)和低氧培养箱(1% O2、5% CO2、 37 ℃)中继续培养。常氧+肌肽组和低氧+肌肽组根据实验所需肌肽浓度加入药物,然后加入适量完全培养基后分别放入常氧培养箱和低氧培养中继续培养。
1.2 试剂和仪器肌肽购自中国生工生物科技公司;MTT粉末购自上海碧云天生物技术有限公司;DMSO购自北京索莱宝科技有限公司。一抗试剂包括:c-Myc(1:1000,美国Abcam公司),L-型氨基酸转运蛋白1(L-type amino acid transporter 1, LAT1)(1:1000,美国Affinity公司),β-actin(1:1000,上海碧云天生物技术有限公司)。仪器主要包括酶标仪Varioskan flash(美国赛默飞公司)、流式细胞仪CytoFLEX(美国贝克曼公司)、超高效液相 Acquity UPLC H-Class/Acquity UPLC IClass(美国Waters公司)、高分辨质谱Xevo-G2-XS QTOF(美国Waters公司)、低温高速离心机(德国Eppendorf公司)、Milli-Qs超纯水仪(德国Merck Millipore公司)、二氧化碳恒温细胞培养箱(美国赛默飞公司)、Galaxy 170R CO2培养箱(美国Eppendorf公司)。
1.3 MTT实验将细胞以2×103的密度接种在96孔板中,然后用不同浓度的肌肽(25 mmol/L和 50 mmol/L)处理细胞72 h。接下来向每孔加入 100 μL 5 g/L MTT溶液,将板放置在37 ℃下孵育4 h,弃掉上清液后加100 μL DMSO溶液溶解甲臜结晶。最后使用酶联免疫吸附仪在570 nm处测量每个样品的吸光度。MTT实验表明,与25 mmol/L相比, 50 mmol/L肌肽处理后细胞活力变化更显著,细胞状态还可以,可以进行后续实验,实验结果也更明显,所以确定用50 mmol/L肌肽进行研究。
1.4 克隆形成实验将细胞以每孔300个的密度接种于6孔板中,待贴壁后用50 mmol/L肌肽处理细胞。每隔3~4 d换1次液,连续培养至形成肉眼可见的克隆团。用PBS洗涤后,4%多聚甲醛固定,0.5%结晶紫溶液染色样品后计数克隆团。
1.5 Annexin/PI凋亡实验将约6×105个细胞接种到培养皿中,用50 mmol/L肌肽处理72 h,然后按照试剂盒手册方案KGA-108(南京凯基生物科技公司)通过流式细胞术观察和检测胶质瘤细胞的凋亡情况。
1.6 非靶向代谢组学用肌肽处理U251细胞72 h后,0.25%胰酶消化,离心收集细胞。PBS洗涤细胞3次后,离心去除上清液。样品液氮急剧冷冻后迅速转入-80 ℃保存,收集常氧组、常氧+肌肽组共12个样本送至杭州联川生物技术有限公司进行分析。
1.7 LC-MS法检测蛋氨酸水平变化用有机试剂提取代谢样品,然后从每个样品中吸取20 μL混合制成QC样品。使用孔径为0.22 μm PTFE膜过滤上清液,然后装入2 mL琥珀色色谱瓶中(带250 μL内套管),拧紧盖子,排出内套管中的气泡。Acquity UPLC H级/Acquity UPLC I-Class超高效液相色谱仪配备了QSM四元系统和BSM二元系统,FTN自动进样器,在线脱气器。设置以下所有参数,T3柱温为40 ℃,酰胺柱温为45 ℃,进样盘温度为10 ℃,进样体积为5 μL。
1.8 蛋白质印迹(Western blot)法将肌肽处理细胞72 h(课题组前期研究选择了24、48、72 h 3个处理时间,发现作用72 h既能显著抑制细胞增殖,也不会过度损伤而影响后续各项检测)后提取总蛋白,通过BCA方法测定蛋白质浓度,根据标准程序进行Western blot。使用聚丙烯酰胺凝胶分离蛋白质样品,然后转移到PVDF膜上。膜在5%脱脂牛奶中缓慢摇动2 h,一抗中4 ℃孵育过夜,在二抗山羊抗兔抗体(1:1000,上海碧云天生物技术有限公司)孵育1 h。最后使用化学发光试剂BeyoECL Plus(上海碧云天生物技术有限公司)和凝胶成像分析仪(美国Bio-Rad公司)曝光条带。
1.9 实时荧光定量PCR将2×104个细胞/孔接种到6孔板中,用肌肽处理72 h后提取总RNA。接下来采用Nanodrop仪器(Nanodrop 2000 Technologies) 检测RNA浓度。使用合成cDNA HiScript II Q RT SuperMix进行反转录。荧光定量PCR在CFX96荧光定量PCR仪器(美国Bio-Rad公司)中进行。所用引物的序列如下:c-Myc上游引物5’-GTCAAGAGGCGAAC ACACAAC-3’,下游引物5’-TTGGACGGACAGGATAT-3’;LAT1上游引物5’-ATATCACGCTGCTCAACGGTG-3’,下游引物5’-CTCCAGCATGTAGGCGTAGTC-3’;GAPDH上游引物5’-CACCATGAAGATCAAGATCATTGC-3’,下游引物5’-GG CCGGACTCATCGTACTCCTGC-3’。
1.10 统计学处理方法采用Graphpad prism 8.0统计学软件对数据进行统计学分析。计量资料以±s表示。两组间的比较用t检验;多组间比较用单因素方差分析,组间两两比较用LSD-t法;多元统计分析采用主成分分析(principal component analysis, PCA)和偏最小二乘判别分析(partial least squares discriminant analysis, PLS-DA)。P<0.05为差异有统计学意义。
2 结果
2.1 肌肽对胶质瘤细胞增殖的影响在常氧和低氧条件下,用不同浓度的肌肽(25 mmol/L、 50 mmol/L)处理U251和U87细胞72 h后,U251、U87细胞常氧+肌肽组与常氧组比细胞活力显著下降,差异有统计学意义(均P<0.05);低氧+肌肽组与低氧组比,细胞活力也显著下降,差异有统计学意义(均P<0.05);并且肌肽浓度越高,对细胞增殖抑制作用越明显,差异有统计学意义(P<0.05),见图1。
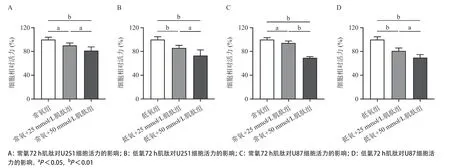
图1 肌肽对脑胶质瘤细胞细胞活力的影响
2.2 肌肽对脑胶质瘤细胞克隆形成能力的影响在常氧和低氧条件下,用50 mmol/L肌肽处理U251和U87细胞后,U251、U87细胞常氧+肌肽组与常氧组比克隆团数显著减少,差异有统计学意义(均P<0.01);低氧+肌肽组与低氧组比克隆团数也显著减少,差异有统计学意义(均P<0.01)。50 mmol/L 肌肽处理后,脑胶质瘤细胞的克隆形成能力明显受到抑制,见图2。
2.3 肌肽对脑胶质瘤细胞凋亡的影响在常氧和低氧条件下,用50 mmol/L肌肽处理U251细胞72 h后,常氧+肌肽组与常氧组比,凋亡细胞比例上升,差异有统计学意义(P<0.05);低氧+肌肽组与低氧组比,凋亡细胞比例也上升,差异有统计学意义(P<0.05)。见图3。这表明肌肽促进胶质瘤细胞的凋亡进程。
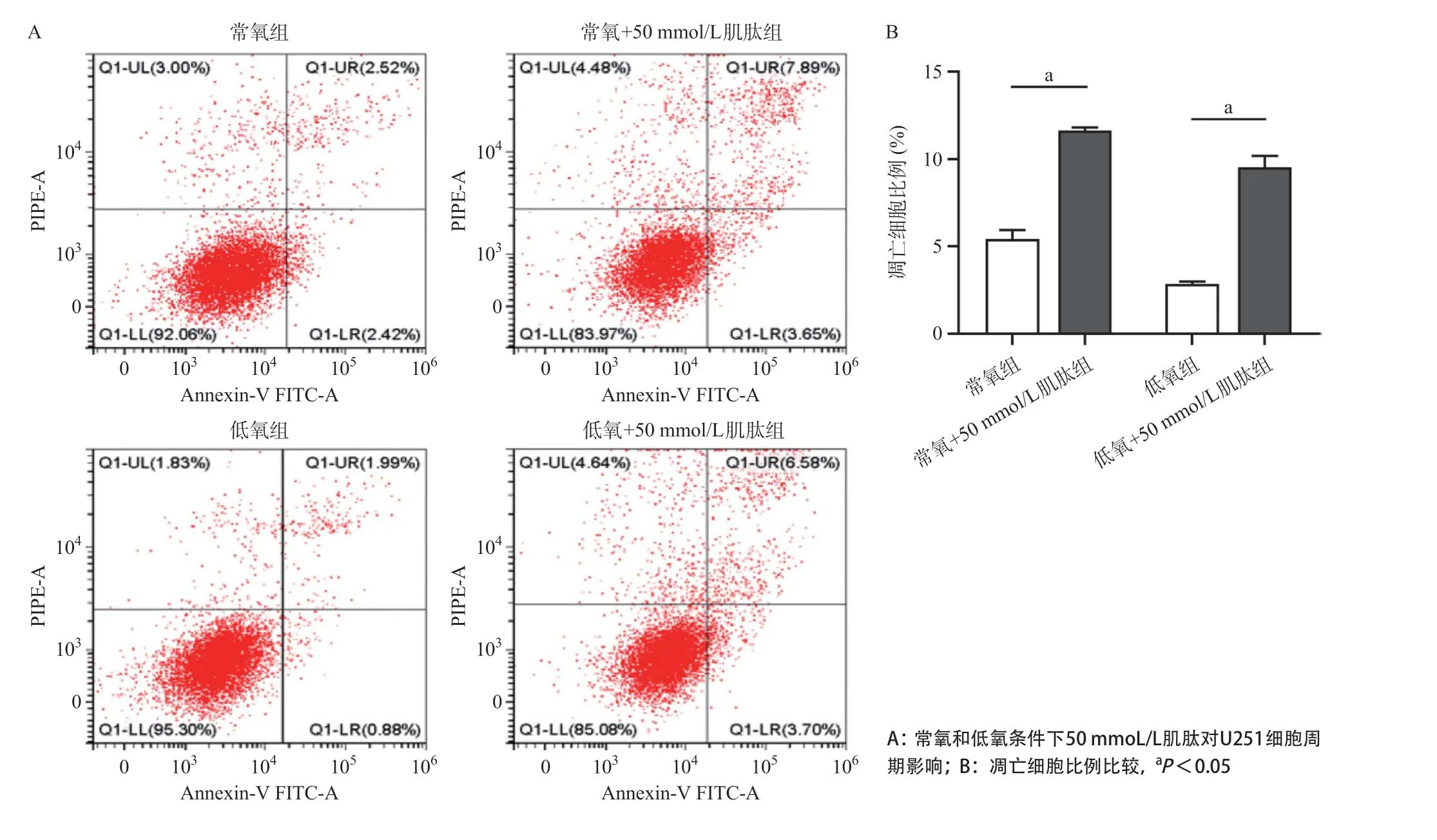
图3 肌肽对U251细胞凋亡的影响
2.4 肌肽对胶质瘤细胞代谢的影响PCA图显示常氧+肌肽组与常氧对照组分离趋势明显,见图4A;PLS-DA提示模型稳定可靠,可用于后续差异物的寻找与分析,见图4B。用火山图和热图表示差异分析结果,火山图和热图提示肌肽作用后代谢物存在显著性差异,见图4C、图4D。50 mmoL/L肌肽处理U251细胞72 h后,常氧+肌肽组与常氧组比,部分代谢物含量发生变化,赖氨酸、蛋氨酸、精氨酸、鞘氨醇、烟酰胺单核苷酸的含量下调,差异有统计学意义(P<0.05),见图4E。
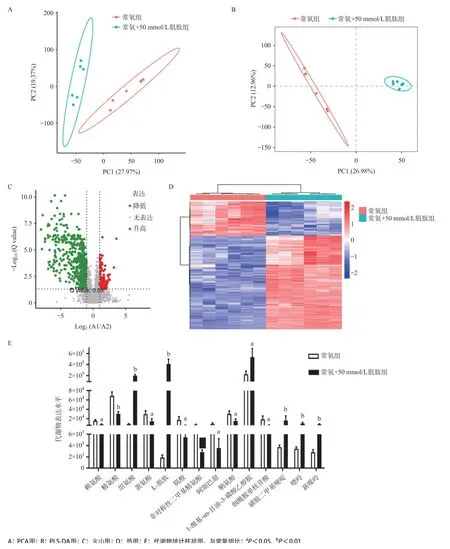
图4 肌肽对胶质瘤细胞代谢的影响
2.5 肌肽对脑胶质瘤细胞蛋氨酸水平的影响在常氧条件下,用50 mmol/L肌肽处理U251细胞72 h后,常氧+肌肽组与常氧组比蛋氨酸含量显著下降,差异有统计学意义(P<0.05),见图5。
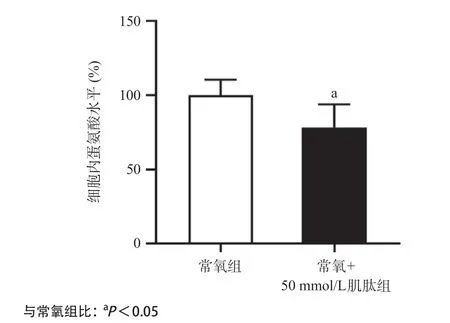
图5 肌肽对U251细胞蛋氨酸水平的影响
2.6 肌肽对脑胶质瘤细胞c-Myc表达的影响与常氧组或低氧组比,常氧+肌肽组和低氧+肌肽组的c-Myc蛋白和mRNA的表达水平下调,差异有统计学意义(P<0.05),表明肌肽从转录水平上影响c-Myc的表达,见图6。
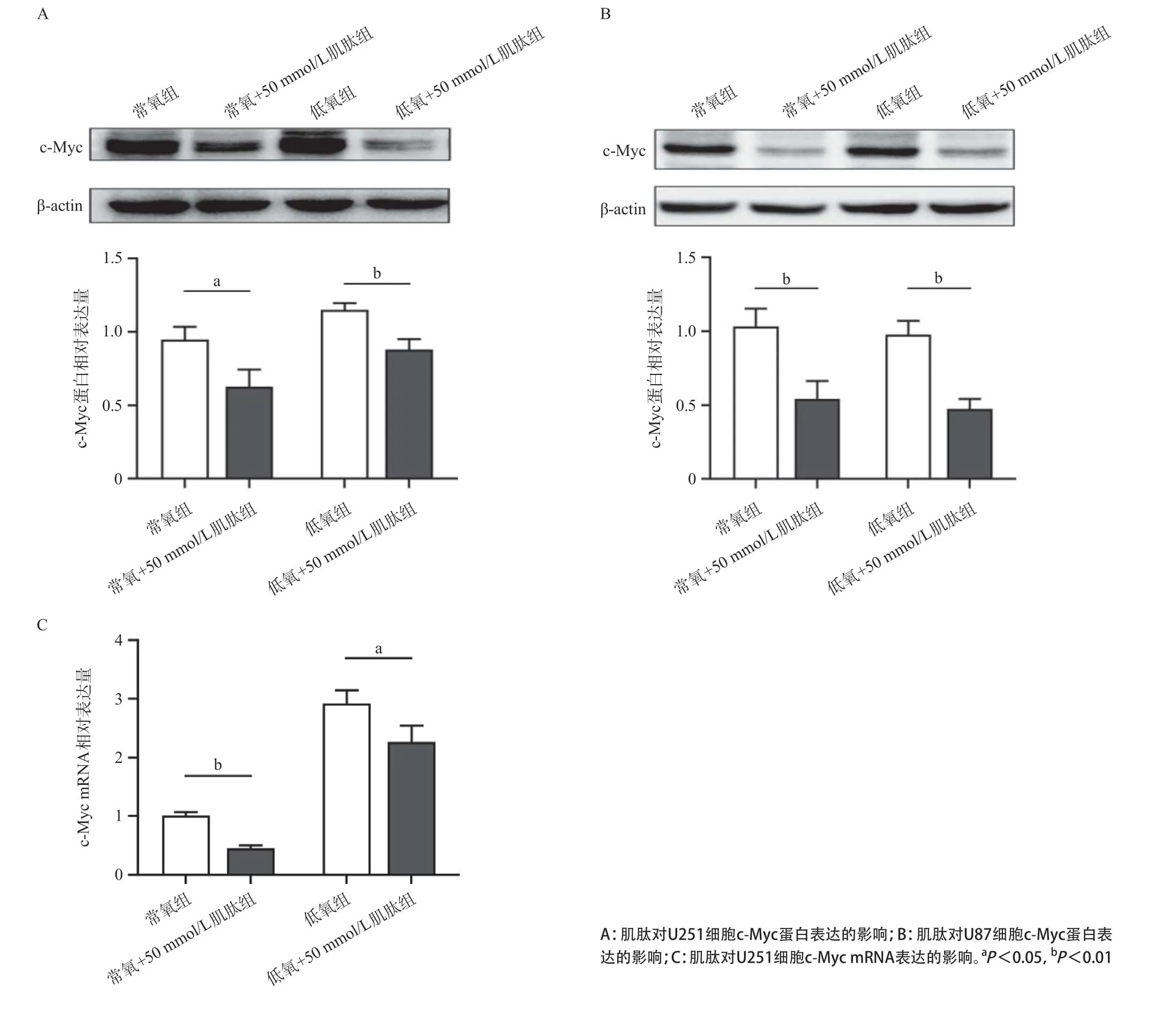
图6 肌肽对胶质瘤细胞c-Myc表达的影响
2.7 肌肽对脑胶质瘤细胞LAT1表达的影响与常氧组或低氧组比,肌肽处理组下调了U251细胞LAT1蛋白和mRNA的表达水平,差异有统计学意义(P<0.05);但肌肽对U87细胞LAT1蛋白的表达无影响(P>0.05),见图7。
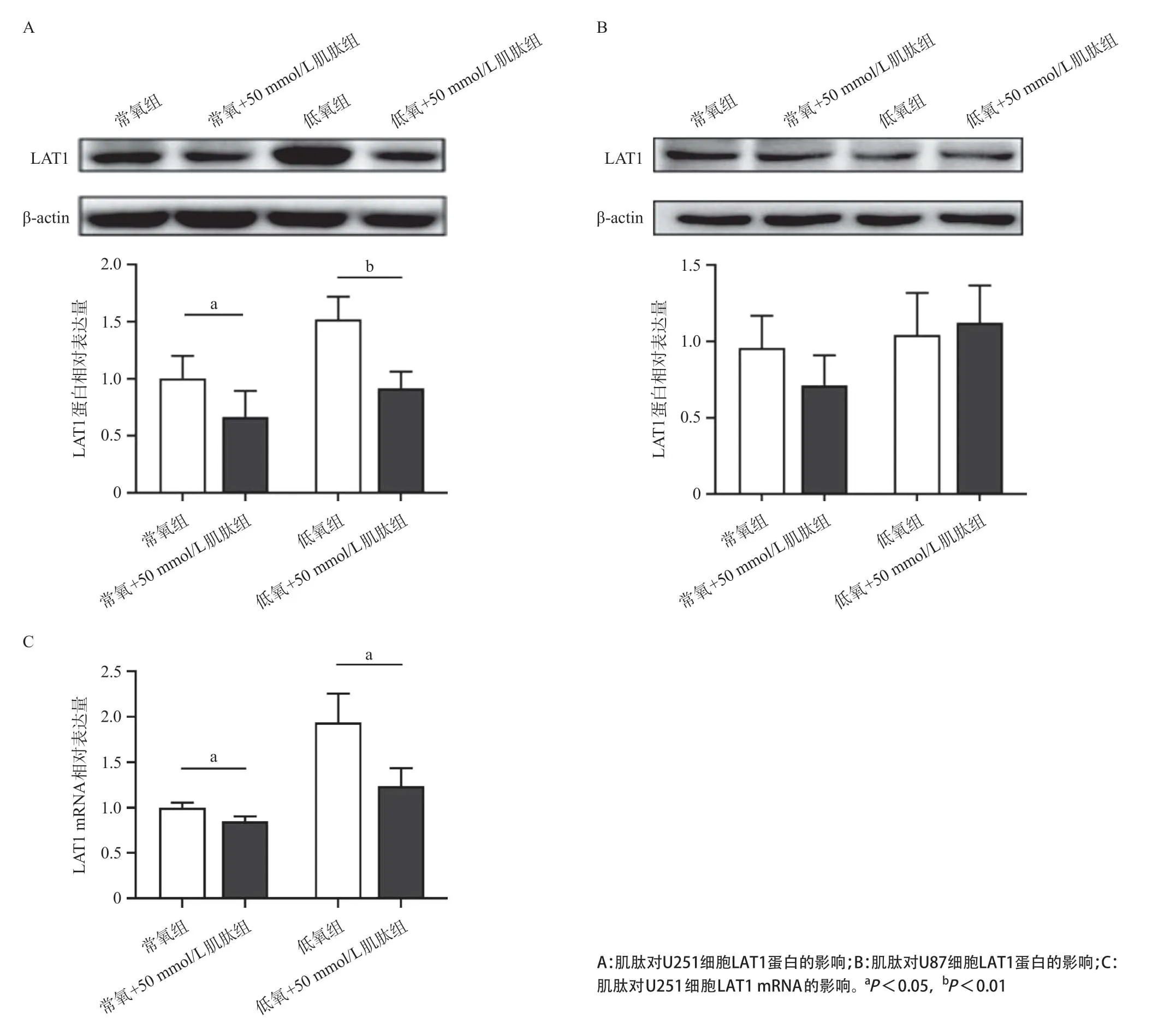
图7 肌肽对胶质瘤细胞LAT1表达的影响
3 讨论
胶质瘤是一种中枢神经系统脑肿瘤疾病,起源于神经胶质细胞的病变,其主要特征是广泛的浸润性生长和新生血管形成[8]。目前胶质瘤的治疗成功率和总生存率仍较低,临床上治疗胶质瘤具有一定的挑战性[9],因此积极寻求新的治疗策略和药物对改善胶质瘤患者的预后变得尤为重要。
近年来,肌肽的广谱抗癌作用引起了研究人员的关注[10]。越来越多的研究表明,肌肽具有抑制体内恶性细胞生长的潜力。相关文献报道,肌肽能够抑制肿瘤细胞的增殖,增强肿瘤细胞周期阻滞,诱导肿瘤细胞凋亡,抑制肿瘤细胞糖酵解[7,11]。因此,肌肽被认为可能是治疗恶性胶质瘤或其他肿瘤的潜在药物[12]。
本研究探索了常氧和低氧条件下肌肽对脑胶质瘤细胞增殖的影响及潜在分子机制。研究发现不同浓度肌肽作用后,不论是常氧还是低氧状态,胶质瘤细胞活力受到明显抑制,具有一定的浓度依赖性。这提示肌肽可能同时作用于线粒体氧化代谢途径和糖酵解途径从而发挥抑制胶质瘤细胞增殖的潜能。肌肽还抑制胶质瘤细胞的克隆形成能力。细胞凋亡指的是为了维持内环境稳定,由基因控制的细胞自主的程序性死亡。凋亡进程的改变是肿瘤发生发展的重要变化之一[13],研究表明肌肽促进胶质瘤细胞的凋亡,进而起到抗肿瘤作用。
过去十年中,在癌细胞代谢领域的研究揭示了代谢改变与癌症进展之间的联系[14]。为了探索肌肽作用后胶质瘤细胞的代谢变化情况,进行了非靶向代谢组学分析。研究发现肌肽导致胶质瘤细胞的氨基酸水平发生变化,部分必需氨基酸包括蛋氨酸、精氨酸、赖氨酸的含量下调。WANDERS等[15]研究证明限制蛋氨酸可以选择性地抑制癌细胞生长。此外,LC-MS实验也表明肌肽使胶质瘤细胞蛋氨酸含量下调,这与代谢组学结果一致。丰富的氨基酸供应对于癌症维持其增殖驱动力很重要[16]。这些结果均提示肌肽可能通过影响胶质瘤细胞的氨基酸代谢从而抑制细胞增殖来发挥抗癌作用。
c-Myc是一种重要的转录因子,在大多数人类肿瘤中表达上调,可调控全局基因表达并协调多种生理过程,包括细胞增殖,细胞分化,细胞周期,代谢和凋亡等[17]。本研究发现肌肽能够下调胶质瘤细胞c-Myc蛋白的表达,进而起到抗癌作用。高度增殖的癌细胞对氨基酸的需求增加,需要选择性上调氨基酸转运蛋白,其受转录途径的调节[18]。LAT1运输包含部分必需氨基酸在内的大的中性氨基酸,在介导氨基酸摄取中起重要作用,从而调节细胞生长、增殖以及其他细胞功能[19]。肌肽作用后,胶质瘤细胞的LAT1表达下调,限制了部分氨基酸的转运,从而影响了细胞的氨基酸代谢并产生增殖抑制作用。综上所述,本研究发现肌肽能显著抑制胶质瘤细胞的增殖,且常氧和低氧条件下的增殖抑制作用没有显著差异,这种抑制作用可能与c-Myc/LAT1轴相关。肌肽影响胶质瘤细胞的氨基酸代谢,进而限制肿瘤细胞的增殖来发挥抗癌作用。
