CT引导下125I粒子植入术联合化疗治疗结直肠癌肺转移瘤的临床疗效和预后因素分析
2023-06-25李燕珺陈敏江涂建飞潘艺影王君禾纪建松
李燕珺,陈敏江,涂建飞,潘艺影,王君禾,纪建松
温州医科大学附属第五医院 放射科 浙江省影像诊断与介入微创研究重点实验室,浙江 丽水 323000
结直肠癌(colorectal cancer, CRC)是最常见的消化系统恶性肿瘤,其发病率占所有癌症的10.2%,是癌症死亡的第二常见的病因[1]。疾病向远处器官的播散被认为是引起CRC患者死亡的主要原因[2-3],约20%的CRC患者在确诊时发现转移灶[4],其中肺转移灶占10%~15%[5-6],是CRC第二常见的转移部位,仅次于肝脏,同时也是腹膜外最常见的转移部位[7]。肺转移常提示患者病情已到了晚期[8],预后差,总生存期(overall survival, OS)短[9]。针对发生肺转移的肿瘤患者,及时有效地延缓并终止转移灶进程将明显提升患者的生存期。
近年来,随着新的化学药物的开发以及新的治疗方式的产生,临床上治疗肺转移瘤的方法逐步增多,治疗方法大体包括全身系统药物治疗以及局部治疗。由于肺转移瘤的数量、位置、大小、肺外转移以及基因分型等多种因素均影响预后及治疗决策,因此需要在多学科的会诊讨论下,根据患者病情,制定不同的治疗方案。
目前,对于可切除的CRC肺转移瘤,R0手术切除仍是主要治疗手段[10],但由于多数患者发现转移时已处于晚期,患者心肺功能差,难以耐受手术,能手术的患者仅有20%~30%。研究[3]表明,对于可切除的CRC肺转移瘤,术后辅助化疗可以提高患者生存率,与单纯手术相比,接受辅助化疗的患者无病生存期更长,但仍有部分肺转移灶对化疗不敏感,因此需要联合局部损毁治疗控制病灶进展。
新兴技术的产生为不可切除的CRC肺转移患者提供了新的治疗方案。其中内放射治疗是一种常用的治疗手段,且具有精准治疗的优势,靶病灶剂量大,且放射性在短距离内迅速衰减,对周围肺组织影响小,从而达到最大限度地消灭癌组织和保护正常组织的作用[11]。目前,临床上常用的内放射治疗为125I放射性粒子植入术,疗效肯定[12],但针对肺转移瘤治疗相关报道较少且缺乏长期疗效的数据。基于此,本研究对125I放射性粒子联合化疗治疗CRC肺转移瘤的安全性、有效性及影响预后的危险因素进行探讨,旨在为CRC肺转移患者的临床治疗方案的制定提供参考依据。
1 对象和方法
1.1 研究对象连续性选取2016年1月1日至2020年12月31日于温州医科大学附属第五医院介入诊疗中心治疗的97例CRC肺转移患者,根据临床诊疗指标及患者意愿分为经皮穿刺植入125I粒子并联合化疗治疗患者(联合治疗组)43例,常规化疗治疗的患者(对照组)54例。在入组的患者中,男58例,女 39例;年龄62(57,70)岁。无瘤间期(disease-free interval, DFI)定义为诊断原发肿瘤到确诊肺转移瘤的时间,以12个月为界限,分为≤12个月组和>12个月组;体力状态评分采用美国东部肿瘤协作组织(Easten Cooprative Oncology Group, ECOG)制定的体力状态评分5分法。纳入标准:①电子肠镜下病理活检为CRC,且经影像学检查及临床表现确诊为肺转移,多学科会诊后一致认为无外科手术指征;②根据改良后实体瘤疗效评价标准(modified response evalution criteria in solid tumors,mRECIST)评估肺内至少具有一个可测量的肿瘤病灶;③诊断肺转移瘤期间使用相同的化疗方案;④无125I放射性粒子植入治疗及化疗的禁忌证;⑤具有125I放射性粒子植入治疗及化疗的完整记录。排除标准:①原发灶不明确的患者;②有出凝血功能障碍且难以纠正的患者;③有心、肝、脑、肾等重要脏器严重病变的患者;④临床资料不完整的患者。所有入组患者及家属均同意接受125I放射性粒子植入及化疗的治疗,并签署知情同意书。本研究经本院伦理委员会批准。
1.2 仪器设备德国Siemens公司Somaris/7 svngo VA62A CT;北京启麟科技有限公司提供的放射治疗计划系统(treatment planning system, TPS),产品型号为Prowess panther V4.72;天津赛德生物制药有限公司提供的125I粒子,能量为27~35 keV、半衰期为59.4 d,放射性活度为14.8~29.6 MBq。
1.3 治疗方法对照组行单一XELOX化疗方案。具体如下:每个疗程第1天应用奥沙利铂130 mg/m2+ 5%葡萄糖注射液,静脉滴注,时间为2 h,第1~14天应用卡倍他滨1000 mg/m2,口服,2次/d,1个周期为21 d。所有患者给予利尿、水化、护肝等支持治疗。
联合治疗组行CT引导下125I粒子植入术,125I粒子植入术具体操作流程如下:术前宣教,签署知情同意书。患者术前完善相关检查及术前准备。术前行胸部CT增强扫描;将增强CT的影像上传至TPS系统,根据TPS系统确定125I放射性粒子植入的数量及靶区分布,于肿瘤周边匹配剂量(matched peripheral dose, MPD)即处方剂量,拟定为110~140 Gy;CT所示靶区为肿瘤靶区(gross tumer volume, GTV),GTV外扩1.0~1.5 cm定义为计划靶区(planning target volumn, PTV),要求PTV 90%体积达到处方剂量。根据患者肺内病灶的部位安排适当的体位,消毒铺巾,1%利多卡因麻醉,CT扫描定位选取穿刺点,按照TPS治疗计划布针、植入粒子,选用放射性活度为0.7 mCi的粒子,设计针道,各进针点间距为0.5 cm,手术完成后按压穿刺点20 min。操作完成后,将CT图像传入TPS系统进行验证,根据剂量体积直方图(dose volume histogram, DVH)得出PTV 90%体积的平均照射剂量即D90,验证粒子种植后剂量分布是否与治疗计划一致,剂量不足者立即或择期进行粒子补救手术,以保证PTV 90%体积达到处方剂量。术后1 d行XELOX方案化疗,化疗方案及疗程同对照组。
1.4 术后复查及疗效评估术后复查:术后1 d复查X线胸片检测肺部并发症情况。患者治疗期间每3个月复查血常规、肝肾功能、血清肿瘤标志物水平等实验室指标。粒子植入术后1年内每3个月复查胸部增强CT,以后每6个月复查,至末次随访停止。半年后通过病历提供的联系方式进行电话随访,随访期间记录内容包括患者血液指标、胸部CT影像、术后不良反应及术后恢复情况。以患者接受二线治疗开始为随访起点,截止于末次随访或死亡,本研究末次随访时间为2022年1月1日。
疗效评估:根据3个月后的胸部增强CT检查,选择对照组患者肺部最大转移灶以及联合治疗组患者粒子植入病灶作为靶病灶,参考修改后实体瘤疗效评价标准(modified response evalution criteria in solid tumors, mRECIST)评价近期疗效,分为四种情况:完全缓解(complete response,CR):所有目标病灶动脉期增强显影均消失;部分缓解(partial response, PR):目标病灶(动脉期增强显影)的直径总和缩小≥30%;病情稳定(stable disease, SD):缩小未达PR或增加未到病情进展(progressive disease, PD);PD:目标病灶(动脉期增强显影)的直径总和增加≥20%或出现新病灶。客观缓解率(objective response rate, ORR)为CR和PR之和在该组患者总例数所占百分比;疾病控制率(disease control rate, DCR)为CR、PR和SD之和在该组患者总例数所占百分比。远期疗效参考无进展生存期(progression free survival, PFS)和OS。PFS定义为从患者接受二线治疗开始至患者出现疾病进展的时间。OS定义为患者接受二线治疗开始至死亡的时间。同时根据病历、检验报告及影像检查记录术后的不良反应,采用不良事件通用术语标准(commom terminology criteria for adverse events, CTCAE)5.0版来评估两组患者不良反应发生情况,纳入评估的化疗后不良反应包括:白细胞减少、血小板减少、恶心呕吐、肝功能损伤及肾功能损伤,粒子植入术后不良反应包括:气胸、胸痛、出血、粒子游走及放射性肺炎。
1.5 统计学处理方法采用SPSS23.0软件进行分析。符合正态分布的计量资料以±s表示,2组间比较采用独立样本t检验;不符合正态分布的计量资料以M(P25,P75)表示,2组间比较采用Mann-WhitneyU检验。计数资料以例和率表示,2组间比较采用χ2检验。生存曲线的绘制采用Kaplan-Meier曲线,并采用Log-rank检验进行两组间中位PFS、OS比较。PFS、OS的影响因素分析采用Cox回归模型。P<0.05为差异有统计学意义。
2 结果
2.1 患者临床特征2组患者的个体特征及病理结果差异无统计学意义(P>0.05),见表1。

表1 入组患者的基线资料[例(%)]
2.2 粒子植入评价联合治疗组43例患者均成功实施粒子植入手术,共植入粒子942颗。9例患者于术后1个月内进行了粒子补救,40个病灶植入粒子数量与TPS计划分布一致,符合率为93.0%,3例患者因病灶与大血管及纵隔关系密切而未能按计划植入,术中根据医师经验选择合适的针道及角度进针。
2.3 临床疗效评估与预后分析
2.3.1 近期疗效评估:至末次随访时间,全部患者共随访3~87个月,中位随访时间为45个月。截至随访终点,共75例(77.3%)死亡,其中联合治疗组31例(72.1%),对照组44例(81.5%)。联合治疗组患者靶病灶ORR(72.1%vs.33.3%,χ2=14.387,P<0.001)、DCR(93.0%vs.75.9%,χ2=5.946,P=0.005)明显高于对照组,差异有统计学意义。
2.3.2 生存曲线:联合治疗组PFS中位数为13.0(7.0,16.0)月,对照组PFS中位数为7.0(4.0,12.0)月,两组总体PFS分布存在统计学差异(Z= 3.18,P=0.001)。联合治疗组OS中位数为20.0(14.0,40.0)月,对照组OS中位数为17.0(12.8,24.5)月,两组总体OS分布差异有统计学意义(Z=1.97,P= 0.049)。2组患者PFS、OS的Kaplan-Meier曲线见图1。

图1 2组患者PFS和OS的Kaplan-Meier曲线比较
2.3.3 肿瘤标志物水平:治疗前血清肿瘤标志物水平差异无统计学意义(P>0.05),治疗3个月后联合治疗组CA242低于治疗前,对照组CA19-9低于治疗前,治疗后联合治疗组CA19-9低于对照组,差异有统计学意义(P<0.05),见表2。

表2 两组患者治疗前后血清肿瘤标志物水平[M(P25,P75)]
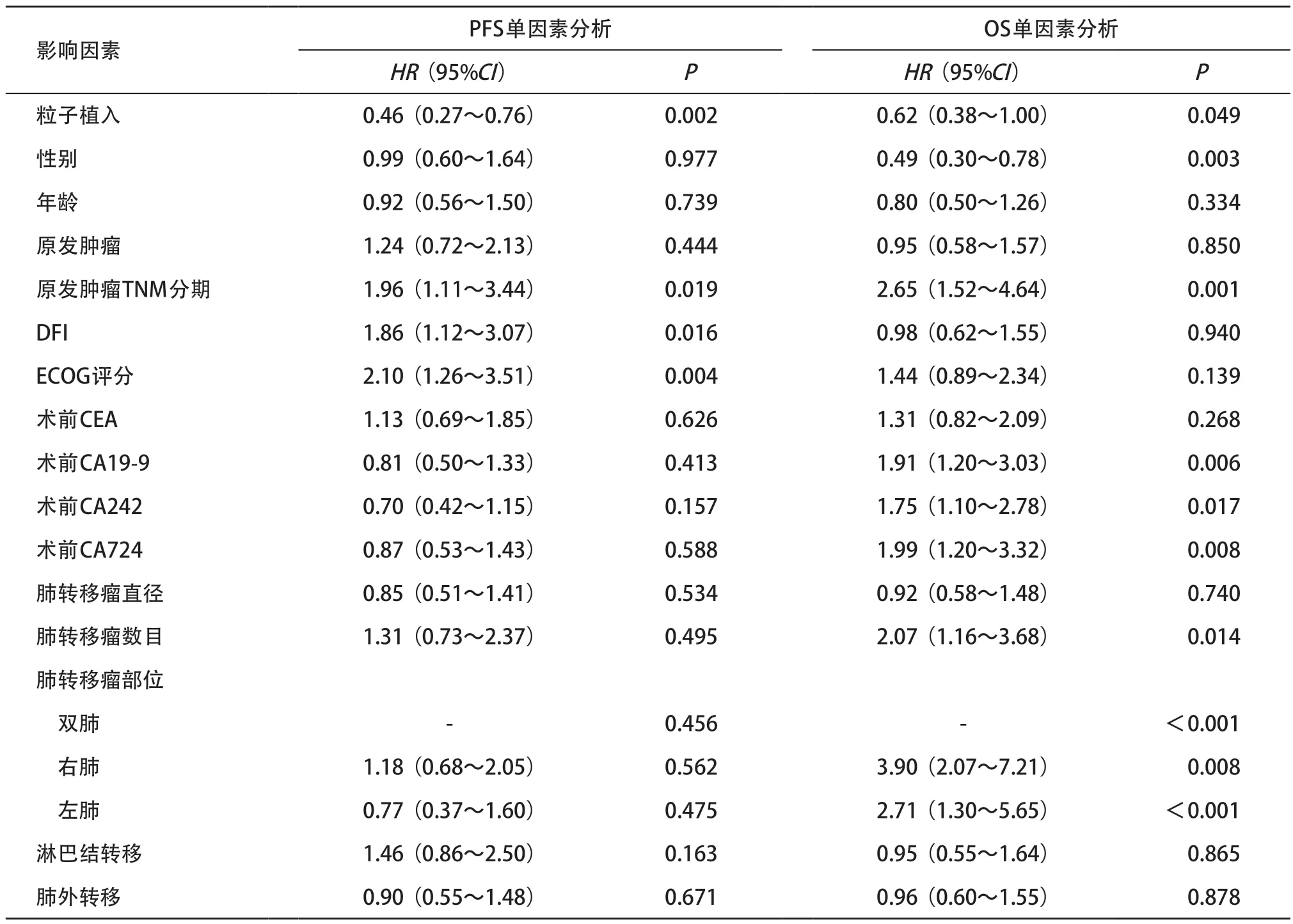
表3 97例CRC肺转移瘤患者PFS及OS单因素Cox回归分析结果

表4 97例CRC肺转移瘤患者PFS多因素Cox回归分析
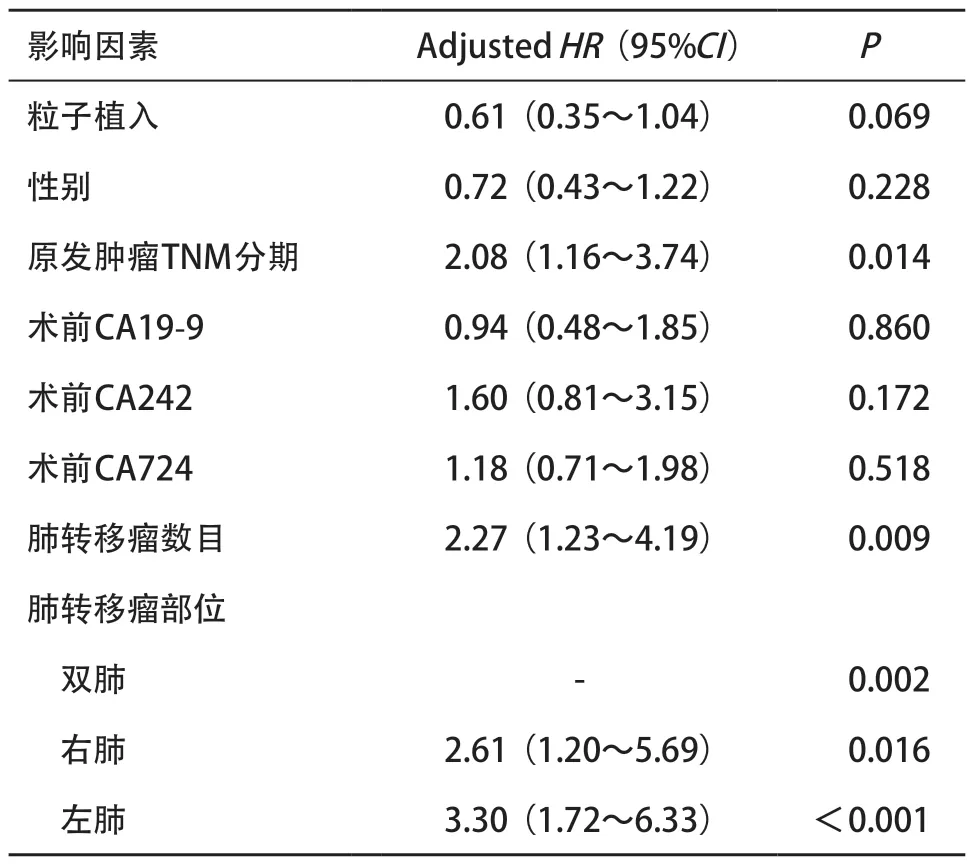
表5 97例CRC肺转移瘤患者OS多因素Cox回归分析
2.3.4 单因素及多因素分析:将性别、年龄、原发肿瘤类型、原发肿瘤TNM分期、DFI、ECOG评分、术前CEA、术前CA19-9、术前CA242、术前CA724、转移瘤直径、数目、部位、是否有淋巴结转移及肺外转移等基线特征纳入单因素和多因素分析,多因素分析显示粒子植入(HR=0.35,P<0.001)、原发肿瘤TNM分期(HR=2.59,P=0.002)、DFI(HR=1.71,P=0.040)以及患者ECOG评分(HR=2.18,P=0.004)与PFS有关,粒子植入术后、CRC早期患者、体力状态好以及DFI长的患者PFS更长;原发TNM分期(HR= 2.08,P=0.014)、肿瘤数目(HR=2.27,P=0.009)及肿瘤部位(HR=2.61,P=0.016;HR=3.30,P<0.001)与OS有关,CRC早期患者、肿瘤数目≤3个以及转移瘤发生部位为单肺的患者OS更长。见表3-5。
2.4 两组患者发生不良反应情况联合治疗组发生骨髓抑制、恶心呕吐、肝功能损害和肾功能损害的不良反应例数与对照组相比差异无统计学意义(P>0.05)。联合治疗组43例患者125I放射性粒子植入术中不良反应发生率为74.4%,最常见的不良反应为气胸,共23例(53.5%),其中2例采用胸腔闭式引流后好转,其余均采用保守治疗后自行吸收好转;术后出血患者中1例给予垂体后叶素好转,1例血凝块堵塞气管,气管插管后好转,其余均采用术区压迫治疗后好转;发热患者药物降温治疗后好转;胸痛患者给予止痛药后好转,粒子迁移及放射性肺炎患者均对症治疗后好转出院。所有不良反应均为轻度。见图2。
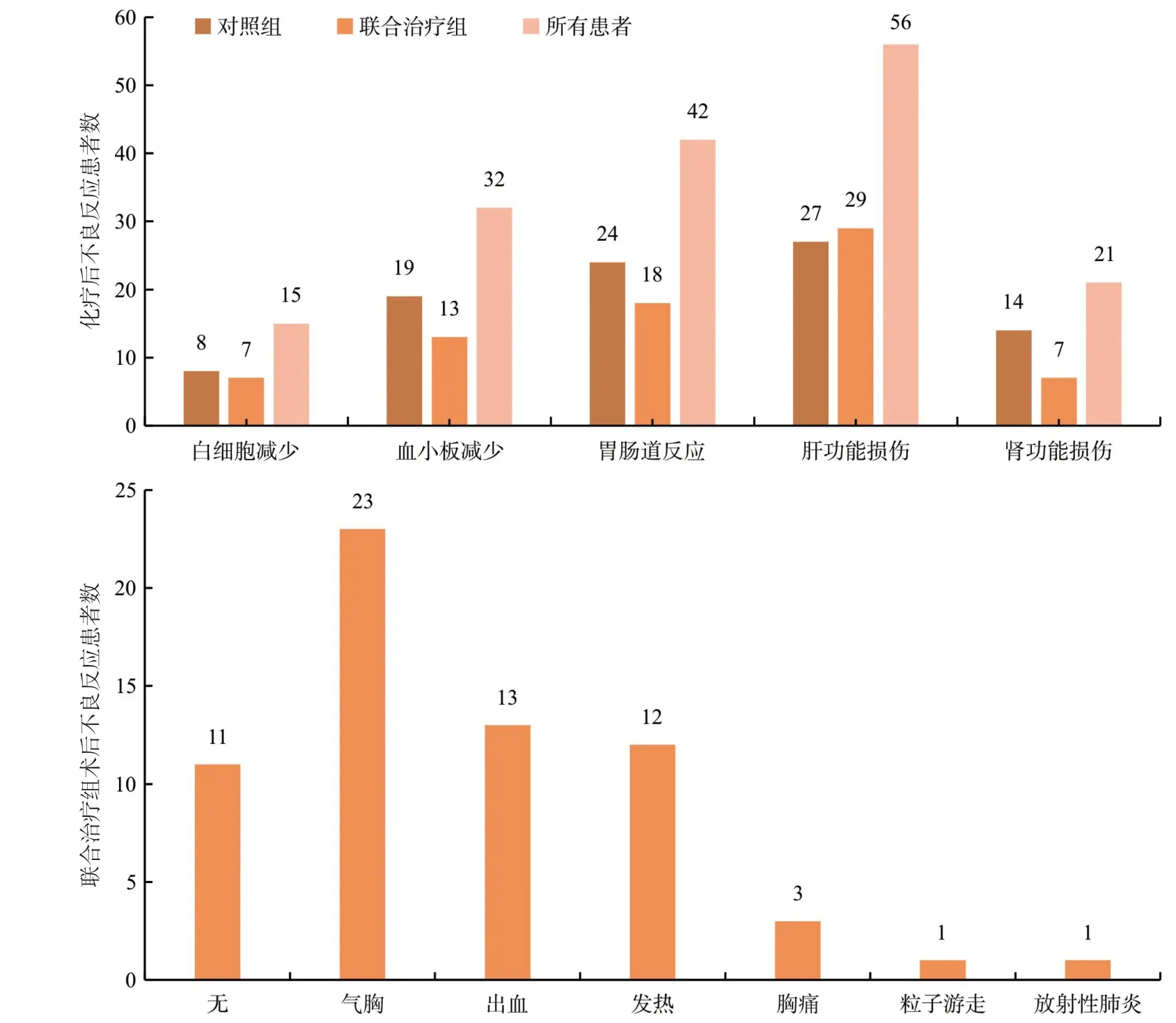
图2 两组患者化疗后的不良反应及联合治疗组患者CT引导下125I放射性粒子植入术后的不良反应
3 讨论
由于肺存在肺动脉和支气管动脉双重血供,并且其血流压力相对较低,使肺成为CRC远处转移第二常见靶器官[13]。大部分肺转移瘤的患者早期并无明显或特异性症状,直到肿瘤侵犯胸壁出现疼痛或病灶出血引起咯血才被发现,此时已经失去了最佳手术时机[13-14],因此放化疗为主的综合治疗是目前治疗晚期肺转移瘤的主要手段。化疗在肺转移瘤患者中应用广泛,但晚期患者身体条件差,且常合并肝、肾功能异常等,使化疗药物不能正常代谢,化疗疗效受限[15-16]。近年来,治疗肺转移瘤的方法越来越多,延长生存期,提高生存质量成了目前临床的热点问题。研究[17]表明,125I放射性粒子植入为控制局部病灶进展的有效方法,患者疼痛轻,恢复快,对复发或者多个病灶能进行多次手术,显著提升患者的生存时间和生命质量。然而,目前针对125I放射性粒子植入联用化疗在CRC肺转移瘤患者中的获益情况仍未知,相关研究较为缺乏。
放射性粒子植入术属于近距离放射治疗范畴,其中125I为常用的放射性粒子。125I的半衰期为 59.4 d,其释放能量的作用时间长达197 d[18],分析其是长期控制局部病灶,延长患者生存时间的原因。本研究表明联合治疗组靶病灶的ORR和DCR以及患者的PFS、OS明显高于对照组,分析联合治疗疗效优于单纯化疗的机制可能为:化疗是全身治疗,能杀灭增殖期细胞和肿瘤的非干细胞,125I粒子属于局部治疗,能无选择地杀灭靶病灶中所有的肿瘤细胞,两者联合应用能使各期各类肿瘤细胞凋亡,且化疗对循环中远处转移的肿瘤细胞有杀伤作用,粒子植入能有效地控制局部肿瘤的生长[19],降低肿瘤负荷,抑制病灶周围新生血管的形成[20],从而起到全身治疗的效果[21]。
多数文献支持的CRC肺转移预后影响因素主要为:DFI、转移瘤数目、转移瘤最大直径、转移瘤分布、术前CEA水平以及是否合并肺门及纵膈淋巴结转移,即DFI>12个月、单肺单发、最大直径<3 cm、 术前CEA<5 ng/mL和无淋巴结转移的患者具有较好的预后,但部分文献关于预后的结论并不一致[22]。 本研究通过多因素分析显示,原发肿瘤TNM分期、DFI以及ECOG评分与PFS有关,提示PFS与患者本身病情状况关系密切;原发肿瘤TNM分期、转移瘤数目及转移瘤部位与OS有关,提示患者OS与患者原发病情状况以及转移瘤进展情况关系密切。
一般来说,DFI越长,患者的预后越好,但是目前对DFI值的确定仍存在争议,大部分人采用的DFI值为12个月,本研究也采用了12个月为界,但SALAH等[23]认为DFI<36个月为影响预后的不良因素,而PARK等[3]使用约登指数计算出理想的DFI值为22个月。有研究[24-25]发现,单个肺转移患者的预后明显好于双肺多发患者,证实肺转移灶的数目及部位是影响患者预后的独立危险因素,本研究与此相符。LIZASA等[26]研究提示,肺转移瘤<3 cm患者的5年生存率为45.8%,≥3 cm患者的5年生存率为36.1%,但差异无统计学意义,本研究中肺转移瘤直径在预后上也并未显示出明显差异。多数研究对CEA数值的高低对CRC肺转移的预后影响基本达成统一,术前CEA<5 ng/mL的患者具有较好的预后,本研究与此不相符,这可能与患者的个体差异以及选择偏倚有关,各患者间血清肿瘤指标差异大,预测预后的准确性较低。有人认为肺门及纵隔淋巴结转移也是影响预后的重要因素,SCHWEIGER等[27]研究证实,当患者淋巴结活检呈阳性时,CRC患者生存率会下降10%~36%,但在CRC肺转移的切除术中,并没有预防性地进行淋巴结清扫术的共识。本研究中淋巴结转移并不是影响患者预后的重要因素,如果怀疑淋巴结转移,可应用PET-CT检查进行进一步治疗指导。入组患者化疗引起的不良反应差异没有统计学意义,说明在化疗的基础上增加125I粒子植入术并不会增加患者的不良反应。
本研究也仍存在一定的不足之处,作为回顾性单中心研究,纳入病例均为非手术患者,缺少手术治疗者进行对比,不可避免地存在病例选择偏倚,入组的病例数少,仍存在一定的局限性,根据患者病情进展,后续药物剂量有所调整,可能导致结论的科学性和有效性不足,有待进一步多中心、大样本、前瞻性的研究。
综上所述,125I放射性粒子植入联合化疗治疗CRC肺转移瘤有较好的临床疗效,优势在于全身治疗的同时,在局部控制病灶上疗效显著,可以达到减瘤的目的,不良反应少,患者恢复时间短,对于容易复发和新发转移的晚期患者可以短期多次手术达到控制疾病进展的效果,并且能延长患者的PFS和OS,是CRC和肝癌肺转移瘤患者一种较好的综合治疗手段。
