HPLC法测定盐酸莫西沙星有关物质
2023-06-11李彧车宝泉李珉孙毅坤
李彧?车宝泉?李珉?孙毅坤
摘要:目的 建立高效液相色谱法测定盐酸莫西沙星原料有关物质。方法 采用Inertsil Phenyl柱苯基键合硅胶(4.0 mm×250 mm,5 μm)色譜柱,以四丁基硫酸氢铵缓冲液-甲醇为流动相,梯度洗脱,流速1.3 mL/min,柱温50℃,检测波长293 nm。结果 盐酸莫西沙星与15个已知杂质A~O均能良好分离。6个厂家盐酸莫西沙星样品测定结果显示,已知杂质及其他最大单个杂质含量均小于0.05%,杂质总含量小于0.06%。结论 本方法灵敏、专属性强,准确度高,可用于盐酸莫西沙星原料药有关物质测定。
关键词:盐酸莫西沙星;高效液相色谱法;有关物质;质量控制
中图分类号:R917文献标志码:A
Abstract Objective To establish an HPLC method for method for the determination of the related substances in moxifloxacin hydrochloride. Methods The determination was performed on a phenyl column(4.0 mm×250 mm, 5 ?m). The mobile phase consisted of tetrabutyl ammonium bisulfate buffer solution and methanol with gradient elution. The flow rate was 1.3 mL/min, and the column temperature was maintained at 50℃,the detection wavelength was set at 293 nm. Results The resolutions between the peaks of moxifloxacin hydrochloride and fifteen known impurities(including impurities A~O)were good. The determination results of the six batches of moxifloxacin hydrochloride samples showed that the known impurities and the maximum single unknown impurity were less than 0.05%, and the total impurity was less than 0.06%. Conclusion The method is proved to be simple, accurate, and could be used for the determination of related substances in moxifloxacin hydrochloride.
Key words Moxifloxacin hydrochloride; HPLC; Related substances; Quality control
盐酸莫西沙星是德国拜耳医药保健品公司在1999年开发的第四代喹诺酮类广谱抗菌药,制剂商品名为“拜复乐”,于2001年在中国上市。与早期喹诺酮类抗菌药相比既有良好的抗菌活性,又增强了对厌氧菌、革兰阳性菌及非典型微生物如衣原体、支原体和军团菌的抗菌活性,是广谱抗菌药。盐酸莫西沙星的杀菌作用与其他喹诺酮类抗菌药一样,作用于抑制细菌DNA复制、转录、修复和重组所需的拓扑异构酶Ⅱ和拓扑异构酶Ⅳ。同时安全性也优于其他喹诺酮类药物,降低了耐药性,光毒性下降[1-2]。盐酸莫西沙星临床多用于呼吸系统疾病,如社区获得性肺炎[3]、肺结核[4]和慢性支气管炎[5]。国内已批准上市的制剂有片剂、注射剂和滴眼液。
盐酸莫西沙星主要有两种合成途径[6],一种是以7-氟莫西沙星喹啉羧酸(即杂质I)为起始产物,另一种是以7-氟莫西沙星喹啉羧酸乙酯(即杂质J)为起始产物(图1)。目前,USP、BP及EP收载的盐酸莫西沙星原料药有关物质检测方法,均采用等度洗脱法,将工艺杂质A、B、C、D、E作为特定杂质分别予以控制。USP还收载有片剂和滴眼液标准;片剂有关物质检测方法与原料相同,仅控制了工艺杂质(杂质A~E),缺少对降解杂质的控制;滴眼液标准则采用两个不同的液相系统,控制工艺杂质和四个降解杂质。莫西沙星在氧化及光照条件下易降解形成多种降解杂质。据相关文献报道[7],虽有采用梯度洗脱法分析盐酸莫西沙星有关物质,但相比USP、BP等收载杂质仅增加了杂质F和杂质G,缺乏其他已知杂质研究,有关物质检测准确度低。本文在杂质A~E的基础上增加杂质F~O(图2),建立了既可检测工艺杂质,同时又可检测降解杂质,能更高效地控制盐酸莫西沙星原料及其制剂有关物质的高效液相色谱系统。
1 仪器与试药
1.1 仪器
岛津LC-20AT高效液相色谱仪、Waters e2695高效液相色谱仪,DIONEX UltiMate 3000高效液相色谱仪;Mettler XS205型天平。
1.2 试药
盐酸莫西沙星原料药,共6个厂家001~006,每个厂家3个批号。对照品:盐酸莫西沙星(批号:50140-202003)、杂质A(批号:510074-212102)、杂质B(批号:510075-201401)、杂质C(批号:510076-202102)、杂质D(批号:510190-202102)、杂质E(批号:510077-201901)、杂质F(批号:510186-201901)、杂质G(批号:510185-202001)、杂质H(批号:510188-202001)、杂质I(批号:510189-202001)、杂质J(批号:510191-202001),以上均为中检院对照品;杂质K(批号:17-JUN-21-25)、杂质L(批号12-JUN-19-76:)、杂质M(批号:16-OCT-21-66)、杂质N(批号:15-MAR-21-70)、杂质O(批号:21-JUN-21-44),以上均购自北京金百环科技有限公司。
甲醇为色谱纯,购自Merck公司;水为超纯水;其他试剂均为分析纯。
2 方法
2.1 色谱条件
采用苯基键合硅胶色谱柱(Inertsil Phenyl,4.0 mm×
250 mm,5 μm);流动相A(取四丁基硫酸氢铵1.5 g、磷酸二氢钾1.0 g,磷酸2 mL,加水1000 mL使溶解,三乙胺调节pH值至2.5±0.1)-流动相B(甲醇),梯度洗脱(表1);流速1.3 mL/min,检测波长293 nm,柱温50℃,进样体积20 μL。
2.2 溶液配制
供试品溶液制备:取盐酸莫西沙星适量,精密称定,加流动相A溶解并稀释成含约0.1 mg/mL的溶液。
对照品溶液制备:取盐酸莫西沙星对照品适量,精密称定,加流动相A溶解并稀释成每1 mL中含约0.1 μg的溶液。
杂质储备液制备:分别取杂质A、B、C、D、E、F、G、H、I、J、K、L、M、N和O适量,精密称定,加甲醇适量,溶解并稀释成含约0.1 mg/mL的溶液。
系統适用性溶液制备:取盐酸莫西沙星对照品与杂质储备液适量,加流动相A溶解并稀释制成约0.1 mg/mL的溶液、杂质各1 μg的溶液。
灵敏度溶液制备:精密量取对照品溶液适量,用流动相A溶解并稀释成约0.05 μg/mL的溶液。
2.3 强制降解试验
未破坏:取盐酸莫西沙星原料药约25 mg,置25 mL量瓶中,加流动相A溶解并稀释至刻度,摇匀,即得。
酸降解:取盐酸莫西沙星原料药约25 mg,置于25 mL量瓶中,加1 mol/L盐酸1 mL,置80 ℃水浴中放置24 h,放置至室温后,加1 mol/L氢氧化钠
1 mL,加流动相A稀释至刻度,摇匀,即得。
碱降解:取盐酸莫西沙星原料药约25 mg,置于25 mL量瓶中,加1 mol/L氢氧化钠1 mL,置80℃水浴中放置24 h,放置至室温后,加1 mol/L盐酸
1 mL,加流动相A稀释至刻度,摇匀,即得。
氧化降解:取盐酸莫西沙星原料药约25 mg,置于25 mL量瓶中,加30%过氧化氢1 mL,常温放置
24 h,加流动相A稀释至刻度,摇匀,即得。
高温降解:取盐酸莫西沙星原料药约25 mg,置于25 mL量瓶中,于105℃下放置24 h,放置至室温后,加1 mol/L盐酸1 mL,加流动相A稀释至刻度,摇匀,即得。
紫外光降解:取盐酸莫西沙星原料药约25mg,置于25 mL量瓶中,加水1 mL,于254 nm、365 nm光照条件下放置48 h,加流动相A稀释至刻度,摇匀,即得。
2.4 有关物质测定
系统适用性要求:系统适用性溶液色谱图(图3)中各峰分离度均大于1.5,灵敏度溶液色谱图中,莫西沙星峰峰高的信噪比应大于10。
测定方法:精密量取供试品溶液和对照品溶液各20 μL,分别注入液相色谱仪,记录色谱图。供试品溶液中如有杂峰,按加校正因子的主成分外标法计算其含量。
3 结果
3.1 色谱方法建立
USP盐酸莫西沙星原料药中收载有关物质方法为等度洗脱,无法有效分离诸降解杂质;在USP盐酸莫西沙星滴眼液有关物质梯度洗脱方法的基础上,改变四丁基硫酸氢铵浓度、pH值进行优化。此系统中,杂质K与杂质D和杂质E为难分离杂质,以此为优化对象,得到理想分离结果(图3)。
在优化过程中,增加四丁基硫酸氢铵浓度可有效增加分离度, 而流动相pH对其影响不明显。色谱柱对分离亦影响显著,采用ZORBAX Eclipse XDB-Phenyl、Waters XBridge Shield RP18苯基柱,杂质K完全包含在杂质D中,且杂质C和杂质D分离度仅有0.93;采用Inertsil Phenyl苯基柱,各峰最小分离度大于1.5,且采用不同批号(批号:SH5-6313、SH5-5823)色谱柱均可得到相同结果,故选定Inertsil Phenyl苯基柱作为分析色谱柱。
3.2 方法学考察
吸取“2.2”项下系统适用性溶液20 μL,记录色谱图(图3),各杂质分离良好。
3.2.1 专属性考察
吸取上述6种强制降解溶液各20 μL,分别注入液相色谱仪,记录色谱图。可见,本品对酸、碱、氧化、光照不稳定,高温较稳定(图4)。
各强制降解产生的杂质均与主成分莫西沙星峰分离度良好,证明该系统色谱测定盐酸莫西沙星有关物质专属性强;采用二极管列阵检测器(PDA)对强制降解色谱图主峰与各杂质峰检测,各色谱峰纯度指数均大于0.99(纯度阈值均大于纯度角度),说明主成分峰与各杂质峰均为单一峰,不包含其他杂质。同时,在该系统色谱条件下,主成分峰与强制降解杂质均在293 nm下有最大吸收,因此采用293 nm为检测波长为最检测波长。
3.2.2 线性关系考察
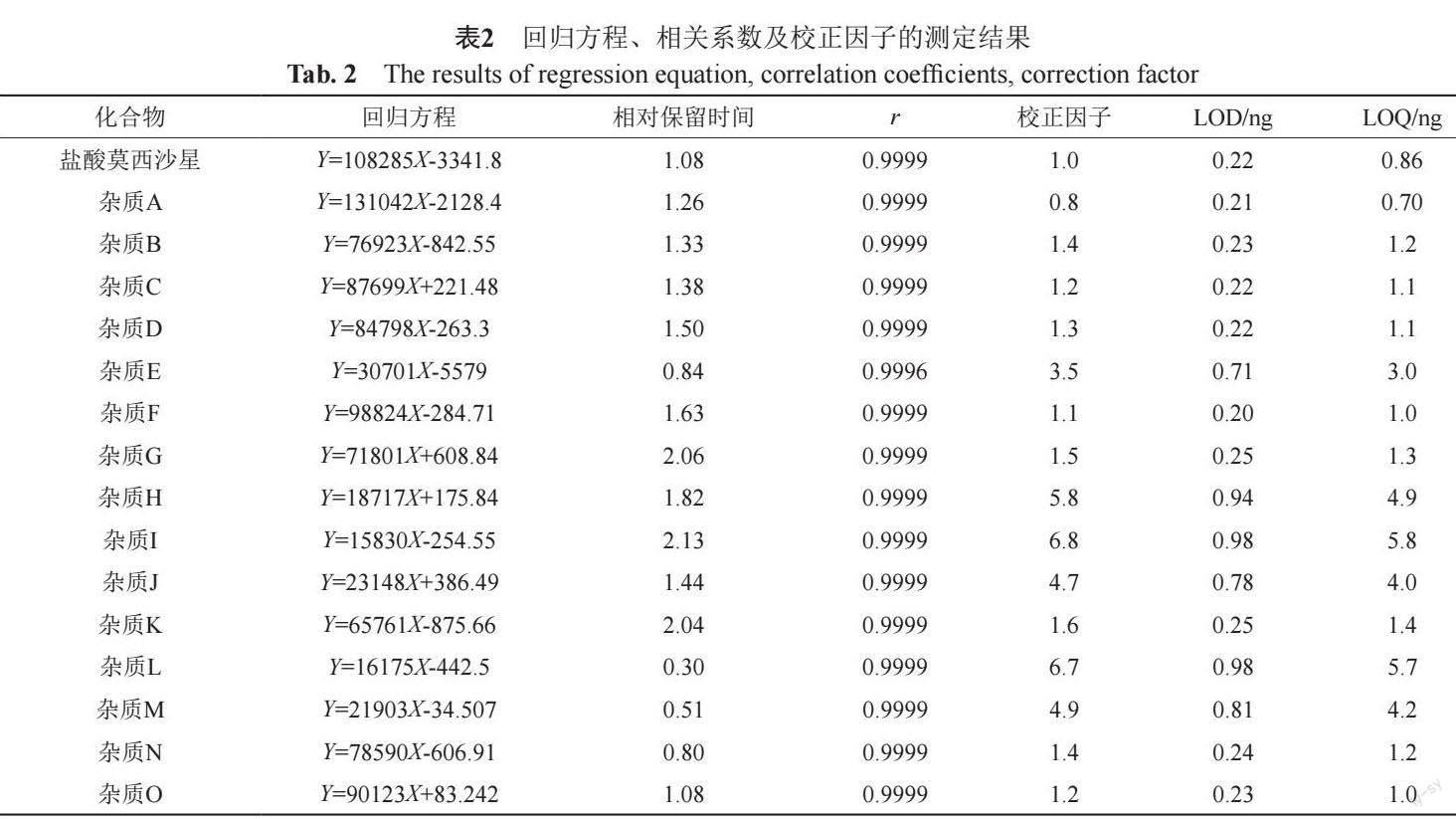
精密称取盐酸莫西沙星对照品与杂质A~O对照品适量,加溶剂溶解并逐步稀释制成10、5、2、1、0.4、0.2和0.1 μg/mL的系列溶液,摇匀。取上述溶液,分别进样20 μL,记录峰面积。以浓度对进行线性回归,得回归方程和相关系数;以各杂质线性方程中斜率除以主成分线性方程中斜率得各杂质校正因子(表2)。结果表明各成分在0.1~10 μg/mL的浓度范围内线性关系良好。
3.2.3 检测限和定量限考察
用线性溶液逐步稀释,以信噪比S/N=9.20对应莫西沙星浓度0.04 μg/mL为定量限,以信噪比S/N=3.71对应莫西沙星浓度0.01 μg/mL为检测限。
3.2.4 溶液稳定性考察
对照品溶液稳定性:取“2.2”项下对照品溶液在室温下放置,在不同时间进样,以第一针对照品溶液进样时间为0h点,考察12h内对照品溶液稳定性,主峰峰面积RSD值为1.4%,无明显变化趋势,说明对照品溶液稳定。
供试品溶液稳定性:取“2.2”项下供试品溶液在室温下放置,在不同时间进样,以第一针对照品溶液进样时间为0点,考察12 h内供试品溶液稳定性。采用面积归一法计算各杂质的百分含量,各杂质及杂质总量变化均小于0.01%,主峰峰面积RSD值为0.04%,无明显变化趋势,说明供试品溶液稳定。
3.2.5 精密度考察
对照品溶液精密度:取“2.2”项下对照品溶液连续进样6次记录色谱图,主峰保留时间RSD值为0.09%,主峰峰面积RSD值为1.1%,证明对照品溶液精密度良好。
供试品溶液重复性:取盐酸莫西沙星原料药
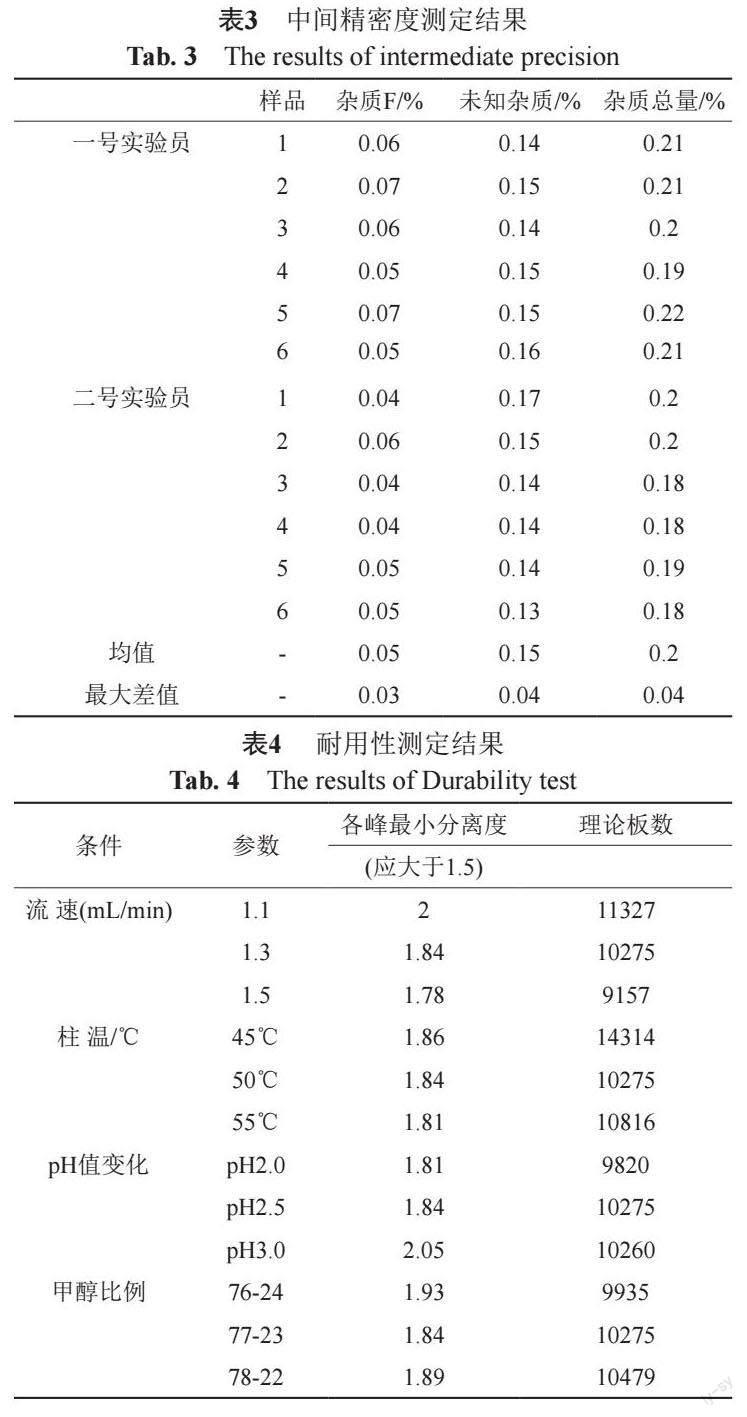
10 mg,精密称定,置100 mL量瓶中,用溶剂溶解并稀释至刻度,摇匀,平行制备6份,采用加校正因子的主成分外标法测定各杂质的百分含量。6份供试品溶液测定结果显示,杂质数量无变化,杂质含量差异小于0.03%,说明该方法重复性良好。
3.2.6 中间精密度考察
取盐酸莫西沙星原料药10 mg,精密称定,置100 mL量瓶中,用溶剂溶解并稀释至刻度,摇匀。实验员1采用DIONEX UltiMate3000液相色谱仪,色谱柱Inertsil Phenyl柱(4.0 mm×250 mm,5 μm,批號:SH5-6313),实验员2采用Waters e2695液相色谱仪,色谱柱Inertsil Phenyl柱(4.0 mm×250 mm,
5 μm,批号:SH5-5823),在不同日期进行试验,每人平行制备6份供试品溶液,分别测定有关物质(表3)。结果可见,12份样品中杂质数量相同,杂质含量差异小于0.04%,证明该方法精密度良好。
3.2.7 耐用性考察
取“2.2”项下系统适用性溶液照有关物质测定方法,在改变流速、柱温和流动相比例等条件下,分别取系统适用性溶液20μL注入液相色谱仪,考察系统适用性变化情况(表4)。结果表明,流速、柱温、pH值等微弱变化对系统适用性无显著影响,说明系统耐用性良好。
3.3 样品测定
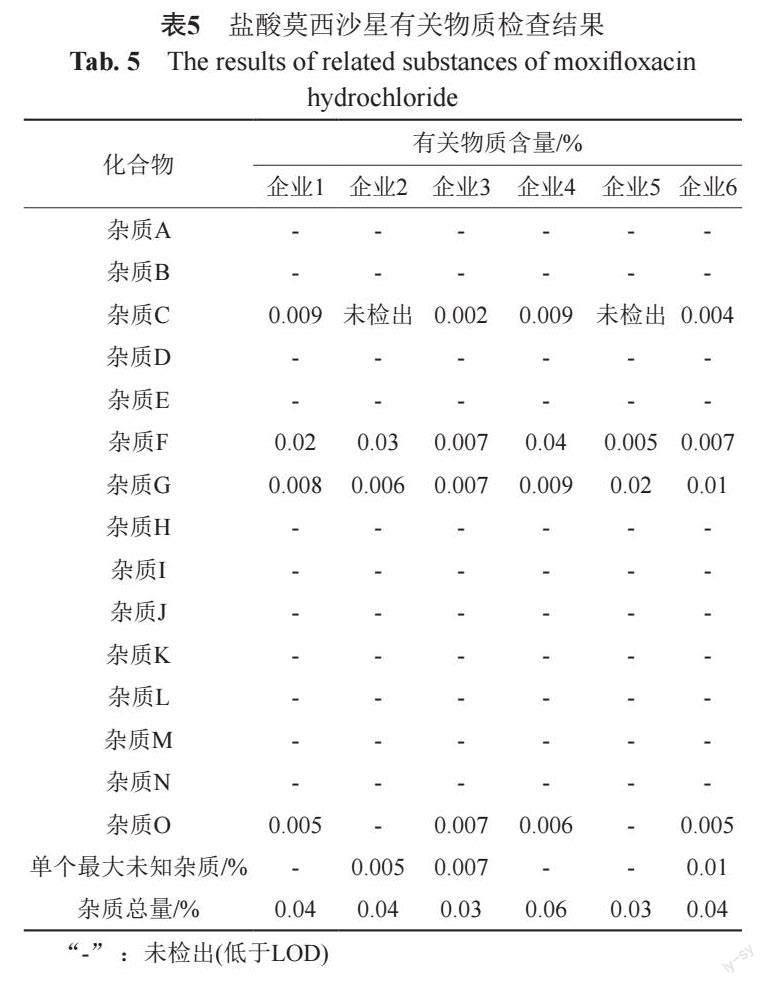
按照“2.2”项下制备盐酸莫西沙星供试品、对照品溶液、系统适用性溶液及灵敏度溶液,按“2.1”项下的色谱条件进样分析,对6个厂家的盐酸莫西沙星原料药进行有关物质检查,将每个厂家3个批号取平均值,检查结果见表5。
4 讨论与结论
目前,在EP与USP收载的盐酸莫西沙星原料药有关物质方法色谱条件一致,流动相比例相同,均为等度洗脱;杂质A、B、C、D、E的限度均为0.1%,其他单个杂质不得过0.1%,杂质总量不得过0.3%及0.5%;上述方法无法有效控制杂质F~O。多批检测结果表明,在盐酸莫西沙星原料药中含有杂质F、杂质G及杂质O。本文新优化的方法可控制多达15个杂质,在原有杂质基础上引入杂质F~O,杂质F~O定量限满足ICH杂质限度(0.1%)控制的要求,且进行了校正因子研究,更适合对盐酸莫西沙星产品的质量控制。
强制降解试验结果表明,杂质N、O为酸降解产物,杂质F、M、K为碱降解产物,杂质G、I、L、J为氧化降解产物,杂质G、D、C、E为紫外光降解产物。在生产过程中,无法避免使用盐酸与氢氧化钠,对盐酸莫西沙星原料药的有关物质分析结果表明,主要杂质包括C、F、G、O,因此提示在合成工艺及储存中应注意酸、碱、氧化及光照对产品的影响。
本文建立了一种新的盐酸莫西沙星有关物质检测方法,本方法不仅可检测已知的工艺杂质,还可有效检测出酸、碱、氧化、光照等降解条件下的降解杂质。经过方法学验证,该方法灵敏、专属性强、准确度高,可有效用于盐酸莫西沙星产品的质量控制。
参 考 文 献
王夕静, 常春, 温秀红, 傅强. HPLC法测定盐酸莫西沙星的有关物质[J]. 药物分析杂志, 2020, 40(11): 2048-2055.
李林梅, 宋太发, 索成林, 等. HPLC法测定盐酸莫西沙星片中光降解杂质的含量[J]. 邵阳学院学报(自然科学版), 2020, 17(5): 52-58.
任明霞, 赵皖京. 清咳平喘颗粒联合莫西沙星治疗成人轻中度社区获得性肺炎临床观察[J]. 中草药, 2022, 53(11): 3410-3414.
张伯鹏, 赵艳, 张建伟. 莫西沙星治疗耐多药肺结核病临床效果观察[J]. 临床肺科杂志, 2014, 19(6): 1126-1128.
杨庆玺, 倪庆, 姬光东, 等. 羧甲司坦口服溶液联合莫西沙星治疗慢性支气管炎急性发作的临床研究[J]. 现代药物与临床, 2022, 37(9): 2035-2039.
邵杰, 杨玉东, 朱红强, 等. 盐酸莫西沙星治疗呼吸系统感染的有效性和安全性评价[J]. 当代医学. 2016, 22(9): 142-143.
杨成钰. 盐酸莫西沙星合成及相关杂质分析的研究[D]. 杭州: 浙江工业大学, 2016.
崇小萌, 田冶, 王立新, 等. 盐酸莫西沙星原料及片剂有关物质及稳定性分析[J]. 中国新药杂志, 2022, 31(15): 1531-1541.
