注射用亚胺培南西司他丁钠无菌检查法的优化及标准化
2023-06-11欧国栋肖建光赖珊洪建文
欧国栋?肖建光?赖珊?洪建文

摘要:目的 对注射用亚胺培南西司他丁钠的无菌检查方法进行优化及确认。方法 依据《中国药典》2020版四部通则1101无菌检查法,对供试液、敏感菌、冲洗量和中和剂等可能的影响因素进行了探讨,并在供试液配制,滤膜,冲洗量及冲洗次数、中和剂及其使用量、阳性对照菌等方面对注射用亚胺培南西司他丁钠的无菌检查方法进行优化。结果 选取4个厂家样品对注射用亚胺培南西司他丁钠的无菌检查方法进行确认, 6株阳性试验菌在规定时间内都生长良好。结论 该方法能有效去除注射用亚胺培南西司他丁钠的抑菌性,具有操作简便,高效可靠等优点,适用于注射用亚胺培南西司他丁钠上市抽验样品和批出厂产品的无菌检查。
关键词:注射用亚胺培南西司他丁钠;无菌检查法;金属酶;方法适用性试验
中图分类号:R978.1文献标志码:A
Abstract Objective To improve and confirm the sterility test method of imipenem and cilastation sodium for injection. Methods According to the sterility test method in general rule 1101 of Chinese Pharmacopoeia (2020 Edition), The factors that might influence such as the test solution, sensitive bacteria, flushing amount and neutralizer, etc were explored, and the sterility test method of imipenem and cilastation sodium for injection was optimized in the aspects of test solution preparation, filter membrane, flushing amount and flushing times, neutralizer and its use amount, positive control bacteria, etc. Results The samples of four manufacturers were selected to confirm the sterility test method of imipenem and cilastation sodium for injection, Six positive test bacteria grew well within the specified time. Conclusion The optimized and standardized method can effectively eliminate bacteriostasis of mipenem and cilastation sodium for injection,and has the advantages of simple operation, high efficiency and reliability,it is suitable for the sterility test of imipenem and cilastation sodium for injection for market sampling and batch products.
Key words Imipenem and cilastation sodium for injection; Sterility test; Metalloenzyme; Method applicability test
注射用亞胺培南西司他丁钠是由碳青霉烯类抗生素亚胺培南和肾肽酶抑制剂西司他丁钠按1:1比例组成的一种复合制剂[1],属于β-内酰胺类抗生素的硫霉素类抗生素,具有抗菌谱广和抗菌活性强的特点[2-3],对革兰阳性菌、革兰阴性菌、厌氧菌均有抑制作用[4]。1985年在日本上市[5],现国内生产企业和进口企业均为5家,市售规格有0.5、1.0和2.0 g,临床上常用于治疗多种病原体所致与需厌氧菌导致的混合感染[6]。
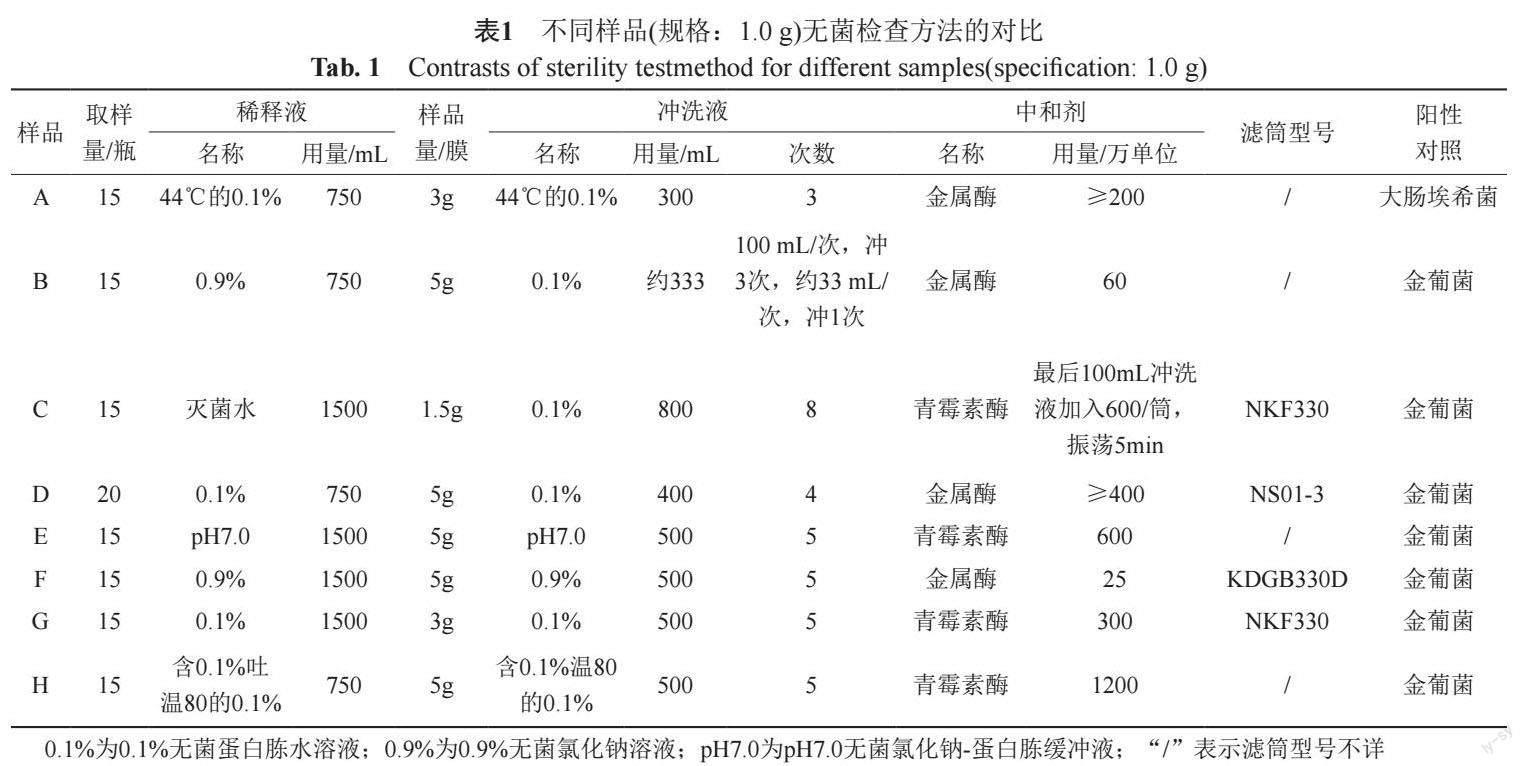
注射用亚胺培南西司他丁钠是2022年国家药品抽验品种,共计抽检80批次,来自22个省级行政区,涉及8家企业和2个规格。在无菌检验过程中发现,8家企业均采用了薄膜过滤法联用中和剂的方法,但采用的无菌检查的方法不尽相同,且存在不一致或需改进的地方,和其它抗生素品种无菌检验中发现的情况相似[7],普遍表现在敏感菌选择、供试液配制、冲洗量及中和剂选择和用量等方面[8-9],对其无菌检查方法进行统计对比,结果见表1。
由表1可见,各厂家无菌检查方法中不仅存在敏感菌选择不一致和冲洗量过大的问题,而且在供试液配制方面还存在稀释液使用量不够和操作繁琐的问题,这既不利于样品的充分溶解,也限制了在无菌检查用隔离系统中检查(如水浴);在中和剂使用方面还有一半厂家选择青霉素酶作为中和剂,而选择金属酶的个别厂家直接以最低标示酶活性使用,未能按实际酶活性并根据需要配制成相应浓度,使用量大易造成浪费,不利于降低检验成本。为了提升无菌检查的可靠性、准确性和效率,节约资源,本文采用薄膜过滤法,通过合理选择中和剂,优化并统一了注射用亚胺培南西司他丁钠的无菌检查方法。
1 仪器与材料
1.1 设备和耗材
GF88DA立式自动压力蒸汽灭菌器(致微(厦门)仪器有限公司);1379生物安全柜(赛默飞世尔(苏州)仪器有限公司);BRE240生化培养箱(Froilabo公司);HTY-602集菌仪(杭州泰林生物技术设备有限公司);NS01-75D1T薄膜过滤器(北京牛牛基因技术有限公司);KDGB220D、KDGB330D集菌培养器(浙江泰林生命科学有限公司)。
1.2 培养基和试剂
沙氏葡萄糖液体培养基(SDB,批号:1091021),硫乙醇酸盐流体培养基(FTM,批号:1100095),胰酪大豆胨液体培养基(TSB,批号:1111461),以上培养基购自广东环凯微生物科技有限公司;哥伦比亚琼脂培养基(批号:210224),胰酪大豆胨琼脂培养基(TSA,批号:220412),沙氏葡萄糖琼脂培养基(SDA,批号:220223),以上培养基购自北京三药科技开发公司。培养基的无菌性检查和灵敏度检查均符合规定。
0.9%无菌氯化钠溶液(广州化学试剂厂,批号:20210902 19) ,0.1%无菌蛋白胨水溶液(广东环凯微生物科技有限公司,批号:1100901),金属β-内酰胺酶(金属酶,杭州北望生物技术有限公司,批号:6022248D,规格:≥200万单位/支,酶活性为216.38万单位/支);青霉素酶(杭州北望生物技术有限公司,批号:6012190D,规格:1000萬单位/支,酶活性为1606.51万单位/支)。
1.3 试药
注射用亚胺培南西司他丁钠,规格:1.0 g(亚胺培南0.5 g和西司他丁0.5 g),来自国产企业3家和进口企业1家,分别以代码表示为 A (批号:220320809、211120803、211120801、210920801、220320802),B (批号:21088211、21105811、21038711),C(批号:2112038、2112035、2106022),D (批号:U035730、U028209、U027236)。
1.4 菌种
大肠埃希菌 [CMCC(B)44102]、金黄色葡萄球菌[CMCC(B)26003]、生孢梭菌 [CMCC(B)64941]、枯草芽胞杆菌[CMCC(B)63501]、白念珠菌[CMCC(F)98001]、黑曲霉 [CMCC(F)98003] [10],均购自中国食品药品检定研究院,工作用菌株为第三代。
2 方法
2.1 菌液制备
大肠埃希菌、金黄色葡萄球菌、生孢梭菌、枯草芽胞杆菌、白念珠菌和黑曲霉,按照《中国药典》2020年版四部通则1101的要求,制备成不大于l00 cfu/mL的菌悬液或者孢子悬液[11]。
2.2 供试液制备
取样品[规格:1.0 g(亚胺培南0.5 g和西司他丁0.5 g)]5支,用0.9%无菌氯化钠溶液溶解并稀释至
500 mL,制成含亚胺培南5 mg/mL的供试品溶液。
2.3 预试验
2.3.1 敏感菌的选择[12]
取菌悬液或孢子悬液各1 mL,分别加入不同无菌平皿中,再各加入“2.2”项下溶液0.1 mL,金黄色葡萄球菌、大肠埃希菌、枯草芽胞杆菌立即倾注TSA15~20 mL;白念珠菌、黑曲霉立即倾注SDA15~20 mL,每一试验菌株平行制备两个平皿,作为试验组;同上法操作,分别制作菌液组和稀释剂对照组。
取“2.2”项下溶液1mL按薄膜过滤法过滤,用300 mL 0.1%无菌蛋白胨水溶液进行冲洗,在最后一次分别加入金黄色葡萄球菌、大肠埃希菌、枯草芽胞杆菌菌悬液各1 mL,取出滤膜贴于TSA平板上,作为试验组; 同上法操作,分别制作菌液组和稀释剂对照组。
2.3.2 冲洗量的考察
取KDGB220D集菌培养器3套,每个滤筒取“2.2”项下溶液500 mL过膜,再用0.1% 无菌蛋白胨水溶液按100 mL/膜/次进行冲洗,每个滤筒的总冲洗量分别为300、500、700 mL,在最后一次冲洗液中分别加入菌悬液1 mL,冲洗完后分别加入
100 mL FTM或100 mL TSB,阳性对照:另取滤筒不加入样品溶液,其它操作同上。阴性对照:另取滤筒不加入样品溶液和试验菌,其它操作同上。
2.3.3 中和剂及其用量的考察
有文献[13]指出头孢菌素酶对碳青霉烯类(培南类) 中和作用较弱,故考虑分别使用金属酶和青霉素酶进行方法考察。取KDGB220D集菌培养器2套,每个滤筒取“2.2”项下溶液500 mL过膜,再用0.1% 无菌蛋白胨水溶液按100 mL/膜/次进行冲洗,每个滤筒的总冲洗量分别为300 mL,在最后一次冲洗液中分别加入菌悬液1 mL,冲洗完后分别加入100 mL含25或50万单位金属酶的FTM,以及100 mL含25或50万单位金属酶的TSB,阳性对照:另取滤筒不加入样品溶液,其它操作同上。阴性对照:另取滤筒不加入样品溶液和试验菌,其它操作同上。
再取KDGB220D集菌培养器3套和另3家企业的样品适量,冲洗完后每100 mL培养基中分别加入25万单位金属酶,其它操作同上。
另取KDGB220D集菌培养器8套,冲洗完后每100 mL培养基中分别加入300或600万单位青霉素酶,其它操作同上。
2.4 无菌检查方法确认实验
选取4个厂家样品适量,分别对金黄色葡萄球菌、大肠埃希菌、枯草芽胞杆菌、生孢梭菌、白念珠菌、黑曲霉6个菌株进行考察确认。取KDGB330D集菌培养器8套,每个滤筒取“2.2”项下溶液
500 mL过膜,再用0.1%无菌蛋白胨水溶液按100 mL/膜/次进行冲洗,每个滤筒的总冲洗量为300 mL,在最后一次冲洗液中分别加入菌悬液或孢子悬液
1 mL,冲洗完后分别加入100 mL含25万单位金属酶的FTM或100 mL含25万单位金属酶的TSB,阳性对照:另取滤筒不加入样品溶液,其它操作同上。阴性对照:另取滤筒不加入样品溶液和试验菌,其它操作同上。结果见表2。
3 结果与讨论
3.1 结果
3.1.1 试验关键影响因素的探讨
抗生素类药品无菌检查结果的准确与否关键是无菌检查过程中对其抑菌性的有效消除[14],常见消除抑菌活性的方式有:增加稀释液或培养基体积、加入适宜的中和剂或灭活剂、薄膜过滤法[15]等。注射用亚胺培南西司他丁钠属于β-内酰胺类抗生素,抗菌活性强及抗菌谱广。本文采用以上几种方式联合使用的方法,对影响该品种无菌检查法的关键因素进行了确认。
(1)供试液配制和滤膜选择 注射用亚胺培南西司他丁钠是难溶性抗菌药物[17],选择合适的稀释剂配制成合适的供试液浓度很重要。经查文献,取适量样品用0.9%无菌氯化钠溶液溶制成含亚胺培南
5 mg/mL的供试品溶液,可在3 min内完全溶解,有利于减少滤膜对抑菌成分的吸附,还可降低后续冲洗量。本次研究采用了低吸附性的尼龙膜材质滤膜,适合强抑菌性的抗生素药物。
(2)阳性对照菌确认 注射用亚胺培南西司他丁钠是广谱抗菌药,从“2.3.1”项下的结果可知,平皿法结果金黄色葡萄球菌、大肠埃希菌和枯草芽胞杆菌的回收率均为0,白念珠菌和黑曲霉回收率的回收率分别为98%、85%,说明注射用亚胺培南西司他丁钠对细菌有很强的抑菌作用,对真菌几无抑菌性。薄膜过滤法结果金黄色葡萄球菌、大肠埃希菌和枯草芽胞杆菌的回收率分别为38%、69%、47%,可见金黄色葡萄球菌和枯草芽胞杆菌对本品敏感。根据《中国药典》要求,抗革兰阳性菌为主的供试品,以金黄色葡萄球菌为阳性对照菌。故本文选择了同为革兰阳性菌但更为敏感的金黄色葡萄球菌作为阳性对照菌。
(3)冲洗量的选择 《中国药典》2020版四部规定,如供试品具有抑菌作用,须用冲洗液冲洗滤膜,冲洗次数一般不少于3次。总冲洗量一般不超过500 mL,最高不得超过1000 mL。而USP-NF2021有更严格的规定,每张滤膜均不得冲洗超过5次,每次100 mL,即使方法適用性试验表明该冲洗方法不能完全清除供试品抑菌性,也不必增加冲洗次数[18]。
由“2.3.2”项下的结果可知,当冲洗液用量为300 mL和500 mL时,金黄色葡萄球菌1 d后生长良好,而枯草芽胞杆菌培养5 d后都未能正常生长;当冲洗量为700 mL 时,1 d后两种试验菌均生长良好,说明当采用薄膜过滤法,每膜冲洗量为700 mL时可以消除注射用亚胺培南西司他丁钠的抑菌性,但增加冲洗量和冲洗次数会使滤膜上的微生物损伤导致假阴性,故考虑采用冲洗量300 mL添加中和剂的方法进行考察。
(4)中和剂及其用量的选择 注射用亚胺培南西司他丁钠可选用β-内酰胺酶去除其抗菌活性,排除其对无菌检查结果的影响。本次研究采用青霉素酶和金属酶作为中和剂进行比较,由“2.3.3”项下的结果可见,当冲洗液用量为300 mL时,在培养基中添加25万单位金属酶,1 d后2种试验菌均生长良好;使用同等体积冲洗液,在培养基中添加300万单位青霉素酶,样品B和C的枯草芽胞杆菌培养5 d后都未能正常生长;在培养基中添加600万单位青霉素酶,1天后两种试验菌都生长良好。以上数据说明在冲洗量一致的情况下,25万单位金属酶与600万单位青霉素酶均可有效去除抑菌成分。因金属酶有效使用量比青霉素酶低,且有文献[19-22]报道金属酶通过水解β-内酰胺类抗生素的内酰胺环使之失活,能更为有效分解碳青霉烯类(如培南类)和除单环β-内酰胺类抗生素之外的几乎所有其他β-内酰胺类抗生素,作用谱范围更广泛,故首选它作为中和剂。
3.1.2 无菌检查方法的确认结果
注射用亚胺培南西司他丁钠的无菌检查方法确认实验结果见表2。结果显示,与对照管比较,在规定培养时间内,6个菌株的生长情况良好,说明该方法适用于注射用亚胺培南西司他丁钠的无菌检查。
3.1.3 优化的无菌检查方法
整理方法如下:取样品[规格: 1.0g(亚胺培南0.5g和西司他丁0.5 g)]15支,每5支用0.9%无菌氯化钠溶液溶解并稀释至500 mL,制成含亚胺培南5 mg/mL的供试品溶液,按薄膜过滤法过滤,用0.1%无菌蛋白胨水溶液冲洗滤膜,按100 mL/膜/次,冲洗3次,冲洗后在一管泵入100 mL含25万单位金属酶的TSB,另两管分别泵入100 mL含25万单位金属酶的FTM,其中1管加入含菌数不大于100 cfu/mL的金黄色葡萄球菌作为阳性对照,置规定温度培养,依法检查。
3.2 讨论
2022年抽检注射用亚胺培南西司他丁钠共计80批次,涉及5家国产企业和3家进口企业,包括0.5 g和1.0 g两个规格;其中样品A~D约占总批次的86%,规格为1.0 g的样品占80%。故选取A~D四个厂家规格为1.0 g的样品,按5g/膜进行试验;而根据《中国药典》2020版四部1101表1和表3的要求,对于规格为300 mg≤M≤5 g的样品,每膜过滤样品量不低于3 g即符合要求,所以建立的无菌检查方法也适用于0.5 g
和2.0 g两个规格。
针对表1存在的问题,本文对注射用亚胺培南西司他丁钠无菌检查法进行了优化。研究采用对该品种较为敏感的金黄色葡萄球菌和枯草芽胞杆菌作为试验菌,分别对冲洗量、中和剂及其用量等关键影响因素进行考察,最终确认以0.1%无菌蛋白胨水溶液300 mL分3次冲洗滤膜,每100 mL培养基中添加金属酶25万单位作为无菌检查方法,结果试验组与阳性对照组均生长良好。该方法既保证了结果的可靠有效,同时降低了检验成本,提高了检验效率,也为该品种不同规格的注射剂无菌检查法提供了借鉴,有利于实现资源共享。
参 考 文 献
刘婷婷, 王先利. 注射用亚胺培南西司他丁钠致产褥感染患者粒细胞缺乏1例[J]. 中国临床药学杂志, 2021, 30(6): 465-468.
徐运娥, 卢忠义, 敖弟书, 等. 亚抑菌浓度亚胺培南西司他丁钠诱导铜绿假单胞菌生物被膜形成的体外研究[J].遵义医科大学学报, 2022, 45(4): 433-437.
王芳, 周秋云, 鲁涛. 亚胺培南西司他丁钠或美罗培南治疗早期肺癌合并重症肺部感染[J].中国临床研究, 2022, 35(9): 1305-1309.
曹娟, 冯琼. 谷氨酰胺联合亚胺培南治疗重症急性胰腺炎合并感染的临床效果及对炎症因子的影响[J]. 临床医学研究与实践, 2022, 7(27): 38-41.
艾效曼, 陶凤蓉, 赖惠英, 等. 比阿培南等10 种抗菌药物对常见革兰阴性杆菌体外抗菌活性比较[J]. 中国新药杂志, 2020, 29(5): 541-546.
李恒杰. 亚胺培南西司他丁钠与美罗培南治疗重症细菌感染的对比研究[J]. 黑龙江医学, 2022, 46(16): 1978-1980.
刘荔, 田妮娜, 张晓萍, 等. 对不同厂家生产的氯霉素滴眼液无菌检查法的确定[J]. 甘肃科技, 2018, 34(10): 31-32, 50.
肖建光, 欧国栋, 赖珊, 等. 注射用头孢尼西钠无菌检查方法的优化及关键影响因素[J]. 中国抗生素杂志, 2021, 46(4): 287-290.
刘洪祥, 刘海玲, 解慧, 等. 注射用替加环素无菌检查的研究及优化[J]. 药物分析杂志, 2020, 40(8): 1443-1450.
刘荔, 田妮娜, 朱仁愿, 等. 注射用头孢哌酮钠舒巴坦钠(2:1)无菌检查法的研究[J]. 甘肃科技, 2019, 35(6): 94-95.
李娅男, 李伟, 曹晓云. 注射用硫酸头孢匹罗无菌检查法的确定[J]. 天津药学, 2019, 31(6): 31-33.
石蓉, 彭诗富. 注射用甲磺酸培氟沙星无菌检查方法改进及验证[J]. 海峡药学, 2020, 32(3): 91-93.
吴扬, 余辉, 沈祝飞, 等. 卫生学检查中和剂头孢菌素酶作用范围研究[J]. 哈尔滨商业大学学报( 自然科学版), 2016, 32(4): 433-434.
傅莉萍, 王朝丽, 李婷, 等. 氨曲南及其注射剂无菌检查方法适用性试验[J]. 药学服务与研究, 2021, 21(6): 419-423.
潘海虹, 徐有斌. 抑菌性药品的微生物检查与分析[J]. 化工管理, 2019, 11: 182-183.
国家药典委员会. 中华人民共和国药典2020年版.四部 [S]. 北京: 中国医药科技出版社, 2020: 156-160.
周亚林, 林碧英, 叶少霞. 某院难溶性抗菌药物的配制分析[J]. 中国医药指南, 2020, 18(34): 238-239.
李玉立, 江志杰, 刘文杰, 等. 中美现行药典无菌检查法比对[J]. 中国药业, 2022, 31(8): 6-9.
吴扬, 文静, 王鑫, 等. 探讨无菌检查中和剂β-内酰胺酶IV的作用范围及水解效果[J]. 国外医药抗生素分册, 2019, 40(4): 390-391.
卞聪, 马贝贝, 胡来兴, 等. 金属碳青霉烯酶的作用机制及其抑制剂研究进展[J]. 中国抗生素杂志, 2017, 42(11): 923-931.
韩江雪, 刘忆霜, 肖春玲. β-内酰胺酶抑制剂研究进展[J]. 中国抗生素杂志, 2019, 44(6): 647-653.
周海英, 曹原, 邓劲, 等. 氨曲南联合头孢他啶/阿维巴坦对产金属β-内酰胺酶肠杆菌目细菌的体外协同作用初探[J]. 中國抗生素杂志, 2021, 46(8): 784-788.
